乙炔的分子结构和物理性质
乙炔_乙炔
化学 性质
二、乙炔的性质
物理性质
乙炔为无色、无味的气体, 密度比空气略小,微溶于水,易 溶于有机溶剂。
化学性质
(A)氧化反应:
(1)被氧气氧化:
甲烷、乙烯、乙炔的燃烧
淡蓝色火焰
火焰明亮 带有黑烟
火焰很明亮带 有浓烈黑烟
实验现象:火焰很明亮,带有浓烈黑烟 完全燃烧方程式:
2C2H2+5O2 点燃 4CO2+2H2O
观察分析上面的热化学方程式,并思考生产中 为什么常用氧炔焰来切割或焊接金属,而不用 氧烷焰或氧烯焰呢?
乙炔完全燃烧所需氧的物质的量最少,生成水的 物质的量也最少,因此燃烧时用以提高氧温度以 及水气化所消耗的反应热也最少,所以乙炔火焰 温度最高。
(2)被酸性KMnO4溶液氧化。
2KMnO4 + 3H2SO4 + C2H2 → 2MnSO4 + K2SO4 + 2CO2 + 4H2O
b.与H2加成
催化剂
CHCH + H2
CH2=CH2 + H2
催化剂
CH2=CH2
CH3CH3
c.与HCl加成
CHCH + HCl nCH2 = CHCl
催化剂
CH2= CHCl
氯乙烯
催化剂
加温、加压
CH2CH
n
Cl
聚氯乙烯
聚乙烯:用聚乙烯薄膜做成塑料袋是无毒的,可
以用来盛装食物,只是强度差些,且不能经受80℃ 以上的高温,并有一定的透气性,不宜长期用来盛 装茶叶、香料等。
四、乙炔的用途
1、乙炔燃烧时产生的氧炔焰可用来切割或 焊接金属。 2、 乙炔是一种重要的基本有机原料,可 以用来制备氯乙烯、 聚氯乙烯和乙醛等。
炔烃的物理性质,化学 性质

4、乙炔
(1)乙炔的分子结构:
电子式:
H C
● ×
●● ●● ●●
C H
● ×
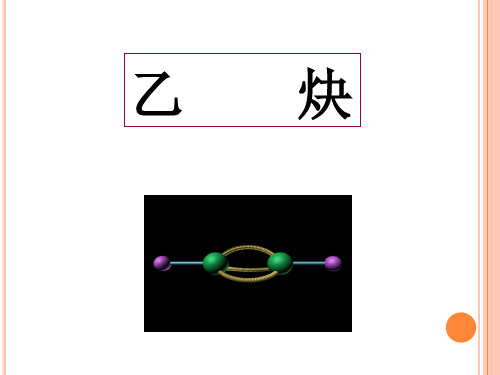
结构式: H—C≡C—H 结构简式: CH≡CH 或 HC≡CH 空间结构: 直线型,键角1800
PS:乙炔结构
1、C≡C的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不 稳定,容易断裂,有一个键较稳定。
原 油 的 分 馏 及 裂 化 的 产 品 和 用 途
石油炼制 的方法
分馏
裂化
裂解
在一定条件下, 利用各成分沸点 在高温下,把 的不同,用蒸发和 把相对分子质 石油分馏产品 量大、沸点高 冷凝的方法把石 中长链烃断裂 原理 油分成不同沸点 的烃断裂为相 为短链气态小 范围的分馏产物 对分子质量小、 分子烃。 沸点较低的烃。 化学变化 物理变化 化学变化 变化 重油 原油 石油分馏产品 主要原料 提高轻质油, 制得由短链气 得到各种不同 特别是汽油的 态不饱和烃组 目的 沸点范围的烃。 产量和质量 成得裂解气 乙烯、丙烯、 石油气,汽油,煤油, 主要产品 柴油,润滑油,重油等 汽油 1,3-丁二烯等
5、描述CH3—CH = CH—C≡C—CF3分子结构的下列 叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
习题1. 鉴别甲烷、乙烯、乙炔三种气体可采用 的方法是:
A. 通入溴水中,观察溴水是否褪色。 B. 通入酸化的高锰酸钾溶液中,观察颜色是否 变化。 C. 点燃,检验燃烧产物。 D. 点燃,观察火焰明亮程度及产生黑烟量的多 少。
《乙炔》 教学设计

《乙炔》教学设计一、教学目标1、知识与技能目标(1)学生能够了解乙炔的分子结构和物理性质。
(2)掌握乙炔的化学性质,包括氧化反应、加成反应等。
(3)学会乙炔的实验室制取方法和实验操作要点。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、分析问题和解决问题的能力。
(2)通过对乙炔化学性质的学习,提高学生的逻辑思维能力和知识迁移能力。
3、情感态度与价值观目标(1)培养学生严谨的科学态度和实事求是的精神。
(2)激发学生学习化学的兴趣,增强学生对化学与生活密切联系的认识。
二、教学重难点1、教学重点(1)乙炔的化学性质,特别是加成反应。
(2)乙炔的实验室制取方法和实验操作。
2、教学难点(1)加成反应的原理和反应方程式的书写。
(2)实验室制取乙炔时的实验装置和操作要点。
三、教学方法讲授法、实验法、讨论法、多媒体辅助教学法四、教学过程1、导入新课通过展示生活中常见的塑料制品、橡胶制品等,引出有机化合物在生活中的广泛应用。
提问学生:“这些有机化合物是如何制取的呢?”从而引出本节课的主题——乙炔。
2、新课讲授(1)乙炔的分子结构展示乙炔的球棍模型和比例模型,引导学生观察并分析乙炔的分子结构。
讲解乙炔分子中碳原子的成键方式(sp 杂化),以及碳碳三键的特点。
(2)乙炔的物理性质通过展示实物、图片或视频等资料,让学生了解乙炔的颜色、状态、气味、密度、溶解性等物理性质。
强调乙炔是一种无色、无味、密度比空气略小、微溶于水、易溶于有机溶剂的气体。
(3)乙炔的化学性质①氧化反应演示乙炔在空气中燃烧的实验,让学生观察火焰的颜色(明亮的火焰,伴有浓烈的黑烟)。
讲解产生黑烟的原因(乙炔含碳量高,燃烧不充分)。
写出乙炔燃烧的化学方程式:2C₂H₂+ 5O₂ → 4CO₂+2H₂O。
演示乙炔通入酸性高锰酸钾溶液的实验,观察溶液颜色的变化(紫红色褪去),说明乙炔具有还原性。
②加成反应讲解加成反应的概念,以乙炔与溴水的反应为例,演示实验并写出化学方程式:CH≡CH + 2Br₂ → CHBr₂CHBr₂。
乙炔知识点复习

CCHHH CCC F 3120o180O煤化工和乙炔一、乙炔的组成和结构:分子式:C 2H 2 电子式:结构式:H —C ≡C —H 结构简式:CH ≡CH 乙炔:直线型,键角180°[例题] CH 3—CH==CH —C ≡C —CF 3分子结构的下列叙述中,正确的是( B C ) A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子都在同一平面上D 、6个碳原子不可能都在同一平面上解析:该物质空间结构可表示为:注:该物质并不是所有原子均共面,如—CH 3中的3个氢原子,—CF 3中的3个氟原子均类CH 4中氢原子,是空间的。
甲烷、乙烯、乙炔结构的比较结构简式 CH 3—CH 3CH 2==CH 2 HC ≡CH 键角 109°28′(约) 120° 180° 碳碳键长(m ) 1.54×10--10 1.33×10--10 1.20×10--10碳碳键能(KJ/mol )384615812乙炔的键能812<3×384,也比C —C 单键和C==C 双键键能之和小,所以说明乙炔的C ≡C 中有两个键易断裂。
三键中一个为C —C δ键,两个为π键。
二、乙炔的实验室制法:1、原料:电石(CaC 2中常含CaS 、Ca 3P 2)、饱和食盐水电石来源:CaCO 3一一→CaO + CO 2↑ CaO + 3C 一一→CaC 2 + CO ↑(电炉中进行)2、反应原理:CaC 2 + 2H 2O Ca(OH)2 + C 2H 2↑ 离子型碳化物,与水的反应相当于水解 [解释]乙炔为无色、无味气体,常因含有H 2S 、PH 3等杂质而有特殊难闻的臭味。
副反应: Ca 3P 2 + 6H 2O 3Ca(OH)2 + 2PH 3↑ CaS +2H 2O Ca(OH)2 + H 2S ↑H 2S 、PH 3气体具有还原性,会影响C 2H 2的检验,应注意除杂(用CuSO 4除H 2S ,PH 3,CuSO 4可氧化PH 3。
乙炔

炔
一,乙炔的结构
分子式 C2H2
电子式
结构式
H× C C ×H
HC≡CH ≡
二,乙炔的性质
纯的乙炔是没有颜色,没有臭 的乙炔是没有颜色 颜色, 物 理 性 质 气体. 味的气体 密度是1.16克 味的气体.密度是1.16克/升, 比空气稍轻.微溶于水,易溶 比空气稍轻.微溶于水, 于有机溶剂. 于有机溶剂.
CH≡CH + HCl ≡ nCH2=CH Cl
催化剂
CH2=CHCl CH2CH n Cl
催化剂 加温, 加温,加压
(2)乙炔燃烧时产生的氧炔焰可用来切割或 乙炔燃烧时产生的氧炔焰可用来切割或 乙炔燃烧时产生的氧炔焰可用来切割 焊接金属 金属. 焊接金属.
�
甲烷,乙烯, 甲烷,乙烯,乙炔的燃烧
1. 氧化反应
(1) 在空气或在氧气中燃烧 完全氧化 — 2C2H2 + 5O2 → 4CO2 + 2H2O (2) 被氧化剂氧化 使酸性KMnO 溶液褪色 使酸性KMnO4溶液褪色
点燃
化 学 性 质
2.加成反应 加成反应
1, 2—二溴乙烯 二溴乙烯
1, 1, 2, 2—四溴乙烷 四溴乙烷
与氢气
书写下列化学方程式
催化剂
CH≡CH + H2 ≡
CH2=CH2 CH3CH3 CH2=CHCl
CH2=CH2 + HFra bibliotek CH≡CH + HCl ≡
催化剂
催化剂
3.乙炔的用途 3.乙炔的用途
(1)乙炔是一种重要的基本有机原料,可以 乙炔是一种重要的基本有机原料, 乙炔是一种重要的基本有机原料 用来制备氯乙烯,聚氯乙烯和乙醛等. 用来制备氯乙烯,聚氯乙烯和乙醛等.
乙炔是易燃易爆气体

乙炔是易燃易爆气体乙炔,化学式为C2H2,是一种无色、有刺激性味道的易燃易爆气体。
乙炔在常温下为无色气体,易燃,能和空气形成爆炸性混合气体,是危险的化学物质之一。
下面将对乙炔的性质、危险性和安全措施等进行介绍。
乙炔的性质乙炔的物理性质如下:•分子量:26.02•熔点:-80.8℃•沸点:-84℃•密度:0.91 g/cm³•闪点:-18℃•爆炸极限:2.5%-82.5%乙炔是一种电负性很强的分子,且其分子形态使得分子中的所有碳-碳键角度都是180度,因此其化学性质非常活泼。
乙炔和氧气在特定条件下能够发生剧烈的反应,产生强烈的热量和光能。
由于其易燃性和爆炸性,乙炔常被用于焊接和切割金属,也用于化工和制药行业的生产过程中。
乙炔的危险性由于乙炔是一种易燃易爆的气体,因此其存在许多危险性。
主要包括以下方面:爆炸危险乙炔能与空气形成一种可燃混合物,具有一定的爆炸性。
当混合物浓度介于2.5%至82.5%之间时,就有可能发生爆炸。
由于乙炔的密度比空气小,所以在室内存在乙炔时,乙炔会浮在空气上方,这进一步增加了爆炸的危险性。
窒息危险乙炔在空气中的浓度超过其燃点时,会产生一定等量的一氧化碳,一氧化碳是无色、无味的毒气,能抑制人体对氧气的吸入。
长时间暴露在高浓度的一氧化碳下,会对身体造成严重损害,甚至危及生命。
刺激性危险乙炔在一定浓度下会对人体眼睛、皮肤和呼吸道造成刺激。
长时间暴露在高浓度的乙炔下,会对健康造成不良影响。
安全措施由于乙炔的危险性较高,它应该在使用前进行充分的安全措施。
主要包括以下内容:储存乙炔需要在封闭、阴凉、干燥的环境下储存。
储存容器应该符合相应的标准,并能够有效地避免乙炔和空气接触。
运输运输时,乙炔应该在安全的储存容器内进行,必须保证储存容器牢固而不会破裂。
焊接和切割在焊接和切割乙炔前,应该对周围环境进行检查,清除有可能引火的物品,并保证使用安全的防护措施。
废弃物处理在使用完乙炔后,需要将容器清洗干净,并对废弃的乙炔进行妥善处理。
乙炔

反应原理: CaC2+ 2H2O
发生及收集装置: 固 +液
用CuSO4溶液出去H2S、PH3等杂质 除杂:
思考及推测
甲烷
乙烯
乙 炔
乙炔性质实验探究:
①将乙炔通入酸性高锰酸钾溶液中 ②将乙炔通入溴水中 ③点燃验纯后的乙炔
乙炔性质实验探究:
饱和食盐水
CuSO4溶液 ①将乙炔通入酸性高锰酸钾溶液中 ②将乙炔通入溴水中 ③点燃验纯后的乙炔
4、乙炔的化学性质 5、乙炔的用途
小试身手, 连接高考(2005全国卷Ⅱ)
右图中的实验装置可用于制取乙炔请填空:
①图中,A管的作用 。 。 反应; ;
制取乙炔的化学方程式是:
②乙炔通入KMnO4酸性溶液中观察到 的现象是 ;乙炔发生了
③乙炔通入溴的CCl4溶液中观察到的现象是 乙炔发生了 反应; ④为了安全,点燃乙炔前应 的实验现象是
C、CH≡C—CH3
6、7
B、CH2=CH2
D、CH2=C(CH3)CH3
练习
8
8、含一叁键的炔烃,氢化后的产物结构简式 为
此炔烃可能有的结构有( B ) A.1种 B.2种 C.3种 D.4种
C5H10
C5H8
1. 有甲烷、乙烯、乙炔三种有机物,它们 共同具有的性质是( A. 燃烧时有浓烟生成 B. 完全燃烧时生成二氧化碳和水 C. 可发生加成反应 D. 都是无色无味的气体 ) B
2. 下列说法错误的是(
)
A. 乙烷、乙烯、乙炔中碳碳键长有大到小排
B. 乙炔分子里的所有原子处在一条直线上 C. 电石必须防潮密封干燥保存 D. 实验室制取乙炔需要广口瓶、分液漏斗和酒 精灯
②与H2、HCl等加成,请写出下列加成反应的
乙炔的知识点总结

乙炔的知识点总结1. 物理性质乙炔是一种无色、有毒、易燃的气体,味道刺激性。
乙炔的密度为0.911g/L,比空气轻,易上升并扩散,容易形成爆炸性的混合物。
乙炔可以在-80℃下液化,也可以通过加压制成液态。
2. 化学性质乙炔具有高度的活性,容易与氧气、氯气等发生反应,产生大量的热能。
乙炔与氧气在适当条件下可以发生爆炸性反应,因此在存储和使用时需要特别注意安全。
乙炔还可以与卤素发生加成反应,生成相应的卤代烃。
3. 制备方法工业上的乙炔主要是通过电石法制备,即将石灰石和焦炭煅烧成石灰,再用石灰和焦炭进行电石反应得到电石。
然后用水解反应将电石分解成乙炔和氢氧化钙。
此外,乙炔还可以通过乙烷脱氢、甲基汞分解等方法来制备。
4. 应用领域乙炔在工业领域有广泛的应用,主要用于乙炔焊接和切割。
乙炔气体和氧气在适当条件下可以燃烧,生成高温的火焰,可以用于焊接和切割各种金属。
此外,乙炔还可以用于有机合成,如合成乙炔醇、乙烯、乙酰乙烯等有机化合物。
乙炔的火焰温度高达3300℃,因此还可以用于金属熔炼和玻璃加工等领域。
另外,乙炔还可以用于照明和燃料,但由于其高度的活性和危险性,照明和燃料方面的应用已经逐渐减少。
5. 安全注意事项乙炔是一种有毒、易燃的气体,使用时需要特别注意安全。
首先,乙炔需要专门的储存和输送设施,并严格控制乙炔的浓度,以防止爆炸事故的发生。
其次,乙炔的气态火焰非常明亮,并且在室内可燃气体泄漏时,容易发生爆炸,因此需要密切注意通风和防爆措施。
另外,在乙炔的应用过程中也需要注意防止与氧气、氯气等发生危险反应,以及避免乙炔的毒性对人体的危害。
因此,在乙炔的生产和使用过程中,需要严格遵守相关的安全标准和规定,以确保生产和使用的安全。
总之,乙炔是一种重要的工业气体,具有广泛的应用前景。
但是,由于其高度的活性和危险性,生产和使用过程中需要特别注意安全,以免发生爆炸和中毒等意外事件。
希望今后能够在乙炔的生产和使用中,进一步完善安全标准和技术手段,以提高乙炔的生产和使用安全性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节 脂肪烃
乙炔的分子结构和物理性质(9)
氧炔焰
复习思考 写出乙烷、乙烯的分子式、电子式、结构 式和结构简式。 乙烷 乙烯
分子式: 电子式 结构式 结构简式: C 2H 6
H H
H
C 2H 4
H:C::C:H H H
H H C— C — H H
H H
H
H:C:C:H
H— C— C— H H H
颜色 无色
气味 无味 稍有气味 无味 有特殊气味 状态 气体 比空 密度 气小
气体
气体
液体
比水小
比空气 比空气 略小 略小
练一练:描述CH3-CH=CH-C≡C-CF3分
子结构的下列叙述中,正确的是( ) A、6个碳原子有可能都在一条直线上 B C B、6个碳原子不可能在一条直线上 C、6个碳原子有可能都在同一平面上 D、6个碳原子不可能都在同一平面上
8 思考:该分子结构中至少可以有——个原子在 10 同一个平面?最多可以有——个原子在同一个 平面?
特征的碳碳叁键有什么特点呢?
乙烷
C—C
乙烯
C=C
120°
乙炔
C≡C
180°
键角 :109°28′ Nhomakorabea四种烃的结构对比
乙烷
推测乙炔可能具有的化学性质?
分子结构对比
甲烷 元素 分子式 CH4 最简式 CH4 乙烯 乙炔 苯
均为 C、H C2H4
C2H2 CH
C6H6 CH
CH2
CnH2n+2 CnH2n CnH2n-2 通式 (n≥1) (n≥2) (n≥2)
一、结构
甲烷 结构 式 乙烯 乙炔
HCCH
苯
结构 简式 分子 构型
CH4 CH2=CH2 CH≡CH 正四 面体
平面型 直线型 平面型
乙炔的物理性质
纯的乙炔是 (1)无色
(2)无味
(3)气体
(4)比空气稍轻
(5)微溶于水,易溶于有机溶剂。
物理性质的对比
甲烷 乙烯 无色 乙炔 无色 苯 无色
CH3CH3
CH2=CH2
思考:经实验测定,在相同条件下,乙炔气体密度是 氢气的13倍,又知它的含碳量为92.3%,求该烃 的分子式?
一、乙炔的分子组成和结构
分子式: C2H2 电子式: H∶C C∶H
结构式: H—C C—H 结构简式:HC CH
乙炔的空间结构是什么样的?
平面结构:直线型
讨论:乙炔的空间结构是直线型,表征它结构
