高考化学与化学能与电能有关的压轴题
备战高考化学与化学能与电能有关的压轴题附详细答案

备战高考化学与化学能与电能有关的压轴题附详细答案一、化学能与电能1.亚硝酰氯NOCl可用于合成清洁剂等。
它可用Cl2与NO在常温常压下合成:它的熔点为-64.5℃,沸点为-5.5℃,常温下是黄色的有毒气体,遇水易水解。
请按要求回答下列相关问题:(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为:______________________。
(2)制备NOCl的装置如下图所示,连接顺序为:a→_________________________(按气流自左向右方向,用小写字母表示)。
①装置A和B作用是①干燥NO和Cl2,②___________________________________________。
②装置D的作用是______________________________________。
③装置E中NOCl发生反应的化学方程式为________________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:该过程中阴极的电极反应式为:__________________________________________。
【答案】3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O e→f→c→b→d或f→e→c→b→d观察气泡调节气体流速防止E中水蒸气进入F,引起NOCl的水解 NOCl+2NaOH=NaCl+NaNO2+H2O 2HSO3—+2e—+2H+= S2O42—+ 2H2O【解析】【分析】(1)过量铁屑和稀硝酸反应生成硝酸亚铁、一氧化氮和水;(2)将氯气和NO干燥后在装置F中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,注意NOCl遇水易水解。
(3)由间接电化学法示意图可知,阴极上HSO3—放电生成S2O42—,S2O42—在吸收塔中将NO还原为N2。
【详解】(1)过量铁屑和稀硝酸反应生成硝酸亚铁、一氧化氮和水,反应的离子方程式为3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O,故答案为3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O;(2)将氯气和NO干燥后在装置F中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,故答案为e→f(或f→e)→c→b→d;①装置A和B作用是除干燥NO、Cl2外,另一个作用是通过观察气泡调节气体的流速控制反应的发生,故答案为观察气泡调节气体流速;②NOCl遇水易水解,装置D中氯化钙做干燥剂,吸收水蒸气,防止E中水蒸气进入反应器F中,引起NOCl的水解,故答案为防止E中水蒸气进入F,引起NOCl的水解;③装置E的目的吸收尾气,防止污染环境,NOCl与氢氧化钠溶液反应生成NaCl、NaNO2和H2O,反应的化学方程式为NOCl+2NaOH=NaCl+NaNO2+H2O,故答案为NOCl+2NaOH=NaCl+NaNO2+H2O;(3)由间接电化学法示意图可知,阴极上HSO3—放电生成S2O42—,S2O42—在吸收塔中将NO还原为N2,阴极的电极反应式为2HSO3—+2e—+2H+= S2O42—+ 2H2O,故答案为2HSO3—+2e—+2H+= S2O42—+ 2H2O。
高考化学压轴题专题化学能与电能的经典综合题及答案解析

高考化学压轴题专题化学能与电能的经典综合题及答案解析一、化学能与电能1.研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。
某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有________(填序号)。
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐_______________(填“加快”、“不变”、“减慢”),你认为影响因素为________________________________________时间/min13579液柱高度/cm0.8 2.1 3.0 3.7 4.2(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:实验操作实验现象实验结论向 NaCl溶液中滴加 2~3 滴酚酞指示剂a 点附近溶液出现红色a 点电极反应为①___________________然后再滴加 2~3 滴②________________b 点周围出现蓝色沉淀b 点电极反应为③___________________根据以上实验探究,试判断____________(填“a”或“b”)为负极,该点腐蚀更严重。
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。
测定锥形瓶内气压和空气中氧气的体积分数随时间变化见下图,从图中可分析,t1~t2之间主要发生__________ 腐蚀(填吸氧或析氢),原因是__________________________________________。
(5)金属阳极钝化是一种电化学防腐方法。
将 Fe 作阳极置于 H2SO4溶液中,一定条件下Fe 钝化形成致密 Fe3O4氧化膜,试写出该阳极电极反应式________________________。
高考化学与化学能与电能有关的压轴题及详细答案
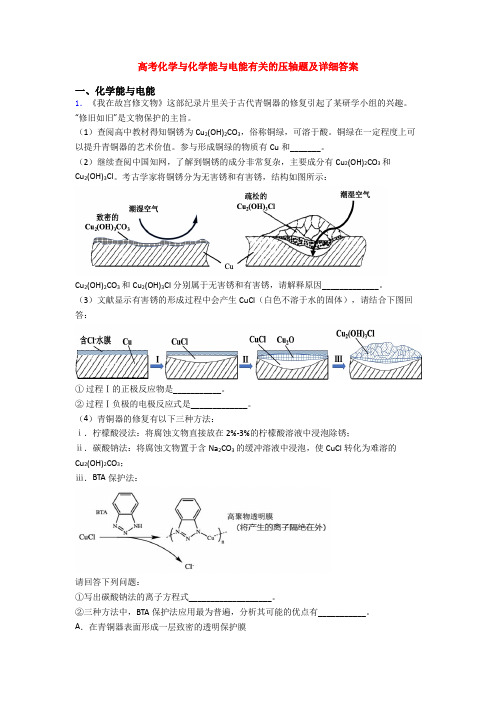
高考化学与化学能与电能有关的压轴题及详细答案一、化学能与电能1.《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。
“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。
铜绿在一定程度上可以提升青铜器的艺术价值。
参与形成铜绿的物质有Cu和_______。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。
考古学家将铜锈分为无害锈和有害锈,结构如图所示:Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:①过程Ⅰ的正极反应物是___________。
②过程Ⅰ负极的电极反应式是_____________。
(4)青铜器的修复有以下三种方法:ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;ⅲ.BTA保护法:请回答下列问题:①写出碳酸钠法的离子方程式___________________。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________。
A.在青铜器表面形成一层致密的透明保护膜B.替换出锈层中的Cl-,能够高效的除去有害锈C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”【答案】O2、H2O、CO2碱式碳酸铜为致密结构,可以阻止潮湿空气进入内部进一步腐蚀铜;而碱式氯化铜为疏松结构,潮湿空气可以进入空隙内将内部的铜进一步腐蚀氧气(H2O) Cu-e-+Cl-=CuCl 4CuCl+O2+2H2O+2CO32-=2Cu2(OH)2CO3+4Cl- ABC【解析】【分析】(1)由质量守恒定律可知,反应前后元素种类不变;(2)结合图像可知,Cu2(OH)2CO3为致密结构,Cu2(OH)3Cl为疏松结构;(3)正极得电子发生还原反应,过程Ⅰ的正极反应物是氧气,Cu作负极;(4)在青铜器表面形成一层致密的透明保护膜;替换出锈层中的Cl-,能够高效的除去有害锈;BTA保护法不破坏无害锈。
高考化学压轴题专题化学能与电能的经典综合题含答案(1)

高考化学压轴题专题化学能与电能的经典综合题含答案(1)一、化学能与电能1.方法与规律提炼:(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag +Fe3+能够发生的实验操作及现象是_________________________(2)用零价铁(Fe)去除水体中的硝酸盐(NO)已成为环境修复研究的热点之一。
Fe还原水体中NO3-的反应原理如图所示。
上图中作负极的物质是___________。
正极的电极反应式是______________。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。
电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____【答案】负 FeSO4或FeCl2溶液分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深铁 NO3-+8e-+10H+=NH4++3H2O Fe3++e-= Fe2+ 5.6L 2H++2e-= H2 ↑ K+a→b原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。
高考化学—化学能与电能的综合压轴题专题复习附详细答案

高考化学—化学能与电能的综合压轴题专题复习附详细答案一、化学能与电能1.电解原理在化学工业中有广泛应用。
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题。
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:(1)电解池中X极上的电极反应式是____________,在X极附近观察到的现象是_________________。
(2)Y电极上的电极反应式是____________,检验该电极反应产物的方法是____________。
【答案】2H++2e-=H2↑放出气体,溶液变红 2Cl--2e-=Cl2↑把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝【解析】【详解】由题意或图像可知,此池为电解池,X极为阴极,Y极为阳极。
电极为惰性电极,饱和NaCl溶液中存在Na+、Cl-、H+、OH-,在阴极上,H+放电能力强于Na+,故阴极上发生的电极反应式为2H++2e-=H2↑,因而导致X极附近有气体放出,溶液呈碱性,溶液颜色由无色变为红色;在阳极上,Cl-放电能力强于OH-,故阳极上发生的电极反应式为2Cl--2e-=Cl2↑。
2.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。
Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。
阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。
此时,应向污水中加入适量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH(2)电解池阳极发生了两个电极反应,电极反应式分别是Ⅰ.___________________;Ⅱ._________________;(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是__________________;(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
高考化学——化学能与电能的综合压轴题专题复习及详细答案

高考化学——化学能与电能的综合压轴题专题复习及详细答案一、化学能与电能1.FeSO4溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
(稳定是指物质放置在空气中不易发生各种化学反应而变质)I.硫酸亚铁铵晶体的制备与检验(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。
向 FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-II.实验探究影响溶液中 Fe2+稳定性的因素(3)配制 0.8 mol/L 的 FeSO4溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)沉淀Fe(OH)2Fe(OH)3开始沉淀pH7.6 2.7完全沉淀pH9.6 3.7①请用离子方程式解释 FeSO4溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中 Fe2+稳定性较好。
高考化学与化学反应与能量变化有关的压轴题含答案解析

高考化学与化学反应与能量变化有关的压轴题含答案解析一、化学反应与能量变化练习题(含详细答案解析)1.短周期元素X、Y、Z、W、R、T在周期表中的位置如图所示。
请按要求回答下列问题。
(1)R与W形成化合物的电子式为________________________。
(2)Y的氢化物与T的氢化物反应的生成物中含有的化学键为_________。
(3)X与Z形成的二元化合物中,所含电子数为18的分子的化学式为______。
(4)实验室制取T单质的离子方程式为______________________________。
(5)如图,a、b为多孔石墨电极(电极不参与反应),插入W的最高价氧化物对应水化物的溶液中,两端分别通入X单质和Z单质,发现电流计指针发生偏转。
①电池工作时,电子的移动方向为由_____到_____(填“a”或“b”)。
②该电池反应产物环保无污染,则该电池的总反应式为____________。
【答案】离子键、共价键 H2O2 MnO2+4H++2Cl-ΔMn2++Cl2↑+2H2O ab 2H2+O2=2H2O【解析】【分析】根据元素在周期表的位置可得,X为H元素,Y为N元素,Z为O元素,W为Na元素,R 为S元素,T为Cl元素,据此分析解答;【详解】(1) R为S元素,W为Na元素,R与W形成化合物为Na2S,电子式为;(2) Y为N元素,T为Cl元素,Y的氢化物与T的氢化物分别为NH3和HCl,反应的生成物为NH4Cl,属于含有共价键的离子化合物,其中含有的化学键为离子键、共价键;(3) X为H元素,Z为O元素,X与Z形成的二元化合物为H2O、H2O2,所含电子数为18的分子的化学式为H2O;(4) T为Cl元素,实验室用二氧化锰和浓盐酸在加热的条件下制取氯气,的离子方程式为MnO 2+4H ++2Cl -ΔMn 2++Cl 2↑+2H 2O ;(5) W 为Na 元素,W 的最高价氧化物对应水化物的溶液为氢氧化钠溶液,两端分别通入H 2和O 2,发现电流计指针发生偏转,说明该装置构成氢氧燃料电池。
高考化学与化学能与电能有关的压轴题附答案解析

高考化学与化学能与电能有关的压轴题附答案解析一、化学能与电能1.方法与规律提炼:(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag +Fe3+能够发生的实验操作及现象是_________________________(2)用零价铁(Fe)去除水体中的硝酸盐(NO)已成为环境修复研究的热点之一。
Fe还原水体中NO3-的反应原理如图所示。
上图中作负极的物质是___________。
正极的电极反应式是______________。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。
电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____【答案】负 FeSO4或FeCl2溶液分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深铁 NO3-+8e-+10H+=NH4++3H2O Fe3++e-= Fe2+ 5.6L 2H++2e-= H2 ↑ K+a→b原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学与化学能与电能有关的压轴题一、化学能与电能1.二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。
某研究小组欲用以下三种方案制备ClO2,回答下列问题:(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。
实验室模拟该过程的实验装置(夹持装置略)如图所示。
①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。
某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。
【答案】FeS2+15ClO3-+14H+=15ClO2+Fe3++2SO42-+7H2O 恒压漏斗安全瓶提高化学反应速率,同时防止过氧化氢受热分解稀释ClO2,防止其爆炸 2CN-+2ClO2=2CO2+N2+2Cl-吸收ClO2等气体,防止污染大气 BaCl2 Cl--5e-+2H2O=ClO2↑+4H+【解析】【分析】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
分别利用无机反应和电解原理制备二氧化氯,三种方法均利用了氧化还原反应。
【详解】(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,根据氧化还原反应中电子守恒和元素守恒,可以写出制备ClO2的离子方程式为FeS2+15ClO3-+14H+=15ClO2+Fe3++2SO42-+7H2O。
(2)①装置A的名称为恒压漏洞,装置C为安全瓶,起到防止液体倒吸的作用。
②升高温度可以提高化学反应速率,但是原料中含有过氧化氢,过氧化氢在过高的温度下可以发生分解反应,因此反应容器B应置于30℃左右的水浴中。
③根据题文可知,ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸,故通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是稀释ClO2,防止其爆炸。
④ClO2处理含CN-废水发生氧化还原反应,将CN-转化为无污染的CO2和N2,故离子方程式为2CN-+2ClO2=2CO2+N2+2Cl-;装置E在整套装置之后,起到吸收尾气,防止环境污染的作用。
(3)①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质,需要过量的碳酸根离子、氢氧根离子和钡离子,过量的钡离子可以用碳酸根离子除去,因此在加入Na2CO3之前应先加入过量BaCl2。
②用石墨做电极,电解池的阳极发生氧化反应,元素化合价升高,因此氯离子在阳极失电子和水反应得到ClO2,电极反应式为Cl--5e-+2H2O=ClO2↑+4H+。
2.某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。
请回答下列问题:(1)从 a口通入的气体为_______。
(2)B电极的电极材料是________。
(3)写出甲中通甲烷一极的电极反应式:________________________________ 。
(4)写出乙中发生的总反应的离子方程式为________________________________。
【答案】氧气粗铜 CH4 -8e- + 10OH- = CO32-+ 7H2O 2Cl-+2H2O Cl2↑+H2↑+2OH-【解析】【分析】乙装置为探究氯碱工业原理,说明铁电极为阴极,则b为电源的负极,即通入甲烷,a为电源的正极,通入氧气。
丙为电解精炼铜,则A为精铜,B为粗铜。
【详解】乙装置为探究氯碱工业原理,说明铁电极为阴极,则b为电源的负极,即通入甲烷,a为电源的正极,通入氧气。
丙为电解精炼铜,则A为精铜,B为粗铜。
(1)根据分析a极通入的为氧气;(2)B连接电源的正极,是电解池的阳极,应为粗铜;(3)根据电解质溶液为氢氧化钾分析,甲烷失去电子生成碳酸根离子,电极反应为CH4 -8e- + 10OH- = CO32-+ 7H2O;(4)乙为电解氯化钠溶液,电解反应方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。
【点睛】掌握电解池的工作原理。
若阳极为活性电极,即是除了铂金以外的其它金属时,金属放电,不是溶液中的阴离子放电。
阴极为溶液中的阳离子放电。
掌握燃料电池的电极的书写。
注意电解质的酸碱性。
3.某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
查阅资料:Ag+ + I-= AgI↓ K1=1.2×1016;2Ag+ + 2I-= 2Ag↓+ I2K2= 8.7×108(1)方案1:通过置换反应比较向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性Ag+>Cu2+。
反应的离子方程式是___________________________________________________。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较实验试剂编号及现象试管滴管1.0 mol/LKI溶液1.0 mol/L AgNO3溶液Ⅰ.产生黄色沉淀,溶液无色1.0 mol/L CuSO4溶液Ⅱ.产生白色沉淀A,溶液变黄①经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
②经检验,Ⅱ中溶液含I2。
推测Cu2+做氧化剂,白色沉淀A是CuI。
确认A的实验如下:a.检验滤液无I2。
溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是___________,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:编号实验1实验2实验3实验KI溶液KI溶液 AgNO3溶液a bKI溶液 CuSO4溶液c d现象无明显变化a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转c中溶液较慢变浅黄色;电流计指针偏转(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)①a中溶液呈棕黄色的原因是___________________________(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。
依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_____________________________。
③方案2中,Cu2+能氧化I-,而Ag+未能氧化I-。
其原因一是从K值分析:______;二是从Cu2+的反应特点分析:______________________________________________。
【答案】Cu+2Ag+=2Ag+Cu2+;AgI Cu2+AgCl CuI+2Ag+=Cu2++Ag+AgI2I――2e-=I2将d烧杯内的溶液换为pH≈4的1 mol/L Na2SO4溶液,c中溶液较慢变浅黄,电流计指针偏转K1>K2,故Ag+更易与I_发生复分解反应,生成AgI2Cu2+ + 4I- = 2CuI + I2,生成了CuI沉淀,使得Cu2+的氧化性增强【解析】【分析】【详解】(1)向酸化的硝酸银中插入铜丝,析出黑色固体,溶液变蓝,说明银离子氧化铜,反应生成银单质和铜离子,反应的离子方程式为:Cu+2Ag+=2Ag+Cu2+; (2)经过检验,Ⅱ中溶液含有碘单质,推测铜离子做氧化剂,白色沉淀A为碘化亚铜,沉淀A中加入足量硝酸银溶液得到灰黑色沉淀,过滤得到滤液为蓝色,说明生成了铜离子,滤渣加入浓硝酸得到黄色沉淀为碘化银,溶液中加入稀盐酸生成白色沉淀,说明B为氯化银。
①经检验,Ⅰ中溶液不含I2,黄色沉淀为AgI。
②a.检验滤液无I2。
溶液呈蓝色说明溶液含有铜离子;b.白色沉淀B是氯化银;c.白色沉淀A与AgNO3溶液反应的离子方程式是CuI+2Ag+=Cu2++Ag+AgI。
(3). ①a中溶液较快变棕黄色,b中电极上析出银,说明形成原电池,a为负极失去电子发生氧化反应,溶液变黄色是生成了碘单质,电极反应为2I――2e-=I2。
②实验3不能说明铜离子氧化碘离子,依据是空气中的氧气也有氧化作用,设计实验验证了该依据,实验方案及现象为:将d烧杯内的溶液换为pH≈4的1 mol/L Na2SO4溶液,c中溶液较慢变浅黄,电流计指针偏转。
③方案2中,铜离子氧化碘离子,而银离子未能氧化碘离子的原因,K1>K2,故Ag+更易与I_发生复分解反应,生成AgI。
铜离子氧化碘离子的方程式为:2Cu2+ + 4I- = 2CuI + I2,生成了CuI沉淀,使得Cu2+的氧化性增强。
4.某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
I.KCl作电解质(1)一定电压下,按图-1装置电解,现象如下:石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。
5min后U型管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10min后断开K。
按图-2进行实验。
①石墨电极上的电极反应式是________。
②确认灰绿色固体中含有Fe2+的实验现象是_______。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。
结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_______。
(2)其他条件不变时,用图-3装置重复实验,10min后铁电极附近溶液依然澄清,断开K。
按图-4进行实验①盐桥的作用是_______。
②与实验I中vi、vii与ii~v中的现象比较,可以得出的结论是(答两点):_______。
II.KOH作电解质(3)用图-1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(),没有沉淀产生。
①铁电极上OH-能够放电的原因是______。
②阳极生成的总电极反应式是______。
③某同学推测生成的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
______【答案】2H+ + 2e-= H2↑(或2H2O + 2e- = 2OH- + H2↑)试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀试管i中存在溶解平衡:KCl (s)K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸,增大c(Cl-),平衡逆向移动,析出KCl晶体阻碍OH-向阳极迁移,避免灰绿色固体生成本实验条件下铁在阳极区的产物主要为Fe2+ ,Fe2+在碱性条件下更容易被氧化为Fe3+c(OH-)增大,反应速率加快(更容易放电)Fe -6e-+ 8OH-= FeO42- +4H2O 水;生成红褐色沉淀和无色气体【解析】(1)①石墨电极为阴极,溶液中的氢离子放电生成氢气,电极反应式为2H+ + 2e-= H2↑(或2H2O + 2e- = 2OH- + H2↑),故答案为:2H+ + 2e-= H2↑(或2H2O + 2e- = 2OH- +H2↑);②灰绿色固体用盐酸溶解后的溶液中加入铁氰化钾溶液,生成蓝色沉淀,灰绿色悬浊液过滤后的溶液中加入铁氰化钾溶液,无蓝色沉淀生成,说明灰绿色悬浊液中含有Fe2+,故答案为:试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀;③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色,说明含有钾元素,是因为试管i中存在溶解平衡:KCl (s) K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸,增大c(Cl-),平衡逆向移动,析出KCl晶体,白色晶体为氯化钾晶体,故答案为:试管i中存在溶解平衡:KCl(s) K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸,增大c(Cl-),平衡逆向移动,析出KCl晶体;(2)①盐桥中的氯离子代替氢氧根离子向阳极移动,避免灰绿色固体生成,故答案为:阻碍OH-向阳极迁移,避免灰绿色固体生成;②根据实验I中vi、vii与ii~v中的现象比较可知,①vii中加入铁氰化钾溶液后生成大量蓝色沉淀,说明在使用盐桥的实验条件下铁在阳极区的产物主要为Fe2+ ,vi中溶液在加入KSCN溶液后呈浅红色,说明Fe2+在碱性条件下更容易被氧化为Fe3+,故答案为:本实验条件下铁在阳极区的产物主要为Fe2+ ;Fe2+在碱性条件下更容易被氧化为Fe3+;(3)①c(OH-)增大,反应速率加快,使得铁电极上OH-能够放电,故答案为:c(OH-)增大,反应速率加快(更容易放电);②阳极上生成的氧气能够将亚铁离子氧化生成FeO42-,反应的总电极反应式为Fe -6e-+8OH-= FeO42- +4H2O,故答案为:Fe -6e-+ 8OH-= FeO42- +4H2O;③要推测生成FeO42-的必要条件是浓碱环境,只需要改变溶液的碱性,看是否仍然生成FeO42-即可,实验方案为:将淡紫色(FeO42-)溶液加入水中稀释,使溶液的碱性减弱,4FeO42-+10H2O⇌4Fe(OH)3↓+8OH-+3O2↑,看到生成红褐色沉淀和无色气体,即可说明生成FeO42-的必要条件是浓碱环境,故答案为:水;生成红褐色沉淀和无色气体。
