高等工程热力学-第一章、热力学基本原理及定义
高等工程热力学第1章
t
( C) =5 t(F ) 32 9
° °
33
☻ 压力
绝对压力 p;
表压力 pe(pg); 真空度 pv;
p=
F A
p = pb + pe ( p > pb )
p = pb - pv ( p < pb )
动压力、静压力、滞止压力和绝对压力 ?
☻ 热力学能
Uch
G = G( p, T , n1 , n2 , , nr )
热力平衡系统
其中
是驱使第i 种组分变化的势,即化学势:
12
用A表示的化学势
改变约束条件,化学势还可有其它的表达式、但是 无论如何表示,其实质都相同:
据化学势概念,定温、定容和定压、定温系统的 平衡判据:
13
四. 稳定平衡判据
力学中平衡的稳定性
+
+
1
b2
1
C)状态参数分类: 广延量 强度量 (广延量的比性质,具有强度量特性)32
► 系统两个状态相同的充要条件: 所有状参一一对应相等 简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
► 基本状态参数
☻ 温度
测温的基础—热力学零定律 热力学温标和国际摄氏温标
{t } C = {T }K 273.15
δ AT ,V = 0
1
δ AT , V > 0
2
定温定压系统,平衡与稳定的条件
δ GT , p = 0
1
δ GT , p > 0
2
16
过程
不同形式能量之间的转换必须通过工质的状态变化过程才 能完成。 一切过程都是平衡被破坏的结果,工质和外界有了热的、力的 或化学的不平衡才促使工质向新的状态变化,故实际过程都是不 平衡的。
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
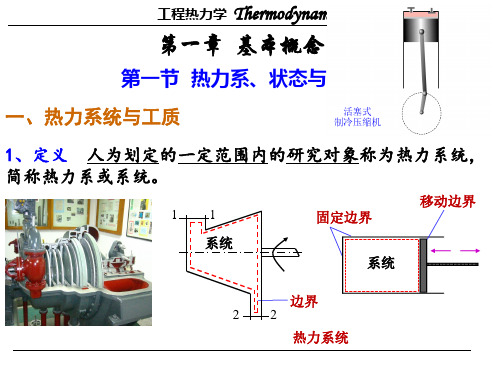
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
高等工程热力学

高等工程热力学介绍热力学是研究能量转化和热效应的科学。
而高等工程热力学则是在原有的基础上针对工程领域的应用进行深入研究的学科。
本文将介绍高等工程热力学的基本概念、原理和应用,以及相关的一些实例。
热力学基本概念热力学的基本概念有热力学系统、热力学过程、热力学性质等。
一个热力学系统是指进行能量交换的物理系统,可以是封闭系统、开放系统或者孤立系统。
热力学过程是指系统从一种状态变换到另一种状态的过程,可以是等温过程、绝热过程、等压过程等。
热力学性质是指描述热力学系统的特性,比如温度、压力、体积等。
热力学原理高等工程热力学基于热力学原理进行研究。
其中,热力学第一定律是能量守恒原理,它表明能量不能被创造或者毁灭,只能从一种形式转换为另一种形式。
热力学第二定律是能量传递的方向性原理,它表明热量自然地从高温物体流向低温物体,而不会反向流动。
熵增原理是热力学第二定律的数学表述,它描述了系统熵的增加趋势。
熵是一个衡量系统有序程度的指标,它的增加代表了能量的不可逆损失。
高等工程热力学应用高等工程热力学的应用十分广泛,涉及到多个工程领域。
以下是一些常见的应用实例:热力学循环分析高等工程热力学经常用于分析热力学循环,如蒸汽动力循环、制冷循环等。
通过对循环中各个组成部分的能量转换和损失进行研究,可以优化循环的效率和性能。
热传导计算在工程中,热传导是一个重要的问题。
高等工程热力学可以通过研究热传导的原理和机制,优化工程中的热传导问题,提高热传导的效率。
热力学系统优化通过对热力学系统进行优化设计,可以提高能量转换效率,降低能量消耗。
高等工程热力学可以通过分析系统的热力学性质,找到最优化的设计方案。
新能源开发高等工程热力学也可以应用于新能源的开发。
通过对新能源的高温特性、热力学性质进行研究,可以优化新能源的利用方式,提高能源利用效率。
结论高等工程热力学是热力学在工程领域中的应用和发展。
它通过研究热力学原理和原理的应用,优化工程中的能量转换和热效应问题。
工程热力学概念整理

⼯程热⼒学概念整理⼯程热⼒学与传热学概念整理⼯程热⼒学第⼀章、基本概念1.热⼒系:根据研究问题的需要,⼈为地选取⼀定范围内的物质作为研究对象,称为热⼒系(统),建成系统。
热⼒系以外的物质称为外界;热⼒系与外界的交界⾯称为边界。
2.闭⼝系:热⼒系与外界⽆物质交换的系统。
开⼝系:热⼒系与外界有物质交换的系统。
绝热系:热⼒系与外界⽆热量交换的系统。
孤⽴系:热⼒系与外界⽆任何物质和能量交换的系统3.⼯质:⽤来实现能量像话转换的媒介称为⼯质。
4.状态:热⼒系在某⼀瞬间所呈现的物理状况成为系统的状态,状态可以分为平衡态和⾮平衡态两种。
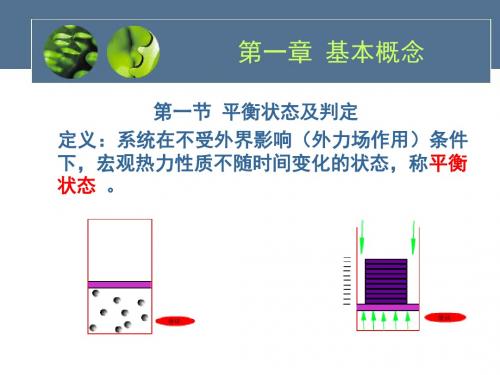
5.平衡状态:在没有外界作⽤的情况下,系统的宏观性质不随时间变化的状态。
实现平衡态的充要条件:系统内部与外界之间的各种不平衡势差(⼒差、温差、化学势差)的消失。
6.强度参数:与系统所含⼯质的数量⽆关的状态参数。
⼴延参数:与系统所含⼯质的数量有关的状态参数。
⽐参数:单位质量的⼴延参数具有的强度参数的性质。
基本状态参数:可以⽤仪器直接测量的参数。
7.压⼒:单位⾯积上所承受的垂直作⽤⼒。
对于⽓体,实际上是⽓体分⼦运动撞击壁⾯,在单位⾯积上所呈现的平均作⽤⼒。
8.温度T:温度T是确定⼀个系统是否与其它系统处于热平衡的参数。
换⾔之,温度是热⼒平衡的唯⼀判据。
9.热⼒学温标:是建⽴在热⼒学第⼆定律的基础上⽽不完全依赖测温物质性质的温标。
它采⽤开尔⽂作为度量温度的单位,规定⽔的汽、液、固三相平衡共存的状态点(三相点)为基准点,并规定此点的温度为273.16K。
10状态参数坐标图:对于只有两个独⽴参数的坐标系,可以任选两个参数组成⼆维平⾯坐标图来描述被确定的平衡状态,这种坐标图称为状态参数坐标图。
11.热⼒过程:热⼒系从⼀个状态参数向另⼀个状态参数变化时所经历的全部状态的总和。
12.热⼒循环:⼯质由某⼀初态出发,经历⼀系列状态变化后,⼜回到原来初始的封闭热⼒循环过程称为热⼒循环,简称循环。
13.准平衡过程:由⼀系列连续的平衡状态组成的过程称为准平衡过程,也成准静态过程。
高等工程热力学 - 绪论

工程热力学 高等工程热ຫໍສະໝຸດ 学 热经济学二、本门课的内容
第一章 热力学基本原理及定义
§1-1 外界分析法(SAM)的热力学模型 §1-2 热力学第一定律 §1-3 热力学第二定律
第二章
热力学微分方程及工质的通用热力性质
§2-1 特性函数
§2-2 热物性参数 §2-3 热力学能、焓及熵的一般关系式 §2-4 有关比热的热力学关系式
四、教材与参考书目
教材:《工程热力学》(第二版)陈贵堂,王永珍, 北京理工大学出版社,2008.1
参考书目:
● 《工程热力学学习指导》陈贵堂,王永珍,北京理工大学出版社
●《高等工程热力学》陈宏芳,杜建华,清华大学出版社 ●《高等工程热力学》苏长荪,高等教育出版社 ●《高等工程热力学》童钧耕, 吴孟余, 王平阳编著,科学出版社
§2-5 焦尔—汤姆孙系数
§2-6 克拉贝龙方程 §2-7 工质的通用热力性质
第三章
无化学反应的多元系统
§3-1 吉布斯方程组 §3-2 齐次函数及欧拉定理 §3-3 分摩尔参数 §3-4 逸度 §3-5 标准态及理想溶液 §3-6 实际溶液、活度及活度系数 §3-7多元系统的相平衡
第四章
化学热力学
高等工程热力学
Advanced Engineering Thermodynamics
绪 论
一、热力学(Thermodynamics )
(狭义)研究热能以及热能与其它能量相互转换 规律的科学。 (广义)研究能量属性及其转换规律,以及工质 热力性质及其变化规律的科学。 研究目的: 掌握和应用这些规律,充分合理地利用能量。 分类 分统计热力学 经典热力学
§4-1 质量守恒定律在化学反应过程中的应用
工程热力学(基本概念)
国际实用温标的固定点
平衡状态
平衡氢三相点 平衡氢沸点 氖沸点 氧三相点 氧冷凝点
国际实用温标指定
值
T,K
t,℃
13.81 -259.34
20.28 -252.87
20.102 -246.048
54.361 -218.789
90.183 -182.962
平衡状态
水三相点 水沸点
锌凝固点 银凝固点 金凝固点
一、热力过程
定义:热力系从一个状态向另一个状态变化时所经 历的全部状态的总和。
二、准平衡(准静态)过程
准平衡过程的实现
工程热力学 Thermodynamics
二、准平衡(准静态)过程
定义:由一系列平衡态组成的热力过程 实现条件:破坏平衡态存在的不平衡势差(温差、
力差、化学势差)应为无限小。 即Δp→0 ΔT→0 (Δμ→0)
工程热力学 Thermodynamics
三、可逆过程
力学例子:
定义: 当系统完成某一热力过程后,如果有可能使系统再
沿相同的路径逆行而恢复到原来状态,并使相互中所涉 及到的外界亦恢复到原来状态,而不留下任何变化,则 这一过程称为可逆过程。
实现条件:准平衡过程加无耗散效应的热力过程 才是可逆过程。
工程热力学 Thermodynamics
用来实现能量相互转换的媒介物质称为工质。
理想气体
工 质
实际气体
蒸气
工程热力学 Thermodynamics
二、平衡状态
(一)热力状态:热力系在某一瞬间所呈现的宏观
物理状况。(简称状态)
(二)平衡状态 1、定义:一个热力系统,如果在不受外界影响的条件下,
系统的状态能够始终保持不变,则系统的这种状态称为平衡 状态。
第一章工程热力学基础解读

第一章工程热力学基础第一节工质热力状态的基本参数一、状态与状态参数状态:热力系统中某瞬间表现的工质热力性质的总状况。
状态参数:描述工质状态特性的各种状态的宏观物理量。
如:温度(T )、压力(P )、比容(υ)或密度(ρ)、内能(u )、焓(h )、熵(s )、自由能(f )、自由焓(g )等。
状态参数的数学特性:1.1212x x dx 表明:状态的路径积分仅与初、终状态有关,而与状态变化的途径无关。
2.dx =0表明:状态参数的循环积分为零基本状态参数:可直接或间接地用仪表测量出来的状态参数。
如:温度、压力、比容或密度温度:宏观上,是描述系统热力平衡状况时冷热程度的物理量。
微观上,是大量分子热运动强烈程度的量度BTwm 22式中22wm —分子平移运动的动能,其中m 是一个分子的质量,w 是分子平移运动的均方根速度;B —比例常数;T —气体的热力学温度。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
摄氏度与热力学温度的换算:tT 2732.压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
f Fp 式中:F —整个容器壁受到的力,单位为牛顿(N );f —容器壁的总面积(m 2)。
微观上:分子热运动产生的垂直作用于容器壁上单位面积的力。
nBTwm n p 322322式中:P —单位面积上的绝对压力;n —分子浓度,即单位容积内含有气体的分子数V N n ,其中N 为容积V 包含的气体分子总数。
压力测量依据:力平衡原理压力单位:MPa相对压力:相对于大气环境所测得的压力。
工程上常用测压仪表测定的压力。
以大气压力为计算起点,也称表压力。
g p B p (P>B )H B p (P<B )式中B —当地大气压力P g —高于当地大气压力时的相对压力,称表压力;H —低于当地大气压力时的相对压力,称为真空值。
注意:只有绝对压力才能代表工质的状态参数3.比容:比容:单位质量工质所具有的容积。
工程热力学第1章-基本概念

输出净功; 在p-v图及T-s图上顺时针进行; 膨胀线在压缩线上方;吸热线在放热线上方。
河北理工大学
工程热力学
四、逆向循环(reverse cycle)
▲制冷循环(refrigeration cycle) ▲热泵循环(heat-pump cycle)
一般地讲:输入净功; 在状态参数图逆时针运行; 吸热小于放热。
t C TK 273.15
河北理工大学
工程热力学
河北理工大学
工程热力学
华氏温标和摄氏温标
{t} ℃=5/9[{t} ℉-32]
{t} ℉ =9/5{t} ℃ +32
河北理工大学
工程热力学
五、压力(pressure)
压力计所测得的压力为工质的真实压力(或 称绝对压力)与环境介质压力之差,叫做表 压力或真空度。 绝对压力 p (absolute pressure) 表压力 pe(pg)(gauge pressure) 真空度 pv(vacuum; vacuum pressure) 当地大气压pb(local atmospheric pressure)
孤立系统(isolated system)— 热力系统与外界无任何形式的能量 和物质交换。
注意: 1)闭口系统与系统内质量不变的区别; 2)开口系统与绝热系统的关系; 3)孤立系统与绝热系统的关系。
河北理工大学
工程热力学
四、热力系示例
1.刚性绝热气缸-活塞系统,B侧设有电热丝 红线内 ——闭口绝热系统 黄线内不包含电热丝 ——闭口系统 黄线内包含电热丝 ——闭口绝热系统 兰线内 ——孤立系统
河北理工大学
工程热力学
作功过程
p
pb
F
f
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑵试写出终态温度T2及排出质量me的表达式。
§1-3 热力学第二定律
一、热力学第二定律的实质及说法
1、热力学第一定律的局限性及热力学第二定律的实质
◆热力学第一定律的实质是能量转换及守恒定律。.
◆任何一个已经完成或正在进行的过程都遵循热力学第一定律。
◆热过程是有方向性的,过程的进行是有条件的, 并有一定的限度。
◆热力学第一定律具有局限性。
热力学第二定律的实质----能质衰贬原理
◆热力学第二定律揭示了不同形式的能量,在转换成功 量的能力上是有“质”的差别的;
◆即使同一种形式的能量,其存在状态不同时,它的转 换能力也是不同的。
◆正是因为各种不同存在形式或不同存在状态的能量, 在传递及转换能力上存在着“质”的差别,所以,在能 量传递及转换过程中,就呈现出一定的方向、条件及限 度的特征。
①能量的存在形式。 有序能>无序能 ②周围环境----定义能质高低的共同基准。
“不能脱离周围环境来进行能质分析!” ③能量的存在状态,即系统所处的状态。
2、寂态(dead state)
当系统与周围环境达到热力学平衡时,系统的状态称为寂态。 此系统中的能量就完全丧失了转换的能力,其能质为零。因此, 寂态可以作为度量任何系统能量品位高低的统一基准。 系统的状态偏离寂态越远,系统能量的品位越高。
∴ 而
则
忽略动、位能变化,则
一种流体的焓增加等于另一种流体的焓减。 即一种流体的吸收的热量等于另一种放出的热量。
例3、喷管
0
0
0
则 对1kg流动工质
∵ ∴ ∴
例4、绝热节流
0
0
0
则
忽略动、位能变化,则
注意:①绝热节流前后焓值相等,但不是一个定焓过程。
②节流过程是不可逆过程。
对绝热节流前后,虽能量在数量上不变,但能质衰贬。
net positive work is impossible to construct。
第二类永动机是不可能制成的。
热力学第二定律还可以概括为更一般的说法:
一切自发过程都是不可逆的; 一切实际过程都是不可逆的; 孤立系统的熵增原理; “能质衰贬”原理.
二、 有关能“质”的基本概念
1、影响能量品位的因素
2. 热机循环和制冷循环
热机循环:
循环热效率:
制冷循环:
制冷系数: 热泵系数:
3、热力学第二定律的典型说法
克劳修斯说法Clausius Statement:
It is impossible to construct a device that operates in a cycle and produces no effect other than the transfer of heat from a lowertemperature body to a higher-temperature body.
热量的能流: 功量的能流: 质量流的能流:
质量流的能容量: 质量流的能流:
0
0
0
0
0
0
有关热力学的工程问题,一般可分为:
闭口系统 开口系统 特例
SSSF(稳定状态稳定流动)
USUF(均匀状态均匀流动 )
(1)闭口系统:
0
即 若忽略宏观动、位能的变化 则
若过程可逆 则
若针对一个循环
0
0
即
(2)开口系统
向真空容器中的绝热充气问题(p46)
由稳定气源( )向体积为V的刚性真空容器绝热
充气,直到容器内压力达到
时关闭阀门。
若已知该气体的比热力学能及比焓与温度的关系分别
为 : u=cvT,h=cpT,k=cp/cv, 试 计 算 充 气 终 了 时 ,
容器内气体的温度T2及充入气体的质量m2。
◆是否满足热力学第一定律的过程,都能够实现? 怎样实现?条件是什么? 例:①一杯热水放在桌子上,会自发地慢慢变冷。 ②杂技中耍手帕,或热功当量实验。 ③煤气(液化气)泄露事故。 热过程具有方向性。
◆自然界中的一切过程总是自发地朝着一定的方向进行。
◆但非自发过程并不是不可能实现的。非自发过程的实现 要花费一定的代价,需要补偿过程同时进行。 压气机→气体的压缩; 热机→热能转变为机械能; 制冷机→热量由低向高传递。
A: 若在 时间内, , , ,
则由 有 即 单位时间内
即
B: SSSF
0
则
例1、动力机与压气机
0
0
则
对1kg流动工质,
例2、换热器
(1)单以一种工质为系统(如1流体)
0
0
则
忽略动、位能的变化,则
即工质吸收(放出)的热量,等于其焓增(减)。
(2)以整个换热器中的工质为系统
0
0
0
SSSF 绝热
开尔文—普朗克说法 Kalvin-Planck Statement :
A device that operates in a cycle and has no effect on the surroundings other than the conversion of heat to an equivalent amount of
解:法一,CV
0
0
则
∴
∵
∴
∴
在绝热充气过程,焓转变为热力学能,
是不可逆过程,适用与任何工质。
又
∴
仅适用于理想气体。
法二,CM
0
0
∴ ∵ ∴ 又
∴
例6:绝热放气(p75)
有一个容积为V的刚性绝热容器,其中贮有 m1状态为p1及T1的理想气体,k为定值。阀门 开启后,一部分气体排向大气,待容器中压力 下降到p2时关闭阀门。
注意:无用能只是指能量的作功能力为零,并非绝对无用, 在非作功场合仍有使用价值。
第一章 热力学基本原理及定义
§1-1 外界分析法(SAM)的热力学模型 §1-2 热力学第一定律 §1-3 热力学第二定律
§1-1 外界分析法(SAM)的热力学模型
外界分析法的基本思想: 外因是变化的条件,
内因是变化的根据, 外因通过内因起作用。
§1-2 热力学第一定律
实质:能量守恒及转换定律
:系统的能容量, :系统的热力学能;
3.有用能及无用能 useful energy and unuseful energy
在一定的环境条件下,一定形态的能量中可以转换成可逆 功的最大理论限度,称为该种形态能量中的有用能,而不可能 转换成功的部分称为无用能。
若以系统能容量E为例,则有
系统在状态1时的有用能,可以用从状态1完全可逆地变化 到寂态0的理想过程中,所能作出的最大可逆功来度量。
