11 铁的单质及其化合物
第11讲 铁及其化合物(教师版)-2020-2021学年高一化学必修第一册同步培优精品讲义
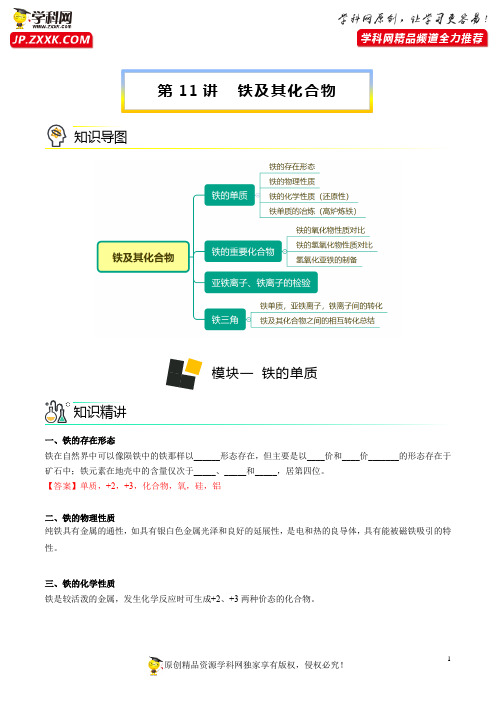
第11讲铁及其化合物知识导图模块一铁的单质知识精讲一、铁的存在形态铁在自然界中可以像陨铁中的铁那样以______形态存在,但主要是以____价和____价_______的形态存在于矿石中;铁元素在地壳中的含量仅次于_____、_____和_____,居第四位。
【答案】单质,+2,+3,化合物,氧,硅,铝二、铁的物理性质纯铁具有金属的通性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性。
三、铁的化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
资料卡片——生铁与纯铁的抗腐蚀性能1.Fe与非金属反应:(横线上填化学方程式)2.Fe与酸反应:(横线上填氧化产物及还原产物)3.Fe与水反应(1)反应原理:_____________________________________________。
【答案】3Fe + 4H2O(g) =====高温Fe3O4 + 4H2(2)实验装置思考与交流【答案】1.提供水蒸气;2.检验反应中生成的H2;3.铁与水反应是有条件的,铁在高温条件下与水蒸气反应,铁不与冷、热水反应,故可以用铁壶盛水。
纯铁的抗腐蚀性能比生铁好。
原因是生铁中含有碳等物质,在有电解质溶液(比如雨水等)情况下会形成原电池,铁作为负极被加速腐蚀。
1.湿棉花的作用:______________________________________________________。
2.肥皂液的作用:______________________________________________________。
3.铁与水可以发生反应,为什么还可以用铁壶来盛水呢?4.铁与盐溶液反应:(横线上填化学方程式)5.常温下,铁在浓硫酸或浓硝酸中会发生钝化。
资料卡片——钝化原理归纳总结——铁的还原性四、铁单质的冶炼(高炉炼铁)铁单质冶炼的原理就是利用还原剂将铁从矿石中还原出来。
高中化学晶胞的相关计算专项训练知识点及练习题及答案

高中化学晶胞的相关计算专项训练知识点及练习题及答案一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.国庆70周年阅兵式展示了我国研制的各种导弹。
导弹之所以有神奇的命中率,与材料息息相关,镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物(如砷化镓、磷化镓等)都是常用的半导体材料。
回答下列问题:(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]__。
(2)根据元素周期律,原子半径Ga__As,第一电离能Ga__As。
(填“大于”或“小于”)(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是__。
3.1 铁及其化合物 讲义【新教材】人教版(2019)高中化学必修一(知识点+习题+作业)

第三章铁金属材料第一节铁及其化合物【必备方程式】知识点一铁的单质一、铁元素的存在1、含量铁元素在地壳中的含量仅次于氧、硅和铝。
2、存在形态(1)游离态:存在于陨铁中。
(2)化合态:主要以+2、+3价铁的化合物存在。
如黄铁矿(FeS2)、赤铁矿( Fe2O3)、磁铁矿(Fe3O4)、菱铁矿(FeCO3)等。
【习题】判断正误。
(1)铁元素在地壳中含量位于第三位。
()(2)在工业中炼制铁单质,所以自然界中无游离态铁。
()(3)工业炼铁,需加入还原剂。
()(4)钢和铁都是铁的合金,钢不易生锈,生铁易生锈,铁锈的主要成份是Fe3O4。
()二、铁的单质1、物理性质:银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
2、化学性质:铁是较活泼的金属,铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定。
①与非金属反应:3Fe + 2O2Fe3O42Fe + 3C122FeCl3说明:铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色。
△Fe + S FeS说明:铁跟氯气、硫反应时,分别生成+3价和+2价的铁,说明氧化性:氯气>硫。
①与水反应:A.在常温下,在水和空气中的O2、CO2等的共同作用下,Fe易被腐蚀(铁生锈)。
B.在高温下,铁能与水蒸气反应生成H2:3Fe + 4H2O(g)Fe3O4 + 4H2①与酸反应:A.与非氧化性酸(如稀盐酸、稀H2SO4等)的反应。
例如:Fe + 2H+Fe2++ H2↑B.铁遇到冷的浓H2SO4、浓HNO3时,产生钝化现象,因此金属铁难溶于冷的浓H2SO4或浓HNO3中。
但在加热条件也可以反应。
①与比铁的活动性弱的金属的盐溶液发生置换反应。
例如:Fe + Cu2+Fe2++ Cu【习题】1、下列物质中,不能与铁发生化学反应的是()A.盐酸B.氯化铁溶液C.氢氧化钠溶液D.氯气2、下列关于铁的叙述正确的是()。
高考化学复习考点知识专题讲解10 铁元素单质及其化合物

高考化学复习考点知识专题讲解专题十、铁元素的单质及其化合物考点知识铁及其化合物的知识年年必考,体现在三个方面:一是铁及其化合物之间的转化关系;二是Fe3+、Fe2+的氧化性与还原性;三是Fe3+、Fe2+的检验,主要题型为选择、计算、实验探究等。
以现代科技有关的问题,与社会生产生活紧密相连的问题为背景,考查Fe3+、Fe2+的氧化性、还原性。
饮用水的净化、FeCl3溶液腐蚀电路板等,也是热点之一。
重点、难点探源一、铁的主要性质及应用1、铁的物理性质铁具有金属的共性,具有能被磁铁吸引的特性。
2、铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
二、铁的氧化物氧化亚铁(FeO)氧化铁(Fe2O3)四氧化三铁(Fe3O4)俗名铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体铁元素价态+2 +3 +2、+3与盐酸反应生成的离子Fe2+Fe3+Fe2+、Fe3+三、铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体与盐酸反应Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O 受热分解2Fe(OH)3△Fe2O3+3H2O制法可溶性亚铁盐与碱反应Fe2++2OH-===Fe(OH)2↓可溶性铁盐与碱反应Fe3++3OH-===Fe(OH)3↓二者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3追踪高考1.【2022新课标1卷】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠【答案】D【解析】正极片碱溶时铝转化为偏铝酸钠,滤渣中含有磷酸亚铁锂,加入硫酸和硝酸酸溶,过滤后滤渣是炭黑,得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,滤液中加入碳酸钠生成含锂的沉淀。
2023年江苏省普通高中学业水平合格性考试化学必备考点归纳与例题精讲11 铁、铜及其化合物

考点11 铁、铜及其化合物【学业要求】1.了解铁、铜及其重要化合物的主要用途。
2.了解铁、铜及其重要化合物的主要物理性质。
3.了解铁、铜分别与氧气、水、酸等物质的反应。
4.了解氧化铁、氧化铜分别与酸等物质的反应。
5.了解Fe 3+的氧化性,认识Fe 3+和Fe 2+之间的相互转化关系。
一、金属铁的性质1.铁元素的存在铁在自然界中可以以单质形态(主要存在于陨石中)存在,但主要以+2价和+3价化合物的形态存在,地壳中含量居第四位,仅次于氧、硅和铝。
(1)铁与氯气、硝酸、浓硫酸等强氧化剂反应可显+3价: 2Fe +3Cl 2=====△2FeCl 3;Fe +4HNO 3(稀)===Fe(NO 3)3+NO↑+2H 2O ; 2Fe +6H 2SO 4(浓)=====△Fe 2(SO 4)3+3SO 2↑+6H 2O 。
(2)铁与H +、Cu 2+、Fe 3+等弱氧化剂反应可显+2价:Fe +2H +===Fe 2++H 2↑;Fe +Cu 2+===Cu +Fe 2+;Fe +2Fe 3+===3Fe 2+。
(3)钝化不是不反应而是生成一种致密的氧化物薄膜。
2.Fe 2+、Fe 3+的检验Fe 2+Fe 3+溶液的颜色 浅绿色 棕黄色 滴加KSCN 溶液无明显现象 溶液变血红色 反应原理 不反应Fe 3++3SCN -===Fe(SCN)3结论利用含有Fe 3+的盐溶液遇到KSCN 溶液变成血红色,检验Fe 3+的存在3.Fe 2+、Fe 3+相互转化的实验探究实验操作实验现象先滴加KSCN 溶液,溶液变血红色再加适量铁粉后,血红色褪去 先滴加KSCN 溶液后没有变化,再滴加新制氯水,溶液变成血红色离子方程式2Fe 3++Fe===3Fe 2+2Fe 2++Cl 2===2Fe 3++2Cl -、Fe 3++3SCN -===Fe(SCN)3 实验结论Fe 3+铁氯气Fe 2+二、铁的重要化合物及其转化 1.铁的重要氧化物——Fe 2O 3 (1)俗名:铁红。
高中化学人教版必修第一册铁及其化合物(共21张ppt)

一、铁的单质 2.化学性质 活泼金属可以与水反应,那么铁是否能于水反应呢? 生活经验告诉我们,常温下,铁不会和水反应。
钢铁厂提示: 在进行钢水浇铸过程中,模具必须要进行干燥处 理,这是为什么呢?
11
一、铁的单质 2.化学性质 铁与水蒸气在高温时发生反应,生成四氧化三铁和氢气
12
13
二、铁的化合物 1.铁的氧化物 铁元素共有3种氧化物,分别是FeO、Fe2O3、Fe3O4。 FeO是一种黑色的粉末,不太稳定 Fe2O3是一种红棕色粉末,俗称铁红,常用作涂料等颜料。 Fe3O4是一种复杂的化合物,也是具有磁性的黑色晶体,俗 称磁性氧化物。
金属材料
第一节 铁及其化合物
同学们认不认识图片中的东西?
3
这种东西叫做“陨铁” 是一种来自外太空的陨石,含有大量的铁单质 早在4000多年前,人类就已经利用陨铁开始制 造工具。 早期人类为什么不直接用地球上的铁单质直接 创造工具呢?
4
自然界只存在化合态的铁元素,并没有铁单质。
美丽的张掖七彩丹霞地貌中的红土富含Fe2O3
21
14
二、铁的化合物
1.铁的氧化物
Fe2、+3 FeO·Fe2O3
15
二、铁的化合物 1.铁的氧化物 1mol铁单质与水蒸气高温下反应转移8/3mol电子
16
二、铁的化合物 2.铁的氢氧化物 铁有两种氢氧化物,Fe(OH)2、 Fe(OH)3 那么,如何制备这两种氢氧化物呢?
2.化学性质
铁能和多种物质发生反应。
铁在氯气中点燃
铁与稀盐酸反应
铁与硫酸铜反应
Fe 还原剂
Cl2 H+、Cu2+
FeCl3 Fe2+
铁的化合物

错误!错误!铁及其化合物考点一 铁的单质、氧化物和氢氧化物1.铁 (1)物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
2.铁的物理性质和存在纯净的铁是银白色的金属,铁的熔点较高。
当含有碳和其它元素时,熔点将降低,导电性比铜、铝差。
铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性。
铁在地壳中的含量占第4位。
自然界中铁元素主要以化合态形式存在。
重要的铁矿石有(填化学式):赤铁矿Fe 2O 3,磁铁矿Fe 3O 4,褐铁矿2Fe 2O 3·3H 2O ,菱铁矿FeCO 3。
(2)结构(3)化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
按要求书写下列反应的方程式: ①Fe 与Cl 2、S 反应的化学方程式:2Fe +3Cl 2=====点燃2FeCl 3;Fe +S ====△FeS 。
②Fe 与水蒸气的反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与氧化性酸(如HNO 3)的反应(写离子方程式)。
Fe 与过量稀HNO 3的反应:Fe 与少量稀HNO 3的反应:④Fe 与FeCl 3溶液的反应(写离子方程式):二、铁的氧化物和氢氧化物题组一铁的单质、氧化物和氢氧化物的性质1.下列有关铁及其化合物的说法中正确的是()A.铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在B.铁在纯氧中燃烧或在氯气中燃烧所得产物中铁的化合价均为+3价C.工业上可用铁质容器储存浓硝酸和浓硫酸,原因是铁在常温下与两种酸不反应D.工业上用CO在高温条件下还原含Fe2O3的铁矿石炼铁2.(2017·大连高三调研)在一定条件下,下列物质能与铁单质发生反应,其中能将铁元素从0价转变为+3价的是()A.盐酸B.稀硫酸C.稀硝酸D.硫酸铜溶液3.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。
铁及其化合物

铁及其化合物知识点复习重点1.铁单质的化学性质2.铁的重要化合物的氧化还原性;3.Fe(Ⅱ)、Fe(Ⅲ)的相互转化是高考的热点。
一、铁单质1、铁结构铁位于元素周期表中第4周期,第Ⅷ族,其原子结构示意图为:其失电子情况: Fe-2e-→Fe2+或Fe-3e-→Fe3+。
因而铁是中等活动性的金属,具有可变化合价(+2或+3)。
2、物理性质(1)物理性质:铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是银白色,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
(2)存在形态:铁分布很广,能稳定地与其他元素结合,常以氧化物的形式存在,有赤铁矿(主要成分是Fe2O3)、磁铁矿(主要成分是Fe3O4)、褐铁矿(主要成分是Fe2O3·3H2O)、菱铁矿(主要成分是FeCO3)、黄铁矿(主要成分是FeS2)、钛铁矿(主要成分是FeTiO3)等。
铁是活泼的过渡元素。
3、化学性质(1)与非金属单质反应3Fe+2O2Fe3O4 2Fe+3Cl22FeCl3 Fe+S FeS2Fe+3Br2 = 2FeBr3 Fe+I2=FeI2 3Fe+C Fe3C1、下列物质间的转化不能通过一步化合反应实现的是()A.Fe→FeCl3B.FeCl2→Fe(OH)2C.FeCl3→FeCl2D.Fe→Fe3O42、下列物质不能由单质与氯气直接反应制得的是()A. FeCl2B. NaClC. HClD. CuCl2(2)与水反应3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换)注意:铁在常温下不会和水发生反应,但在水和空气中O2和CO2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀)3、在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe 与水蒸气的反应实验”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高
三
化
学
等
级
考
专
题
复
习
3.4 铁
一、选择题(每小题只有一个答案)
1、我国是世界上文明发达最早的国家之一,我国古代的化学工艺和化学知识是我国文化宝库中的珍贵遗产,也是世界文明史上的重要篇章。
下列物质与制造年代不相符的是()
A、战国时代炼丹
B、商代制青铜器
C、春秋晚期冶铁
D、春秋早期炼钢
2、下列性质中,不属于金属共同特性的是()
A.高熔点B.延展性C.导电性和导热性D.金属光泽
3、下列物质不属于合金的是()
A.钢B.锰钢C.不锈钢D.三氧化二铁
4、地壳中含量最多的元素和人体中含量最多的金属元素形成的化合物是()
A.Al2O3B.SiO2C.H2O D.CaO
5、从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是()
A.地壳中金属元素的含量B.金属的延展性C.金属的导电性D.金属冶炼的难易程度6、下列关于合金的叙述,正确的是()
A.合金一定是由几种金属熔合而成的B.合金的熔点一般比成分的熔点高
C.合金的硬度一般比成分的硬度低D.组成不同的合金具有不同的特性
A.铜和铝B.铁和铜C.铁和钠D.钠和铝
8、利用铝合金代替铝制钥匙是利用铝合金的()
A.熔点低B.不易锈蚀C.硬度大D.密度小
9、下列说法正确的是()
A.晶体中含阳离子,一定同时含有阴离子B.晶体中含阴离子,一定同时含有阳离子C.离子化合物中一定含离子键和共价键D.共价化合物中一定含有共价键,可能含离子键10、下列物质中,不能由两种单质直接化合得到的是()
A.Fe3O4B.FeCl2C.FeS D.Cu2S
11、最近,科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是()A.硬度比生铁低B.在潮湿的空气中放置不易生锈
C.在冷的浓硫酸中可钝化D.熔点比生铁低
12、将铁片投入下列溶液中,铁片质量减少,溶液质量变重的是()
A.FeSO4溶液B.稀H2SO4C.CuSO4溶液D.AgNO3溶液
13、在氯化铁溶液中,加入下列物质会使溶液呈血红色的是()
A.KSCN溶液B.氨水C.NaOH溶液D.CuSO4溶液
14、生铁和稀盐酸反应后会留有残渣,残渣的主要成分是()
A.氯化亚铁B.三氧化二铁C.碳D.铁
15、下列关于铁的叙述错误的是()
A.纯净的铁是光亮的银白色金属
B.铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性
C.铁是地壳中含量最多的金属元素,所以分布在地壳的铁有游离态也有化合态
D.纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化
16、向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当再滴加几滴溴水后,混和液出现血红色,那么由此得出下列结论错误的是()
A.该晶体中一定含有SCN-B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+与SCN-不能形成血红色的化合物D.Fe2+被Br2氧化Fe3+
17、下列微粒中,既有氧化性又有还原性的是()
A.H+ B.Fe C.Fe2+D.Fe3+
18、下列离子方程式书写正确的是()
A.氯化铁溶液中加入铁粉:Fe3++Fe→Fe2+
B.氯化铁溶液中加入铜粉:Fe3++Cu→Fe2++Cu2+
C.铁投入稀硫酸中:2Fe+6H+→2Fe3++3H2
D.氯化亚铁中通入氯气:2Fe2++Cl2→2Fe3++2Cl-
19、现榨的苹果汁含有Fe2+,在空气中会由淡绿色变为棕黄色。
若加入维生素C,可有效防止这种现象发生。
这说明维生素C具有()
A.氧化性B.还原性C.碱性D.酸性
20、已知某溶液的pH=1,并含有Fe2+和Ba2+,则溶液中可能存在的阴离子是
A.Cl-B.CO32-C.SO42-D.SO32--
二、填空题
21、金属有多种分类方法。
根据密度不同,金属可以分为和,把密度在4.5g/cm3以上的金属叫做,密度在4.5g/cm3以下的金属叫做。
在冶金工业中,人们又把金属分为色金属和色金属两大类。
色金属是指, , ,及它们的合金,除色金属以外的所有金属叫做色金属。
22、常温下,除为液态外,其余金属都是固体。
请你写出你所了解的几个金属之最:电的最好导体是,熔点最低的是,熔点最高的是,地壳中含量最多的是,人体中含量最多的是,人类冶炼最多的是,最活泼的是,抗腐蚀能力最强的是。
23、由于金属原子半径一般较大,最外层电子容易被释放出成为。
在金属晶体中
通过吸引而产生较强的相互作用,称为键。
以,
等基本微粒,通过键形成的晶体,即为金属晶体。
24、在金属中,原子按照一定的规则排列起来,形成金属晶体,金属具有很多共同的性质,这与金属晶体的微粒构成有关:金属通电后定向移动,金属具有性;
给金属加热,能传递热量,金属具有性;金属受到力的作用,层间彼此滑动,金属具有性。
25、化学键是指,它包括、
、。
26、金属键是指。
27、铁是比较活泼的金属,铁原子共有个电子层,铁原子在反应中容易(填“失去”或“得到”)最外层的个电子,变成带个单位电荷的离子。
铁原子在反应中也可以(填“失去”或“得到”)最外层的个电子和次外层的个电子,变成带个单位电荷的离子。
因此,铁的化合价显价或价。
28、铁是比较活泼的金属,它可以发生多种反应,分别写出下列各种反应的化学方程式,并回答问题。
(1)铁在氧气中燃烧:
现象是:
化学方程式是:
(2)铁和硫粉混合加热:
现象是:
化学方程式是:
(3)铁丝在氯气中燃烧:
现象是:
化学方程式是:
(4)铁跟盐酸反应:
现象是:
化学方程式是:
(5)铁跟硫酸铜溶液反应:
现象是:
离子方程式是:
(6)红热的铁和水蒸气反应:
化学方程式是:(标出电子转移的方向和数目)。
三、简答题
29、一种黑色固体A,加入盐酸后生成浅绿色溶液B,同时放出臭鸡蛋气味气体C;在浅绿色溶液B中通入氯气则转变为黄色溶液D。
将D溶液分成两份,一份滴加几滴KSCN溶液,生成红色溶液E;另一份通入气体C,则棕黄色溶液D重新变成浅绿色溶液B,并析出淡黄色沉淀G;在溶液B中加入烧碱溶液,立即出现白色沉淀,并迅速变成灰绿色,最后得到一种红褐色沉淀F。
则
写出各物质的化学式 A B C D F G
答案
一、填空
二、填空(略)
三、简答题
29、化学式 A、FeS, B 、FeCl2, C 、H2S, D 、FeCl3, F 、Fe(OH)3, G、S.
30、(1)HCl 溶液(2) NaOH (3) 铁粉(4)氯水(5)铁粉。
