小汗腺肿瘤病理诊断
小汗腺血管瘤样错构瘤1例

Pa tho l ,
19 9 0 ,
17 (1):
16 - 2 1 .
【3 】 [4 ]
曲 P i n s
MR ,
R o s e n tha l
DI ,
Sp r in
e ld
DS ,
et
a1 .
F lo r id
e x tra v a s e u —
( l a r p a p i l l a r y e n d o t h e l i a l h y p e r p l a s i a
瘤组织
中可 见
出血
坏死及胆
、
固
醇
结
晶[5
1
。
本 例患 者 临床及 组 织 病 理 改 变 皆符 合血 管 内乳
头 状 内皮 细胞增 生 。
厚壁 血 管弹性纤维染色 阳性 , 进
一 步证 实病变位 于血 管 内 对本病 的诊断与鉴别诊 断 ,
有一
定的帮助 。
值得 注 意 的是本例患者
CD 3
1
阳性
主
,
M d j ’ a s s o n S p s e u g o a “ o s a r c 0 一
) i l i a
Ⅲ f p r e s e n t i n g a s a i s o t — t s s u e s a r c o m a
A r c h P m h o l La b
Me d ,
19 9 3 ,
[1] 【2 】 [3 ]
吴 志 华 . 现 代 皮 肤 性 病 学 『M1. 广 州 : 广 东 人 民 出 版 社 , 1 9 9 9 :
957 .
樊应 俊 , 周 晓鸿 , 龙福 泉. 等 . 小 汗 腺 血 管瘤样 错 构瘤 1 例 『J 1.中
小汗腺汗孔癌的临床研究进展

小汗腺汗孔癌(eccrine porocarcinoma, EPC)又 称恶性小汗腺汗孔瘤(malignant eccrine poroma, MEP)O EPC通常很少见,起源于外分泌汗腺的表 皮内部分。它们占皮肤肿瘤的0.005%〜0.01%, 很少累及眼睑⑴,但它是最常见的恶性汗腺肿瘤, 约占小汗腺癌的一半。本病可一开始即为恶性,或 发生于时间较长的良性肿瘤基础上,常见于老年女 性,表现为疣状的斑块或息肉状,好发于肢体和头 皮,肿瘤易出现溃疡、出血。常误诊为鳞状细胞癌、 Eowen病、脂溢性角化或化脓性肉芽肿。肿瘤容易
* [基金项目]国家自然科学基金项目(编号:81660515) ▲在读硕士研究生
△[通信作者]E - mail: 136399711@qq. com
702
加了研究这种罕见疾病的重要性⑷。
1发病机制 汗孔癌的发病机制尚未明确,但它与烧伤、创
伤、放射治疗、长时间紫外线照射、免疫抑制、霍奇金 病、慢性淋巴细胞白血病(CLL)、恶性贫血、人类免 疫缺陷病毒(艾滋病毒)感染、结节病、乳腺外佩吉特 病和色素性干皮病和恶性疾病有关。有时,一些汗 孔癌可基于病程较长的良性小汗腺或顶泌汗孔瘤上 发生。此外,也有报道汗孔癌是由先前存在的脂溢 性角化病、皮脂腺痣和鲍恩病引起的⑸。汗孔癌是 一种罕见的侵袭性汗腺肿瘤。到目前为止,关于这 些肿瘤中与恶性进展相关的基因改变的数据有限 。 激活HRAS、PIK3CA和可能的EGFR突变可能是 致癌的驱动因素,其中,HRAS突变也在汗孔瘤中被 报道过。EWSR1重排已在单一的汗孔癌病例中被 报道。影响RKL和TP53的突变经常出现在汗孔癌 中,而在汗孔瘤中似乎不存在,这表明这些肿瘤抑制 因子在汗腺肿瘤的恶性进展中发挥了作用。据报 道,在不同的汗孔癌亚群中发生突变的其他肿瘤抑 制基因包括CDKN2A.APC和PTEN⑹。 2临床表现
小汗腺汗孔瘤与小汗腺汗孔癌的临床病理观察

小汗腺汗孔瘤与小汗腺汗孔癌的临床病理观察李军红;刘丁;程蔚蔚【期刊名称】《中国现代医生》【年(卷),期】2013(51)13【摘要】目的探讨小汗腺汗孔瘤与小汗腺汗孔癌的临床特点、病理诊断、鉴别诊断及免疫组化作用.方法收集10例小汗腺汗孔瘤和3例小汗腺汗孔癌的临床病理资料,进行光镜观察和免疫组化Envision染色,并复习相关文献.结果患者中男6例,女7例,小汗腺汗孔瘤就诊年龄为32~72岁,小汗腺汗孔癌的就诊年龄为57~74岁.发病部位为足部、腿部、头皮、胸背部、面部等.皮肤表现多为增生性病变,若肿物或皮损短期内生长较快,或出现破溃、出血等表现,应考虑到恶变为小汗腺汗孔癌.免疫组化P16染色在10例小汗腺腺瘤中有2例灶状阳性表达,在3例小汗腺汗孔癌中均弥漫阳性表达.结论小汗腺汗孔瘤和小汗腺汗孔癌均缺乏特异性临床表现,且有相关联系,临床极易误诊,确诊需依靠病理诊断,免疫组化P16染色在良、恶性诊断中有重要价值.【总页数】4页(P76-77,80,封3)【作者】李军红;刘丁;程蔚蔚【作者单位】郑州大学附属洛阳市中心医院病理科,河南洛阳 471009;郑州大学附属洛阳市中心医院皮肤科,河南洛阳 471009;郑州大学附属洛阳市中心医院病理科,河南洛阳 471009【正文语种】中文【中图分类】R739.5【相关文献】1.67例小汗腺汗孔瘤临床及病理分析 [J], 刘钟; 方美珍; 李东升; 陈柳青; 黄萌; 陈娜; 张良2.32例小汗腺汗孔瘤的临床病理特征 [J], 刘军; 汪五清; 袁春艳; 陈永其; 浦文兰; 洪亮; 谢蕴3.17例小汗腺汗孔瘤的临床病理特征分析 [J], 张粉娟;何会女;董兵卫4.小汗腺汗孔瘤37例临床及病理分析 [J], 翁立强;陈俊;龙琴琴;张春萍5.小汗腺汗孔癌的临床研究进展 [J], 何月;李林烨;刘芳芳;段妍因版权原因,仅展示原文概要,查看原文内容请购买。
恶性小汗腺汗孔瘤应该做哪些检查?

恶性小汗腺汗孔瘤应该做哪些检查?
*导读:本文向您详细介恶性小汗腺汗孔瘤应该做哪些检查,常用的恶性小汗腺汗孔瘤检查项目有哪些。
以及恶性小汗腺汗孔瘤如何诊断鉴别,恶性小汗腺汗孔瘤易混淆疾病等方面内容。
*恶性小汗腺汗孔瘤常见检查:
常见检查:大生化检查、血常规
*一、检查:
1.大生化检查。
2.血常规。
3.组织病理:恶性小汗腺汗孔瘤可见于小汗腺汗孔瘤或纯粹表皮内小汗腺汗孔瘤毗邻处。
在良性小汗腺汗孔瘤毗邻处见间变细胞,具有大而染色深,不规则形核,亦可见多核细胞,细胞内富含糖原。
原发肿瘤的恶性细胞可限局于表皮或可扩展至真皮内。
真皮内有一些游离的瘤细胞岛。
由于表皮内有许多界限清楚的瘤细胞巢增生,所以表皮常有相当的棘层肥厚。
表皮及真皮细胞巢中可见囊腔。
皮肤转移时,表皮和真皮内均有很多瘤细胞巢,表皮中界限清楚的大小瘤细胞巢由增生的表皮鳞状细胞围绕,呈“湿疹样癌”样方式。
真皮内某些瘤巢位于扩大的淋巴管内,提示肿瘤在皮肤淋巴管内扩散。
由于肿瘤细胞的“向表皮性”,肿瘤细胞可侵入
其上表皮。
*以上是对于恶性小汗腺汗孔瘤应该做哪些检查方面内容的相关叙述,下面再来看看恶性小汗腺汗孔瘤应该如何鉴别诊断,恶性小汗腺汗孔瘤易混淆疾病。
*恶性小汗腺汗孔瘤如何鉴别?:
*一、鉴别
一般不会与其他疾病混淆。
*温馨提示:以上内容就是为您介绍的恶性小汗腺汗孔瘤应该做哪些检查,恶性小汗腺汗孔瘤如何鉴别等方面内容,更多更详细资料请关注疾病库,或者在站内搜索“恶性小汗腺汗孔瘤”了解更多,希望以上内容可以帮助到大家!。
小汗腺汗孔癌一例
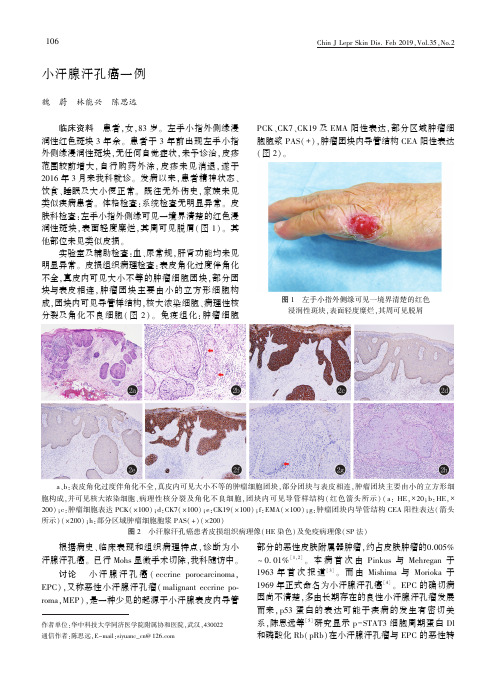
小汗腺汗孔癌一例魏㊀蔚㊀林能兴㊀陈思远㊀㊀临床资料㊀患者ꎬ女ꎬ83岁ꎮ左手小指外侧缘浸润性红色斑块3年余ꎮ患者于3年前出现左手小指外侧缘浸润性斑块ꎬ无任何自觉症状ꎬ未予诊治ꎬ皮疹范围较前增大ꎬ自行购药外涂ꎬ皮疹未见消退ꎬ遂于2016年3月来我科就诊ꎮ发病以来ꎬ患者精神状态㊁饮食㊁睡眠及大小便正常ꎮ既往无外伤史ꎬ家族未见类似疾病患者ꎮ体格检查:系统检查无明显异常ꎮ皮肤科检查:左手小指外侧缘可见一境界清楚的红色浸润性斑块ꎬ表面轻度糜烂ꎬ其周可见脱屑(图1)ꎮ其他部位未见类似皮损ꎮ㊀㊀实验室及辅助检查:血㊁尿常规ꎬ肝肾功能均未见明显异常ꎮ皮损组织病理检查:表皮角化过度伴角化不全ꎬ真皮内可见大小不等的肿瘤细胞团块ꎬ部分团块与表皮相连ꎬ肿瘤团块主要由小的立方形细胞构成ꎬ团块内可见导管样结构ꎬ核大浓染细胞㊁病理性核分裂及角化不良细胞(图2)ꎮ免疫组化:肿瘤细胞PCK㊁CK7㊁CK19及EMA阳性表达ꎬ部分区域肿瘤细胞胞浆PAS(+)ꎬ肿瘤团块内导管结构CEA阳性表达(图2)ꎮ图1㊀左手小指外侧缘可见一境界清楚的红色浸润性斑块ꎬ表面轻度糜烂ꎬ其周可见脱屑㊀㊀a㊁b:表皮角化过度伴角化不全ꎬ真皮内可见大小不等的肿瘤细胞团块ꎬ部分团块与表皮相连ꎬ肿瘤团块主要由小的立方形细胞构成ꎬ并可见核大浓染细胞㊁病理性核分裂及角化不良细胞ꎬ团块内可见导管样结构(红色箭头所示)(a:HEꎬˑ20ꎻb:HEꎬˑ200)ꎻc:肿瘤细胞表达PCK(ˑ100)ꎻd:CK7(ˑ100)ꎻe:CK19(ˑ100)ꎻf:EMA(ˑ100)ꎻg:肿瘤团块内导管结构CEA阳性表达(箭头所示)(ˑ200)ꎻh:部分区域肿瘤细胞胞浆PAS(+)(ˑ200)图2㊀小汗腺汗孔癌患者皮损组织病理像(HE染色)及免疫病理像(SP法)㊀㊀根据病史㊁临床表现和组织病理特点ꎬ诊断为小汗腺汗孔癌ꎮ已行Mohs显微手术切除ꎬ我科随访中ꎮ讨论㊀小汗腺汗孔癌(eccrineporocarcinomaꎬEPC)ꎬ又称恶性小汗腺汗孔瘤(malignanteccrinepo ̄romaꎬMEP)ꎬ是一种少见的起源于小汗腺表皮内导管作者单位:华中科技大学同济医学院附属协和医院ꎬ武汉ꎬ430022通信作者:陈思远ꎬE-mail:siyuanc_cn@126.com部分的恶性皮肤附属器肿瘤ꎬ约占皮肤肿瘤的0.005%~0.01%[1ꎬ2]ꎮ本病首次由Pinkus与Mehregan于1963年首次报道[3]ꎮ而由Mishima与Morioka于1969年正式命名为小汗腺汗孔癌[4]ꎮEPC的确切病因尚不清楚ꎬ多由长期存在的良性小汗腺汗孔瘤发展而来ꎬp53蛋白的表达可能于疾病的发生有密切关系ꎬ陈思远等[5]研究显示p-STAT3细胞周期蛋白Dl和磷酸化Rb(pRb)在小汗腺汗孔瘤与EPC的恶性转601ChinJLeprSkinDis.Feb2019ꎬVol.35ꎬNo.2化过程中有一定的作用ꎮ本病发病年龄多为60~80岁ꎬ其中女性居多ꎬ在儿童及青年人中也有报道ꎬ目前为止报道的最小发病年龄为8岁[6]ꎮEPC好发于下肢㊁躯干㊁头部㊁颈部及上肢ꎬ也可见于乳腺㊁外阴㊁眼睑及甲床等[2ꎬ6]ꎮEPC临床多表现为单个疣状结节㊁息肉㊁斑块或隆起性肿物ꎬ易发生破溃㊁出血ꎮEPC的组织病理特点包括:①肿瘤灶可原发亦可继发于汗孔瘤处及其邻近ꎬ瘤体局限于表皮也可蔓延至真皮ꎻ②恶变区瘤细胞巢大部分由不典型性嗜伊红鳞状细胞样细胞和基底样细胞组成ꎬ以前者为多ꎻ③瘤细胞核大㊁深染ꎬ可多核或形成瘤巨细胞ꎬ病理性核分裂象多见ꎻ④广泛的透明细胞改变ꎻ⑤瘤巢内可见充分发育的导管及正在形成导管的空泡化细胞ꎮ免疫组织化学可见肿瘤细胞内EMA及CEA表达阳性ꎬ但有报道认为CEA在大部分EPC中表达阴性ꎮ只在部分有分化良好的导管结构的EPC中呈阳性表达ꎮ另有研究表明p16蛋白㊁p53蛋白可用于EPC的早期筛查[3ꎬ5]ꎮ本病应与小汗腺汗孔瘤㊁Paget病㊁鳞状细胞癌㊁透明细细胞癌㊁胞汗腺瘤㊁脂溢性角化病㊁基底细胞癌㊁寻常疣㊁化脓性肉芽肿㊁基底细胞癌㊁黑色素瘤和转移瘤等鉴别[2ꎬ7]ꎮ尤其需要与鳞状细胞癌及基底细胞癌的组织病理学表现相鉴别:①鳞状细胞癌的鳞状细胞团块向下增生进入真皮ꎬ瘤巢内无管状及囊腔样结构ꎬ并有角化倾向ꎬ故瘤体内可见个别角化或角化不良细胞㊁角珠[8]ꎻ②基底细胞癌可见细胞不典型性及核分裂ꎬ无细胞间桥ꎬ肿瘤团块周围细胞呈栅栏状排列ꎬ肿瘤团块与周围基质之间可见收缩间隙ꎬ不含或很少含糖原ꎮEPC既可发生局部淋巴结转移也可发生远处转移ꎬ其发生率分别为20%和11%ꎬEPC患者有淋巴结转移的存活率约为67%[9ꎬ10]ꎮ治疗通常采用广泛的手术切除ꎬ对有淋巴结受累时ꎬ须行淋巴结清扫ꎮ前哨淋巴结活检对确定肿瘤分期有一定意义ꎮ肿瘤的厚度往往是影响预后的主要因素ꎬ若肿瘤侵犯深度>7mm㊁组织病理显示每高倍镜下超过14个有丝分裂像或真皮内淋巴血管遭受侵袭ꎬ则提示预后较差[2ꎬ6ꎬ11]ꎮEPC手术切除后局部复发率约为20%[12]ꎬ有证据表明采用Mohs显微手术可明显降低EPC的发病率及局部复发率[13]ꎮ目前已有病例报道显示对于已发生转移的患者采用放疗及化疗的效果均不理想[14]ꎮ本患者已行Mohs显微外科手术切除治疗ꎬ但因本病有较高的复发率ꎬ故仍须动态观察患者病情ꎮ参考文献[1]ChoiSHꎬKimYJꎬKimJHꎬetal.Ararecaseofabdominalporocarcinoma[J].ArchPlastSurgꎬ2014ꎬ41(1):91-93. [2]吴亚桐ꎬ常建民.小汗腺汗孔癌[J].临床皮肤科杂志ꎬ2014ꎬ43(4):236-237.[3]PinkusHꎬMehreganAH.Epidermotropiceccrinecarcinoma.acasecombiningfeaturesofeccrineporomaandPaget sder ̄matosis[J].ArchDermatolꎬ1963ꎬ88:597-606. [4]MishimaYꎬMoriokaS.Oncogenicdifferentiationoftheintra ̄epidermaleccrinesweatduct:eccrineporomaꎬporoepithelio ̄maandporocarcinoma[J].Dermatologicaꎬ1969ꎬ138:238-250.[5]陈思远ꎬ钱悦ꎬ朱里ꎬ等.细胞周期蛋白D1和磷酸化Rb蛋白在小汗腺汗孔癌和小汗腺汗孔瘤中的表达[J].中华皮肤科杂志ꎬ2008ꎬ41(10):696-697.[6]MasamattiSSꎬNarasimhaAꎬBhatAꎬetal.Eccrineporocar ̄cinomaofthescalp:ararecasereportwithreviewoflitera ̄ture[J].JClinDiagnResꎬ2016ꎬ10(1):15-16. [7]NguyenAꎬNguyenAV.Eccrineporocarcinoma:areportof2casesandreviewoftheliterature[J].Cutisꎬ2014ꎬ93(1):43-46.[8]孟雪梅ꎬ赵芹ꎬ李玉芬ꎬ等.恶性小汗腺汗孔瘤一例[J].中华皮肤科杂ꎬ2010ꎬ43(9):644.[9]RobsonAꎬGreeneJꎬAnsariNꎬetal.Eccrineporocarcinoma(malignanteccrineporoma):aclinicopathologicstudyof69cases[J].AmJSurgPatholꎬ2001ꎬ25:710-720. [10]GraysonWꎬLoubserJS.Eccrineporocarcinomaofthepenis[J].JUrolꎬ2003ꎬ169:611-612.[11]庄贺婷ꎬ李航ꎬ陈喜雪ꎬ等.小汗腺汗孔瘤恶变[J].临床皮肤科杂志ꎬ2009ꎬ38(9):579-580.[12]TidwellWJꎬMayerJEꎬMaloneJꎬetal.Treatmentofec ̄crineporocarcinomawithMohsmicrographicsurgery:aca ̄sesseriesandliteraturereview[J].IntJDermatolꎬ2015ꎬ54(9):1078-1083.[13]TidwellWJꎬMayerJEꎬMaloneJꎬetal.Treatmentofec ̄crineporocarcinomawithMohsmicrographicsurgery:aca ̄sesseriesandliteraturereview[J].IntJDermatolꎬ2015ꎬ54(9):1078-1083.[14]ParmarNꎬMohamedMꎬElmoghrabiAꎬetal.EccrinePo ̄rocarcinomapresentingasanabdominalwallmassinapa ̄tientwithulcerativecolitis-Ararecasereport[J].IntJSurgCaseRepꎬ2016ꎬ23:40-43.(收稿:2017-06-21㊀修回:2017-07-31)701中国麻风皮肤病杂志㊀2019年2月第35卷第2期。
小汗腺汗孔瘤与小汗腺汗孔癌的临床病理观察

小汗腺汗孔瘤与小汗腺汗孔癌的临床病理观察目的探讨小汗腺汗孔瘤与小汗腺汗孔癌的临床特点、病理诊断、鉴别诊断及免疫组化作用。
方法收集10例小汗腺汗孔瘤和3例小汗腺汗孔癌的临床病理资料,进行光镜观察和免疫组化Envision染色,并复习相关文献。
结果患者中男6例,女7例,小汗腺汗孔瘤就诊年龄为32~72岁,小汗腺汗孔癌的就诊年龄为57~74岁。
发病部位为足部、腿部、头皮、胸背部、面部等。
皮肤表现多为增生性病变,若肿物或皮损短期内生长较快,或出现破溃、出血等表现,应考虑到恶变为小汗腺汗孔癌。
免疫组化P16染色在10例小汗腺腺瘤中有2例灶状阳性表达,在3例小汗腺汗孔癌中均弥漫阳性表达。
结论小汗腺汗孔瘤和小汗腺汗孔癌均缺乏特异性临床表现,且有相关联系,临床极易误诊,确诊需依靠病理诊断,免疫组化P16染色在良、恶性诊断中有重要价值。
标签:小汗腺汗孔瘤;小汗腺汗孔癌;临床病理;免疫组化小汗腺汗孔瘤和小汗腺汗孔癌均为较少见的皮肤附属器肿瘤,临床表现缺乏特异性,临床极易误诊为其他良恶性病变。
病理诊断也有容易造成干扰的鉴别诊断。
为了提高临床病理医生对该病的认识,我们收集了10例小汗腺汗孔瘤和3例小汗腺汗孔癌的临床病理资料进行回顾性分析并复习相关文献。
1材料与方法1.1 材料来源10例小汗腺汗孔瘤和3例小汗腺汗孔癌均来自郑州大学附属洛阳市中心医院2000年1月~2010年12月门诊及住院病例,临床资料来自病历记录,病理资料来自本院病理科存档的病理切片及蜡块。
1.2方法与诊断标准摘录临床病历资料中记载的性别、年龄、部位、主诉、临床诊断等信息并列表(表1)。
原病理诊断为汗腺肿瘤的存档病理切片经两位高年资病理医师参照Rosia&Ackerman外科病理学中的诊断标准[1]重新诊断,选取确诊为小汗腺汗孔瘤病例10例和小汗腺汗孔癌病例3例,13例标本均行免疫组织化学染色,采用Envision两步法,所选一抗P16及二抗均购自福州迈新生物技术开发有限公司,设阴性及阳性对照。
小汗腺螺旋腺癌1例
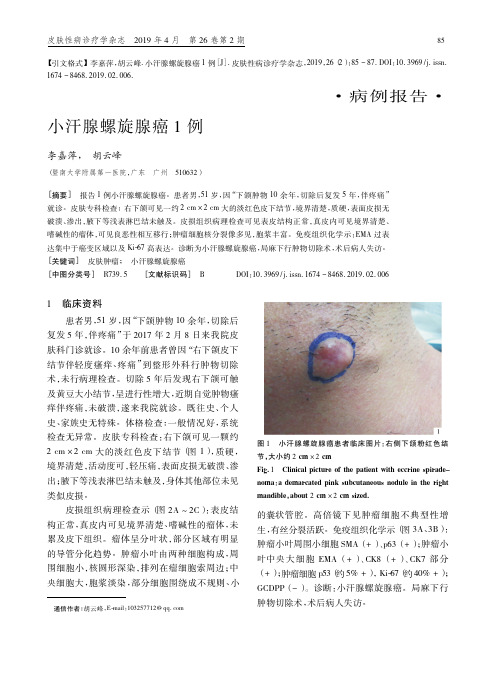
小汗腺螺旋腺癌 1 例
李嘉萍, 胡云峰
( 暨南大学附属第一医院,广东 广州 510632)
[摘要] 报告 1 例小汗腺螺旋腺癌。患者男,51 岁,因“下颌肿物 10 余年,切除后复发 5 年,伴疼痛”
就诊。皮肤专科检查: 右下颌可见一约 2 cm × 2 cm 大的淡红色皮下结节,境界清楚,质硬,表面皮损无
的囊状 管 腔。高 倍 镜 下 见 肿 瘤 细 胞 不 典 型 性 增 生,有丝分裂活跃。免疫组织化学示( 图 3A、3B) : 肿瘤小叶周围小细胞 SMA( + ) 、p63( + ) ; 肿瘤小 叶中央 大 细 胞 EMA ( + ) 、CK8 ( + ) 、CK7 部 分 ( + ) ; 肿瘤细胞 p53( 约 5% + ) ,Ki-67( 约 40% + ) ; GCDPP( - ) 。诊断: 小汗腺螺旋腺癌。局麻下行 肿物切除术,术后病人失访。
高[2]。多数的案例是由长期无 症状的良性小汗腺螺旋腺瘤恶变所致[2],严重者 可导致死亡。而螺旋腺癌临床表现无特征性,因 此主要靠病理活检诊断。大多数情况下 MES 与 ES 的临床表现相似,皮疹一般为孤立性、境界清 楚的质硬结节,伴疼痛,位于真皮内,直径常小于 1 cm。皮损也可多发,可呈线样或带状疱疹样分 布[3]。平均好发年龄为 59 岁( 21 ~ 92 岁) ,无性 别差异。 优 先 累 及 躯 干 和 四 肢 ( 报 告 病 例 占 92% ) [4]。另外在头皮、乳房、膝盖等部位也有报 道并且有转移倾向[5 - 7]。
下可观察到两种独特的组织学模式,一种类型可见 从良性逐渐过渡到恶性的移行区,细胞成分从良性 肿瘤的两型细胞移行为单一的癌细胞[8]。另一种 类型表现为恶性区与良性区相邻但不移行,这类肿 瘤组织学表现多样,可呈鳞状细胞癌样、腺瘤样、螺 旋导管癌样、肉瘤样癌等[9 -10]。而本病例向螺旋 导管腺癌转化,肿瘤细胞团块中下部可见良恶性相 互移行,良性肿瘤细胞有两型: 一型位于细胞团块 的周边,胞核小而深染; 另一型胞核大而淡染,位 于中央。在癌巢周围可见完整肌上皮围绕,腺管 和导管样结构,肿瘤细胞不典型性增生,细胞较密
皮肤小汗腺螺旋腺瘤恶变1例并文献复习

皮肤小汗腺螺旋腺瘤恶变1例并文献复习郭文若;陈奕昭;柳剑英;黄向阳;黄幼玉;黄惠珍【期刊名称】《国际病理科学与临床杂志》【年(卷),期】2017(037)011【摘要】对1例皮肤小汗腺螺旋腺瘤恶变进行观察,形态学分析及免疫组织化学染色,结合文献分析其临床病理特征.患者,女,58岁,发现左下腹部皮肤肿物30多年.B 超探及一大小约2.1 cm×1.8 cm的囊壁回声结节,囊实性,界清,边界完整.镜下示肿瘤位于真皮深层,呈囊实性,大部分区域呈典型良性螺旋腺瘤形态,但肿瘤细胞核质比增高,核分裂象易见,局部发生恶性变.免疫组织化学方面,肌上皮的减少或丧失以及Ki-67的高表达有助于确诊.皮肤螺小汗腺旋腺瘤恶变罕见,熟悉其组织学特点有助于正确诊断.【总页数】6页(P2511-2516)【作者】郭文若;陈奕昭;柳剑英;黄向阳;黄幼玉;黄惠珍【作者单位】福建省南安市医院病理科,福建南安362300;北京大学医学部病理学系暨北京大学第三医院病理科,北京100191;福建省泉州市中医院病理科,福建泉州362000;北京大学医学部病理学系暨北京大学第三医院病理科,北京100191;福建省南安市医院病理科,福建南安362300;福建省南安市医院病理科,福建南安362300;福建省南安市医院病理科,福建南安362300【正文语种】中文【相关文献】1.皮肤小汗腺螺旋腺瘤恶变1例并文献复习 [J], 郭文若;陈奕昭;柳剑英;黄向阳;黄幼玉;黄惠珍;;;;;;;2.多发性小汗腺螺旋腺瘤恶变1例 [J], 郭广秀;张连郁;潘毅3.多发性小汗腺螺旋腺瘤癌变临床病理分析并文献复习 [J], 郭广秀;张功亮;王建;黄金长4.足部小汗腺汗管纤维腺瘤1例并文献复习 [J], 王帅;郝峰;刘国艳5.多发性小汗腺螺旋腺瘤误诊1例分析并文献复习 [J], 林挺;杨慧兰;庞文林因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
直径一般10mm.
小汗腺汗孔瘤
• 形态特征 • 肿瘤细胞类似于末端汗管。EMA总是阳性。 • 组织学特点是小的非色素性上皮细胞增生,增生 • • •
上皮与相邻表皮间界限清楚。 肿瘤细胞巢索内有导管和境界清楚的鳞状上皮岛 形成。部分细胞因富含糖元而呈空泡样。此显现 几乎发生与任何小汗腺肿瘤。 肿瘤可以局限于表皮内或真皮内(又称真皮导管 肿瘤),但以表皮真皮同时受累更为常见。 本瘤主要需与基底细胞癌及脂溢性角化病鉴别
7.侵袭性指(趾)乳头状腺瘤 8.汗腺癌 (1)导管癌 A.小汗腺汗孔癌 B.实性及圆柱状导管癌 C.乳头状导管癌 (2)粘液性小汗腺癌 (3)透明细胞小汗腺癌 (4)小汗腺腺癌 9.微囊性附属器癌
小汗腺汗孔瘤
• 临床相关 • 好发于中年,头面部或手掌、足底部。 • 肿瘤绝大多数为单发,为壕沟和小丘状,
指/趾乳头状癌
• WHO新分类摒弃了侵袭性指/趾乳头状腺瘤
的名称,原因是组织学参数不能预测其生 物学行为。 • 指/趾乳头状癌几乎窦位于手指、足趾、手 掌和足底,手比足更常受累。 • 男性多见,高发年龄为50~60岁。 • 指/趾乳头状癌大多数表现为指趾部生长缓 慢的深在性结节,病变直径可达数厘米。
特点,我们常认为是相应良性肿瘤恶变。 因而冠以相应恶性名称。 • 恶性汗腺肿瘤的诊断,首先应排除转移癌, ck18阳性,支持小汗腺来源。
Primary cutaneous mucinous carcinoma: the nuclei are positive for (a) estrogen and (b) progesterone receptors
Primary cutaneous mucinous carcinoma: the tumor cells express CAM 5.2
微囊性附属器癌
• 好发于成人,为缓慢生长的硬结或斑块。 • 好发于面部,特别是上唇。
形态特征
• 肿瘤细胞为大小一致的上皮细胞,排列呈
索条或巢状。 • 肿瘤可见角质囊肿形成,可见灶状导管分 化。偶见皮脂腺分化。 • 含有致密的胶原性间质。 • 肿瘤的浸润性强,有时可扩展至皮下脂肪 组织和神经周间隙。
汗管瘤
• 本病常见,女性比男性多见,常起于青少年或青 • •
年,多为散发性。发疹性汗管瘤典型者表现为广 泛的多发性病变,可以分批出现。 最常见部位于眼睑,面颊上半部也不少见。 表现为很多质硬、光滑、半球形、肉色或微黄色 丘疹,直径1~3mm,常位于下睑皮肤。
形态特征
• 病变范围较小,局限于真皮网状层上部,有大量 • • •
形态特征
• 肿瘤一般位于真皮,由多结节状、伴有囊
腔的上皮团构成。 • 筛状结构常位于实性区,乳头状结构常位 于囊腔内,有些乳头状突起内有纤维血管 轴,而有些乳头仅由上皮细胞堆积而成, 没有支持性间质。 • 上皮细胞为矮柱状或立方形,细胞异性不 明显。
小汗腺腺癌
• 肿瘤好发于成人,也有发生于儿童报道。 • 肿物直径常大于3cm,常伴有皮肤破溃。 • 有些汗腺癌保留一些与汗腺瘤相似的形态
皮肤附属器肿瘤系列 小汗腺肿瘤病理诊断
毛发源性肿瘤回顾
• 良性毛发源性肿瘤多发于成年人,全身可发,但以头颈部 • • • •
多见。肿瘤常为单发结节,直径1cm左右。 肿瘤常呈界限清楚的结节状生长。 毛发源性肿瘤常见特征性的外毛根鞘型角化及毛乳头样结 构。 肿瘤结节常有规则的基底样细胞或透明细胞构成。 在实际诊断过程中基底细胞癌(结节型或伴附属器分化型) 与良性皮肤附属器肿瘤在形态上有交叉,最好归类于良性 附属器肿瘤,例如基底细胞毛囊错构瘤、毛发上皮瘤、生 发上皮瘤或毛根鞘瘤。根据个人经验认为两者有如下鉴别 点,供大家参考。
+ + 少见 +/+/-
+ +/较常见 -
+ + +/无 + +
汗孔瘤恶变/恶性小汗腺汗孔瘤
• 结节常增大,常大于3cm。 • 常有表面破溃。 • 浸润较深,边界不清。 • 虽然肿瘤大部分仍有细胞大小较一致,似
基底细胞样细胞以及汗孔分化特点。但细 胞异型性较明显,核分裂较多。
小汗腺螺旋腺瘤
• 临床相关 • 部位:大多发生于面部和躯干上人,一般为孤立性、境界清楚的 质硬结节,直径常小于1cm。但也有巨大型 及多发性报道。 • 疼痛是螺旋腺瘤的主要临床特点之一。
形态特征
• 低倍镜下,肿瘤特征性的真皮单个或多个嗜碱性 • • •
实性结节。 肿瘤结节内可见衬覆上层上皮细胞的小管。管腔 表面细胞为分泌上皮,核染色浅有核仁。周围有 一层或几层染色深的细胞为基底细胞或肌上皮细 胞。 另一个特点是有大量淋巴细胞散在分布于肿瘤结 节内。 结节之间常为水肿性间质,其中有扩张的血管, 扩张的血管周围的“硬化”圈被认为是病变存在 时间长而引起一种“老化”现象
汗腺瘤
• 汗腺瘤为散发病变,无性别差异,多见于
成年人,也有儿童的报告。 • 一般好发于头皮、躯干和肢体近端,手足 少见,眼睑也可发生。 • 无特异性临床表现,为肉色或红棕色皮肤 结节。
形态特征
• 低倍镜下,肿瘤多为于真皮,呈结节状(又称为结节状汗 • •
腺瘤),境界清楚,有时与表皮相连,间质常硬化,可富 于扩张的血管。 部分肿瘤与毛囊相连,主要与表皮相连或甚至替代表皮, 类似于小汗腺汗孔瘤。 汗腺瘤由多种类型细胞构成:透明或淡染细胞,含有丰富 的糖原,细胞膜清楚,各例病变中透明细胞数量不等,如 果这类细胞占主要成分,则称为透明细胞汗腺瘤比较合适; 鳞状细胞样细胞为多角形,核位于细胞中央、呈空泡状, 胞浆嗜酸性,细胞常形成漩涡状构成;黏液细胞所占比例 最小,细胞体积较大,胞浆呈嗜碱性颗粒状。不同细胞之 间常有移形。肿瘤细胞密集成片,其中散在分布的导管和 腺体,可呈大汗腺分化。
小的上皮性实性巢、索和小管构成。 特征性的上皮性管状结构有1层腔面细胞和1~2排 外层细胞构成,腔面扩张可使内层上皮变扁,较 大的细胞团索呈“逗号样”或“蝌蚪样”外观, 细胞巢、索和小管形成分支并相互吻合。 上皮细胞核小,核仁不明显,没有分裂像,胞浆 嗜酸或透明。 上皮巢之间为致密排列的胶原纤维束构成的致密 间质,伴有少量纤维细胞。
要点 生长方式
界限 表面角化 亢进 角质囊肿 真皮内孤 立上皮团 真皮深层 或皮下浸 润
小汗腺汗 孔瘤 表皮内或 向真皮内 生长 清楚 +/+/-
老年疣 向外或向 内生长 清楚 + + -
基底细胞 癌 向真皮内 生长 不清楚 +/+ +
基底细胞样 细胞 细胞团中央 栅烂状基底 样细胞 色素 汗孔分化 鳞状漩涡 腺管结构 细胞异型性 坏死囊性变
鉴别点
• 核分裂像多。 • 特化性间质缺乏,结节周围为一般性间质,
并可见认为收缩裂隙及浸润。 • 核拥挤,排列紊乱,极向缺乏,多形。
小汗腺肿瘤
1.小汗腺汗孔瘤(小汗腺汗孔上皮瘤) 小汗腺汗孔瘤恶性变 2.小汗腺螺旋腺瘤 3.汗管瘤 4.实性汗腺瘤 5.透明细胞汗腺瘤(透明细胞肌上皮瘤) 恶性肌上皮瘤 6.乳头状小汗腺腺瘤
