人教版高二年级化学《化学平衡常数》教案
《化学平衡常数》教案

《化学平衡常数》教案教案:化学平衡常数教学目标:1.了解化学反应达到平衡的条件;2.掌握如何计算化学平衡常数;3.理解平衡常数对化学反应的影响;4.能够运用平衡常数进行化学反应的定量分析。
教学重点:1.化学反应平衡条件的理解和应用;2.平衡常数的计算和应用。
教学难点:1.如何计算平衡常数;2.平衡常数对化学反应的影响。
教学准备:1.投影仪和电脑;2.白板和彩色粉笔;3.相关实验器材和实验药品。
教学内容和步骤:一、引入(5分钟)通过展示一些常见的化学反应方程式,引发学生对化学反应平衡的思考,通过讨论,引导学生探讨什么是化学反应平衡。
并提出一个问题:为什么有些反应不会往前进行,而会保持一个恒定的物质浓度?二、概念讲解(15分钟)1.化学反应达到平衡的条件:闭合体系、反应物浓度不变、反应速率相等。
2.化学平衡与动态平衡的关系:理解化学平衡是一种动态平衡,指反应物与生成物的浓度不再发生明显变化,但是反应仍在持续进行。
3.平衡常数的定义:平衡常数是在化学反应达到平衡时,反应物和生成物的浓度之比的乘积,用于描述平衡位置和反应的进行方向。
三、计算平衡常数(20分钟)1.理论计算方法:给出一个简单的一级反应方程式,带领学生通过理论推导,了解如何根据反应方程式和反应物浓度计算平衡常数。
2.示范计算过程:通过投影仪示范计算平衡常数的过程,注重解题思路和方法。
3.练习训练:现场解答并指导学生进行相关计算练习。
四、平衡常数的意义和应用(20分钟)1.平衡常数对化学反应的影响:根据平衡常数的大小,可以判断反应的进行方向和平衡位置。
让学生通过实际例子,理解平衡常数的作用。
2.平衡常数与浓度的关系:根据平衡常数的定义式,讲解平衡常数与浓度之间的关系,并给出相关的定量分析方法和计算例题。
五、实验示范(15分钟)通过实验演示的方式,展示平衡常数的实际测量方法和实验结果,并简单讲解实验原理和步骤。
六、作业布置(10分钟)给学生布置相关的作业,要求学生运用平衡常数进行计算和分析,巩固所学知识。
人教版高二年级化学必修三《化学平衡常数》教案

化学平衡常数一.教学目标知识与技能:1.理解化学平衡常数的含义。
2.能利用化学平衡常数进行简单的计算。
过程与方法:1.通过化学平衡常数的计算教学,培养学生的计算能力。
2.通过数据分析,培养学生分析、处理数据的能力,提高学生逻辑归纳能力。
情感、态度与价值观:通过对数据的分析,培养学生严谨求实、积极实践的科学作风。
二.教学重点:化学平衡常数表达式的书写、化学平衡常数的含义。
三.教学难点:化学平衡常数的有关计算四.教学内容:1.化学平衡常数①概念:在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度以化学计量数为指数的幂的乘积与反应物浓度以化学计量数为指数的幂的乘积的比值是一个常数。
这个常数就是该反应的化学平衡常数(简称平衡常数,用K 表示)。
②表达式:对于一般的可逆反应,mA(g)+nB(g)pC(g)+qD(g),当在一定温度下达到平衡时,K=。
③平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。
K值越大,表示反应进行得越完全,反应物转化率越大;K值越小,表示反应进行得越不完全,反应物转化率越小。
④使用平衡常数应注意的问题:(1)化学平衡常数只受温度影响,与反应物或生成物的浓度变化无关。
(2)在平衡常数表达式中,纯液体物质、固体物质的浓度不写C(s)+H2O(g)CO(g)+H2(g) K=;c p(C)·c q(D)c m(A)·c n(B)c(CO)·c(H2)c(H2O)c(CO2)FeO(s)+CO(g) Fe(s)+CO2(g) K=(3)化学平衡常数表达式与化学方程式的书写方式有关(以合成氨反应为例讲解)2.化学平衡常数的有关计算在某温度下,将H2和I2(g) 各0.10 mol的气态混合物充入10 L的密闭容器中,充分反应达到平衡后,测得c(H2)=0.0080 mol·L-1。
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若通入H2(g)和各I2(g)各0.20 mol,试求达到化学平衡状态时各物质的浓度。
化学平衡常数教案

化学平衡常数教案一、教学目标1.了解化学平衡的概念和特点;2.掌握化学平衡常数的计算方法;3.理解化学平衡常数与反应物浓度的关系;4.能够应用化学平衡常数计算反应物浓度和平衡浓度。
二、教学内容1. 化学平衡的概念和特点化学平衡是指在一定条件下,反应物与生成物之间的反应速率相等,反应物和生成物的浓度保持不变的状态。
化学平衡的特点包括:1.反应物和生成物的浓度保持不变;2.反应物和生成物的摩尔比例固定;3.反应物和生成物的速率相等。
2. 化学平衡常数的计算方法化学平衡常数是指在一定条件下,反应物和生成物之间的浓度比例的乘积的稳定值。
化学平衡常数的计算方法如下:K c=[C]c[D]d [A]a[B]b其中,a,b,c,d分别表示反应物和生成物的摩尔数,[A],[B],[C],[D]分别表示反应物和生成物的浓度。
3. 化学平衡常数与反应物浓度的关系化学平衡常数与反应物浓度的关系可以用 Le Chatelier 原理来解释。
当反应物浓度增加时,平衡常数会减小;当反应物浓度减少时,平衡常数会增大。
4. 应用化学平衡常数计算反应物浓度和平衡浓度应用化学平衡常数可以计算反应物浓度和平衡浓度。
具体方法如下:1.已知反应物和生成物的浓度,可以计算出平衡常数;2.已知平衡常数和反应物浓度,可以计算出生成物浓度;3.已知平衡常数和生成物浓度,可以计算出反应物浓度。
三、教学方法本课程采用讲授、实验演示和讨论相结合的教学方法。
具体教学步骤如下:1.讲授化学平衡的概念和特点;2.讲授化学平衡常数的计算方法;3.实验演示化学平衡常数的计算方法;4.讨论化学平衡常数与反应物浓度的关系;5.讨论应用化学平衡常数计算反应物浓度和平衡浓度的方法。
四、教学评价本课程的教学评价主要包括学生的课堂表现和实验报告。
学生的课堂表现包括听课情况、提问情况和讨论情况;实验报告主要评价实验设计、实验操作和实验结果分析。
化学平衡常数教案

化学平衡常数教案化学平衡常数教案一、教学目标1. 知识与理解:(1)了解化学反应的正向反应和逆向反应;(2)了解平衡常数的概念和计算方法;(3)了解影响平衡常数的因素。
2. 技能与过程:(1)掌握写出化学反应式;(2)能够计算平衡常数的数值;(3)能够利用平衡常数计算浓度和反应物质量的变化。
3. 情感态度价值观:(1)培养学生对化学平衡的兴趣;(2)培养学生观察、实验、思考和解决问题的能力;(3)通过讨论和实验提高学生合作学习的能力。
二、教学重点与难点1.教学重点:(1)化学反应的正向反应和逆向反应;(2)平衡常数的概念和计算方法;(3)平衡常数的影响因素。
2.教学难点:(1)化学反应的正向反应和逆向反应的理解;(2)平衡常数的计算方法的掌握;(3)平衡常数的影响因素的理解。
三、教学过程1.探究活动(1)学生实验:①原料:梅酒酯、水②实验步骤:取一定量的梅酒酯和水,装入试管中,摇匀后静置。
③结果及讨论:观察实验现象,思考梅酒酯和水是如何反应形成平衡的。
(2)学生讨论及总结:①梅酒酯和水反应生成酯和酒的反应是否是单向的?②为什么反应会形成平衡状态?③平衡常数是什么意思?2.概念讲解(1)正向反应和逆向反应的概念和特点。
(2)平衡常数的定义及计算方法。
(3)平衡常数受温度、浓度和压强的影响。
3.练习与讨论(1)练习题:①在化学反应A+B=C+D中,平衡常数Kc的表达式是什么?②已知一个反应的平衡常数Kc=10,C和D的初始浓度都为0.2mol/L,求A和B的初始浓度。
③在以下反应中,哪个反应的平衡常数最大?反应1:2A+2B=3C反应2:A+B=C反应3:A=2B(2)讨论:学生根据实际情况分组讨论平衡常数受温度、浓度和压强的影响,并汇报讨论结果。
4.实验(1)实验内容:学生自行设计一个反应实验,通过测量不同条件下反应物和产物的浓度或质量,来确定平衡常数Kc的数值。
(2)实验步骤:①学生设计实验方案。
《化学平衡常数》教学设计

《化学平衡常数》教学设计课程主题:化学平衡常数课时安排:2课时教学目标:1.了解化学反应的平衡状态和平衡常数的概念;2.掌握计算化学反应的平衡常数的方法;3.理解温度、浓度对化学平衡的影响;4.能够根据化学平衡常数计算反应物和生成物的浓度。
课程内容及教学步骤:第一课时:步骤一:导入(10分钟)1.引入化学平衡的概念,通过一个生活中的例子引发学生对化学反应平衡的思考。
2.引导学生思考化学反应为什么会趋向于达到平衡态。
步骤二:概念讲解(15分钟)3.解释化学反应的平衡态和平衡常数的概念,以反应物和生成物的摩尔比例为基础进行说明。
4.讲解化学平衡常数的计算公式和表示方法。
步骤三:计算平衡常数(25分钟)5.通过示例化学反应方程式,引导学生计算平衡常数。
6.提供几个常见反应的平衡常数示例,让学生独立进行计算。
步骤四:评价(10分钟)7.给学生一些平衡常数的计算题目,考察他们的理解程度。
8.指导学生互相评价,并就常见问题进行解答。
第二课时:步骤一:回顾(5分钟)1.复习上一节课所学内容,检查学生对化学平衡常数的理解程度。
步骤二:影响平衡态的因素(20分钟)2.讲解温度、压力、浓度等因素对化学平衡的影响。
3.通过实验和示例,让学生深入理解这些因素对平衡常数的影响。
步骤三:浓度计算(25分钟)4.提供一个化学反应方程式,并给出初始浓度。
引导学生计算平衡浓度。
5.引导学生发现平衡浓度和平衡常数的关系。
步骤四:应用实例(20分钟)6.提供一些实际应用的例子,要求学生根据给定的反应方程式和平衡常数计算浓度或预测反应方向。
7.鼓励学生进行小组讨论,分享解题方法和答案。
步骤五:总结(10分钟)8.总结课程所学内容,包括化学反应的平衡态和平衡常数的概念、计算方法,以及温度、浓度对平衡的影响。
9.提供一些练习题,巩固学生对平衡常数的掌握。
教学方法和学具使用:1.通过引导和讲解的方式让学生理解化学反应的平衡和平衡常数的概念。
化学平衡常数教案

化学平衡常数教案教案标题:化学平衡常数教案教案目标:1. 了解化学平衡常数的概念和意义;2. 理解平衡常数与反应物浓度之间的关系;3. 掌握计算平衡常数的方法;4. 理解平衡常数对反应方向和反应速率的影响。
教案步骤:引入(5分钟):1. 通过实例或问题引起学生对化学平衡常数的兴趣,例如:“当我们烧一根蜡烛时,为什么蜡烛会燃烧完而不会继续燃烧下去?”2. 引导学生思考并讨论可能的原因,引出化学平衡常数的概念。
知识讲解(15分钟):1. 解释化学平衡的概念,即反应物和生成物浓度之间达到稳定状态的情况。
2. 介绍平衡常数的定义,即反应物浓度与生成物浓度的乘积的比值。
3. 解释平衡常数对反应方向的影响,当平衡常数大于1时,反应向生成物方向偏移,当平衡常数小于1时,反应向反应物方向偏移。
4. 引导学生理解平衡常数与反应速率的关系,平衡常数大的反应速率较快,平衡常数小的反应速率较慢。
示例演练(20分钟):1. 提供一个化学反应的方程式,并要求学生计算该反应的平衡常数。
2. 引导学生按照平衡常数的计算公式进行计算,并解释计算过程。
3. 帮助学生理解平衡常数的数值意义,比较不同反应的平衡常数大小。
4. 给学生提供更多的化学反应方程式,让他们自己计算平衡常数,并讨论结果。
拓展应用(15分钟):1. 引导学生思考平衡常数与温度的关系,解释温度对平衡常数的影响。
2. 提供一些实际应用的例子,让学生分析平衡常数在这些例子中的作用。
总结(5分钟):1. 回顾本节课学习的内容,强调化学平衡常数的重要性和应用。
2. 鼓励学生继续探索化学平衡常数的相关知识,并与实际生活联系起来。
教学资源:1. 化学平衡常数的教材和参考书籍;2. 化学实验室或模拟实验软件,用于演示化学反应平衡的实验过程;3. 计算器或电脑,用于计算平衡常数。
评估方式:1. 课堂讨论和问题解答;2. 学生完成的计算平衡常数的练习题;3. 学生对平衡常数在实际应用中的理解和分析。
化学平衡常数教案
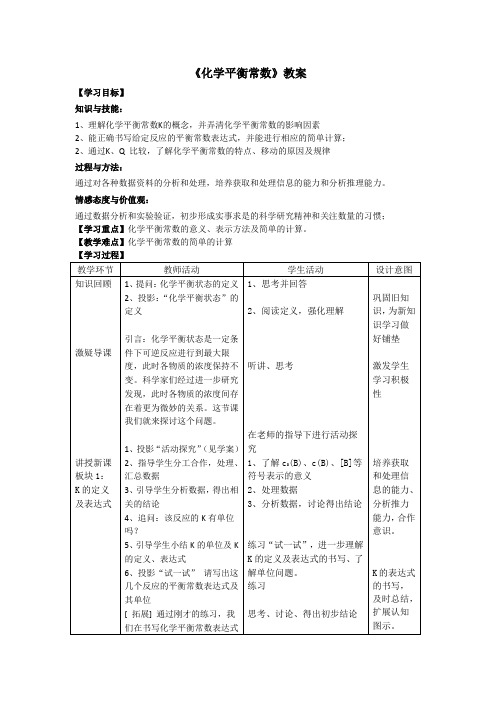
《化学平衡常数》教案【学习目标】知识与技能:1、理解化学平衡常数K的概念,并弄清化学平衡常数的影响因素2、能正确书写给定反应的平衡常数表达式,并能进行相应的简单计算;2、通过K、Q 比较,了解化学平衡常数的特点、移动的原因及规律过程与方法:通过对各种数据资料的分析和处理,培养获取和处理信息的能力和分析推理能力。
情感态度与价值观:通过数据分析和实验验证,初步形成实事求是的科学研究精神和关注数量的习惯;【学习重点】化学平衡常数的意义、表示方法及简单的计算。
【教学难点】化学平衡常数的简单的计算【学习过程】教学环节教师活动学生活动设计意图知识回顾激疑导课讲授新课板块1:K的定义及表达式1、提问:化学平衡状态的定义2、投影:“化学平衡状态”的定义引言:化学平衡状态是一定条件下可逆反应进行到最大限度,此时各物质的浓度保持不变。
科学家们经过进一步研究发现,此时各物质的浓度间存在着更为微妙的关系。
这节课我们就来探讨这个问题。
1、投影“活动探究”(见学案)2、指导学生分工合作,处理、汇总数据3、引导学生分析数据,得出相关的结论4、追问:该反应的K有单位吗?5、引导学生小结K的单位及K的定义、表达式6、投影“试一试”请写出这几个反应的平衡常数表达式及其单位[ 拓展] 通过刚才的练习,我们在书写化学平衡常数表达式1、思考并回答2、阅读定义,强化理解听讲、思考在老师的指导下进行活动探究1、了解c0(B)、c(B)、[B]等符号表示的意义2、处理数据3、分析数据,讨论得出结论练习“试一试”,进一步理解K的定义及表达式的书写、了解单位问题。
练习思考、讨论、得出初步结论巩固旧知识,为新知识学习做好铺垫激发学生学习积极性培养获取和处理信息的能力、分析推力能力,合作意识。
K的表达式的书写,及时总结,扩展认知图示。
板块2:K的影响因素板块3:K 的意义课堂小结巩固练习时,应注意哪些问题呢?[ 思考讨论2]7、分析投影中的实验数据,寻找其中的规律。
化学平衡常数教案

化学平衡常数教案【篇一:高中化学选修4第二章化学平衡常数教案】化学平衡常数【学习目标】:1、化学平衡常数的概念2、运用化学平衡常数对化学反应进行的程度判断3、运用化学平衡常数进行计算,转化率的计算【学习过程】:[引言]当一个可逆反应达到化学平衡状态时,反应物和生成物的浓度之间有怎样的定量关系,请完成44页[问题解决],你能得出什么结论?一、化学平衡常数1的乘积与反应物浓度以系数为指数的幂的乘积的比值是一个常数。
这个常数就是该反应的化学平衡常数(简称平衡常数)2、表达式:对于一般的可逆反应,ma(g)+ nb(g)pc(g)+qd(g)当在一定温度下达到平衡时,k==cpqmn阅读45页表2-7,你能得出什么结论?3、平衡常数的意义:(1)平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。
k值越大,表示反应进行得k值越小,表示反应进行得(2)判断正在进行的可逆是否平衡及反应向何方向进行:qc<k ,反应向正反应方向进行qc=k ,反应处于平衡状态qc>k ,反应向逆反应方向进行(3)利用K可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应(填“吸热”或“放热”)。
若升高温度,K值减小,则正反应为放热反应(填“吸热”或“放热”)。
阅读45页表2-8、2-9,你能得出哪些结论?二、使用平衡常数应注意的几个问题:1、化学平衡常数只与有关,与反应物或生成物的浓度无关。
2、在平衡常数表达式中:水(液态)的浓度、固体物质的浓度不写c(s)+h2o(g)fe(s)+co(g)co(g)+h2(g),fe(s)+co2(g),3、化学平衡常数表达式与化学方程式的书写有关例如:n2(g)+3h2(g)2nh3(g)的平衡常数为k1,1/2n2(g)+3/2h2(g)衡常数为k2,nh3(g)1/2n2(g)+3/2h2(g)的平衡常数为k3;写出k1和k22写出k2和k3写出k1和k3转化率越大,反应越完全!四、有关化学平衡常数的计算:阅读46页例1和例2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节 化学平衡第三课时 化学平衡常数晨背关键语句⒈一定温度下的可逆反应a A+b B c C+d D 达平衡后,K = ⒉化学平衡常数K 只受温度的影响,与反应物或生成物的浓度变化无关。
⒊K 值越大,正向反应进行的程度越大,反应进行得越完全,反应物的转化率越高。
理解教材新知识知识点一 化学平衡常数[自学教材 填要点]1. 概念在一定温度下,可逆反应达到 时, 浓度幂之积与 浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K 表示。
2. 表达式对于任意反应:m A+n Bp C+q D K =3、书写平衡常数表达式时,要注意:(1) 化学平衡常数只与 有关,与反应物或生成物的 无关。
(2) 反应物或生成物中有固体和纯液体存在时,(2) 化学平衡常数表达式与化学方程式的书写方式有关,化学平衡常数是指某一具体反应的平衡常数。
若反应方向改变,则平衡常数 。
若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会 。
[师生互动 解疑难]⑴化学平衡常数只与温度有关。
若升高温度,K 值越大,则正反应为吸热反应,反之亦然。
⑵K 值越大,说明平衡体系中生成物所占比例越大,它的正向反应进行的程度越大。
⑶如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度固定不变,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。
⑷同一化学反应,在同一温度下,平衡常数的具体数值与方程式的写法相关,方程式写法不同,表达式中的幂不同,平衡常数不同。
可以用不同的化学方程式来)(c )(c )(c )(c b a d c B A D C ••表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
小试身手一定条件下,C(s)+H2O(g)CO(g)+H2(g)的平衡常数表达式K= 。
知识点二化学平衡常数的应用[自学教材填要点]⒈平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。
K值越大,表示反应进行得越,反应物转化率越;K值越小,表示反应进行得越,反应物转化率越。
⒉判断正在进行的可逆是否平衡及反应向何方向进行:对于可逆反应:mA(g)+ nB(g)pC(g)+ qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Q c=C p(C)·C q(D)/C m(A)·C n(B),叫该反应的浓度商。
Q c<K ,V正V逆,反应向反应方向进行Q c=K ,V正V逆,反应处于状态Q c>K ,V正V逆,反应向反应方向进行⒊利用K可判断反应的热效应若升高温度,K值增大,则正反应为反应(填“吸热”或“放热”)。
若升高温度,K值减小,则正反应为反应(填“吸热”或“放热”)。
⒋有关化学平衡的计算:在反应aA(g)+bB (g) cC (g)+ dD (g)中,计算关系为:⑴、物质浓度的变化关系:①、反应物:平衡浓度=————————————————②、生成物:平衡浓度=————————————————③、各物质的变化浓度之比=————————————————⑵、反应物的转化率:反应物转化为生成物的百分率[师生互动解疑难]①如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中②稀溶液中进行的反应,如有液态水参加,水的浓度也不必写在平衡关系式中③同一化学反应,在同一温度下,平衡常数的具体数值与方程式的写法相关,方程式写法不同,表达式中的幂不同,平衡常数不同。
小试身手下列化学平衡常数的说法正确的是:A .化学平衡发生移动,平衡常数必发生变化B .对一个化学反应只有一个平衡常数C .改变温度,平衡常数一定改变D .催化剂改变达到平衡的时间,必引起平衡常数的改变把握高考热点方向考向一 化学平衡常数及应用[例一] 反应Fe(s)+CO 2(g)FeO(s)+CO(g) ΔH =a kJ/mol 1,平衡常数为K ; 温度/℃500 700 900 K 1.00 1.47 2.40 (1)若500℃时进行上述反应,CO 2起始浓度为 2 mol/L ,CO 的平衡浓度为________。
(2)上述反应中的a ________0(填“大于”“小于”或“等于”)。
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有________(填序号)。
A .缩小反应器体积B .通入CO 2C .升高温度到900℃D .使用合适的催化剂〔解析〕⑴设500℃时CO 的平衡浓度为xmol/L ,则 Fe(s)+CO 2(g)FeO(s)+CO(g)起始: 2 0变化: x x平衡: 2-x x 则K= = =1,解得x =1。
⑵由表格中数据可知,温度越高K 值越大,推知温度升高平衡向正方向移动,故此反应为吸热反应,即a 大于0。
⑶A 项缩小反应器体积,平衡不移动,错误;B 项通入CO 2,平衡向又移动,正确;C 项升高温度时,平衡向右移动,正确;D 项使用催化剂不会使平衡发生移动,错误。
)(c )(c 2CO COx x 2〔答案〕(1)1mol·L -1(2分) (2)大于(2分) (3)BC跟踪训练I 2在KI 溶液中存在下列平衡:I 2(aq) + I -(aq)I 3一(aq)。
测得不同温度下该反应的平衡常数置如下表: 下列说法正确的是:A.反应I 2(aq) + I -(aq) I 3一(aq)的△H>0B.利用该反应可以除去硫粉中少量的碘单质C.在上述平衡体系中加入苯,平衡不移动D.25℃时,向溶液中加入少量KI 固体,平衡常数K 小于680考向二 平衡常数与转化率的相关计算〔例2〕将等物质的量的CH 4和H 2O(g)充入1L 恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO 的物质的量为0.10mol ,求CH 4的平衡转化率(结果保留两位有效数字)〔解析〕近几年围绕三段式,对平衡常数及转化率的计算并不多见,出现这类题目,可能要重新反思过去我们淡化计算的惯性思路。
广东卷就考查纯计算技巧的题目并不多见,如差量法、平均值法、极值法、守恒法等考得并不多,但并不意味广东卷放弃计算,只考查如溶度积、平衡常数、反应速率的定义计算式,这道题目以及最后实验题中计算的出现,应该对我们的备考多少有一定的提示作用。
此外还应注意重视对有效数字的要求。
CH 4(g)+H 2O (g)CO(g)+3H 2(g)起始: n n 0 0变化: 0.1 0.1 0.1 0.3平衡: n -0.1 n -0.1 0.1 0.3 则K= 转化率=(0.1mol÷0.11mol )×100%=91%〔答案〕 91%借题发挥t/℃5 15 25 35 50 K1100 841 680 533 409 .11.0,27)1.0(3.01.023mol n n ==-⨯(1) 代入平衡常数K 表达式的各浓度一定是某一温度下各反应物和生成物的平衡浓度。
(2) 转化率计算的三个公式:(反应物A (或B )的平衡转化率(%))跟踪训练在一定温度下,反应H 2(g)+X 2(g) 2HX(g)的平衡常数为10。
若将1.0mol 的HX(g)通入体积为1.0L 的密闭容器中,在该温度时HX(g)的最大分解率接近于A .5%B .17%C .25%D .33%随堂基础巩固.⒈下列关于平衡常数的说法中,正确的是( )A .在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示B .化学平衡常数较大的可逆反应,所有反应物的转化率一定大C .可以用化学平衡常数来定量描述化学反应的限度D .平衡常数的大小与温度、浓度、压强、催化剂有关⒉关于 C(s)+H 2O(g)CO(g)+H 2(g)的平衡常数(K)书写形式,正确的是( )A. B. C. D.⒊某温度下,反应2SO 2(g )+O 2(g )⇌2SO 3(g ) 的平衡常数K 1=50,在同一温度下,反应2SO 3(g )⇌2SO 2(g )+O 2(g )的平衡常数K 2的值为( )A .2500B .100C .0.02D .0.001⒋在相同的温度下,已知反应:① N 2(g)+O 2(g)2NO(g)的平衡常K=3.84×10-31② 2SO 2(g)+O 2(g)2SO 3(g)的平衡常K=3.10×1026(mol•L -1)-1则在该温度下,两)(c )(c )(c )(c 22H CO O H C K ••= )(c )(c )(c )(c 22O H C H CO K ••= )(c )(c )(c 22O H H CO K •= )(c )(c )(c 22H CO O H K •=个化学反应的反应程度之间的关系为()A、①> ②B、①< ②C、①= ②D、不能确定⒌写出下列可逆反应的平衡常数(K)的表达式。
(1)2SO2(g)+O2(g)2SO3(g)____________________________;(2)SiCl4(l)+2H2O(g)SiO2(s)+4HCl( g)_____________________________;(3)2N2O5(g)4NO2(g)+O2(g)____________________________;(4)3Fe(s) +4H2O(g)Fe3O4(s)+4H2(g)___________________________ 。
疑点反馈:(通过本课学习、作业后你还有哪些没有搞懂的知识,请记录下来)课时跟踪训练(九)化学平衡常数一、选择题(本题包括7小题,每小题3分,共21分)1.在某温度下,可逆反应的平衡常数为K,下列说法不.正确的是()A.K越大,达到平衡时反应进行得程度越大B.K越大,达到平衡时反应物的转化率越大C.K随反应物浓度的改变而改变D.K随温度的改变而改变2.对于可逆反应:C(s)+CO2(g) 2CO(g),在一定温度下其平衡常数为K,下列条件的变化中能使K发生变化的是()A.将C(s)的表面积增大B.增大体系压强C.升高体系温度D.使用合适的催化剂3.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K值分别是①H2+F22HF K=1047②H2+Cl22HCl K=1017③H2+Br22HBr K=109④H2+I22HI K=1比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是() A.①②③④ B.④②③①C.①④③②D.无法确定4.高温、催化剂条件下,某反应达到平衡,平衡常数K=c CO·c H2Oc CO2·c H2。
恒容时,温度升高,H2浓度减小。
