材料科学基础部分习题
材料科学基础习题

第1章固体结构1.何谓晶体?晶体与非晶体有何区别?2.已知MgO晶体中Mg2+和O2-在三维空间有规律地相间排列,其晶体结构相当于两套面心立方点阵互相套叠在一起,晶胞常数a=b=c=4.20 ,α=β=γ=90℃,请回答:①画出MgO晶体二维和三维空间的晶体结构图.②从①的图形中抽象出MgO晶体的空间点阵图形.③从②中划分出单位空间格子,计算其结点数.④画出晶胞结构图,指出晶胞中的分子数.3.何谓元素电负性,有何意义?在元素周期表中分布规律如何?4.何谓晶格能,用途?试计算MgO晶格能。
已知:MgO属NaCl型结构,立方面心点阵N0=6.023×1023,e=4.8×10-10静电单位,r =1.32 , r =0.78 ,A=1.74765.画出MgO晶体(立方面心点阵)在(1 0 0)、(1 1 0)、(1 1 1)晶面上的结点和离子排布图.6.立方晶系中①画出下列晶面:(0 0 1)、(1 0)、(1 1 1)②在①所画晶面上分别标出下列晶向:[2 1 0]、[1 1 1]、[1 0 ].7.在立方晶系中给出(1 1 1)面和(1 1 )面交棱的晶棱符号.8.找出正交晶系(斜方)(P点阵)宏观对称型.9.何谓布拉维点阵?举例论证为什么仅有14种?14种布拉维点阵分属的七个晶系名称?点阵常数特点?14种布拉维点阵分为几个类型?结点数计算?10.表示晶体的宏观对称性,其特点?如何表示晶体的微观对称性,其特点?11.划分单位平行六面体应遵循那些原则?何谓晶格常数?12.何谓晶胞、原胞、单位空间格子?13.试举例说明:晶体结构与空间点阵?晶胞与单位空间格子的关系?14.什么叫离子半径?有何实用意义?什么叫离子极化?极化对晶体结构有什么影响?15.解释原子,离子配位数. 根据半径比关系,说明下列离子与O2-配位时的配位数及配位多面体的类型.r =1.32 , r =0.39 ,r =0.57 ,r =0.78 ,r =1.10 .16.胞林规则有几条?其要点是什么?应用胞林规则有何局限性?17.试用胞林规则分析MgO晶体结构.(r =0.78 ,r =1.32 )18.运用胞林规则来解释在氧离子立方密堆体中,对于获得稳定结构各需要何种电价的离子,其中:①所有八面体间隙位置均填满.②所有四面体间隙位置均填满.③填满一半八面体间隙位置.④填满一半四面体间隙位置.19.已知:r =0.78 ,Mg的原子量为24.30,r =1.32计算:①MgO的点阵常数;②MgO的密度.20.画出闪锌矿、萤石晶胞结构在(0 0 1)面上的投影图.21.金红石的晶胞为什么不属于四方体心格子而是四方原始格子呢?而萤石的结构为什么不是立方原始格子而是立方面心格子?22.比较ThO2、TiO2、MgO结构中间隙的大小.23.简单说明下列名词的含义:反萤石结构,反尖晶石结构.24.指出下列化合物的结构类型,并改写成化学式:γ-Ca2[SiO4]、Ca2Al[AlSiO7]、CaMg[Si2O6]、Mg3[Si4O10](OH)2、K[AlSi3O8].25.高岭石、叶腊石和云母具有相似的结构,画出它们的结构草图,说明它们结构的区别及由此而引起的性质上的差异.26.下列物质的结构式,化学组成式写成相应的化学组成式和结构式:a) Al2O3·2SiO2·2H2O; ②2CaO·5MgO·8SiO2·H2O;③CaMg[Si206]; ④Na[AlSi3O8]27.说明高岭石、叶腊石和白云母结构区别及由此引起的性质上差异.28.在层状硅酸盐结构中,八面体层中的Al3+可以取代四面体层中的Si4+、而四面体层中的Si4+从来不会置换八面体层中的Al3+为什么?已知:r =1.40 , r =0.40 ,r =0.53 .29.青石2MgO·2Al2O3·5SiO2具有与绿柱石Be3Al2[Si6O8]类型结构,写出它的结构式,并指出它是由绿柱石进行怎样的离子置换而得来的?30.α—方石英属立方晶系,面心立方点阵,a=7.05 ,请a) 画出晶胞在(0 0 1)面上的投影图,注明各离子相对标高。
《材料科学基础》练习题集01

《材料科学基础》复习题第1章原子结构与结合键一、判断题:4、金属键具有明显的方向性和饱和性。
( F)5、共价键具有明显的方向性和饱和性。
( T)6、组成固溶体的两组元完全互溶的必要条件是两组元的电负性相同。
两组元的晶体结构相同( F)7、工程材料的强度与结合键有一定的关系,结合键能越高的材料,通常其弹性模量、强度和熔点越低。
(F)8、晶体中配位数和致密度之间的关系是配位数越大,致密度越小。
(F )二、选择题:1、具有明显的方向性和饱和性。
A、金属键B、共价键C、离子键D、化学键2、以下各种结合键中,结合键能最大的是。
A、离子键、共价键B、金属键C、分子键D、化学键3、以下各种结合键中,结合键能最小的是。
A、离子键、共价键B、金属键C、分子键D、化学键5、已知铝元素的电负性为1.61,氧元素的电负性为3.44,则Al2O3中离子键结合的比例为。
A、28%B、45%C、57%D、68%6、以下关于结合键的性质与材料性能的关系中,是不正确的。
P54A、结合键能是影响弹性模量的主要因素,结合键能越大,材料的弹性模量越大。
B、具有同类型结合键的材料,结合键能越高,熔点也越高。
C、具有离子键和共价键的材料,塑性较差。
D、随着温度升高,金属中的正离子和原子本身振动的幅度加大,导电率和导热率都会增加。
(应该是自由电子的定向运动加剧)7、组成固溶体的两组元完全互溶的必要条件是。
A、两组元的电子浓度相同B、两组元的晶体结构相同C、两组元的原子半径相同D、两组元电负性相同11、晶体中配位数和致密度之间的关系是。
A、配位数越大,致密度越大B、配位数越小,致密度越大C、配位数越大,致密度越小D、两者之间无直接关系三、填空题:2、构成陶瓷化合物的两种元素的电负性差值越大,则化合物中离子键结合的比例越大。
3、体心立方结构的晶格常数为a,单位晶胞原子数为 2 、原子半径为a ,配位数为 8 。
4、面心立方结构的晶格常数为a ,原子半径为 a ,配位数为 12 。
材料科学基础试卷

材料科学基础试卷一、选择题1. 在以下选项中,哪个是材料科学研究的基本目标?A. 提高材料的性能和寿命B. 制定新的材料标准C. 推动材料的商业化应用D. 减少材料的生产成本2. 下列哪个属于材料科学的主要研究内容?A. 材料的机械性能B. 材料的表面处理技术C. 材料的市场价值评估D. 材料的生产工艺3. 晶体结构的表征常用的方法是什么?A. 透射电子显微镜(TEM)B. 扫描电子显微镜(SEM)C. 傅里叶变换红外光谱(FTIR)D. X射线衍射(XRD)4. 以下哪项不是观察材料中晶体缺陷的常用方法?A. 透射电子显微镜(TEM)B. 扫描电子显微镜(SEM)C. 热重分析仪(TGA)D. X射线衍射(XRD)5. 玻璃是一种无序非晶体,其特点是什么?A. 有定型的几何结构B. 具有较高的强度和硬度C. 没有明确的熔点D. 可通过加热重新晶化二、简答题1. 请简述材料科学的定义和研究对象。
材料科学是研究材料的组成、结构、性能和制备工艺等方面的学科。
它的研究对象包括金属、陶瓷、聚合物、复合材料等各种材料的性质和行为。
2. 简要介绍一下晶体和非晶体的区别。
晶体具有有序的、周期性的原子结构,其原子排列呈现规则的几何形态。
非晶体则没有明确的周期性结构,其原子排列无序。
3. 请简述材料的力学性能和热学性能分别指的是什么。
材料的力学性能指材料在外力作用下的表现,包括强度、硬度、韧性等。
热学性能指材料在温度变化下的行为,包括热膨胀系数、热导率等。
4. 请列举一种主要的材料表面处理技术,并简述其原理。
一种主要的材料表面处理技术是阳极氧化。
其原理是将金属材料作为阳极,通过在电解液中施加电流,使得金属表面产生氧化反应形成氧化膜,从而提高材料的耐腐蚀性和表面硬度。
5. 简述材料的疲劳破坏机理。
材料的疲劳破坏是在交变载荷作用下产生的、逐渐发展的、具有累积性的破坏。
其机理是在应力作用下,材料内部会逐渐形成裂纹,裂纹扩展到一定程度后导致材料断裂。
材料科学基础课后习题答案(部分)_第2版_西安交通大学_石德珂主编
2.11 0.77 6.69 0.77
100%
22.6%
Fe3CⅡ%(由 初中析出) 初 % 22.6%
59.36% 22.6% 13.41%
P% 初 % Fe3CⅡ% 59.36% 13.41% 45.95%
相组成物: Fe3C % 6.69 3.0 100% 55.17%
4.
101
2
011
2
1102
1 012
0112
11
02
1 01
2
0112
11
0
2
101
2
011
2
110
2
11 01
2
2
41
4
221
11
2
0
1
2
1
0
6.
晶面及 {100} {110} {111} 〈100〉 〈110〉 〈111〉 晶向
bcc
1
2
7.在两根位错线上12,34为刃位错,其余 为螺位错。
(2)OS上的各段位错都可在该滑移面内 滑移,O’S’上的12,34位错不能运动, 其余各段都可在该滑移面内滑移。
8.(1)AB和CD位错线的形状都不变, 但AB的长度缩短b2,CD的长度增加b1
(2)AB位错上形成右螺型扭折,EF上 形成左螺型扭折。
31
2 23
a2
a2
3a 243 1
2
3
a2
a 2 3a2
a
a
3a
密排面指数 密排面原子密度 密排方向指数 密排方向原 子密度
bcc (110)
2
a2
fcc (111) 4 3
3a2
材料科学基础复习题及答案

单项选择题:(每一道题1分)第1章原子结构与键合1.高分子材料中的C-H化学键属于。
(A)氢键(B)离子键(C)共价键2.属于物理键的是。
(A)共价键(B)范德华力(C)氢键3.化学键中通过共用电子对形成的是。
(A)共价键(B)离子键(C)金属键第2章固体结构4.面心立方晶体的致密度为 C 。
(A)100% (B)68% (C)74%5.体心立方晶体的致密度为 B 。
(A)100% (B)68% (C)74%6.密排六方晶体的致密度为 C 。
(A)100% (B)68% (C)74%7.以下不具有多晶型性的金属是。
(A)铜(B)锰(C)铁8.面心立方晶体的孪晶面是。
(A){112} (B){110} (C){111}9.fcc、bcc、hcp三种单晶材料中,形变时各向异性行为最显著的是。
(A)fcc (B)bcc (C)hcp10.在纯铜基体中添加微细氧化铝颗粒不属于一下哪种强化方式?(A)复合强化(B)弥散强化(C)固溶强化11.与过渡金属最容易形成间隙化合物的元素是。
(A)氮(B)碳(C)硼12.以下属于正常价化合物的是。
(A)Mg2Pb (B)Cu5Sn (C)Fe3C第3章晶体缺陷13.刃型位错的滑移方向与位错线之间的几何关系?(A)垂直(B)平行(C)交叉14.能进行攀移的位错必然是。
(A)刃型位错(B)螺型位错(C)混合位错15.在晶体中形成空位的同时又产生间隙原子,这样的缺陷称为。
(A)肖特基缺陷(B)弗仑克尔缺陷(C)线缺陷16.原子迁移到间隙中形成空位-间隙对的点缺陷称为(A)肖脱基缺陷(B)Frank缺陷(C)堆垛层错17.以下材料中既存在晶界、又存在相界的是(A)孪晶铜(B)中碳钢(C)亚共晶铝硅合金18.大角度晶界具有____________个自由度。
(A)3 (B)4 (C)5第4章固体中原子及分子的运动19.菲克第一定律描述了稳态扩散的特征,即浓度不随变化。
(A)距离(B)时间(C)温度20.在置换型固溶体中,原子扩散的方式一般为。
《材料科学基础》习题

1
2.固态下完全不互溶的三元共晶相图如图6-2所示,画出过Am、PQ的垂直截面。若三组元的熔点tA>tB>tC,请画出tB <t<tA温度下的水平截面。
3.液相面投影图如图6-3,分析O合金的结晶过程,画出冷却曲线、结晶示意图、注明反应式,并计算室温下组织组成物的相对量。
4.液相面投影图如图6-4,请写出全部四相平衡转变。
4.计算面心立方结构(111)、(110)与(100)面的面密度和面间距。
5.FeAl是电子化合物,具有体心立方点阵,试画出其晶胞,计算电子浓度,画出(112)面原子排列图。
6.合金相VC、Fe3C、CuZn、ZrFe2属于何种类型,并指出其结构特点。
第二章 晶体缺陷
1.铜的空位生成能1.7×10-19J,试计算1000℃时,1cm3铜所包含的空位数,铜的密度8.9g/cm3,相对原子质量63.5,玻尔兹曼常数K=1.38×10-23J/K。
1.何为成份过冷?影响成份过冷的因素有那些?试述区域提纯的原理。
2.简述枝晶偏析形成过程和消除方法。
3.分析0.45%C,1.2%C和2.3%C 的铁碳合金的平衡结晶过程,计算室温下组织组成 物的相对量及两相相对量。
4.根据显微组织分析,一灰口铁内石墨的体积占12%,铁素体的体积占88%,试求该合金的碳含量。
如图2-1所示的位错环,说明各段位错的性质,并指出刃位错多余半原子面的位置。
2.如图2-2,某晶体滑移面上有一个 柏氏矢量为b的位错环,受到均匀切应力τ作用,试分析:
该位错环各段位错的结构类型;
求各段位错所受的力;
在τ的作用下,位错环将如何运动?
在τ的作用下,位错环稳定不动,其最小半径应该多大?
(完整版)材料科学基础习题及答案
第一章材料的结构一、解释以下基本概念空间点阵、晶格、晶胞、配位数、致密度、共价键、离子键、金属键、组元、合金、相、固溶体、中间相、间隙固溶体、置换固溶体、固溶强化、第二相强化.二、填空题1、材料的键合方式有四类,分别是(),( ),(),().2、金属原子的特点是最外层电子数(),且与原子核引力(),因此这些电子极容易脱离原子核的束缚而变成( )。
3、我们把原子在物质内部呈( )排列的固体物质称为晶体,晶体物质具有以下三个特点,分别是(),( ),( ).4、三种常见的金属晶格分别为(),( )和().5、体心立方晶格中,晶胞原子数为( ),原子半径与晶格常数的关系为( ),配位数是(),致密度是( ),密排晶向为(),密排晶面为( ),晶胞中八面体间隙个数为(),四面体间隙个数为( ),具有体心立方晶格的常见金属有()。
6、面心立方晶格中,晶胞原子数为( ),原子半径与晶格常数的关系为(),配位数是( ),致密度是(),密排晶向为( ),密排晶面为(),晶胞中八面体间隙个数为( ),四面体间隙个数为(),具有面心立方晶格的常见金属有()。
7、密排六方晶格中,晶胞原子数为(),原子半径与晶格常数的关系为(),配位数是(),致密度是(),密排晶向为( ),密排晶面为(),具有密排六方晶格的常见金属有( )。
8、合金的相结构分为两大类,分别是()和( )。
9、固溶体按照溶质原子在晶格中所占的位置分为()和(),按照固溶度分为()和(),按照溶质原子与溶剂原子相对分布分为()和()。
10、影响固溶体结构形式和溶解度的因素主要有()、()、()、()。
11、金属化合物(中间相)分为以下四类,分别是( ),( ),( ),( )。
12、金属化合物(中间相)的性能特点是:熔点()、硬度( )、脆性(),因此在合金中不作为()相,而是少量存在起到第二相()作用。
13、CuZn、Cu5Zn8、Cu3Sn的电子浓度分别为(),( ),( ).14、如果用M表示金属,用X表示非金属,间隙相的分子式可以写成如下四种形式,分别是( ),(),( ),( ).15、Fe3C的铁、碳原子比为(),碳的重量百分数为(),它是( )的主要强化相。
材料科学基础习题及参考答案
材料科学基础参考答案材料科学基础第一次作业1.举例说明各种结合键的特点。
⑴金属键:电子共有化,无饱和性,无方向性,趋于形成低能量的密堆结构,金属受力变形时不会破坏金属键,良好的延展性,一般具有良好的导电和导热性。
⑵离子键:大多数盐类、碱类和金属氧化物主要以离子键的方式结合,以离子为结合单元,无方向性,无饱和性,正负离子静电引力强,熔点和硬度均较高。
常温时良好的绝缘性,高温熔融状态时,呈现离子导电性。
⑶共价键:有方向性和饱和性,原子共用电子对,配位数比较小,结合牢固,具有结构稳定、熔点高、质硬脆等特点,导电能力差。
⑷范德瓦耳斯力:无方向性,无饱和性,包括静电力、诱导力和色散力。
结合较弱。
⑸氢键:极性分子键,存在于HF,H2O,NF3有方向性和饱和性,键能介于化学键和范德瓦尔斯力之间。
2.在立方晶体系的晶胞图中画出以下晶面和晶向:(1 0 2)、(1 1 -2)、(-2 1 -3),[1 1 0],[1 1 -1],[1 -2 0]和[-3 2 1]。
(213)3. 写出六方晶系的{1 1 -20},{1 0 -1 2}晶面族和<2 -1 -1 0>,<-1 0 1 1>晶向族中各等价晶面及等价晶向的具体指数。
{1120}的等价晶面:(1120)(2110)(1210)(1120)(2110)(1210){1012}的等价晶面:(1012)(1102)(0112)(1012)(1102)(0112) (1012)(1102)(0112)(1012)(1102)(0112)2110<>的等价晶向:[2110][1210][1120][2110][1210][1120]1011<>的等价晶向:[1011][1101][0111][0111][1101][1011][1011][1101][0111][0111][1101][1011]4立方点阵的某一晶面(hkl )的面间距为M /,其中M 为一正整数,为晶格常数。
《材料科学基础》习题及参考答案
答案
2.试从晶体结构的角度,说明间隙固溶体、间隙相及
间隙化合物之间的区别。
答案
返回
3. 何谓玻璃?从内部原子排列和性能上看,
非晶态和晶态物质主要区别何在?
答案
4.有序合金的原子排列有何特点?这种排列
和结合键有什么关系?为什么许多有序合金
在高温下变成无序?
答案
5. 试分析H、N、C、B在Fe和Fe中形成固熔
6.离异共晶
答案
7.伪共晶
答案
8.杠杆定理
答案
返回
二、综合题
1.在图4—30所示相图中,请指出: (1) 水平线上反应的性质; (2) 各区域的组织组成物; (3) 分析合金I,II的冷却过程; (4) 合金工,II室温时组织组成物的相对量表达式。
答案
返回
2.固溶体合金的相图如下图所示,试根据相图确定: ①成分为ω(B)=40%的合金首
答案
返回
7. 根据图7-9所示的A1-Si共晶相图,试分析图中(a),(b),(c)3个金相组 织属什么成分并说明理由。指出细化此合金铸态组织的途径。
答案
返回
8. 青铜( Cu-Sn)和黄铜C Cu--fin)相图如图7-15(a),(b)所示:
①叙述Cu-10% Sn合金的不平衡冷却过程,并指出室温时的 金相组织。
化时是否会出现过热,为什么?
答案
3.欲获得金属玻璃,为什么一般选用液相线很陡,
从而有较低共晶温度的二元系?
答案
4.比较说明过冷度、临界过冷度、动态过冷度等
概念的区别。
答案
5.分析纯金属生长形态与温度梯度的关系。 答案
返回
6.简述纯金属晶体长大的机制。
材料科学基础习题
第一章1.1 为什么说无机材料的化学键与电子结构是决定其晶体结构和物理性能的最基本因素?答:晶体结构是晶体中原子或离子按照一定的排列规律在空间周期性重复排列的结果。
构成晶体的各原子的电子结构决定了它们按照何种键型结合:离子键、金属键、共价键或分子键。
键型是影响晶体中原子配位结构的最主要因素,如纯离子键晶体中离子按照等大球体或不等大球体最紧密堆积方式排列;金属键是离子间的排斥力和电子与离子间引力平衡的结果;共价键中电子排列特点使共价键具有饱和性,原子间只能按照特定的方位结合;极性共价键是离子键向共价键过渡,缩短了部分阴阳离子间的距离,进而影响晶体结构。
晶体的物理性质取决于其晶体结构,也最终与材料的化学键和电子结构有关。
第二章2.3 金属Ni 具有立方最紧密堆积的晶体结构,试问:① 一个晶胞中有几个Ni 原子;② 若已知Ni 原子的半径为0.125 nm ,其晶胞的边长为多少? 答:① 一个晶胞中Ni 原子个数为:4881621=⨯+⨯个② 假设Ni 原子半径为r=0.125 nm ,晶胞边长为a ,则:a r 24=nm r a 354.022==2.4 金属Al 属立方晶系,其边长为0.405 nm ,假定其质量密度是2.70 g/cm 3,试确定其晶胞的布拉菲格子类型。
解:要确定晶胞的布拉菲格子实际上就是确定每个晶胞中Al 原子的个数 每个晶胞的体积为:323333310643.606643.0)405.0(cm nm nm a v ⨯====每个晶胞的质量:23222.70 6.64310 1.79410m v g g ρ--==⨯⨯=⨯每个晶胞中Al 原子个数:4)1002.6/(2710794.12322=⨯⨯==-Al m m n由此可以判断金属Al 为立方面心格子。
2.6试画出立方晶体结构中的下列晶面:(001)、(110)、(111);并分别标出下列晶向:[210]、[111]、[101]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
晶体结构1、解释下列概念晶系、晶胞、晶胞参数、空间点阵、米勒指数(晶面指数)、离子晶体的晶格能、原子半径与离子半径、配位数、离子极化、同质多晶与类质同晶、正尖晶石与反正尖晶石、反萤石结构、铁电效应、压电效应.2、(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求出该晶面的米勒指数;(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的米勒指数。
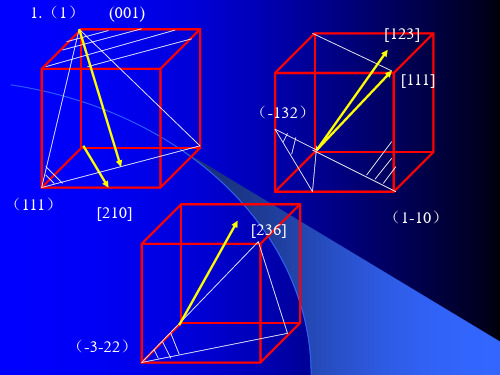
3、在立方晶系的晶胞中画出下列米勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213),[110],[111],[120],[321]4、写出面心立方格子的单位平行六面体上所有结点的坐标。
5、已知Mg2+半径为0.072nm,O2-半径为0.140nm,计算MgO晶体结构的堆积系数与密度。
6、计算体心立方、面心立方、密排六方晶胞中的原子数、配位数、堆积系数。
7、从理论计算公式计算NaC1与MgO的晶格能。
MgO的熔点为2800℃,NaC1为80l℃, 请说明这种差别的原因。
8、根据最密堆积原理,空间利用率越高,结构越稳定,金钢石结构的空间利用率很低(只有34.01%),为什么它也很稳定?9、证明等径圆球面心立方最密堆积的空隙率为25.9%;10、金属镁原子作六方密堆积,测得它的密度为1.74克/厘米3,求它的晶胞体积。
11、根据半径比关系,说明下列离子与O2—配位时的配位数各是多?r o2-=0.132nm r Si4+=0.039nm r K+=0.133nm r Al3+=0.057nm r Mg2+=0.078n m12、为什么石英不同系列变体之间的转化温度比同系列变体之间的转化温度高得多?13、有效离子半径可通过晶体结构测定算出。
在下面NaCl型结构晶体中,测得MgS 和MnS的晶胞参数均为a=0.52nm(在这两种结构中,阴离子是相互接触的)。
若CaS(a=0.567nm)、CaO(a=0.48nm)和MgO(a=0.42nm)为一般阳离子——阴离子接触,试求这些晶体中各离子的半径。
14、氟化锂(LiF)为NaCl型结构,测得其密度为2.6g/cm3,根据此数据汁算晶胞参数,并将此值与你从离子半径计算得到数值进行比较。
15、Li2O的结构是O2-作面心立方堆积,Li+占据所有四面体空隙位置。
求:(1)计算四面体空隙所能容纳的最大阳离子半径,并与书末附表Li+半径比较,说明此时O2-能否互相接触。
(2)根据离子半径数据求晶胞参数。
(3)求Li2O的密度。
16、试解释对于AX型化合物来说,正负离子为一价时多形成离子化合物。
二价时则形成的离子化合物减少(如ZnS为共价型化合物),到了三价、四价(如AlN,SiC)则是形成共价化合物了。
17、MgO和CaO同属NaCl型结构,而它们与水作用时则CaO要比MgO活泼,试解释之。
18、根据CaF2晶胞图画出CaF2晶胞的投影图。
19、算一算CdI2晶体中的I-及CaTiO3晶体中O2-的电价是否饱和。
20、(1)画出O2-作而心立方堆积时,各四面体空隙和八面体空隙的所在位置(以一个晶胞为结构基元表示出来)。
(2)计算四面体空隙数、八而休空隙数与O2-数之比。
(3)根据电价规则,在下面情况下,空隙内各需填入何种价数的阳离子,并对每一种结构举出—个例子。
(a)所有四面体空隙位置均填满;(b) 所有八而体空隙位置均填满;(c) 填满—半四面体空隙位置;(d) 填满—半八面休空隙位置。
21、下列硅酸盐矿物各属何种结构类型:Mg2[SiO4],K[AISi3O8],CaMg[Si2O6],Mg3[Si4O10](OH)2,Ca2Al[AlSiO7]。
22、根据Mg2[SiO4]在(110)面的投影图回答:(1) 结构中有几种配位多面体,各配位多面体间的连接方式怎样?(2) O2-的电价是否饱和?(3) 晶胞的分子数是多少?(4) Si4+和Mg2+所占的四面体空隙和八面体空隙的分数是多少?23、石棉矿如透闪石Ca2Mg5[Si4O11](OH)2具有纤维状结晶习性,而滑石Mg2[Si4O10](OH)2却具有片状结晶习性,试解释之。
24、石墨、滑石和高岭石具有层状结构,说明它们结构的区别及由此引起的性质上的差异。
25、(1)在硅酸盐晶体中,Al3+为什么能部分置换硅氧骨架中的Si4+;(2) Al3+置换Si4+后,对硅酸盐组成有何影响?(3)用电价规则说明Al3+置换骨架中的Si4+时,通常不超过一半,否则将使结构不稳定。
参考答案1、略。
2、解:(1)h:k:l=1/2:1/3:1/6=3:2:1,∴该晶面的米勒指数为(321);(2)(321)3、略。
4、略。
5、解:MgO为NaCl型,O2-做密堆积,Mg2+填充空隙。
r O2- =0.140nm,r Mg2+=0.072nm,z=4,晶胞中质点体积:(4/3×πr O2-3+4/3×πr Mg2+3)×4,a=2(r++r-),晶胞体积=a3,堆积系数=晶胞中MgO体积/晶胞体积=68.5%,密度=晶胞中MgO质量/晶胞体积=3.49g/cm3。
6、解:体心:原子数2,配位数8,堆积密度55.5%;面心:原子数4,配位数6,堆积密度74.04%;六方:原子数6,配位数6,堆积密度74.04%。
7、解:u=z1z2e2N0A/r0×(1-1/n)/4πε0,e=1.602×10-19,ε0=8.854×10-12,N0=6.022×1023,NaCl:z1=1,z2=1,A=1.748,n Na+=7,n Cl-=9,n=8,r0=2.81910-10m,u NaCl=752KJ/mol;MgO:z1=2,z2=2,A=1.748,n O2-=7,n Mg2+=,n=7,r0=2.1010m,u MgO=392KJ/mol;∵u MgO> u NaCl,∴MgO的熔点高。
8、略。
9、解:设球半径为a,则球的体积为4/3πa3,求的z=4,则球的总体积(晶胞)4×4/3πa3,立方体晶胞体积:(2a)3=16a3,空间利用率=球所占体积/空间体积=74.1%,空隙率=1-74.1%=25.9%。
10、解:ρ=m/V晶=1.74g/cm3,V=1.37×10-22。
11、解:Si4+ 4;K+ 12;Al3+ 6;Mg2+ 6。
12、略。
13、解:MgS中a=5.20?,阴离子相互接触,a=2r-,∴rS2-=1.84?;CaS中a=5.67?,阴-阳离子相互接触,a=2(r++r-),∴rCa 2+=0.95?;CaO中a=4.80?,a=2(r++r-),∴r O2-=1.40?;MgO中a=4.20?,a=2(r++r-),∴r Mg2+=0.70?。
14、解:LiF为NaCl型结构,z=4,V=a3,ρ=m/V=2.6g/cm3,a=4.05?,根据离子半径a1=2(r++r-)=4.14?,a<a1。
15、解:(1)如图是一个四面体空隙,O为四面体中心位置。
AO=r++r-,BC=2r-,CE=r-,CG=2/3CE=2r-/3,AG=2r-/3,△OGC∽△EFC,OG/CG=EF/CF,OG=EF/CF×CG=r-/6,AO=AG-OG=r/2,r+=AO-r- =(/2-1)r=0.301?,查表知rLi+=0.68? >0.301?,∴O2-不能互相接触;(2)体对角线=a=4(r++r-),a=4.665?;(3)ρ=m/V=1.963g/cm3.16、略。
17、解:r Mg2+与r Ca2+不同,r Ca2+> r Mg2+,使CaO结构较MgO疏松,H2O易于进入,所以活泼。
18.19.20、(1)略;(2)四面体空隙数/O2-数=2:1,八面体空隙数/O2-数=1:1;(3)(a)CN=4,z+/4×8=2,z+=1,Na2O,Li2O;(b)CN=6,z+/6×6=2,z+=2,FeO,MnO;(c)CN=4,z+/4×4=2,z+=4,ZnS,SiC;(d)CN=6,z+/6×3=2,z+=4,MnO2。
21、解:岛状;架状;单链;层状(复网);组群(双四面体)。
22、解:(1)有两种配位多面体,[SiO4],[MgO6],同层的[MgO6]八面体共棱,如59[MgO6]和49[MgO6]共棱75O2-和27O2-,不同层的[MgO6]八面体共顶,如1[MgO6]和51[MgO6]共顶是22O2-,同层的[MgO6]与[SiO4]共顶,如T[MgO6]和7[SiO4]共顶22O2-,不同层的[MgO6]与[SiO4]共棱,T[MgO6]和43[SiO4]共28O2-和28O2-;(3)z=4;(4)Si4+占四面体空隙=1/8,Mg2+占八面体空隙=1/2。
23、解:透闪石双链结构,链内的Si-O键要比链5的Ca-O、Mg-O键强很多,所以很容易沿链间结合力较弱处劈裂成为纤维状;滑石复网层结构,复网层由两个[SiO4]层和中间的水镁石层结构构成,复网层与复网层之间靠教弱的分之间作用力联系,因分子间力弱,所以易沿分子间力联系处解理成片状。
24、解:石墨中同层C原子进行SP2杂化,形成大Π键,每一层都是六边形网状结构。
由于间隙较大,电子可在同层中运动,可以导电,层间分子间力作用,所以石墨比较软。
25、解:(1)Al3+可与O2-形成[AlO4]5-;Al3+与Si4+处于第二周期,性质类似,易于进入硅酸盐晶体结构中与Si4+发生同晶取代,由于鲍林规则,只能部分取代;(2)Al3+置换Si4+是部分取代,Al3+取代Si4+时,结构单元[AlSiO4][ASiO5],失去了电中性,有过剩的负电荷,为了保持电中性,将有一些半径较大而电荷较低的阳离子如K+、Ca2+、Ba2+进入结构中;(3)设Al3+置换了一半的Si4+,则O2-与一个Si4+一个Al3+相连,阳离子静电键强度=3/4×1+4/4×1=7/4,O2-电荷数为-2,二者相差为1/4,若取代超过一半,二者相差必然>1/4,造成结构不稳定。
晶体结构缺陷1、说明下列符号的含义:VNa,VNa’,VCl•,.(VNa’VCl•),CaK•,CaCa,Cai••2、写出下列缺陷反应式:(1)NaCl溶入CaCl2中形成空位型固溶体;(2)CaCl2溶人NaC1中形成空位型固溶体;(3)NaCl形成肖脱基缺陷;(4)AgI形成弗仑克尔缺陷(Ag+进入间隙)。
