甲烷的性质
甲烷的性质

甲烷甲烷分子式CH4。
最简单的有机化合物。
甲烷是没有颜色、没有气味的气体,沸点-161.4℃,比空气轻,它是极难溶于水的可燃性气体。
甲烷和空气成适当比例的混合物,遇火花会发生爆炸。
化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。
在适当条件下会发生氧化、热解及卤代等反应。
甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一。
它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及文字甲醛等物质的原料。
413kJ/mol、109°28′,甲烷分子是正四面体空间构型,上面的结构式只是表示分子里各原子的连接情况,并不能真实表示各原子的空间相对位置。
1.物质的理化常数:国标编号21007CAS号74-82-8中文名称甲烷英文名称methane;Marsh gas别名沼气分子式CH4 外观与性状无色无臭气体分子量16.04 蒸汽压53.32kPa/-168.8℃闪点:-188℃熔点-182.5℃沸点:-161.5℃溶解性微溶于水,溶于醇、乙醚密度相对密度(水=1)0.42(-164℃);相对密度(空气=1)0.55 稳定性稳定危险标记4(易燃液体) 主要用途用作燃料和用于炭黑、氢、乙炔、甲醛等的制造2.对环境的影响:一、健康危害侵入途径:吸入。
健康危害:甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。
当空气中甲烷达25%-30%时,可引起头痛、头晕、乏力、注意力不集中、呼吸和心跳加速、共济失调。
若不及时脱离,可致窒息死亡。
皮肤接触液化本品,可致冻伤。
二、毒理学资料及环境行为毒性:属微毒类。
允许气体安全地扩散到大气中或当作燃料使用。
有单纯性窒息作用,在高浓度时因缺氧窒息而引起中毒。
空气中达到25~30%出现头昏、呼吸加速、运动失调。
急性毒性:小鼠吸入42%浓度×60分钟,麻醉作用;兔吸入42%浓度×60分钟,麻醉作用。
危险特性:易燃,与空气混合能形成爆炸性混合物,遇热源和明火有燃烧爆炸的危险。
甲烷的理化性质及危险特性表

甲烷的理化性质及危险特性表
该表提供了甲烷的理化性质及危险特性的一般信息。
甲烷是一种无色无味的气体,化学式为CH4,分子量为16.04 g/mol。
其密度为0.717 kg/m³,沸点为-161.5°C,熔点为-182.5°C,不溶于水。
甲烷是一种极易燃、易爆炸的气体,其燃点为580°C。
其致命浓度为5-15%(体积分数)。
甲烷的主要危险特性包括易燃气体和高压气体。
对人体来说,呼吸系统是其主要影响目标器官。
在环境方面,甲烷不会对臭氧层造成破坏。
为了确保安全,建议在使用甲烷时保持良好通风。
请注意,以上信息只是一般性的描述,并不涵盖所有甲烷的特性。
在具体场景中,应该根据实际情况采取适当的防护措施。
高中化学-甲烷

1、甲烷分子的电子式和结构式
2、甲烷分子的立体结构:
以碳原子为中 心, 四个氢原子 为顶点的正四面体。 键角:109度28 分
甲烷分子 的
比例模型
二、甲烷的性质:
1.物理ቤተ መጻሕፍቲ ባይዱ质:
无色、无臭的气体,=0.717g/L
(S.T.P);极难溶于水。
(密度求算公式:M=22.4 )
沼气对于解决我国农村的能源问题,改 善农村环境卫生,提高肥料质量等方面都有 重要意义。
3、化学性质:
通常情况下,性质很稳定,在特 定条件下可与某些物质发生反应。 A.氧化反应:
CH 4 2O2 点燃CO2 2H 2O
烃燃烧的通式:
CxHy (x
y
)O
2
点燃
xCO2
y
H 2O
4
2
B.分解反应:
(三氯甲烷)
(4) CHCl3 Cl2 光CCl4 HCl
(四氯甲烷)
各卤代烃结构式:
二氯甲烷的结构式
二氯甲烷
的 立体结构
取代反应与置换反应的比较:
取代反应
置换反应
可 与 化 合 物 发 生 取 反应物、生成物中一
代,生成物中不一定 定有单质
有单质
反应能否进行受外界 在水溶液中进行的置
条件影响较大
CH 4 高温C 2H 2
C.取代反应: 有机物分子里的某些原子或原子团
被其他原子或原子团所代替的反应。
甲烷取代反应机理
(1) CH 4 Cl2 光CH 3Cl HCl
(一氯甲烷)
(2) CH 3Cl Cl2 光CH 2Cl2 HCl
(二氯甲烷)
甲烷

中文名: 甲烷;沼气;甲基氢化物;液化甲烷英文名: Methane别名: biogas;fire damp;marsh gas;methane gas;methane, compressed;methyl hydride分子结构:分子式: CH4分子量: 16.04物理化学性质性质描述:无色无臭的易燃气体相对密度0.5547(空气=1)沸点-164℃熔点-182.48℃临界温度-82.1℃临界压力4.54MPa自燃点537.78℃燃烧热(25℃)802.86kJ/mol微溶于水,溶于乙醇、乙醚等有机溶剂化学性质较稳定。
在一定条件下能发生卤化反应生成甲烷的卤代烃;经氧化而成醇、醛、酮、酸;经硝化而生成甲烷的硝基化合物;也能发生热解而生成烯、炔烃、燃烧时呈青白色火焰。
与空气的混合气体在燃点时能发生爆炸,爆炸极限为5.3%-14%。
安全信息安全说明:S9:保持容器在一个有良好通风放的场所。
S16:远离火源。
S33:采取防护措施防止静电发生。
其他信息产品应用:甲烷是重要的燃料和重要的化工原料。
以甲烷为主要成分的天然气,作为优质气体燃料,已有悠久的历史,其热值为882.0kJ/mol。
天然气被大规模开采利用,成为世界第三能源。
液化天然气的热值比航空煤油15%,用于汽车、海上快艇和超音速飞机,不但能担高速度。
而且可节省燃料。
除作燃料外,大、氢、乙炔、乙烯、甲醛、二硫化碳、硝基甲烷、氢氰酸和1,4-化可得二、二、三氯甲烷及四氯化碳。
生产方法及其他:在自然界中分布很广,是天然气、煤层气、沼气的主要成分,经分离可以取得。
1.从天然气分离天然气中含甲烷80%-99%,干天然气经清净后使用;湿天然气经清净后,用冷凝法、吸收法、吸附法分离出乙烷以上轻烃后使用。
2.从油田气分离石油开采时从油井中逸出天然气,其中干气含甲烷80%-85%;湿气含甲烷10%。
在加压和冷凝的情况下,可以液化用作化工原料。
3.从炼厂气分离各炼厂石油加工气体中含甲烷20%-50%。
1甲烷的性质

CH2Cl2+Cl2
CHCl3+Cl2
产物为混合物
取代反应:
有机物分子里的某些原子(X 原子)或原子团被其他原子或原 子团所代替的反应。
明确几点 ①反应条件: 光照(室温下在暗处不发生反应) ②反应物质: 纯卤素单质;如甲烷与氯水、溴水不 反应,与Cl2、溴蒸气光照条件下发生 取代反应。 ③甲烷分子中的四个氢原子可逐一被 取代,故甲烷的卤代物并非一种,而 是几种卤代物的混合物。
光照 光照
CH2Br2+HBr
CHBr3+HBr CBr4+HBr
CH2Br2+Br2 CHBr3+Br2
光照
2、在光照条件下,将等体积的甲烷和氯气 混合,得到的产物中物质的量最多的是( D ) A、CH3Cl B、CH2Cl2 C、CCl4 D、HCl
3、将下列气体通入酸性高锰酸钾,酸 性高锰酸钾褪色的是( C ) A、CH4 B、CO2 C、SO2 D、H2
3. 甲烷的受热分解 在隔绝空气并加热至1000℃的高 温下,甲烷分解 CH4
高温
C + 2H2
合成氨、汽油的原料 橡胶工业的原料
可以用于制造颜料、油墨、油漆等
总体: 性质较稳定 甲烷化 学性质
燃烧反应
一定条件下
取代反应 受热分解
练习:1、写出甲烷与溴蒸气反应的化学 方程式。
光照 CH Br+HBr CH4+Br2 3 CH3Br+Br2
一、有物概述
• 烃: 仅含有碳、氢两种元素的有机物。(通式: CxHy)
火
tàn
+
气=烃
q īng
二、甲烷的存在和结构
甲烷标准气体

甲烷标准气体甲烷,化学式为CH4,是一种无色、无味、易燃的气体。
它是最简单的烷烃,也是天然气的主要成分之一。
甲烷在工业生产和生活中有着广泛的应用,同时也是一种重要的标准气体。
甲烷作为标准气体,具有以下几个特点:首先,甲烷具有高纯度。
作为标准气体,甲烷的纯度要求非常高,通常达到99.999%以上。
这样的高纯度可以保证标准气体的稳定性和可靠性,从而满足各种精密仪器和分析测试的需求。
其次,甲烷具有稳定的化学性质。
由于甲烷的化学结构稳定,它不容易发生化学反应,因此在标准气体中具有较长的稳定性。
这对于各种实验和检测工作来说至关重要。
此外,甲烷具有良好的可燃性和可燃性。
这使得甲烷成为了一种理想的燃料,同时也为各种燃烧性能测试提供了便利条件。
甲烷标准气体的应用范围非常广泛。
首先,它常用于各种气体分析仪器的校准和检定。
其次,甲烷标准气体也被广泛应用于工业生产中的燃烧性能测试和燃烧过程监测。
此外,在环境保护和安全生产领域,甲烷标准气体也扮演着重要的角色,用于监测大气中的甲烷浓度和检测工业生产中的甲烷泄漏情况。
在使用甲烷标准气体时,我们需要注意以下几点:首先,要严格按照标准操作程序进行。
在甲烷标准气体的使用过程中,需要严格按照操作规程进行,避免操作失误和安全事故的发生。
其次,要保证甲烷标准气体的储存和使用环境符合要求。
甲烷是一种易燃气体,储存和使用环境必须符合安全要求,避免发生火灾和爆炸事故。
最后,要定期对甲烷标准气体进行检测和校准。
定期的检测和校准工作可以保证甲烷标准气体的质量和稳定性,从而保证各项测试和检测工作的准确性和可靠性。
总的来说,甲烷标准气体作为一种重要的标准气体,在各种工业生产和科研领域都有着重要的应用价值。
我们在使用甲烷标准气体时,需要严格按照操作规程进行,保证安全使用,并且定期对其进行检测和校准,以确保其稳定性和可靠性。
甲烷的性质

6、在光照条件下,将等体积的甲烷和氯气 混合,得到的产物中物质的量最多的是( D) A、CH3Cl B、CH2Cl2 C、CCl4 D、HCl
7、下列叙述正确的是( B ) A、 有机物一定来自有机体内 B、 有机物与无机物可以相互转化 C、 CO属于有机物 D、 A-B + C-D A-C +B-D 一定属于复 分解反应
有机物的特点
种类繁多:3000万种以上 大多易燃烧:甲烷、酒精、汽油…
大多不溶于水而易溶于酒精、汽油等有机溶剂 大多数有机物熔点和沸点较低 大多反应慢、复杂、有副产物
反应用箭头不用等号
1
2
一. 甲烷的组成和结构 甲烷的分子式: CH4
H H C H
H H C H H
结构式
H
电子式
3
甲烷的立体结构
甲烷是正四面体结构,四个C—H键强度相同
球棍模型
比例模型
4
5
二、甲烷的性质
1.物理性质
6
2.化学性质
甲烷的烧
7
1 氧化反应(燃烧)
安静燃烧,淡蓝色火焰,
现象
放出大量的热。
点燃
CH4 + 2O2
CO2 + 2H2O
利用此性质,甲烷可作燃料 注意事项: 1、点燃前要验纯(瓦斯爆炸) CH4爆炸极限:4.9%~16% 2、写有机反应时连接号用“→” 3、 大多数的有机物燃烧后都生成 CO2和H2O
11
CH4 + Cl2
CH3Cl + Cl2
光
CH3Cl + HCl
CH2Cl2 + HCl CHCl3 + HCl
三氯甲烷又叫氯仿 (有机溶剂)
3.1甲烷的化学性质
结构
课堂总结
总体: 性质较稳定
甲烷化 学性质
一定条件下
燃烧反应 列反应属于取代反应的是( A、D )
A、CH3CH2OH + HBr CH3CH2Br + H2O
B、2HI + Cl2
2HCl + I2
C、CH4 +2O2 点燃 CO2 + 2H2O
三、甲烷的化学性质
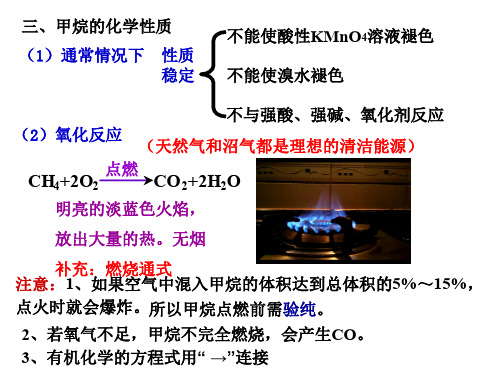
(1)通常情况下 性质 稳定
不能使酸性KMnO4溶液褪色 不能使溴水褪色
不与强酸、强碱、氧化剂反应 (2)氧化反应 (天然气和沼气都是理想的清洁能源)
点燃
CH4+2O2
CO2+2H2O
明亮的淡蓝色火焰,
放出大量的热。无烟
补充:燃烧通式 注意:1、如果空气中混入甲烷的体积达到总体积的5%~15%, 点火时就会爆炸。所以甲烷点燃前需验纯。
注意: 点燃甲烷前必须验纯,否则会爆炸。 CH4爆炸极限:5%~15.4%
(3)取代反应
实验现象(光亮处):
CH4和Cl2
颜色: 黄绿色变浅 水面: 水面上升
量筒: 壁上有油状液体 液面上有少量白雾
(水槽中有白色固体析出)
饱和食盐水 结论:
甲烷的取代反应
甲烷与氯气在光照条件下 发生了反应。
H
+
光照
109°28′
平面四边形
正四面体
例、下列事实能证明甲烷分子中是以C 原子 为中心的正四面体结构的是( B )
A CH3Cl只代表一种物质 B CH2Cl2只代表一种物质 C CHCl3只代表一种物质 D CCl4只代表一种物质
(4)甲烷的受热分解
①甲烷常温时很稳定,高温时可断键 ②甲烷的高温裂解反应方程式:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
光照 光照
CH2Br2+HBr CHBr3+HBr
CHBr3+Br2
光照
CBr4+HBr
取代反应与置换反应的区别?
取代反应
置换反应
生成物中不一定有单质
反应能否进行,受温度、 光照、催化剂等外界条件 的影响较大
反应物和生成物中一定有 单质
在水溶液中进行的反应, 遵循金属活动性顺序等
反应逐步进行,很多反应 是可逆的
二氧化碳的质量为? 13.2g
感谢您的支持!
反应一般为单方向进行
(3)甲烷的受热分解 CH4 高温
C+2H2
• 结构
决定
决定
• 性质
• 用途
1.下列事实能证明甲烷分子中是正四面体结构而非平面正 四边形结构的是( B ) A. CH3Cl只代表一种物质 B. CH2Cl2只代表一种物质 C. CHCl3只代表一种物质 D. CCl4只代表一种物质
2.向下列物质的水溶液中滴加硝酸银溶液,能产生白色沉 淀的是( BE ) A.CH3Cl B.NaCl C.KClO3 l4 E.HCl
3.常温下将甲烷与空气混合,甲烷体积分数为多少时
爆炸最强?(设O2占空气的1/5) ( A )
A. 9%
B. 5% C. 15 %
D. 33.3 %
4.将一定量的甲烷燃烧后得到CO、CO2及水蒸气, 共49.6g,通过氯化钙时,氯化钙增加25.2g,则
氯水不可! 量最多的是?
(3)若1molCH4与Cl2反应生成等物质的量的四种有
机物,则消耗的氯气的物质的量为
2.5mol
请利用糖果和牙签制作甲烷和氯气的结 构模型,并模拟取代反应的过程。(注意 选择不同的颜色)
甲烷与溴蒸气反应的化学方程式:
光照
CH4+Br2
CH3Br+HBr
CH3Br+Br2 CH2Br2+Br2
2.取代反应:有机物分子里的某些原子或原子团被其 他原子或原子团所代替的反应,叫取代反应。
CH4+Cl2
光照
CH3Cl+HCl 一氯甲烷
一氯甲烷的形成
H
+ Cl—Cl 光 H C Cl + H Cl
H
二氯甲烷的形成
H
H
Cl C H + Cl—Cl 光 Cl C Cl + H Cl
H
H
三氯甲烷的形成
二氯甲烷(难溶于水的无色液体)
CH2Cl2 + Cl2 光 CHCl3 + HCl 三氯甲烷又叫氯仿 (有机溶剂)
CHCl3 + Cl2 光 CCl4 + HCl
四氯甲烷又叫四氯化碳(有机溶剂、灭火剂)
H HCH
+ Cl Cl
H 光
H C Cl
+ H Cl
H
H
但光线不能太强
(1)反应条件为光照,气态卤素单质 (2)连锁反应,生成物为混合物
淮阳中学化学组夏伟
一、甲烷的物理性质 无色无味的气体,密度比空气小,极难溶于水。
推测CH4化学性质:
酸性? 还原性?
甲烷
二、甲烷的化学性质 甲烷
甲烷
高锰酸钾
溴水
氢氧化钠和酚酞
上述溶液均不褪色
1.通常情况下,不易与其它物质反应:与强酸、强碱、 强氧化剂都不起反应
2.氧化反应 CH4 + 2O2 点燃 CO2 + 2H2O
说明: (1)有机物化学反应方程式的书写。 用“→”不用“=”
(2)淡蓝色火焰,放出大量热
(3)点燃甲烷和空气,可能会发生爆炸(空气中爆炸极限
5% ~ 15.4%) ,因此,在点燃甲烷之前,必须进行的操 作是 检验纯度。
甲烷与氯气反应的现象是什么? 如何验证HCl的生成呢? 常温下,除了CH3Cl是气体外,其他三种都 是无色液体,为什么我们看到黄色油珠呢?
Cl
Cl
H C H + Cl—Cl 光 H C Байду номын сангаасl + H Cl
Cl
Cl
四氯甲烷的形成
Cl
Cl
Cl C H + Cl—Cl 光 Cl C Cl + H Cl
Cl
Cl
甲烷的取代反应
CH4 + Cl2 光 CH3Cl + HCl
一氯甲烷(无色气体)
CH3Cl + Cl2 光 CH2Cl2 + HCl
