3-1 晶体的常识(人教版化学选修3)
高二人教版化学选修3课件3-1晶体的常识

本章内容虽为理论知识,但与生产、生活等联系密切,
完全可以通过实物模型,晶体认识的发展史等方面的介绍,
再辅之以微观分析,使学生更好地掌握知识。 本章的重点是分子晶体、原子晶体、金属晶体、离子 晶体的概念,晶体类型、结构和性质的关系。难点是干冰、 金刚石、NaCl、CsCl、K、Mg、Cu等晶体的结构。
________ 。整块晶体可以看作是数量巨大的晶胞“无隙并 置 ” 而 成 , 所 谓 “ 无 隙 ” 是 指 ________ 任 何 间 隙 , 所 谓 “并置”是指所有晶胞都是________。 2.对于一个平行六面体的晶胞来说,晶胞顶角上的原 子是 ________ 个晶胞共用的,晶胞棱上的原子是 ________ 个晶胞共用的,晶胞面上的原子是 ________ 个晶胞共用的, 晶胞内部的原子则________。
堆积方式。 从知识和技能上来说,要系统了解四种晶体内的作用 力和它们所具有的性质特点以及在科学研究和生产生活中 的应用,理解结构与性质的关系。
从过程与方法上来说,要通过讨论,掌握各种晶胞的
分析方法和策略,能够通过对比、 归纳使知识系统化和网
络化。 从情感态度和价值观上来说,要在理论分析和实验探 究过程中学习辩证唯物主义的方法论,逐步形成科学的价 值观,对生产、生活、科学研究中材料的结构分析,培养 学习兴趣,感受物质结构的奇妙与和谐。
第一节
晶体的常识(共1课时)
1.了解晶体与非晶体的概念。 2.了解自然界中晶体产生的途径。 3.理解晶体与非晶体的本质差异。 4.掌握晶体的有关物理性质。
一、晶体与非晶体
1 .固体分为 ________ 和 ________ 。晶体的自范性即
__________________的性质,它是晶体中粒子在微观空间里 ________________________的宏观表象。晶体呈自范性的条 件之一是________________________。 2.晶体与非晶体的本质差异 主 要 看 是 否 有 ________ , 还 看 微 观 结 构 中 原 子 是 否 ________排列。
人教版高中化学选修三3.1《晶体的常识》配套课件优质课件PPT

顶点:1/8 棱边:1/4 面心:1/2
体心:1
小结:长方体或正方体晶胞中不同位置的 粒子对晶胞的贡献
(1)处于顶点的粒子,同时为8个晶胞共有 ,每个粒子有1/8属于该晶胞。
(2)处于棱上的粒子,同时为4个晶胞共有 ,每个粒子有1/4属于该晶胞。
(3)处于面上的粒子,同时为2个晶胞共有 ,每个粒子有1/2属于该晶胞。
中重要的组成部分,主要表现在对于在压力或者困境中,个体自我安慰、自我积极暗示、自我调节的能力,在个体克服困难、顶住压力、勇对挑战等情况下,都
激励能力的人,富有弹性,经常表现出反败为胜、后来居上、东山再起的倾向,而缺乏这种能力的人,在逆境中的表现就大打折扣,表现为过分依赖外界的鼓励
院练习棒球。在挥动球棒前,对自己大喊:“我是世界上最棒的棒球手!”然后扔出棒球,挥动……但是没有击中。接着,他又对自己喊:“我是世界上最棒的
好。我们感到自己“状态不佳”或精力不足时,往往会把必须做的事放在一边,或静等灵感的降临。你可不要这样。如果有些事你知道需要做却又提对待自己做不好的事情,一旦做起来了尽管乐在其中。所以,这次犯错,是为了下次接受挑战后,要尽量放松。在脑电波开
晶态石英的谱图 非晶态石英的谱图
非晶态和晶态石英的X-射线粉末衍射图谱
二﹑晶胞
1.定义:描述晶体结构的基本单元叫做晶胞
蜂巢与蜂室
铜晶体
铜晶胞
晶体与晶胞的关系可用蜂巢与峰室的关系比喻
2.特点:习惯采用的晶胞是平行六面 体,整块晶体可看作数量巨大的晶胞 “无隙并置”而成;所谓“无隙”是指 相邻晶胞间无间隙;所谓“并置”是指 所有晶胞平行排列,取向相同)
离子晶体 原子晶体 晶体 分子晶体 金属晶体 混合型晶体
晶体为什么具有规则的几何外形?
人教版高中化学选修三课件:第三章 第一节 晶体的常识(26张PPT)

You made my day!
我们,还在路上……
解析:甲中X位于立方体体心,有1个,Y位于立方体的
顶点,实际有
1 8
×4=
1 2
个,N(X)∶N(Y)=1∶
1 2
=2∶1,
故甲的化学式为X2Y;乙中A有
1 8
×8=1个,B有
1 2
×6
=3个,C在体心,有1个,故N(A)∶N(B)∶N(C)=
1∶3∶1;丙中D点被8个同样的晶胞共用,故结合E的个
解析
解析:晶胞中的粒子分为4种:①体心上的粒
子完全属于该晶胞;②面心上的粒子
1 2
属于该
晶胞;③棱上的粒子
1 4
属于该晶胞;④顶点上
的粒子
1 8
属于该晶胞。本题粒子Y位于体心,粒子X位于顶
点,所以该晶体的化学式为Y2X(或XY2)。观察图,4个X和1
个Y构成了一个正四面体,故∠XYX=109°28′。
D.粉末状固体一定不是晶体 解析:晶体的特点有:内部粒子排列得高度有序性、
有自范性和各向异性。当晶体的晶粒较小时,即为粉
末状,故D不正确。
答案:D
3.某物质的晶体内部一截面上原子的排布情况
如右图所示,则该晶体的化学式可表示为
()
A.A2B
B.AB
C.AB2
D.A3B
解析:由该晶体一截面上原子的排布情况可知,每一个A
数是8个。
返回
“课时跟踪检测”见“课时跟踪检测(九)” (单击进入电子文档)
•不习惯读书进修的人,常会自满于现状,觉得没有什么事情需要学习,于是他们不进则退2022年4月13日星期三2022/4/132022/4/132022/4/13 •读书,永远不恨其晚。晚比永远不读强。2022年4月2022/4/132022/4/132022/4/134/13/2022 •正确的略读可使人用很少的时间接触大量的文献,并挑选出有意义的部分。2022/4/132022/4/13April 13, 2022 •书籍是屹立在时间的汪洋大海中的灯塔。
2020人教版高中化学选修三3.1晶体的常识

第一节 晶体的常识教材分析:本节内容是安排在原子结构、分子结构以及结构决定性质的内容之后来学习,对于学生的学习有一定的理论基础。
本节内容主要是通过介绍各种各样的固体为出发点来过渡到本堂课的主题——晶体和非晶体。
而晶体和非晶体的学习是以各自的自范性和微观结构比较为切入点,进而得出得到晶体的一般途径以及晶体的常见性质和区分晶体的方法。
[学习目标][知识梳理]一、晶体与非晶体1.晶体的自范性即______________________________________________________.晶体呈自范性的条件之一是____________________________________________________.2.得到晶体一般有三条途径:(1)____________,(2)___________________________,(3)_________________________3.自范性 微观结构 晶体非晶体4. 晶体的熔点较__________,而非晶体的熔点_______________,区分晶体与非晶体最可靠的科学方法是______________________________________________.二、晶胞5._________________________________ _________________是晶胞。
[方法导引]晶胞中粒子数的计算方法:晶体结构类习题最常见的题型就是已知晶胞的结构而求晶体的化学式。
解答这类习题首先要明确一个概念:由晶胞构成的晶体,其化学式不一定是表示一个分子中含有多少个原子,而是表示每个晶胞中平均含有各类原子的个数,即各类原子的最简个数比。
解答这类习题,通常采用分摊法。
在一个晶胞结构中出现的多个原子,这些原子并不是只为这个晶胞所独立占有,而是为多个晶胞所共有,那么,在一个晶胞结构中出现的每个原子,这个晶体能分摊到多少比例呢。
高中化学人教版选修3教案-3.1 晶体的常识
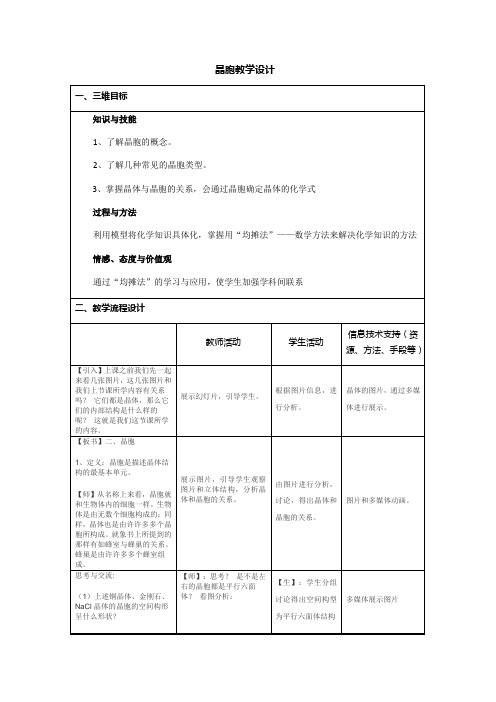
(1)上述铜晶体、金刚石、NaCl晶体的晶胞的空间构形呈什么形状?
(2)在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?
【师】:思考?是不是左右的晶胞都是平行六面体?看图分析:
【生】:学生分组讨论得出空间构型为平行六面体结构
【生】:不是所有的晶胞都是平行六面体,应该是大多数是平行六面体。
多媒体展示图片
【板书】2、晶胞的特点:
(1)大多是平行六面体。
(2)排列方式:“无隙并置”
【板书】3、计算晶体化学式或晶胞中粒子数的一般方法——均摊法
下面我们一起来看一个小视频来分析一下。
【师】:通过视频我们可以明显的看出顶点的原子是被八个晶胞所拥有,所以我们可以得出结论:
【板书】⑴顶点——同时为8个晶胞所共有——每一个晶胞拥有:1/8;
【随堂练习】
练习1:现在我们一起再来回顾一下在一个氯化钠晶胞里是13个钠离子,多少14氯离子?
生:不是
氯离子:8*1/8+6*1/2=4
钠离子:1+12*1/4=4
【学与问】
金属钠:8×1/8+1 =2
金属锌:8×1/8+1 = 2
晶体碘:(8×1/8+6×1/2)×2 = 8
金刚石:8×1/8+6×1/6+4 = 8
【师】:在立方晶胞中,粒子可能出现在到下这几个位置:
【师】:当原子位于顶点时这个原子将被八个晶胞所共用,就像我手中的八个晶胞模型一样,每一个晶胞只拥有该原子的1/8.
【生】:氯离子:8个顶点各有一个,6个面上各有一个,一共是14个铜原子。
钠离子:12在棱的中点1个在体心
共13个
顶点:1/8
棱上:?
面心:?
晶胞教学设计
一、三维目标
3.1 晶体的常识(课时作业)高二化学(人教版选修3)(解析版)

第三章 晶体结构与性质第一节 晶体的常识一、基础练1.有一种蓝色晶体,化学式可表示为()x y 6M Fe CN ⎡⎤⎣⎦,经X 射线衍射实验发现,它的结构特征是3+Fe 和2+Fe 分别占据立方体互不相邻的顶点,而CN -位于立方体的棱上。
其晶体中阴离子的最小结构单元如图所示。
下列说法正确的是( )A .该晶体的化学式为()226M Fe CN ⎡⎤⎣⎦B .该晶体属于离子晶体,M 呈+1价C .该晶体属于离子晶体,M 呈+2价D .晶体中与每个3+Fe 距离最近且相等的CN 有3个【答案】B【详解】A .由题图可得出,晶体中阴离子的最小结构单元中2Fe +及Fe 3+个数均为11482⨯=,CN -的个数为11234⨯=,因此阴离子的化学式为()26Fe CN -⎡⎤⎣⎦,则该晶体的化学式为()26M Fe CN ⎡⎤⎣⎦,A 项错误; B .由阴、阳离子形成的晶体为离子晶体,M 的化合价为+1,B 项正确;C .M 的化合价为+1,C 项错误;D .由题图可看出与每个3+Fe 距离最近且相等的CN -有6个,D 项错误;故选:B 。
2.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式是XY 的是(图中:o-X , -Y)( )A .B .C .D .【答案】A【详解】[根据顶点、棱上、面上、体心和其他处于立方体内部的原子对晶胞的贡献分别为111842、、、1,求出X 、Y 的数目之比,其化学式分别为XY 、X 3Y 、XY 4、XY 4;故选:A 。
3.下图为高温超导领域里的一种化合物(钙钛矿)结构中的最小重复单元。
该化合物中,每个钛离子周围与它最接近且距离相等的钛离子有a 个,元素氧、钛、钙的原子个数比为b 。
则a 、b 是( )A .6,3∶1∶1B .24,10∶8∶1C .12,5∶4∶1D .3,3∶2∶1【答案】A【详解】 由晶胞结构可知,晶胞顶点上相邻的钛离子相距最近,则钛离子周围与它接近且距离相等的钛离子有6个,a=6;晶胞中位于顶点的钛原子个数为8×18=1,位于棱上的氧原子个数为12×14=3,位于体内的钙原子的个数为1,则氧、钛、钙的原子个数比为 3:1:1,故选A 。
人教版高中化学选修三 3.1 晶体的常识(课件1)
身体记忆法小妙 招
超级记忆法--故 事法
鲁迅本名:周树人
主要作品:《阿Q正传》、、 《药 》、
《狂人日记》、《呐喊》、《孔 乙己》
《故乡》、《社戏》、《祝福》(图片来自网络) 。
超级记忆法-记忆 规律
TIP1:我们可以选择记忆的黄金时段——睡前和醒后! TIP2:可以在每天睡觉之前复习今天或之前学过的知识,由于不受后摄抑制的 影 响,更容易储存记忆信息,由短时记忆转变为长时记忆。
如何利用规律实现更好记忆 呢?
超级记忆法-记忆 规律
TIP3:另外,还有研究表明,记忆在我们的睡眠过程中也并未停止,我们的大 脑 会归纳、整理、编码、储存我们刚接收的信息。所以,睡前的这段时间可是 非常 宝贵的,不要全部用来玩手机哦~
场景记忆法小妙 招
超级记忆法--身 体法
1. 头--神经系统 2. 眼睛--循环系统 3. 鼻子--呼吸系统 4. 嘴巴--内分泌系统 5. 手--运动系统 6. 胸口--消化系统 7. 肚子--泌尿系统 8. 腿--生殖系统
超级记忆法-记忆 方法
TIP1:在使用身体记忆法时,可以与前面提到过的五感法结合起来,比如产生 一 些听觉、视觉、触觉、嗅觉、味觉,记忆印象会更加深刻;
如何利用规律实现更好记忆 呢?
超级记忆法-记忆 规律
第四个记忆周期是 1天 第五个记忆周期是 2天 第六个记忆周期是 4 天 第七个记忆周期是 7天 第八个记忆周期是15天 这五个记忆周期属于长期记忆的范畴。 所以我们可以选择这样的时间进行记忆的巩固,可以记得更扎实。
如何利用规律实现更好记忆 呢?
人教版高中化学选修三教案-3.1 晶体的常识
第三章晶体的结构与性质第一节晶体的常识【教学目标】1、了解晶体的初步知识,知道晶体与非晶体的本质差异,学会识别晶体与非晶体的结构示意图。
2、知道晶胞的概念,了解晶胞与晶体的关系,学会通过分析晶胞得出晶体的组成。
3、培养空间想象能力和进一步认识“物质结构觉得物质性质”的客观规律。
【教学重点】晶体、晶胞的概念。
【教学难点】计算晶胞的化学式。
【教学过程】[导入]走进化学实验室,你能见到许多固体,如蜡状的白磷(P4)、黄色的硫黄、紫黑色的碘(I2)和高锰酸钾(KMnO4)、蓝色的硫酸铜(CuSO4·5H20)、白色的碳酸钙等。
放眼世界,自然界中绝大多数矿物也都是固体。
你一定还能说出生活中常见的更多的固体,如金属、玻璃、陶瓷、砖瓦、水泥、塑料、橡胶、木材……你是否知道固体有晶体和非晶体之分?绝大多数常见的固体是晶体,只有如玻璃之类的物质属于非晶体(又称玻璃体)。
晶体与非晶体有什么本质的差异呢?今天我们开始学习…。
[板书] 第三章晶体的结构与性质第一节晶体的常识[投影]常见的晶体(或展示实物):[思考]晶体规则的几何外型与组成晶体的微粒在空间的存在什么关系?[投影]表3-1晶体与非晶体的本质差异[讲解]即自动发生的过程。
不过,“自发”过程的实现,仍需要一定的条件。
例如,水能白发地从高处流向低处,但不打开拦截水流的闸门,水库里的水就不能下泻。
晶体呈现自范性的条件之一是晶体生长的速率适当。
熔融态物质冷却凝固,有时得到晶体,但凝固速率过快,常常只得到看不到多面体外形的粉末或没有规则外形的块状物。
[板书]1、晶体的自范性即晶体能白发地呈现多面体外形的性质。
[投影]图3-1天然水晶球里的玛瑙和水晶。
[讲述]最有趣的例子是天然的水晶球。
水晶球是岩浆里熔融态的Si02侵入地壳内的空洞冷却形成的。
剖开水晶球,常见它的外层是看不到晶体外形的玛瑙,内层才是呈现晶体外形的水晶。
其实,玛瑙和水晶都是二氧化硅晶体,不同的是,玛瑙是熔融态Si02快速冷却形成的,而水晶则是热液缓慢冷却形成的。
人教版选修3 化学:3.1 晶体的常识 课件(共25张PPT)
学与问 P64
2
2
8
8
练习: 下面几种晶胞中分别含有几个原子?
各1/2个
各4个 绿色:8× 1/8+6×1/2 = 4 灰色:12× ¼+1=4
小结:
1、晶胞:晶体中的最小重复单元
2、晶胞对质点的占有率 顶点: 1/8
立方晶胞
棱边: 1/4 面心: 1/2 体心: 1
课堂练习
1.钛酸钡的热稳定性好,
选修3 物质结构与性质 第三章 晶体结构与性质
第一节 晶体的常识
教学目标: 知识与技能
1.了解分子晶体和原子晶体的特征。 2.通过NaCl、Cu的晶体结构,学生知道晶体中粒子的 排列规律。 3.通过对晶胞的分析,学生会计算晶胞中粒子的个数。 过程与方法
通过几种典型的晶体(金刚石、石墨、NaCl、金属) 结构的分析,学生能从三维的角度考虑粒子在空间的分 布。 情感态度与价值观
0.39 a3
g. ㎝-3
晶胞 解法3:依ρ= m/v
每个晶胞中所含的Na+和Cl-的个数均为4个,即含4个“NaCl”。
每个晶胞的体积为: (a×10-8)3㎝3
即含4个“NaCl”所占的体积为:(a×10-8)3㎝3
那么1个“NaCl”所占的体积为:(a×10-8)3 /4 ㎝3
则:1molNaCl所占的体积为: 6.02×1023 ·(a×10-8)3 /4 ㎝3
A: 14
B: 4
C: 8
D: 6
答案: B 为什么呢?
请看:
84 51
顶点:1/8
棱边:1/4
31
42
73
面心:1/2
62 2
1
1 体心:1
高中化学选修3课件-3.1 晶体的常识5-人教版
金刚石的多面体外形、晶体结构和晶胞示意图
NaCl晶体结构和晶胞
思考与交流:
在NaCl晶体中,晶胞是如何排列的?晶胞之间是否存在 空隙?
ห้องสมุดไป่ตู้
三种典型立方晶体结构
简单立方 体心立方 面心立方
二﹑晶胞
1.描述晶体结构的基本单元叫做晶胞 2.一般来说,晶胞都是平行六面体.
晶胞在晶体中是“无隙并置”而成. 3.晶胞中粒子数的计算:均摊法
(2)体心立方:在立方体顶点的微粒 为8个晶胞共享,处于体心的金属原 子全部属于该晶胞。
微粒数为:8×1/8 + 1 = 2
长方体晶胞中不同位置的粒子对晶胞的贡献: 顶 ----1/8 棱----1/4 面----1/2 心----1
谢谢
(3)晶体自范性的条件之一:生长 速率适当。
(4)晶体形成的途径: ①熔融态物质凝固. ②气态物质冷却不经液态直接凝固(凝华). ③溶质从溶液中析出.
一、晶体与非晶体
1.定义:有规则几何形状的固体
2、晶体与非晶体的差异
性质
晶 体 非晶体
自范性
有
无
熔点
固定 不固定
各向异性
有
无
X-衍射(粉末)明锐线条 漫峰
3、晶体鉴别
(1)可靠的科学方法:
晶体的X-射线衍射实验
(2)测熔点:晶体的熔点较固定
1.下列关于晶体与非晶体的说法正
确的是 A.晶体一定比非晶体的熔点高
C
B.晶体有自范性但排列无序
C.非晶体无自范性而且排列无序
D.固体SiO2一定是晶体
2.区别晶体与非晶体最可靠的科学 方法是 A.熔沸点 B.硬度
C.颜色 D.x-射线衍射实验 D
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可靠的科学方法是对固体进行X射线衍射实验。
答案 B
笃学二
晶胞
描述晶体结构 的基本单元,习惯采用的,晶胞都是 1. 晶胞是_____________ 平行六面体 。整块晶体可以看作是数量巨大的晶胞“无隙并 ___________ 相邻晶胞之间没有 置”而成,所谓“无隙”是指 __________________任何间 平行排列的,取向相同 隙,所谓“并置”是指所有晶胞都是 ______________________。 2. 8 4 对于一个平行六面体的晶胞来说,晶胞顶角上的原子是 __ 2 个晶胞共用的,晶胞棱上的原子是 ___个晶胞共用的,晶胞面 完全属于该晶胞 上的原子是 ___个晶胞共用的,晶胞内部的原子则 _______________。
具有自范性。两种物质在性质上的差异正是其内部结构不
同的体现。故选B。 答案 B
【体验1】► 下列说法错误的是
(
)。
A.同一物质有时可以是晶体,有时可以是非晶体 B.区分晶体和非晶体最可靠的科学方法是确定有没有固
定熔点
C.雪花是水蒸气凝华得到的晶体 D.溶质从溶液中析出可以得到晶体 解析 本题考查晶体获得的途径及区别晶体和非晶体的方 法。A项正确,如晶态SiO2和非晶态SiO2;B项错误,最
无隙是指相邻晶胞之间没有任何间隙,所谓并置,是指所
有晶胞都是平行排列的,取向相同。
要点二
|
晶体中粒子数的求算方法
1 如某个粒子为 n 个晶胞所共有,则该粒子有n属于这个晶 胞
长方体(正方体)晶胞中不同位置的粒子数的计算(如下图) 1.
非长方体(非正方体)晶胞中粒子视具体情况而定,如石墨晶 2. 胞每一层内碳原子排成六边形,其顶点(1 个碳原子)被三个 1 六边形共有,每个六边形占该粒子的 。 3
1 1 项中 E、F 都位于顶点,各有 4× = 属于该晶胞,则该 8 2 晶胞中所含 E、F 个数的最简整数比为 1∶1,化学式为 EF;C 选项中属于该晶胞的 X 微粒(位于体心)1 个,Y 微 1 1 粒(面心)6× =3 个,Z 微粒(顶点)8× =1 个,最简整数 2 8 比为 1∶3∶1,化学式为 XY3Z;D 选项中 A 微粒位于晶 胞面心和顶点,B 微粒位于晶胞的体心和棱上,则该晶胞 1 1 1 中 A、 B 的个数比为 6×2+8×8∶ 1+12×4= 4∶4= 1∶1,化学式为 AB。
得到晶体的三条途径 3. (1)_______ 熔融态 物质凝固; 气态 物质冷却不经液态,直接凝固(凝华); (2)_____ (3)溶质从溶液中析出。 玛瑙 ,缓慢冷却形成_____ 水晶 。 熔融态的SiO2快速冷却形成_____ 外形和内部质点 排列的高度有序性;② 晶体的特点:①_______________ 4. _________ ;③晶体的_____ 固定。 各向异性 熔点
要点一
|
晶体与非晶体
晶体与非晶体的本质差异(如下表所示) 1. 自范性 微观结构
有(能自发呈现多面体 原子在三维空间里呈周 晶体 外形) 期性有序排列 没有(不能自发呈现多 非晶体 面体外形) 原子排列相对无序
2. 晶体呈现自范性的条件 晶体生长的速率适当。熔融态物质冷却凝固,有时得到晶
体,但凝固速率过快,常常只得到看不到多面体外形的粉
【例2】► 根据晶体的晶胞结构,判断化学式正确的是(
)。
解析 A 选项中 A 微粒处于晶胞中心, 完全为该晶胞所有, B 微粒处于立方体的 8 个顶点上,每个 B 微粒为 8 个晶胞 1 共有, 平均一个晶胞中含有 B 微粒的个数为: 8× =1, A、 8 B 微粒个数的最简整数比为 1∶1,化学式应为 AB;B 选
填表对比晶体与非晶体 【慎思1】 提示
固体 性质 自范性(本质区别) 是否均一 固定熔沸点 某些物理性质的 各向异性 能否发生X射线 衍射(最科学的区 分方法) 举 例 晶体 有 均一 有 有 非晶体 无 不均一 无 无 不能(能发生 散射) 玻璃、橡胶 等
能 NaCl晶体、I2晶 体、SiO2晶体、 Na晶体等
第一节 晶体的常识
1.了解晶体的特征和性质,理解晶胞的含义。(重点) 2.了解均摊法确定晶体组成的方法,通过练习掌握晶胞
中微粒个数的求法。(重点、难点)
笃学一
晶体与非晶体
晶体能自发 1. 固体分为_____ 晶体 和_______ 非晶体 ,晶体的自范性即___________ 地呈现多面体外形 的性质。晶体的自范性是晶体中粒子 _________________ 呈现周期性的有序排列 的宏观表象。晶体 在微观空间里______________________ 晶体生长的速率适当 。 呈自范性的条件之一是___________________ 2.晶体与非晶体的本质差异 自范 性,原子空间排列是否_________ 相对有序 。 主要看是否有_____
末或没有规则外形的块状物。如玛瑙是熔融态SiO2快速冷 却形成的,而水晶则是熔融态SiO2缓慢冷却形成的。 晶体具有自范性的原因 3. 晶体中粒子在微观空间里呈周期性的有序排列。非晶体中 粒子的排列则相对无序,因而无自范性。 晶体的特点 4. (1)晶体的外形和内部质点的排列高度有序。
(2)晶体表现出各向异性。
【慎思2】 晶体与晶胞有什么关系? 提示 (1)晶胞是描述晶体结构的基本单元。 一般来说,晶胞都是平行六面体,晶胞只是晶体微观空间
里的一个基本单元,在它的上下、左右、前后,无隙并置
地排列着无数晶胞,而且所有晶胞的形状及其内部的原子 种类、个数及几何排列是完全相同的。 (2)晶体和晶胞的关系 整块晶体可以看作是数量巨大的晶胞无隙并置而成,所谓
答案
C
【体验2】► 已知X、Y、Z三种元素组成 的化合物是离子晶体,其晶胞如图
所示,则下面表示该化合物的化学
式正确的是 A.ZXY3 C.ZX4Y8 ( B.ZX2Y6 D.ZX8Y12 )。
解析
由晶胞的结构可知 X 是在正方体的 8 个顶点上, 每 1 1 一个晶胞只占有顶点的 ,一个晶胞占有 X 的个数为: × 8 8 8=1,Y 在正方体的 12 条棱上,每一个晶胞只占有一条 1 1 棱的 ,一个晶胞占有 Y 的个数为 ×12=3,Z 在正方体 4 4 的体心,一个晶胞完全占有一个 Z。因此 X、Y、Z 的原 子个数比为 1∶3∶1,因此化学式为 ZXY3。
(3)晶体的熔、沸点固定。
(4)当单一波长的X射线通过晶体时,不同的晶体会得到
不同的X射线衍射图谱。如图所示。
【例1】► 普通Biblioteka 璃和水晶的根本区别在于A.外形不一样
(
)。
B.普通玻璃的基本构成微粒无规则排列,水晶的基本构
成微粒按一定规律呈周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点 D.水晶可用于能量转换,普通玻璃不能用于能量转换 解析 普通玻璃为非晶体,水晶为晶体,它们的根本区别 在于内部微粒是否按一定规律呈周期性重复排列,即是否
答案
A
