水的总硬度的测定
水硬度测定

水的总硬度的测定一、实验原理水的总硬度是指水中+2Ca 、+2Mg 的总量。
EDTA 和金属指示剂铬黑T )(3In H 分别与+2Mg 、+2Ca 形成络合物,稳定性为---->>>CaIn MgIn MgY Y C a 22,当水样中加入少量铬黑T 指示剂时,它首先和+2Mg 生成红色络合物-MgIn ,然后与+2Ca 生成红色络合物-CaIn 。
+----++=+H HIn CaY Y H CaIn 2222+----++=+H HIn MgY Y H MgIn 2222红色 蓝色二、实验步骤1.取水样:100mL2.控制水样的pH 值:加入氨性缓冲溶液5mL ,控制pH=103.加入掩蔽剂:三乙醇胺掩蔽+3Fe 、+3Al 等。
4.滴定:用EDTA 标准溶液滴定至溶液由紫红色——蓝色三、数据记录及数据处理见实验报告水的硬度有多种表示方法,常以水中Ca 、Mg 总量换算为CaO 含量的方法表示,以每升水中含10mg CaO 为1度 ( o ),用度来表示水的硬度。
即1度=10mg CaO /1L(H 2O)。
100)(/⨯⋅=︒水样)(水的总硬度V M CV CaO EDTA 四、钙硬的测定 移取100mL 水样于250mL 锥形瓶中,加入5mL NaOH L g 140-⋅加少许钙指示剂,用EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色为终点。
水样V Mca CV EDTA l mg Ca 32)(10)(1⨯⨯=-⋅ρ 水样V M V V C Mg EDTA l mg Mg 321)(10)(1⨯⨯-=-⋅ρ五、注意事项 因水样中的钙、镁含量不高、滴定时,反应速度较慢,故滴定速度要慢。
六、思考题1.什么叫水的总硬度?怎样计算水的总硬度?答:水中Ca 2+、Mg 2+的总量称为水的总硬度。
计算水的总硬度的公式为: 1000)(⨯⨯水V M cV CaO EDTA (mg·L -1) 100)(⨯⨯水V M cV CaO EDTA ( o ) 2.为什么滴定Ca 2+、Mg 2+总量时要控制pH≈10,而滴定Ca 2+分量时要控制pH 为12~13?若pH>13时测Ca 2+对结果有何影响?答:因为滴定Ca 2+、Mg 2+总量时要用铬黑T 作指示剂,铬黑T 在pH 为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。
自来水总硬度的测定

指示剂的作用原理
铬黑T(EBT)
滴定前:M+EBT(蓝色)=M-EBT(紫红色) 溶液呈紫红色 滴定中:M+EDTA(无色)=M-EDTA (无色) 溶液呈紫红色 滴定终点:M-EBT+EDTA=M-EDTA+EBT(蓝色) 溶液呈蓝色-指示剂本身的颜色
二、实验步骤
1.EDTA溶液的标定:
CaCO3(ml) NH3-NH4Cl(ml) 1 2 20 20 20 20 K-B EDTA(ml)
3
20
20
2. 水样分析:
水样(ml) 三乙醇胺(ml)
NH3-NH4Cl(ml)
铬黑T
EDTA(ml)
1
ห้องสมุดไป่ตู้2 3
150
150 150
5 5 5
5
5 5
计算:
水的硬度的表示方法
度(°) 1硬度单位表示十万份水中含有一份CaO,即 1L水中含有10mgCaO为1° 0-4°很软的水 4-8°软水 8-16°中等硬水 16-30°硬水 30°以上 很硬的水
EDTA溶液: CaCl2溶液: 三乙醇胺: NH3-NH4Cl缓冲液:pH=10 铬黑T指示剂 K-B指示剂
自来水总硬度的测定
一、原理 测定水的总硬度就是测定水中钙、镁的 总量,采用EDTA络合滴定法。 用pH=10氨性缓冲液,以EDTA作为络 合滴定剂剂,与水中的钙、镁反应,生成 EDTA-钙和EDTA-镁络合物,根据滴定消 耗的EDTA体积和EDTA浓度可求得水中 钙和镁的含量。
EDTA
最常用的氨羧配位剂
实验五水总硬度的测定

总硬度的测定方法:
采用络合滴定法 ( EDTA )测定: 在pH≈10的氨性溶液中,采用 铬黑T(In)做指
示剂,用EDTA标准溶液直接测定 Ca2+、Mg2+总量。
水硬度 ? C V EDTA EDTA ? MCaO ? 100 德国度 ( °) V水
水硬度 ? C V EDTA EDTA ? MCaO ? 1000 mg/L V水
水硬度分类表
总硬度度数
(°) 0~4 标 志 很软水
4~8 软水
8~16
中等硬度水
16~30 硬水
30以上 很硬水
? 硬度对工业用水影响很大,尤其是锅炉用水,硬度较高的 水都要经过软化处理并经滴定分析达到一定标准后才能输 入锅炉。其他很多工业对水的硬度也都有一定的要求。生 活饮用水中硬度过高会影响肠胃的消化功能,我国生活饮 用水卫生标准中规定硬度(以CaCO3计)不得超过450mg·L1。
有:K CaY>KMgY>K MgIn>Y CaIn
分别测定水中钙硬和镁硬时,可取等量水样 加NaOH调节溶液 pH=12~13 ,使Mg2+生成 Mg(OH)2沉淀,在滴定时不再参与与 EDTA的络 合反应,在溶液中加入 钙指示剂 用EDTA滴定水 中Ca2+含量,然后再计算出 Mg2+含量。
滴定时, Fe3+、Al3+等干扰离子用 三乙醇胺 掩蔽, Cu2+、Pb2+、Zn2+等重金属离子可用 KCN、 Na2 S或巯基乙酸掩蔽 。
3. 自来水总硬度的测定
水中总硬度的测定
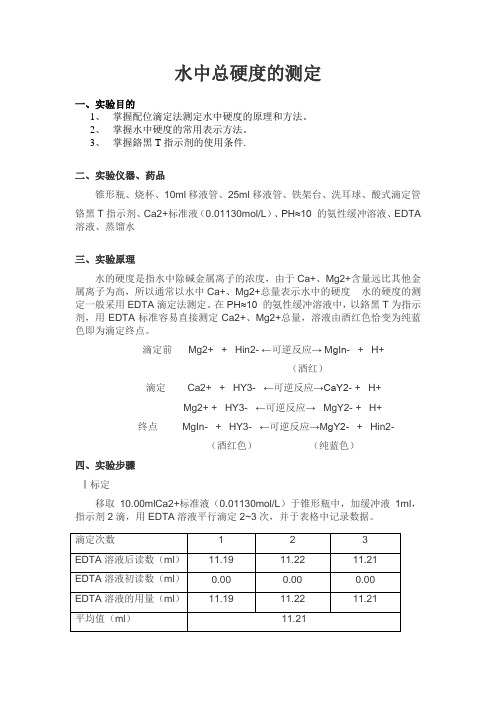
水中总硬度的测定一、实验目的1、掌握配位滴定法测定水中硬度的原理和方法。
2、掌握水中硬度的常用表示方法。
3、掌握鉻黑T指示剂的使用条件.二、实验仪器、药品锥形瓶、烧杯、10ml移液管、25ml移液管、铁架台、洗耳球、酸式滴定管铬黑T指示剂、Ca2+标准液(0.01130mol/L)、PH≈10 的氨性缓冲溶液、EDTA 溶液、蒸馏水三、实验原理水的硬度是指水中除碱金属离子的浓度,由于Ca+、Mg2+含量远比其他金属离子为高,所以通常以水中Ca+、Mg2+总量表示水中的硬度水的硬度的测定一般采用EDTA滴定法测定。
在PH≈10 的氨性缓冲溶液中,以鉻黑T为指示剂,用EDTA标准容易直接测定Ca2+、Mg2+总量,溶液由酒红色恰变为纯蓝色即为滴定终点。
滴定前Mg2+ + Hin2- ←可逆反应→ MgIn- + H+(酒红)滴定 Ca2+ + HY3- ←可逆反应→CaY2- + H+Mg2+ + HY3- ←可逆反应→MgY2- + H+终点MgIn- + HY3- ←可逆反应→MgY2- + Hin2-(酒红色)(纯蓝色)四、实验步骤Ⅰ标定移取10.00mlCa2+标准液(0.01130mol/L)于锥形瓶中,加缓冲液1ml,指示剂2滴,用EDTA溶液平行滴定2~3次,并于表格中记录数据。
Ⅱ测定移取25.00ml自来水于锥形瓶中,加缓冲液1ml,指示剂2滴,滴定至终点,平行滴定2~3次,并于表格中记录数据。
五、实验数据记录及处理实验数据已填于上述表格中实验数据计算:EDTA溶液浓度标定:由C(Ca2+)*V(Ca2+)=C(EDTA)*V(EDTA)得C(EDTA)= C(Ca2+)*V(Ca2+)/V(EDTA)= 0.01130mol/l*10.00ml/11.21ml =0.01008mol/l自来水硬度测定:由n(EDTA)=C(EDTA)V(EDTA)n(Caco3):n(EDTA)=1:1 n(Caco3)=m (Caco3)/ M(Caco3)自来水硬度ρ=m (Caco3)/ Vaq 所以计算可得ρ=0.135g/l=135mg/l六、注意事项:1.各个使用仪器用前需要润洗的注意润洗;2. 络合反应速度较慢,滴定时滴加速度不能太快,特别是临近终点时,要边滴边摇晃。
水中总硬度的测定

总硬度2.7.1 EDTA 滴定法1)适用范围本法适用于原水、工业循环水中钙、镁含量在2~200mg/L 的测定。
水的总硬度包括钙硬度和镁硬度。
硬水能使换热设备结垢,影响传热效果及安全生产。
2)测定原理在PH=10时,乙二胺四乙酸二钠盐能与水中钙镁离子生成稳定的络合物,以铬黑T 作指示剂,便可确定水中总硬度。
3)试剂3.1) 硫酸:1+1溶液3.2) 过硫酸钾:40g/L 溶液贮存于棕色瓶中(有效期1个月)3.3) 三乙醇胺:1+2水溶液3.4) 氢氧化钾:200g/L 溶液3.5) 铬黑T 指示剂:溶解0.50g 铬黑T[1-(1-羟基-2-萘偶氨-6-硝基-萘酚-4-黄酸钠)]于85mL 三乙醇胺中,再加入15mL 无水乙醇溶液即可使用。
3.6) C (EDTA )=0.0100mol/L 标准溶液3.7) 氨-氯化铵缓冲溶液(PH=10)67.54g 氯化铵溶于200mL 水中,加入570mL 浓氨水定容到1000mL 。
4)仪器50mL 酸式滴定管5) 分析步骤5.1) 循环水分析步骤用移液管吸取50.00mL 水样于250mL 锥形瓶中,加入1mL 硫酸溶液,5mL 过硫酸钾溶液加热煮沸至近干,取下冷却至室温,加50mL 水和3mL 三乙醇胺溶液,用氢氧化钾溶液调节PH 近中性,再加5mL 氨-氯化铵缓冲溶液和3滴铬黑T 指示剂,用EDTA 滴定到纯蓝色即为终点。
5.2) 原水分析步骤用移液管吸取50.00mL 水样于250mL 锥形瓶中,加5mL 氨-氯化铵缓冲溶液和3滴铬黑T 指示剂,用EDTA 滴定到纯蓝色即为终点。
6) 结果计算以CaCO 3计的总硬度按下式计算:100008.100/⨯⨯⨯=O EDTA V V C L mg )总硬度(式中:V 0—取样体积,mLV —EDTA 标准溶液消耗体积,mLC EDTA —EDTA 的物质的量浓度,mol/L100.08—CaCO 3的摩尔质量,g/moL7)注意事项7.1)原水中钙镁测定不用加硫酸和过硫酸钾。
水的总硬度的测定实验报告

水的总硬度的测定实验报告水的总硬度的测定实验报告引言:水是人类生活中不可或缺的资源,而水的硬度是一个重要的水质指标,对于水的使用、处理和保护都具有重要意义。
本实验旨在通过测定水的总硬度,了解水质状况并探讨硬水对人类和环境的影响。
实验方法:1. 实验材料准备:- 高纯度去离子水- 0.02 mol/L EDTA(乙二胺四乙酸)溶液- 碳酸钙标准溶液- Eriochrome Black T指示剂- 硬度试剂盒- 烧杯、滴定管等实验器材2. 实验步骤:1) 取一定体积的水样,加入适量的Eriochrome Black T指示剂。
2) 用0.02 mol/L EDTA溶液滴定至溶液颜色由蓝色变为红色,记录滴定所需的EDTA溶液体积。
3) 用去离子水代替水样进行空白试验,重复步骤1和2。
4) 用硬度试剂盒中的碳酸钙标准溶液进行标定,记录滴定所需的EDTA溶液体积。
实验结果与分析:根据实验数据计算出水样的总硬度,可以通过以下公式计算:总硬度(mg/L)= (V2 - V1) × C × 1000 / V其中,V1为空白试验所需EDTA溶液体积,V2为水样试验所需EDTA溶液体积,C为碳酸钙标准溶液的浓度,V为取样体积。
通过实验测得的数据,我们可以得出水样的总硬度。
根据总硬度的不同范围,可以对水质进行评价:- 总硬度低于60 mg/L,水质属于软水,适合饮用和生活用水。
- 总硬度在60-120 mg/L之间,水质属于中硬水,对人体无明显危害。
- 总硬度在120-180 mg/L之间,水质属于硬水,可能会对人体健康产生一定影响。
- 总硬度高于180 mg/L,水质属于超硬水,对人体健康和环境都有不利影响。
结论:通过本实验的测定,我们了解了水的总硬度对水质的影响。
根据实验结果,我们可以评价水样的硬度水平,进而选择适合的水处理方法或选择合适的饮用水。
然而,本实验只是对水样总硬度的初步测定,仅能提供一个大致的硬度范围。
水总硬度的测定

一、实验原理总硬度、钙硬度、镁硬度的概念及表示方法;水的硬度主要是指水中含可溶性的钙盐和镁盐。
总硬度通常以每L水中含的碳酸钙的mg数,即mg/L.钙硬度即每1L水中含的钙离子的mg数,mg/L.镁硬度即每1L水中含的镁离子的mg数,mg/L测定条件:以NH3-NH4Cl 缓冲溶液控制溶液pH=10,以铬黑T为指示剂,用EDTA滴定水样。
原理:滴定前水样中的钙离子和镁离子与加入的铬黑T指示剂络合,溶液呈现酒红色,随着EDTA的滴入,配合物中的金属离子逐渐被EDTA夺出,释放出指示剂,使溶液颜色逐渐变蓝,至纯蓝色为终点,由滴定所用的EDTA的体积即可换算出水样的总硬度。
总硬度=(CV1)EDTA M CaCO3/0.1实验步骤总硬度的测定用100mL吸管移取2份水样,分别加5mL NH3-NH4Cl 缓冲溶液(PH=10),2~3滴铬黑T指示剂,用EDTA标准溶液滴定,溶液由酒红色变为纯蓝色即为终点。
NH3-NH4Cl 缓冲溶液(PH=10):取氯化铵5.4g,加水20ml溶解后,加浓氨溶液35ml,再加水稀释至100ml,即得。
液态铬黑T的配制方法:称取0.50g铬黑T和2.0g盐酸羟胺溶于乙醇,用三乙醇胺稀释至100ml冰箱冷藏3个月。
选择工作基准试剂的原则是与测定对象尽量一致,因此在水硬度的测定中,标定EDTA溶液的工作基准试剂也可选用CaCO3。
<1> CaCO3基准试剂的干燥将CaCO3放烘箱中于393K下干燥2h,稍冷后置于干燥器中冷至室温。
<2> CaCO3标准溶液配制准确称取0.17~0.20gCaCO3,先用少量水湿润,盖上表面皿,缓慢加1:1 HCl 10mL,加热溶解。
溶解后将溶液转入250mL容量瓶中,用水稀释至刻度,摇匀。
<3> 0.01mol·L-1 EDTA标准溶液的标定a. 用吸管吸取25.00mLCa2+试液,加入10mLpH=10的氨缓冲溶液,2~3滴K-B指示剂(0.2g酸性铬蓝K和0.4g萘酚B,配制为1000mL水溶液),用EDTA溶液滴定至溶液由紫红色变为蓝绿色,即为终点。
水的总硬度的测定实验报告

水的总硬度的测定实验报告《水的总硬度的测定实验报告》实验目的:本实验旨在通过测定水样的总硬度,了解水中的钙和镁离子含量,从而评估水的质量。
实验原理:水的总硬度是指水中钙和镁离子的总和。
通常使用EDTA(乙二胺四乙酸)滴定法来测定水样的总硬度。
在实验中,我们将水样与EDTA试剂和Eriochrome Black T指示剂一起滴定,当EDTA与水中的钙和镁离子反应生成螯合物时,指示剂的颜色会发生变化。
通过记录滴定消耗的EDTA滴数,再结合反应方程式,就可以计算出水样的总硬度。
实验步骤:1. 取适量水样倒入容器中。
2. 加入Eriochrome Black T指示剂,使水样呈现出明显的蓝色。
3. 用标定好的EDTA溶液滴定水样,同时搅拌容器。
4. 当水样颜色由蓝色变为粉红色时,停止滴定,并记录所耗EDTA滴数。
5. 重复以上步骤,直至结果一致。
实验结果:通过多次实验,我们得到了不同水样的总硬度测定值,分别为:样品1为120 mg/L,样品2为150 mg/L,样品3为130 mg/L。
实验分析:根据实验结果,我们可以得出不同水样的总硬度不同,说明它们含有不同程度的钙和镁离子。
根据相关标准,水样的总硬度在某一范围内属于优质饮用水,而超出范围则可能对人体健康造成影响。
因此,通过测定水样的总硬度,可以评估水的质量,为水质监测和饮用水处理提供重要参考。
结论:本实验通过EDTA滴定法测定了水样的总硬度,得到了水样中钙和镁离子的含量。
实验结果表明,不同水样的总硬度存在差异,这对水质的评估具有重要意义。
在实际应用中,我们可以根据水样的总硬度来评估水的质量,并采取相应的处理措施,以保障人们的饮用水安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
题目:水的总硬度的测定专业:化学生物学教师:吴明君课程:分析化学实验姓名:水的总硬度的测定摘要:为测定水中总硬度,本文采用了EDTA络合滴定法。
首先用碳酸钙标准品标定EDTA标准溶液,然后以铬黑T为指示剂测定自来水的总硬度,再以钙试剂为指示剂测定自来水的钙硬度,镁硬度为二者之差。
实验结果为,自来水的总硬度为11.87︒,RSD为1.1%;钙硬度为11.18︒,RSD为0.6%;镁硬度为0.69︒。
此方法简单便捷,可广泛用于水质硬度的测定。
关键词:EDTA,自来水,硬度Determination of total hardness of waterAbstract: In order to determine the total hardness of water, this paper uses the EDTA complex titration method. First, the standard solution of EDTA was calibrated with calcium carbonate standard, then the total hardness of tap water was measured with chrome black T as indicator, and the calcium hardness of tap water was measured with calcium reagent as indicator, and Hardness of magnesium is the difference between the two. Experimental results are that the total hardness of tap water is 11.87︒,RSD is 1.1%;Calcium hardness is 11.18︒,RSD is 0.6%;hardness of magnesium is 0.69︒. This method is simple and convenient, and can be widely used for the determination of water hardness.Key words: EDTA, tap water, hardness引言水的硬度最初是指水中钙、镁离子沉淀肥皂水化液的能力。
一般含有钙、镁盐类的水叫硬水(硬水和软水尚无明确的界限,硬度小于5°的,一般可称软水)。
硬度有暂时硬度和永久硬度之分。
暂硬和永硬的总和称为“总硬”。
由镁离子形成的硬度称为“镁硬”。
由钙离子形成的硬度成为“钙硬”。
水的硬度的表示方法有很多种,随各国的习惯有所不同,我国目前采用的表示方法:以度(︒)计,一硬度表示一百万分水中含一份CaO,即1︒=10mg·L-1CaO。
水是人类最为宝贵的自然资源,也是人类以及所有动植物生存的基础。
目前水的硬度的测定方法主要可分为化学分析法和仪器分析法[1],主要有EDTA 络合滴定法,分光光度法,原子吸收法,ICP —AES法,离子色谱法自动电位滴定法,离子选择性电极一流动技术法,电解液阴极大气辉光放电原子发射光谱法[2]等几种测定方法。
本文采用EDTA 络合滴定法测定水的硬度。
水的硬度在生产和生活中都有极大的作用。
硬水易形成水垢,容易造成锅炉设备的爆炸,且硬水对衣物的洗护作用较差。
在生产中,水的硬度影响面包发酵的效果[3],对海参的泡发率也有一定的影响[4],同时胶印润版液中水的硬度对乳化之后油墨的粘着性等性质均产生影响[5]。
目前,我们采用的降低水的硬度的普遍方法是煮沸法,在科研工作中还有用改性大豆皮[6]降低水的硬度的研究和曝气-石灰碱化法[7]降低水的硬度等研究。
本实验采用操作简单的EDTA络合滴定法对水的硬度进行测定,结果准确。
1.实验部分1.1仪器与试剂细口试剂瓶,称量瓶,烧杯,表面皿,250mL容量瓶,25mL移液管,锥形瓶,酸式滴定管,10mL量筒。
乙二胺四乙酸二钠(固体,AR),CaCO3(AR),镁溶液(实验室自制),100g·L-1NaOH溶液,钙指示剂,铬黑T 指示剂,NH3-NH4Cl缓冲溶液,自来水,蒸馏水。
1.2实验内容1.2.1 EDTA标准溶液的标定0.02mol·L-1EDTA溶液的配制:在托盘天平称取7.6g乙二胺四乙酸二钠,溶解并稀释至1L,置于细口瓶中。
0.02mol·L-1钙标准溶液的配制:准确称取碳酸钙基准物质0.5~0.6g于小烧杯中,盖以表面皿,加水润湿,再从杯嘴边逐滴加入数毫升1:1HCl溶液至完全溶解,加热至近沸,冷却后定容于250mL容量瓶中。
标定:移取25mL标准钙溶液,置于锥形瓶中,加入约25mL水、2mL镁溶液,5mL100g·L-1NaOH溶液及约10mg钙指示剂,摇匀后,用EDTA溶液滴定至由红色变为蓝色,即为终点。
平行测定6次。
1.2.2总硬度的测定量取自来水样150mL放于250mL锥形瓶中,加入5mL NH3-NH4Cl缓冲溶液,摇匀。
再加入适量铬黑T指示剂,摇匀,溶液呈红色,以0.02mol·L-1EDTA标准溶液滴定至纯蓝色,即为终点。
平行测定5次。
1.2.3钙硬度的测定量取150mL自来水样,放入250mL锥形瓶中,加4mL100g·L-1NaOH溶液,摇匀再加入约10mg钙指示剂,摇匀溶液呈红色,用0.02mol·L-1EDTA标准溶液滴定至纯蓝色,即为终点。
平行测定5次。
1.2.4镁硬度的确定由总硬度减去钙硬度即得镁硬。
2.结果2.1EDTA标准溶液的标定EDTA的标定测定次数第1次第2次第3次第4次第5次第6次EDTA的初读数/ml 0.70 0.70 0.32 0.10 0.00 0.15 EDTA的终读数/ml 28.50 28.32 28.02 27.10 27.80 27.40V EDTA/ml 27.80 27.62 27.70 27.00 27.80 27.25C EDTA/mol·l-10.01868 0.01880 0.01875 0.01923 0.01868 0.01906⎺c EDTA/mol·l-10.01886标准偏差0.00023相对标准差0.012表 1 EDTA标准溶液的标定置信区间:μ=⎺C±ts/,在置信度P=0.95.N=6时,查表得t(0.05,5)=2.57解得μ=0.01886±2.4⨯10-4RSD=S/⎺C=1.2%碳酸钙基准物的质量为0.5197g,实验数据如表1,EDTA标准溶液在置信度为95%,浓度的置信区间为0.01886±2.4⨯10-4,RSD为1.2%。
2.2总硬度的测定水的总硬度的测定测定次数第1次第2次第3次第4次第5次EDTA的初读数/ml 0.05 0.22 0.01 0.10 0.20EDTA的终读数/ml 16.80 16.90 17.15 16.90 16.95VEDTA/ml 16.75 16.68 17.14 16.80 16.75总硬度(°) 11.81 11.76 12.09 11.85 11.81总硬度平均值(°) 11.87标准偏差0.13相对标准差0.011表2水的总硬度的测定总硬度(︒)=c EDTA⨯V EDTA⨯M CaO⨯105/(V水⨯1000)置信区间:μ=⎺C±ts/,在置信度P=0.95.N=5时,查表得t(0.05,5)=2.78解得μ=11.87±0.16RSD=S/⎺C=1.1%实验数据如表2,在置信度为95%,水的总硬度的置信区间为11.87±0.16(︒),RSD为1.1%。
2.3钙硬度的测定水的钙硬度的测定测定次数第1次第2次第3次第4次第5次EDTA的初读数/ml 0.20 0.15 0.10 0.01 0.10EDTA的终读数/ml 16.00 15.85 16.00 15.89 16.05 V EDTA/ml 15.80 15.70 15.90 15.88 15.95钙硬度(︒) 11.14 11.07 11.21 11.20 11.25 钙硬度平均值(°) 11.18标准偏差0.07相对标准差0.006表3水的钙硬度的测定钙硬度(︒)=c EDTA⨯V EDTA⨯M CaO⨯105/(V水⨯1000)置信区间:μ=⎺C±ts/,在置信度P=0.95.N=5时,查表得t(0.05,4)=2.78解得μ=11.18±0.07RSD=S/⎺C=0.6%实验数据如表3,在置信度为95%,水的钙硬度的置信区间11.18±0.07(︒),RSD为0.6%。
2.4镁硬度镁硬度=总硬度-钙硬度=0.693.讨论3.1测定水总硬度的方法及选择原子吸收法分别测定钙、镁等离子的浓度,该方法虽灵敏准确,但较繁琐;等离子发射光谱法,虽方法灵敏、快速,但该仪器昂贵没有普及;EDTA 滴定法测水中Ca2+、Mg2+的浓度,该方法简单快速、准确可靠、仪器价廉,这是最常使用的方法。
但由于EDTA 是一种较强的络合剂,它易受到水中其它物质或外界条件的干扰,从而影响测定结果的准确性。
3.2EDTA标定基准物质的选取标定EDTA溶液常用的基准物质有Zn、ZnO、CaCO3、Bi、Cu、MgSO4.7H2O、Hg、Ni、Pb等。
通常选用其中与被测物质组分相同的物质作为基准物质,这样,滴定条件较一致,可以减小系统误差。
用EDTA溶液测水中的Ca2+、Mg2+含量则宜用CaCO3为基准物质。
3.3CaCO3作为基准物质引起的误差在配制钙标准溶液的过程中由于操作习惯的原因造成标准溶液的体积不准从而引起误差。
并且在滴定过程中,Fe3+、Al3+对指示剂有封闭作用,可用三乙醇胺作掩蔽剂来消除,Co2+、Cu2+、Ni2+对指示剂有封闭作用,可用Na2S或KCN 等作掩蔽剂来消除。
3.4 PH对测量的影响EDTA是弱酸性物质,在标定EDTA的过程中,加入2mL镁溶液,5mL100g•L-1NaOH溶液调节PH≈12,再次酸度下钙试剂的显色效果最好,同时加入少量镁溶液,在PH≈12时形成微量沉淀与钙试剂结合使显色更加明显。
用铬黑T为指示剂测定水的总硬度时,pH 值变低,金属离子络合物的稳定常数变小,使Ca2+、Mg2+与EDTA 生成的络合物不能定量形成;pH值过高(大于12),则Mg2+变成Mg(OH)2 沉淀,而不能与EDTA 完全反应,所以加入5mL NH3-NH4Cl缓冲溶液,使溶液PH≈10达到铬黑T的最好效果需要的酸度。
