GUS染色液
gus染色原理

gus染色原理Gus染色原理Gus染色原理是一种常用的分子生物学实验技术,用于检测和观察基因的表达情况。
它基于酶反应原理,通过染色剂Gus的添加和酶反应的发生,使得目标基因在组织或细胞中显示出特定颜色,从而可以直观地观察基因的表达水平和组织分布情况。
Gus染色原理的基本步骤如下:1. 样品处理:首先需要获取待检测的组织样品或细胞,可以是植物组织、动物组织或细菌等。
样品需要经过一系列处理步骤,如固定、脱水、透明化等,以保证染色的准确性和可靠性。
2. Gus染色液制备:Gus染色液通常由染色底物、缓冲液和酶反应辅助物质组成。
常用的染色底物有X-β-Glucuronide,它是一种无色底物,在酶反应中会被酶催化分解为产生特定颜色的产物。
缓冲液的选择要根据实验的需要,可以是酸性缓冲液或碱性缓冲液。
3. Gus染色反应:将处理好的样品与Gus染色液进行充分混合,使得染色底物与目标基因的酶发生反应。
在反应过程中,底物被酶催化分解,产生特定颜色的产物。
染色的时间和温度需要根据实验要求进行控制,以保证染色效果的准确性和可靠性。
4. 观察结果:染色反应完成后,观察样品的颜色变化。
正常情况下,目标基因的表达区域会显示出特定颜色,可以是蓝色、紫色等,而未表达的区域则没有颜色变化。
观察结果可以使用显微镜或肉眼进行观察和记录。
Gus染色原理的优点在于其操作简单、成本低廉,可以在大量样品中快速进行检测。
同时,由于染色结果直观明了,可以用肉眼观察和记录,无需复杂的仪器设备。
因此,Gus染色在基因表达研究、遗传工程和植物学等领域得到广泛应用。
然而,Gus染色原理也存在一些限制和注意事项。
首先,染色结果的可视化程度受样品的固定和处理等步骤的影响,不同的样品处理方法可能导致染色结果的差异。
其次,染色结果只能显示目标基因的表达水平和组织分布情况,无法提供更详细的信息,如基因的调控机制和表达动力学等。
此外,由于染色底物的选择和反应条件的不同,染色结果可能存在一定的差异性,需要在实验设计和数据分析中进行合理控制。
GUS 组织化学染色-拟南芥

幼苗GUS染色实验GUS洗液配方:0.1 M PBS, pH 7.010mM EDTA2mM 亚铁氰化钾potassium ferrocyanide2mM 六氰合铁酸钾potassium ferricyanide300mL中加0.254 g亚铁氰化钾,0.198 g六氰合铁酸钾,EDTA 6 mL(10 mM)GUS染色液(1mM)就是把5 mg X-Glus(5 mg加100µL DMSO助溶,X-Glus用前离心3min)加到5 mL洗液里即成染色液。
一次配5 mL染色液,1.5 mL离心管每管分装200 µL,锡纸包住-20℃保存。
步骤:一般5d幼苗可进行试验,早上做以方便白天随时观察幼苗着色情况。
1.90%丙酮固定20min;(丙酮(acetone)渗透力很强,能使蛋白质沉淀凝固,但不影响蛋白质的功能基团而保存酶的活性,用于固定磷酸酶和氧化酶效果较好,因此可用于GUS染色前的固定,可防止GUS信号的扩散。
缺点是固定快、渗透力强,易使组织细胞收缩,保持细胞结构欠佳。
一般4℃下20分钟为宜)2. 加1 mL GUS洗液洗去丙酮,洗2遍;3. 加GUS染色液,冰上抽真空15-20 min;4. 37℃放置,隔一阵观察一下,染上色了就进行下面步骤;5. 吸出染色液,加入1 mL 70%乙醇,停止染色反应及脱色;6. 更换几次乙醇直到脱色完全;7. 解剖镜及显微镜拍照观察载玻片上加适量HCG透明液,用镊子取出幼苗在透明液中铺平,盖上盖玻片,解剖镜观察整株,显微镜观察细节并拍照。
实验原理:GUS基因编码β-葡萄糖苷酸酶,相当稳定而不易降解。
根据GUS基因检测所用的底物不同,可以选择三种检测方法:组织化学法、分光光度法和荧光法(灵感度为分光光度检测法最高)。
其中最为常用的是组织化学法。
组织化学法检测以5-溴-4-氯-3-吲哚-β-葡萄糖苷酸(X-Gluc)作为反应底物,将被检材料用含有底物的缓冲液浸泡。
GUS染色液配制

GUS染色液配制2篇【文章一】GUS染色液配制原理及方法GUS染色液是一种用于检测植物细胞中β-葡萄糖苷酸酯酶(GUS)活性的染色液。
本篇将介绍GUS染色液配制的原理及方法。
一、原理GUS染色液配制的原理是基于GUS酶催化水合酶活性,使含有1-甲基-β-吡喃糖苷(X-Gluc)的染色底物在酶的作用下发生蓝色沉淀反应。
该底物被GUS酶水解后可产生自由的5,5’-二溴-4,4’-二氯-3’-靛酚(X)和5-溴-4-氯-3-(2,6-二甲基-4-氧代酰基苯氨基)苯甲醇(Gal)。
这两种产物在碱性条件下进行聚合反应,生成可见的蓝色沉淀。
二、方法1. 准备所需材料:pH 5.0缓冲液、10% Triton X-100、X-Gluc染色底物(20mg/ml),甲醇,硫酸铵,硼酸,氢氧化钠,孵育液。
2. 配制pH 5.0的缓冲液:取适量的硼酸和氢氧化钠,配制一定浓度的缓冲液,并将溶液调至pH值为5.0。
3. 配制10%的Triton X-100:取适量的Triton X-100,加入适量蒸馏水溶解,使其浓度为10%。
4. 配制X-Gluc染色底物溶液:取适量X-Gluc,加入适量甲醇溶解,制成浓度为20mg/ml的X-Gluc溶液。
5. 配制孵育液:将硫酸铵和甲醇按一定比例混合,制成适量的孵育液。
配制步骤:1. 取适量的pH 5.0缓冲液,加入10% Triton X-100,并充分混合。
2. 加入适量的X-Gluc染色底物溶液,再次充分混合。
3. 加入适量的甲醇和孵育液,并充分混合。
4. 将配制好的GUS染色液过滤,以去除杂质颗粒,得到高纯度的染色液。
5. 将GUS染色液储存于4℃的冰箱中,避光保存。
三、注意事项1. 在配制GUS染色液时,应注意避免阳光直射和长时间的暴露。
2. 染色底物X-Gluc是一种易燃物质,使用时应注意安全操作。
3. 配制过程中的工具和容器应干净无杂质,以防止污染。
4. 孵育液的制备要按照所需配比进行,过量或不足都会影响染色效果。
GUS染液配方

GUS染液配方
100mM sodium phosphate buffer (pH7.0) 磷酸钠缓冲液
0.1% Triton X-100
0.1% N-laurylsarcosine(十二烷基肌氨酸纳)
10 mM Na2EDTA
1 mM K3Fe(CN)6铁氰化钾
1 mMK4Fe(CN)6亚铁氰化钾
0.5 mg/mL X-Gluc
100mM sodium phosphate buffer (pH7.0) 磷酸钠缓冲液的配制方法:
计算方法:
pH7.0时,Na2HPO4.12H2O占61%,NaH2PO4.2H2O占39%
配制100ml时,所需Na2HPO4.12H2O的量为:100*10-3*0.1*358.14*0.61=2.18 g 所需NaH2PO4.2H2O的量为:100*10-3*0.1*156.01*0.39=0.61 g
GUS染液配制方法(500ml):
1. 分别称取10.92 g Na2HPO4.12H2O和3.04 g NaH2PO4.2H2O溶于400ml蒸馏水中;
2. 依次将0.5g十二烷基肌氨酸纳、1.86 g Na2EDTA、0.16 g铁氰化钾、0.21 g亚铁氰化钾和500ul Triton X-100加入磷酸缓冲液中,完全溶解后,定容至500 ml;
3. 根据实验需要取一定量的上述溶液,如100ml,称取0.05 g X-Gluc溶于溶液中,遮光保存。
若准备长时间之后用,将其分装后保存与-20度。
各种试剂分子量:Na2EDTA
K3Fe(CN)6
K4Fe(CN)6。
GUS组织化学染色

GUS组织化学染色GUS组织化学染色GUS组织化学染色1. 实验原理适宜的反应条件下,β-葡聚糖苷酶(GUS)可将X-Gluc水解成蓝色物质,因此具有GUS活性的部位或位点呈现蓝色或蓝色斑点,可用肉眼或显微镜观察到。
2.实验材料1)转基因烟草叶片或试管苗2)非转基因烟草的叶片或试管苗(阴性对照)3.药品试剂1) X-Gluc,用N-N-二甲基酰胺配成20mM的贮存液,分装成每管100L,保存于-20℃。
2) 底物溶液(染色液):3) 1mM X-Gluc加入100mM磷酸钠缓冲液(pH=7.0),缓冲液中含10mM EDTA-Na2,1-5mM K3[Fe(CN)6](铁氰化钾),1-5mM K4[Fe(CN)6](亚铁氰化钾),0.001%(V/V)Triton X-100 4.实验器材小药瓶,培养皿,培养箱(37℃),微量移液器5.实验步骤1) 将准备好的叶片放入小药瓶,加入染色液浸没试材,封好盖子;2) 37℃培养箱中温育1小时至过夜;3) 将浸染过的试材转入70%或95%乙醇中脱色2-3次(除去叶绿素),至阴性对照材料呈白色为止。
6.结果叶片上GUS活性的部位或位点呈现蓝色或蓝色斑点。
先用DMSO溶解X-GLUC 好像是100mg/2ml PBF 94ML+X-GLUC 0.1ML+***** X-100 2ML +FE2+ 2ML+ FE3+ 2ML Gus staining1. Excise root and leaf segments, wash with 100mM potassiumphosphate buffer (pH7.0) for 3 times.GUS组织化学染色2. Immerse in the Gus substrate solution, 37C, dark, 12-24h3. Rinse in phosphate buffer4. Fix for 4h or longer5. Rinse in the same buffer6. Observe as whole specimens or as sections.1M potassium phosphate buffer (pH7.0)K2HPO4: 34.8g ---200mlKH2PO4: 27.2g----200ml184.5ml K2HPO4+115.5ml KH2PO4---- 300ml 1M potassium phosphate buffer(pH7.0)Gus substrate solutionVolume(500ml)Final concentrationPotassium ferricyanide82mg0.5mMPotassium ferrocyanide105.6mg0.5mMPotassium phosphate buffer (pH7.0, 1M)50ml100mMStore at -20C. Add 1mM x-gulc (MW521.8~~0.5mg/ml) freshly when use.Fix solution2.5% glutaraldehyde200mM sodium cacodylate, pH7.2GUS组织化学染色共培养后愈伤的瞬时表达、抗性愈伤的鉴定以及转基因植株的鉴定用GUS组织化学法测定.将待测定的材料,如愈伤或叶片,浸入适量X-Gluc溶液,于37 ℃保温过夜后,在体视显微镜下观察,拍照记录.若将加有X-Gluc溶液的材料抽真空,染色效果将更好.如材料存在色素干扰问题,染色后用酒精脱色,使色素的颜色褪掉而使染成的蓝色保存.X-Gluc染色液:(20*)0.2 mol/L Na3PO4缓冲液(62 mL 0.2 mol/L Na2HPO4;38 mL 0.2 mol/L NaH2PO4),pH 7.0;0.1 mol/L K3[Fe(CN)6];0.1 mol/L K4[Fe(CN)6].3H2O;1.0 mol/L Na2EPTA;0.1% X-Gluc.1000mlx-gluc 1000mg (20ml dmso)Na2HPO4: 620*0.2*M=0.620*0.2*358(12H2O)=44NaH2PO4: 380*0.2*M=0.358*0.2*156(2H2O)=11K3[Fe(CN)6:1000*0.01*M=329.26*0.01=3.3K4[Fe(CN)6]:1000*0.01*M=422.39(3H2O)*0.01=4.2Triton 1MLNa2EPTA:1000*0.1*M=372.24(2H2O)=371. 取 5 mg X-Gluc (5-bromo-4-chloro-3-indolyl glucuronide)溶於100 l DMSO於中.2. 加入10 ml reaction buffer (10 mM Na2EDTA, 100 mM NaH2PO4H2O, 0.1% Triton, 0.5 mM potassium ferricyanide, 0.5 mM potassium ferrocyanide, pH 7.0).3. 混合均匀后分装於eppendorf tube中,保存於-20℃冰箱内.100ml x-gluc染液配制x-gluc 50mg加入溶入1ml dmso1ml triton 100Na2EDTA (20mM) 10mM 5ml ; K3Fe(CN)6 (0.1M) 5mM 0.5ml K4Fe(CN)6 (0.1M) 5mM 0.5ml ; Na2HPO4 (0.2M) 100mM 3.1ml。
GUS染色液使用说明
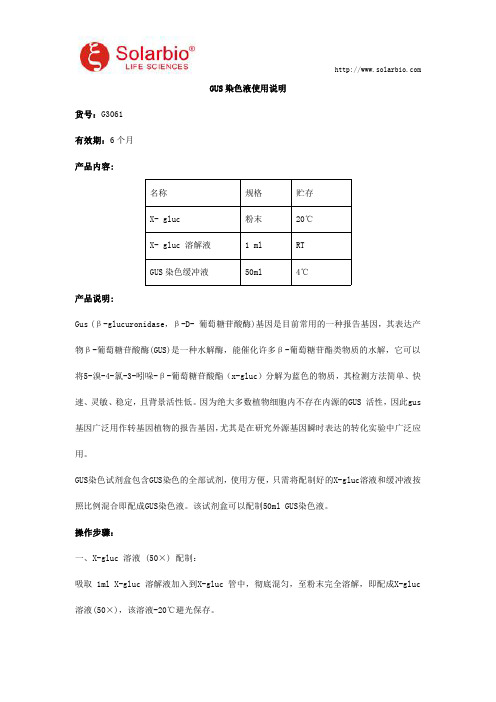
GUS染色液使用说明货号:G3061有效期:6个月产品内容:名称规格贮存X-gluc粉末20℃X-gluc溶解液1ml RTGUS染色缓冲液50ml4℃产品说明:Gus(β-glucuronidase,β-D-葡萄糖苷酸酶)基因是目前常用的一种报告基因,其表达产物β-葡萄糖苷酸酶(GUS)是一种水解酶,能催化许多β-葡萄糖苷酯类物质的水解,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(x-gluc)分解为蓝色的物质,其检测方法简单、快速、灵敏、稳定,且背景活性低。
因为绝大多数植物细胞内不存在内源的GUS活性,因此gus 基因广泛用作转基因植物的报告基因,尤其是在研究外源基因瞬时表达的转化实验中广泛应用。
GUS染色试剂盒包含GUS染色的全部试剂,使用方便,只需将配制好的X-gluc溶液和缓冲液按照比例混合即配成GUS染色液。
该试剂盒可以配制50ml GUS染色液。
操作步骤:一、X-gluc溶液(50×)配制:吸取1ml X-gluc溶解液加入到X-gluc管中,彻底混匀,至粉末完全溶解,即配成X-gluc 溶液(50×),该溶液-20℃避光保存。
注:正常的X-gluc溶液颜色为无色,如果溶液变为红色或棕色,表明溶液失效。
二、GUS染色工作液配制:GUS染色工作液配制量1ml5ml10mlX-gluc溶液(50×)20μl100μl200μlGUS染色缓冲液1ml5ml10ml注:GUS染色工作液最好现用现配,短期贮存可以-20℃保存2-3天。
三、GUS染色步骤:1.预处理:将叶片、花瓣、根茎等组织剪成小片,放于1.5ml离心管中,加入预冷的90%丙酮完全覆盖材料,常温处理20-30分钟。
此步骤可以预固定组织并且可以去除部分叶绿素。
注:用于染色的植物材料的制备方法要因涉及的特定组织和器官的不同而异。
例如,拟南芥的根、花和叶片以及烟草幼苗的根就可以不作任何预处理而直接染色。
gus染色原理

gus染色原理Gus染色原理。
Gus染色是一种常用的细胞染色技术,用于检测β-葡萄糖苷酶(β-glucuronidase)的活性。
β-葡萄糖苷酶是一种水解酶,能够水解含有葡萄糖醛酸酯的底物,产生游离的葡萄糖醛酸。
Gus染色的原理是利用β-葡萄糖苷酶水解底物后产生的蓝色产物,对细胞或组织进行染色,从而观察β-葡萄糖苷酶的活性和分布情况。
在进行Gus染色之前,首先需要准备Gus染色液和底物。
Gus染色液通常由染色缓冲液、染色底物和其它辅助试剂组成。
染色底物是一种含有葡萄糖醛酸酯的化合物,一般为5-溴-4-氯-3-吲哚基葡萄糖醛酸(X-gluc)。
X-gluc在β-葡萄糖苷酶的作用下会产生蓝色的沉淀物,用于显示β-葡萄糖苷酶的活性。
辅助试剂通常包括有机溶剂、金属离子螯合剂等,用于增强染色效果和稳定染色产物。
在实际操作中,将待检测的细胞或组织样品加入Gus染色液中进行染色处理。
在适当的温度和时间条件下,X-gluc会被β-葡萄糖苷酶水解,产生蓝色的沉淀物。
通过显微镜观察染色结果,可以直观地了解β-葡萄糖苷酶在样品中的活性和分布情况。
活性高的细胞或组织会呈现出深色的染色,而活性低的则呈现较浅的染色或无染色。
Gus染色技术在植物学、动物学和微生物学等领域得到了广泛的应用。
在植物学中,可以利用Gus染色观察植物各部位中β-葡萄糖苷酶的表达情况,从而研究植物的生长发育过程和应激响应机制。
在动物学中,Gus染色也可用于研究动物胚胎发育过程中的基因表达和细胞分化情况。
在微生物学中,Gus染色可以用于检测细菌和真菌中β-葡萄糖苷酶的活性,从而研究微生物的代谢特性和环境适应能力。
总之,Gus染色技术是一种简单、直观的细胞染色方法,能够有效地检测β-葡萄糖苷酶的活性和分布情况。
通过对样品进行Gus染色,可以为细胞生物学和生物化学研究提供重要的实验数据,促进对生物学问题的深入理解和探讨。
随着生物技术的不断发展,相信Gus染色技术在生命科学领域中会有更广泛的应用和深入的研究。
GUS染色及相关溶液配制

GUS染色(1)测量称重的同时另取20株幼苗经行GUS染色,注意选取长势近似的植株。
(2)用吸水纸吸干表面水分后切除苗,保持根部完整,装入量程适当的离心管中,贴好标签标记处理。
(3)用移液枪加入适量GUS缓冲液,加入缓冲液后用锡箔纸包裹离心管,盖好离心管后晃动几下,再加入GUS底物,保证1ml染液中GUS缓冲液950ul,GUS 底物50ul的比例,染液总量可浸没所有种子和根为宜。
(4)将用锡箔纸包裹好的离心管捆扎好,放于37℃ 200rad的摇床上过夜,可至24 h。
GUS染液的配方50 ml 100 ml 500 ml1 M NaH2PO47.8 g 15.6 g 78.005 g1 M Na2HPO417.91 g 35.81 g 179.08 g0.5 M9.31 g 18.61 g 93.1 gEDTA(PH=8)Triton X-100 10 ml 20 ml 100 ml0.5 M 亚铁氰化钾10.55 g 21.1g 105.5 g0.5 M 铁氰化钾8.25 g 16.5 g 82.5 gX-Gluc 50 mg 100 mg 500 mgGUS 染液的配置以500 ml GUS 染液为准,配比如下GUS母液配比(每500 ml)1 M NaH2PO421.15 ml1 M Na2HPO428.85 ml0.5 M EDTA(PH=8) 1 mlTriton X-100(20%) 25 ml0.5 M 亚铁氰化钾 5 ml0.5 M 铁氰化钾 5 mlX-Gluc 500 mg注:已知1 M的磷酸钠缓冲液(PH=7)中V(NaH2PO4):V (Na2HPO4) = 42.3 : 57.7亚铁氰化钾K4Fe(CN)6.3H2O铁氰化钾K3Fe(CN)6GUS染液体系GUS 缓冲液GUS 底物3 mL 体系2850 μl150 μl5 mL 体系4750 μl250 μlGUS脱色(1)配置稀释过的NaClO溶液,浓度在3%左右(因NaClO易分解,详细浓度无法精确),配置好后封口避光保存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
南京森贝伽生物科技有限公司 网址:/
第1页 仅供科研
版本号:181126
GUS 染色液
【产品组成】
【保存条件】
-20℃,避光;4℃,避光,12个月
【产品概述】
GUS(β-Galactosidase)基因是存在于E.coli 等一些细菌基因组内的编码β-葡萄糖苷酸酶的一种水解酶,该基因常作为融合标记用于植物转基因分析和调控研究中。
GUS 受体基因系统有表达E.coliGUS 酶的稳定性和在植物内的低活性,绝大多数植物没有检测到葡萄糖苷酸酶的背景活性,以β-葡萄糖苷酸酯类物质为底物,其反应产物可用多种方法检测出来。
5-Bromo-chloro-3-indolyl β-D-glucuronide ,
cyclohexylammonium salt(简称为X-Gluc 或X-GlcA)分子量为521.8,CAS 号为18656-96-7,是检测大肠杆菌中GUS 基因的底物,可快速检测植物中GUS 基因融合标记。
β-葡萄糖苷酶基因染色试剂盒(β-Galactosidase Reporter Gene Staining Kit)简称为GUS 染色液,其染色原理是适宜的反应条件下β-葡萄糖苷酶(GUS)可将X-Gluc 水解成蓝色物质,该物质不溶解于转基因的细胞核组织中的靛蓝物质,具有GUS 活性的部位或位点呈现蓝色或蓝色斑点,可用肉眼或显微镜观察到,GUS 染色液可用于生物化学活性分析、免疫分析以及组织和细胞的组织化学染色,多用于转基因植物的GUS 基因表达分析。
该试剂仅用于科研领域,不适用于临床诊断或其他用途。
【使用方法】
1、配制X-GlcA Solution :取X-GlcA Solvent 229μl 加入至80mg X-GlcA 中或取适量上述2种物质溶解,使其浓度达到350mg/ml ,轻轻Vortex 混匀,即为Solution ,分装后,-20℃避光保存。
2、按下列比例配制GUS 染色液:
3、固定(
①取转基因植物组织,入3~5ml清洁小瓶或多孔板中。
②取适量2×Fixation Buffer与去离子水等量稀释即获得1×Fixation Buffer,加入1×Fixation Buffer使其完全浸没组织,室温孵育45~60min,弃液。
③配制洗涤液:按GUS Buffer A:去离子水=1:20稀释即为洗涤液,用配制好的洗涤液漂洗3次,每次1min。
4、加入适量GUS染色液,使GUS染色液完全浸没组织。
5、(备选)用真空泵抽取小瓶或多孔板中的气体,抽取时间应大于2min;该步骤是非必需步骤,目的是为了抽取植物组织内的气体,并使染色液更容易进入组织内。
6、立即盖紧瓶子或多孔板,37℃孵育24h;随着孵育时间的延长,蓝色渐渐出现,当表达量较高时,GUS活性的部位或位点呈现蓝色或蓝色斑点。
7、用乙醇脱去样本的叶绿素,一般样本浸没于乙醇1~3h;如有必要可重复该脱色步骤,以便彻底清除叶绿素;样本保存于乙醇中可用肉眼或普通光学显微镜下观察。
【注意事项】
1、GUS染色液最好冰上配制,可以4℃避光保存3天。
2、减少GUS Buffer B、C的使用量会提高检测特异性(即减少假阳性),但常会导致无阳性结果,GUS Buffer
B、C的使用量一般控制在4~40μl/10ml。
3、X-GlcA Solution应避免反复冻融,否则染色效率会下降。
4、由于组织特异性等原因,蓝色颜色反应可能不完全一致,应注意摸索具体实验条件。
第2页
南京森贝伽生物科技有限公司网址:/。
