化学知识点电能转化为化学能 电解
《电能转化为化学能—电解》电解法制备金属

《电能转化为化学能—电解》电解法制备金属在现代工业中,电解法已成为制备金属的重要手段之一。
通过电能转化为化学能的过程,我们能够以高效、精确的方式获得各种金属。
首先,让我们来了解一下电解的基本原理。
电解是将直流电通过电解质溶液或熔融电解质,使电解质在两个电极上发生氧化还原反应的过程。
在电解池中,与电源正极相连的电极称为阳极,与电源负极相连的电极称为阴极。
以电解法制备金属铜为例。
通常,我们会使用含铜离子的溶液作为电解质,比如硫酸铜溶液。
在电解过程中,阳极发生氧化反应,溶液中的阴离子向阳极移动。
在这个例子中,通常是氢氧根离子失去电子生成氧气和水。
阴极发生还原反应,铜离子得到电子被还原为金属铜并沉积在阴极上。
电解法制备金属具有许多优点。
其一,它能够得到高纯度的金属。
因为在电解过程中,只有目标金属离子能够在阴极得到电子被还原,其他杂质离子由于电位的差异难以在阴极放电,从而有效地提高了金属的纯度。
其二,电解法可以实现对金属沉积过程的精确控制。
通过调整电流密度、电解时间等参数,我们可以控制金属的沉积速率和厚度,满足不同的生产需求。
再比如电解法制备铝。
铝是地壳中含量丰富的金属元素,但由于其化学性质活泼,传统的冶炼方法难以直接从矿石中提取纯铝。
而电解法为铝的制备提供了有效的途径。
工业上采用冰晶石氧化铝融盐电解法制备铝。
将氧化铝溶解在熔融的冰晶石中,在电解槽中进行电解。
在阳极,氧离子失去电子生成氧气;在阴极,铝离子得到电子还原为液态铝。
然而,电解法制备金属也并非完美无缺。
它的能耗较高,这是因为电解过程需要消耗大量的电能来驱动化学反应。
此外,电解设备的投资和维护成本也相对较高,需要有良好的技术和管理来保障生产的稳定运行。
为了降低电解过程的能耗和成本,科学家们一直在进行不懈的努力。
一方面,通过改进电解槽的结构和设计,提高电流效率,减少能量损失。
另一方面,探索新型的电解质体系和电极材料,降低电解过程的过电位,提高反应的选择性和速率。
2014年高考化学一轮复习:6-2 电能转化为化学能——电解

3.电解的有关计算 (1)常见计算类型: ①两极产物的定量计算(求析出固体的质量、产生气体的体积 等); ②溶液 pH 的计算; ③相对原子质量和阿伏加德罗常数测定的计算; ④某元素的化合价或确定物质的化学式; ⑤根据电量求产物的量或根据产物的量求电量等。
(2)解答此类问题的常用方法: ①守恒法:原子守恒、电量守恒等; ②总反应式法; ③关系式法,如: 物质(或微粒): H2~O2~Cl2~Cu~Ag~H+~OH-~e- n(mol) 2 1 2 2 4 4 4 4
第2节 电能转化为化学能——电解
[考纲展示] 1.了解电解池的工作原理。 2.能写出电极反应和电解总反应方程式。
一、电解原理 1.电解的定义及能量转化形式 (1)定义 在直流电作用下,电解质在两个电极上分别发生氧化反应和还 原反应的过程。 (2)能量转化形式为:电能转化为化学能。
2.电解池的构造及电极反应
此时溶液中 c(H+)为(假设体积不变)( )
A.1.5 mol·L-1
3.电镀 (1)阳极:镀层金属。 (2)阴极:镀件。 (3)电镀液:一般用含有镀层金属离子的电解质溶液作电镀液。 (4)电极质量及离子浓度变化:电镀池工作时,阳极质量减少, 阴极质量增加,电解质溶液浓度不变。
1.Cu+H2SO4===CuSO4+H2↑可以设计成电解池,但不能设 计成原电池。( )
(3)以铂为电极,使电解质和水量都减少进行电解,则电解质是
____________________________________________________。
【解析】(1)电解电解质型,水不参与反应,可以是无氧酸或较 不活泼金属的无氧酸盐,如 HCl、CuCl2。
(2)电解水型,电解质不参与反应,只起增强溶液导电性作用, 可以是含氧酸,活泼金属的含氧酸盐或强碱,如 H2SO4、Na2SO4。
电能转化为化学能—电解》电解中的能量变化

电能转化为化学能—电解》电解中的能量变化《电能转化为化学能—电解》电解中的能量变化在我们的日常生活和工业生产中,电能与化学能之间的相互转化扮演着至关重要的角色。
其中,电解作为一种将电能转化为化学能的重要方法,不仅具有广泛的应用,还涉及到一系列有趣的能量变化。
让我们先来了解一下什么是电解。
简单来说,电解就是在直流电的作用下,使电解质溶液或熔融电解质中的离子发生定向移动,并在电极上发生氧化还原反应的过程。
这个过程中,电能被输入到体系中,促使化学反应的发生。
在电解过程中,能量的变化主要体现在以下几个方面。
首先,从电能的输入角度来看。
为了使电解反应能够顺利进行,需要提供足够的电压来克服电解池中的各种阻力,包括溶液的电阻、电极的极化等。
当直流电通过电解池时,电能被不断地消耗,转化为其他形式的能量。
其次,在电极表面发生的氧化还原反应中,也伴随着能量的变化。
在阳极,失去电子的物质发生氧化反应,这个过程通常是能量释放的过程。
而在阴极,得到电子的物质发生还原反应,往往需要吸收能量。
例如,在电解水的过程中,阳极的水分子失去电子生成氧气和氢离子,这个过程释放出一定的能量。
而在阴极,氢离子得到电子生成氢气,这是一个需要吸收能量的过程。
此外,电解过程中的能量变化还与电解质溶液的浓度、温度等因素有关。
一般来说,电解质溶液的浓度越高,电阻越小,电能的消耗相对就会减少。
而温度的升高则可以提高离子的迁移速度,降低反应的活化能,从而使电解反应更容易进行,减少电能的消耗。
电解的应用十分广泛,这也从侧面反映了其在能量转化方面的重要性。
比如在电解精炼金属方面。
通过电解,可以将粗金属中的杂质去除,得到纯度较高的金属。
以电解精炼铜为例,粗铜作为阳极,纯铜作为阴极,硫酸铜溶液作为电解质溶液。
在电解过程中,阳极的粗铜逐渐溶解,其中的杂质如铁、锌等比铜活泼的金属优先失去电子进入溶液,而金、银等不活泼的金属则沉淀形成阳极泥。
阴极上则是铜离子得到电子还原为铜单质,从而实现了铜的精炼。
化学电解池知识点总结

化学电解池知识点总结化学电解池是化学电解过程中的重要装置,用于将电能转化为化学能。
它由两个电极和电解质溶液组成,通过外加电压将正负极连接,使电解质溶液中的离子在电场作用下发生氧化还原反应。
下面将从电解质、电极反应、溶液浓度和温度等方面介绍化学电解池的相关知识点。
电解质是化学电解池中起着重要作用的物质。
电解质可以分为强电解质和弱电解质两种。
强电解质在溶液中能完全离解成离子,如盐酸、硫酸等;而弱电解质只有部分离解成离子,如醋酸、氨水等。
在电解质溶液中,阳离子会向阴极移动,而阴离子则向阳极移动,这是因为正离子在电场作用下向负极运动,而负离子则向正极运动。
电解质溶液中的电极反应是化学电解过程中的关键环节。
在阴极上,正离子接受电子,发生还原反应;而在阳极上,负离子失去电子,发生氧化反应。
例如,在氯化钠溶液中,阴极上发生的反应是2H2O + 2e- → H2 + 2OH-,而阳极上发生的反应是2Cl- → Cl2 + 2e-。
这些反应使得电解质溶液中的离子发生变化,从而实现电能到化学能的转化。
溶液的浓度对化学电解过程也有一定影响。
一般来说,溶液的浓度越高,电解过程中的离子浓度越大,反应速度也越快。
而过高或过低的浓度则可能导致电解效果不理想。
温度对化学电解过程也有一定影响。
一般来说,温度升高可以加快反应速率,提高电解效果。
这是因为温度升高会增加离子的运动速度,促使离子更容易与电极发生反应。
然而,过高的温度也可能导致电解质溶液中的水分解,产生氧气和氢气等危险物质,因此在实际操作中需要控制好温度。
化学电解池是化学电解过程中的重要装置,通过外加电压使电解质溶液中的离子发生氧化还原反应。
其中,电解质、电极反应、溶液浓度和温度等因素都对电解过程有一定影响。
了解这些知识点,对于理解电解过程的机理和优化电解效果具有重要意义。
电化学知识点-原电池和电解池
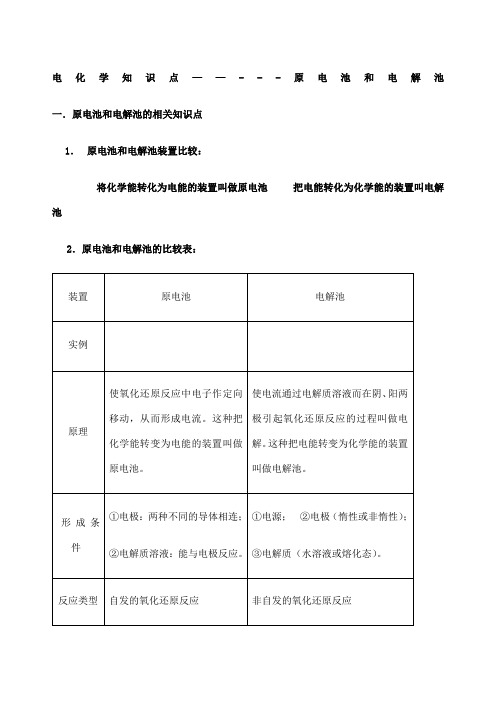
电化学知识点——---原电池和电解池一.原电池和电解池的相关知识点1.原电池和电解池装置比较:将化学能转化为电能的装置叫做原电池把电能转化为化学能的装置叫电解池2.原电池和电解池的比较表:原电池的本质:氧化还原反应中电子作定向的移动过程电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程3.化学腐蚀和电化腐蚀的区别4.吸氧腐蚀和析氢腐蚀的区别5.电解、电离和电镀的区别6.电镀铜、精炼铜比较说明、原电池正、负极的判断:(1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
(2)从电子的流动方向负极流入正极(3)从电流方向正极流入负极(4)根据电解质溶液内离子的移动方向阳离子流向正极,阴离子流向负极(5)根据实验现象①溶解的一极为负极②增重或有气泡一极为正极二.高频考点1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2+ H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2、原电池的应用:①加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快。
②比较金属活动性强弱。
可以利用原电池比较金属的活动性顺序(负极活泼)。
将两种不同金属在电解质溶液里构成原电池后,根据电极的活泼性、电极上的反应现象、电流方向、电子流向、离子移动方向等进行判断。
③设计原电池。
④利用原电池原理可以分析金属的腐蚀和防护问题金属的腐蚀分为化学腐蚀和电化学腐蚀两种,但主要是电化学腐蚀。
根据电解质溶液的酸碱性,可把电化学腐蚀分为:吸氧腐蚀和析氢腐蚀两种。
《电能转化为化学能—电解》电解的应用实例

《电能转化为化学能—电解》电解的应用实例在我们的日常生活和工业生产中,电能转化为化学能的过程——电解,发挥着至关重要的作用。
电解是一种通过电流驱动化学反应的技术,它使得原本难以自发进行的化学反应得以实现,从而创造出许多有价值的物质和产品。
首先,电解在金属冶炼方面有着广泛的应用。
以电解精炼铜为例,粗铜中通常含有锌、铁、镍、银、金等杂质。
将粗铜作为阳极,纯铜作为阴极,放入硫酸铜溶液中进行电解。
在电解过程中,阳极的铜以及比铜活泼的金属(如锌、铁、镍等)会失去电子,变成离子进入溶液;而阴极上,溶液中的铜离子会得到电子,在阴极上析出纯铜。
经过一段时间的电解,阳极的粗铜逐渐溶解,而阴极上则沉积出纯度更高的铜。
这种电解精炼的方法能够有效地提高铜的纯度,满足各种工业和电子领域对高纯度铜的需求。
电解在氯碱工业中也扮演着不可或缺的角色。
氯碱工业通过电解饱和食盐水来制取烧碱(氢氧化钠)、氯气和氢气。
在电解槽中,以涂有钛、钌等氧化物涂层的钛网作为阳极,以铁丝网或石墨作为阴极。
电解时,在阳极,氯离子失去电子生成氯气;在阴极,水电离出的氢离子得到电子生成氢气,同时溶液中的钠离子与氢氧根离子结合形成氢氧化钠溶液。
这个过程不仅为化工生产提供了重要的基础原料,如烧碱用于造纸、纺织、印染等行业,氯气用于生产塑料、农药、消毒剂等,氢气则是一种清洁的能源和化工原料。
此外,电解还被用于电镀。
电镀是利用电解原理在某些金属表面镀上一层其他金属或合金的过程。
例如,在铁制品表面镀铜,将铁制品作为阴极,纯铜作为阳极,放入含有铜离子的电镀液中进行电解。
在电流的作用下,阳极的铜溶解成铜离子进入溶液,同时溶液中的铜离子在阴极上得到电子,沉积在铁制品表面形成一层均匀、致密的铜镀层。
通过电镀,可以提高金属制品的耐腐蚀性、耐磨性和美观度,广泛应用于汽车、电子、五金等行业。
在电解水制氢方面,电解也展现出了巨大的潜力。
随着全球对清洁能源的需求不断增加,氢气作为一种清洁能源受到了广泛关注。
电能转化为化学能-电解

阳极
阴极
氧气
氢 气
实例
电极反应
浓度
PH值
复原
Na2SO4
实例
电极反应
浓度
PH值
复原
Na2SO4
阳极: 4OH- → 4e- + 2H2O+O2 ↑
阴极: 4H ++ 4e- → 2H2 ↑
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+
电解
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
电解
现象: 阳极:有黄绿色气体产生,使湿润的淀粉-KI溶液变蓝 阴极:有气泡产生,滴加酚酞溶液变红
Cl2会和NaOH反应,会使得到的NaOH不纯
H2和Cl2 混合不安全
上述装置的弱点:
02
1、生产设备名称:离子交换膜电解槽
阳极:金属钛网(涂钛钌氧化物) 阴极:碳钢网(有镍涂层) 阳离子交换膜:只允许阳离子通过,把电解槽隔成阴极室和阳极室。
(3)分析电解质溶液的变化情况: 氯化铜溶液浓度降低
CuCl2 Cu+Cl2 ↑
电解
思考:
为何当一个电极存在多种可能的放电离子时,不是大家共同放电,而是只有一种离子放电?放电能力与什么因素有关?
离子放电顺序:
阴离子失去电子而阳离子得到电子的过程叫放电。
①当阳极为活性电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。 ②当阳极为惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是:
6.2电能转化为化学能——电解

B.电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以
使溶液恢复至原状态
C.铅蓄电池在充电时,连接电源正极的电极发生的电
极反应为PbSO4+2e-====Pb+ SO2 4
D.将钢闸门与直流电源的负极相连,可防止钢闸门腐 蚀
【解析】选D。根据金属活动性顺序表可知,阴极上离
子的放电顺序是Fe3+>Cu2+>H+>Fe2+>Al3+,Fe2+和Al3+不
课时小结 【脉络构建】
构建知识体系
明确掌控重点
【核心要素】
1.两个电极的判断: (1)阳极:与电源正极相连、发生氧化反应、阴离子移 向的一极。 (2)阴极:与电源负极相连、发生还原反应、阳离子移 向的一极。
2.阴阳两极的放电顺序:
(2)阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>Al3+> Mg2+>Na+
第 2节
电能转化为化学能——电解
考点
电解原理及其应用
【核心知识通关】 1.原理(电解CuCl2溶液):
正
阴
还原
阴 阴极
阳 阳极
氧化
(1)电解饱和食盐水(氯碱工业)。
2H++2e-====H2↑ 还原
2Cl--2e-====Cl2↑ 氧化
电解 2NaCl+2H O 2 ==== 2NaOH+H 2↑+Cl2↑ 。 总反应方程式:________________________________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学知识点电能转化为化学能电解
广大高中生要想顺利通过高考,接受更好的教育,就要做好考试前的复习准备。
小编带来化学知识点:电能转化为化学能电解,希望大家认真阅读。
电能转化为化学能电解
1、电解的原理
(1)电解的概念:
在直流电作用下,电解质在两上电极上分别发生氧化反应和还原反应的过程叫做电解。
电能转化为化学能的装置叫做电解池。
(2)电极反应:以电解熔融的NaCl为例:
阳极:与电源正极相连的电极称为阳极,阳极发生氧化反应:2Cl-Cl2+2e-。
阴极:与电源负极相连的电极称为阴极,阴极发生还原反应:Na++e-Na。
总方程式:2NaCl(熔)2Na+Cl2
2、电解原理的应用
(1)电解食盐水制备烧碱、氯气和氢气。
阳极:2Cl-Cl2+2e-
阴极:2H++e-H2
总反应:2NaCl+2H2O2NaOH+H2+Cl2
(2)铜的电解精炼。
粗铜(含Zn、Ni、Fe、Ag、Au、Pt)为阳极,精铜为阴极,CuSO4溶液为电解质溶液。
阳极反应:CuCu2++2e-,还发生几个副反应
ZnZn2++2e-;NiNi2++2e-
FeFe2++2e-
Au、Ag、Pt等不反应,沉积在电解池底部形成阳极泥。
阴极反应:Cu2++2e-Cu
(3)电镀:以铁表面镀铜为例
待镀金属Fe为阴极,镀层金属Cu为阳极,CuSO4溶液为电解质溶液。
阳极反应:CuCu2++2e-
阴极反应: Cu2++2e-Cu
以上就是化学知识点:电能转化为化学能电解。
第 1 页。
