《中国药典》2015年版勘误表
2015年版药典勘误(第二次)
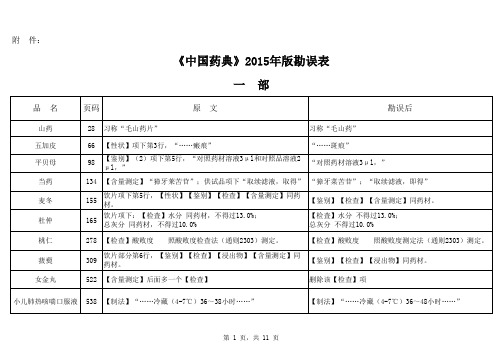
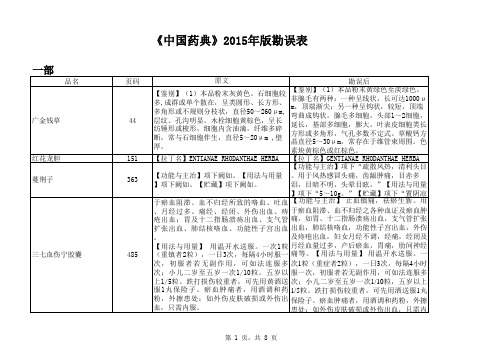
附 件:《中国药典》2015年版勘误表一 部二 部雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部四 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446丁香油460【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,……【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量,……465【折光率】本品的折光率(通则0621)……【折光率】本品的折光率(通则0622)……466【脂肪酸组成】……进样口温度为206℃,……【脂肪酸组成】……进样口温度为260℃,……大豆磷脂468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……469【微生物限度】……还不得检出大肠埃希和沙门菌。
《中国药典》2015年版勘误表.xls
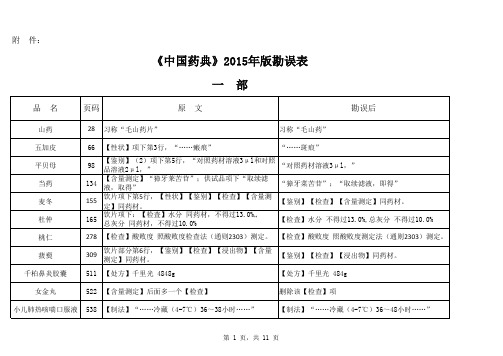
附 件:《中国药典》2015年版勘误表一 部二 部蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲氧基…….附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)-8-甲氧基…….雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446四 部第 11 页,共 11 页。
《中国药典》2015年版中药材增修订内容
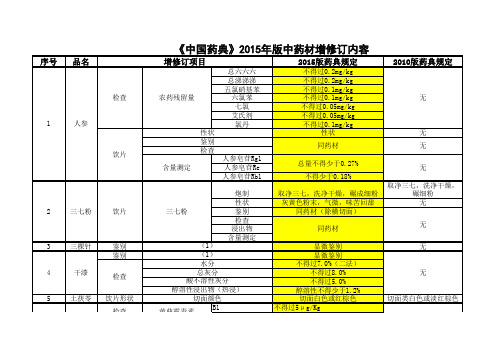
取净大黄片,照炒炭法 炒至表面焦黑色,内部 焦褐色
10 11 12
山银花 山楂 千金子
13
川木香 饮片
煨川木香
无
14 15 16 17 18 19 20 21
川贝母 川芎 广金钱草 女贞子 马兜铃 天仙子 天冬 天花粉
鉴别 性状 饮片 鉴别 鉴别 鉴别 鉴别 检查 饮片 检查 饮片
(2) (3) 表面颜色 表面颜色 (1) (1) (1) (1) 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 (1)
鉴别 22 天竺黄
(2) (3)
检查 性状 鉴别 检查 23 天麻 浸出物 含量测定 饮片
体积比 表面颜色 (3) 二氧化硫残留量 醇溶性浸出物 天麻素 对羟基苯甲醇 性状
贝母素乙及贝母辛 无 表面黄褐色 外表皮黄褐色 无 无 无 无 无 无 无 无 (1)溶媒为盐酸与硝酸 (1)溶媒为醋酸2滴,显色剂一滴 的等混合液,显色剂无 变化 (2)显色反应 (2)显示反应 增加天竺黄为对照药材的薄层色谱 无 鉴别 体积比:中粉10g。轻轻 中粉10g,轻轻装入量筒,体积比 装入量筒,体积比不得 不得少于24ml 少于35ml 黄白色至黄棕色 黄白色至淡黄棕色 增加对羟基苯甲醇为对照品的薄层 无 色谱鉴别 不得过400mg/Kg 无 不得少于10%,溶媒为乙 不得少于15.0%,溶媒为稀乙醇 醇 不得少于0.20% 总量不得少于0.25% 无 淡黄色至黄棕色 淡黄色至淡黄棕色
《中国药典》2015年版中药材增修订内容
序号 品名 增修订项目
总六六六 总涕涕涕 五氯硝基苯 六氯苯 七氯 艾氏剂 氯丹 性状 鉴别 检查 含量测定 人参皂苷Rg1 人参皂苷Re 人参皂苷Rb1 炮制 性状 鉴别 检查 浸出物 含量测定
2015年版《中国药典》药用辅料标准有关问题的答复意见

附件:2015年版《中国药典》药用辅料标准有关问题的答复意见品种反馈问题答复意见聚山梨酯80(供注射用)【脂肪酸组成】项下对照品溶液浓度为每1ml中各含0.01mg的溶液(2015年版《中国药典》勘误第二批)认为该浓度下进样的对照品峰面积过小。
脂肪酸组成按面积归一化法计算,对照品仅仅作为定位用。
乳糖【性状】描述中白色的结晶性颗粒或粉末的理解问题。
【溶液的澄清度与颜色】溶液应澄清无色(不超过0.5号浊度标准液的浊度)。
认为标准过于严格,建议修订浊度限度为:与1号浊度液对比,不得深于对照。
【含量测定】项下以乙腈-水(70:30)为流动相基线不稳,建议以乙腈-水(61:39)为流动相。
加水溶解并稀释制成每1ml各含1mg的溶液响应值太低,导致积分不准确,重现性不好,系统适应性RSD不符合要求。
系统适用性试验理论板数以乳糖峰计算低于5000,达不到要求,建议修订为不低于4000。
1.对性状正确的理解应为:白色的结晶性颗粒,或者白色粉末。
2.乳糖作为注射剂的冻干保护剂使用,为保证药品的安全,药典标准应严格。
3.含量测定项下以乙腈-水(70:30)为流动相基线可以稳定。
每1ml各含1mg的溶液浓度合适,系统适应性RSD可以符合要求。
由于示差折光检测器需要较长时间稳定,建议增加稳定时间。
乳糖峰理论塔板数可以达到要求。
硬脂酸镁【镉盐】【镍盐】两个检测项目,照原子吸收分光光度法(通则0406第二法)测定,均未规定具体的原子化方法,建议两个检测项目标准中均加注“以石墨炉为原子化器,照原子吸收分光光度法(通则0406第二法)测定。
按照本版药典通则0406原子吸收分光光度法的规定,采用原子吸收分光光度法进行的检验,通常不指定原子化器。
检验人员应根据所测元素、仪器性能及工作经验选择相应的原子化器,即使选用了火焰原子化器,可根据被测元素及仪器性能改变燃气和助燃气的种类及比例控制火焰温度,以获得较好的火焰稳定性和测定灵敏度。
《中国药典》2015一部中药材部分Word版91-258页

中国药典2015年版石榴皮• 91 •【检查】水分不得过13.0%(通则0832第二法)。
总灰分不得过6.0%。
(通则2302)。
【漫出物】照醇溶性浸出物测定法(通则2201)项下的 热浸法测定,用稀乙醇作溶剂,不得少于17.0%。
【含置测定】照髙效液相色谱法(通则0512)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶 为填充剂;以甲醇-水(68 : 32)为流动相;检测波长为334nm 。
理论板数按石吊兰素峰计算应不低于3000。
对照品溶液的制备取石吊兰素对照品适量,精密称定, 加甲醇制成每lml 含25网的溶液,即得。
供试品溶液的制备取本品中粉约〇.5g ,精密称定,置 具塞锥形瓶中,精密加人75%甲醇25ml ,密塞,称定重量,超 声处理(功率240W ,频率45kHz )20分钟,放冷,再称定重量, 用75%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法 '分别精密吸取对照品溶液与供试品溶液各 1(^1,注人液相色谱仪,测定,即得。
本品按干燥品计算,含石吊兰素(C 18 H 16 〇 )不得少于0.10%。
饮片【炮制】除去杂质,洗净,切段,干燥。
【性味与归经】苦,温。
归肺经。
【功能与主治】化痰止咳,软坚散结。
用于咳嗽痰多,瘰 疬痰核。
【用法与用置】9〜15g 。
外用适量,捣敷或煎水外洗。
【贮藏】置干燥处。
石决明ShijuemingHALIOTIDIS CONCHA本品为鲍科动物杂色鲍Haliotis diversicolor Reeve 、皱 纹盘鲍 Haliotis discus hannai Ino 、羊鲍 Haliotis ovina Gmelin 、澳洲鲍 Haliotis (Leach)、耳鲍 Haliotis asinina Linnaeus 或白鲍 Haliotis Zaen*贫 (Donovan)的贝壳。
夏、 秋二季捕捞,去肉,洗净,干燥。
《中国药典》2015年版勘误表
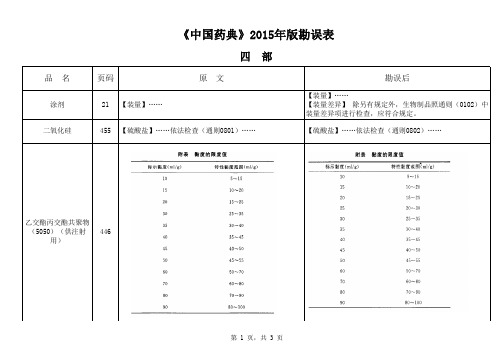
品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……《中国药典》2015年版勘误表四 部乙交酯丙交酯共聚物(5050)(供注射用)446丁香油460【含量测定】测定法 ......另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,......【含量测定】测定法 ......另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量, (465)【折光率】本品的折光率(通则0621)......【折光率】本品的折光率(通则0622) (466)【脂肪酸组成】……进样口温度为206℃,……【脂肪酸组成】……进样口温度为260℃,……大豆磷脂468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ......制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg 、200μg的混合溶液,......【磷脂酰胆碱、磷脂酰乙醇胺含量】 ......制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg 的混合溶液, (469)【微生物限度】……还不得检出大肠埃希和沙门菌。
【微生物限度】……不得检出大肠埃希菌;每10g供试品中不得检出沙门菌。
470【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……木糖醇479【总糖】……取5ml,作为对照品溶液;……【总糖】……取1.0ml,加水至5ml,作为对照品溶液;……正丁醇489【相对密度】 本品的相对密度(通则0612)……【相对密度】 本品的相对密度(通则0601)……交联聚维酮506【含量测定】 ……照氮测定法(通则0704第二法)测定,……【含量测定】 ……照氮测定法(通则0704第一法)测定,……阿拉伯胶516【鉴别】……供试品溶液所显斑点的位置与颜色应与乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
2015年版《中国药典》中有关问题的探讨

2015年版《中国药典》中有关问题的探讨
2015年版《中国药典》中有关问题的探讨
________________________________
2015年版《中国药典》是我国药典编纂和修订的重要一环,它不仅收录了药物本身的各种性质,而且还收录了一些与药物有关的问题。
在本文中,我们将从三个方面对2015年版《中国药典》中有关问题的探讨进行详细的分析。
#### 一、药物名称
2015年版《中国药典》对药物名称的规定是,在列入药典中的药物,应当有一个完整的、可靠的名称,以便消费者和消费者可以更加清楚地了解该药物。
同时,药物名称中不得出现不正确、模糊或引人误解的词语,以及不符合国家相关法律法规的词语。
#### 二、使用方法
2015年版《中国药典》还规定了对于使用方法有关的问题,即使用该药物时,应当遵循科学的使用方法,如选择合适的用法、用量、剂量、用药时间等,避免不必要的危害,以及不当或者错误的使用方法。
#### 三、成分含量
2015年版《中国药典》还对于成分含量有着明确的规定,即所收录的药物中,必须列明该药物中各成分的含量,以便消费者了解该药物的成分,避免使用不当。
总之,2015年版《中国药典》中有关问题的探讨,主要围绕着三个方面进行:一是药物名称;二是使用方法;三是成分含量。
这些内容都是为了保障消费者的权益,使其在使用过程中受到最小的伤害。
《中国药典》2015年版勘误表
《中国药典》2015年版勘误表
大豆磷脂(供注射用)469【微生物限度】取本品,……每1g供试品
中除细菌、霉菌及酵母菌数不得过
100cfu,……
【微生物限度】取本品,……每1g供试品中
除需氧菌总数、霉菌及酵母菌数不得过
100cfu,……
油酸钠528【微生物限度】……,再用预热至45℃的
无菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗
液冲洗二次,每次100ml,取膜,贴膜培养
检查细菌数;……
【微生物限度】……,再用预热至45℃的无
菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗液冲
洗二次,每次100ml,取膜,贴膜培养检查
需养菌总数;……
粉状纤维素551
续表续表
硅化微晶纤维素559【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入钼酸32ml与水
40ml的混合溶液中,……)2ml,……
【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入硝酸32ml与水
40ml的混合溶液中,……)2ml,……
微晶纤维素605
续表
聚山梨酯80(供注射用)625【脂肪酸组成】……。
分别取肉豆蔻酸甲
酯、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸
甲酯、亚油酸甲酯、亚麻酸甲酯以及油酸
甲酯对照品适量,加正庚烷溶解并制成每
1ml中各含0.1g的溶液,……
【脂肪酸组成】……。
分别取肉豆蔻酸甲酯
、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸甲酯
、亚油酸甲酯、亚麻酸甲酯以及油酸甲酯对
照品适量,加正庚烷溶解并制成每1ml中各
含0.01mg的溶液,……。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附 件:
《中国药典》2015年版勘误表
一 部
二 部
蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲
氧基…….
附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)
-8-甲氧基…….
雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules
磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸
钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分
装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷
酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注
射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定
(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则
0101)。
依托度酸666
【检查】有关物质【检查】有关物质
雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为
37.0℃±0.5℃的溶出介质1000ml,
【检查】溶出度 分别取出溶出杯中全部溶液并即时加入
溶出介质1000ml,
水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积
(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部
品 名页码原 文勘误后
涂剂21【装量】……【装量】……
【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……
四 部
乙交酯丙交酯共聚物
(5050)(供注射
用)
446
丁香油460
【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,……【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量,……
465【折光率】本品的折光率(通则0621)……
【折光率】本品的折光率(通则0622)……466【脂肪酸组成】……进样口温度为206℃,……
【脂肪酸组成】……进样口温度为260℃,……
大豆磷脂
468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μ
g的混合溶液,……469【微生物限度】……还不得检出大肠埃希和沙门菌。
【微生物限度】……不得检出大肠埃希菌;每10g供试品
中不得检出沙门菌。
470【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、
100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……木糖醇479【总糖】……取5ml,作为对照品溶液;……【总糖】……取1.0ml,加水至5ml,作为对照品溶液;……
正丁醇489【相对密度】 本品的相对密度(通则0612)……
【相对密度】 本品的相对密度(通则0601)……交联聚维酮506【含量测定】 ……照氮测定法(通则0704第二法)测定,……【含量测定】 ……照氮测定法(通则0704第一法)测定,……
阿拉伯胶516【鉴别】……供试品溶液所显斑点的位置与颜色应与乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
【鉴别】……供试品溶液所显斑点的位置与颜色应与半乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
苯甲醇
519
【细菌内毒素(供注射用)】 ……每1g苯甲醇中含内毒素的量应小于0.1EU。
【细菌内毒素(供注射用)】 ……每1mg苯甲醇中含内毒素的量应小于0.1EU。
活性炭(供注射用)
541【氰化物】……放冷,加盐酸试液1ml……
【氰化物】……放冷,加盐酸1ml……
大豆油
大豆磷脂(供注射
用)
第 11 页,共 11 页。
