有机化学:第四章 炔烃
有机化学 第四章 炔烃
R-C
C-Na + NH3↑
R-C≡C-Na + R/X R/X/
6、聚合反应
Cu2Cl2 2 CH CH NH Cl H2O CH2 CH 4
CH CH CH2 CH Cu2Cl2 NH 4Cl H 2O
C CH
C
C CH CH2
增碳
例: 以乙炔为原料合成下列化合物: (1)Z-3-己烯; (3)醋酸乙烯脂; (2)E-3-己烯;
2) 和卤化氢加成
RC
注:
CH
HX
HgCl2
R
C X
CH2 HX
HgCl2
R
X C X
CH3
① 反应可以停留在卤代烯烃阶段; ② 在催化剂汞盐或铜盐存在时,叁键与HX反应 活性比双键大; ③ 不对称炔烃与HX加成符合马氏规则,对于HBr 有过氧化物效应。
3) 和水加成
RC CH + H2O
HgSO4 H 2SO4 ) (稀
5 4 3 2 1
CH3-CH = CH-C
CH
3-戊烯-1-炔
(不叫 2-戊烯-4-炔)
如对称,优先考虑双键。
HC CCHCH=CH 2 CH 3
6 5 4 3 2 1
3-甲基-1-戊烯-4-炔
HC C-CH2-CH2-CH=CH2
1-己烯-5-炔
§4.3 物理性质(自学) §4.4 化学性质 1、氢化反应 1)催化氢化
RC CR' + H2
催化加氢反应活性:炔烃>烯烃
Ni(Pt , Pd)
RCH
CHR'
Ni(Pt, Pd)
H2
RCH2CH2R'
RC
有机化学-4炔烃

CH3C CCHCH2CH CH2 C2H5 4- 乙基 -1-庚烯 -5-炔
HC C CH CH2 CH3C CCHCH2CH CHCH3 CH CH2
1-丁烯 -3- 炔 5- 乙烯基 -2- 辛烯 -6- 炔
二、炔烃的物理性质
û ³ Ã Æ Ò È ² û È ± ² 1-¶ ¡ È ² 1-Î ì È ² 2-Î ì È ² 3-¼ ³ù » -1-¶ ¡ È ² 1-¼ º È ² 1-· ý È ² 1-Ê ® ° Ë Ì ¼ È ² È µ Û ã / C -81.8 -101.5 -122.5 -98 -101 -124 -80.9 22.5 ²µ Ð ã /C -83.4 -23.3 8.5 39.7 55.5 28(10kPa) 71.4 99.8 180(2kPa) ´ ¶ Ï Ô Ü Ã ¶ È (d20 4 ) 0.618 0.671 0.668 0.695 0.713 0.685 0.719 0.733 0.870
AgNO3
(六)聚合
练习: 1、下列烯烃存在顺反异构的是——
A CH2=C(CH3)2 C CH3CH=CHCH3 2、下列化合物发生亲电加成反应的活性最小的是(
A CH2=CH2 C CH2=C(CH3)2 B CH2=CH2-CH3 D CH2=CHNO2
B CH2=CHCH2CH3 )
3、下列碳正离子最稳定的是( A
乙酸乙烯酯
(四)氧化反应
在强烈条件下氧化时,非端位炔烃生成羧酸(盐),端位炔烃生成羧酸(盐)、 二氧化碳和水。
KMnO4 _COOH + CO +H2O C4H9 C CH 2 C H 4 9 H2O ,OH
炔烃用高锰酸钾氧化,可用于炔烃的定性分析,也可用于推测三 键的位置。
第4章 炔烃

O
HC
CH + CH3C
OH
Zn(OAc)2/活性炭 170~230 °C
O H2C CH O CCH3
乙酸乙烯酯
二、聚合反应 乙炔也能聚合。在不同条件下乙炔可生成链状的二聚
物或三聚物,也可生成环状的三聚物或四聚物。
乙炔的二聚物与氯化氢加成,得到2-氯-1,3-丁二烯 。是合成氯丁橡胶的单体。
三、氧化反应 与C=C双键相似,C≡C三键也被高锰酸钾烟花。
最终的产物是二氧化碳(C≡C三键断裂),高锰酸钾被 乙炔还原生成棕色的二氧化锰沉淀。
如果是非末端炔烃,氧化的最终产物是羧酸(C≡C三键 断裂)。如:
“十二五”职业教育国家规划教材修订版
有机化学
(第六版)
高职高专化学教材编写组 编
Organic Chemistry
第四章 炔 烃
“十二五”职业教育国家规划教材修订版
主要内容
炔烃的通式、同分异构和命名; 炔烃的结构; 炔烃的物理性质; 炔烃的化学性质; 炔烃的制法。
学习目标
了解炔烃的制备方法及炔烃的物理性质; 了解不同杂化状态碳原子电负性的比较; 理解碳原子sp杂化及直线形的空间构型; 理解炔烃的结构; 掌握炔烃的同分异构现象; 掌握炔烃的命名、烯炔的命名; 掌握炔烃的化学性质及其应用。
CH3-CH=CH-C CH
3-戊烯-1-炔 (不叫2-戊烯-4-炔)
第二节 炔烃的结构
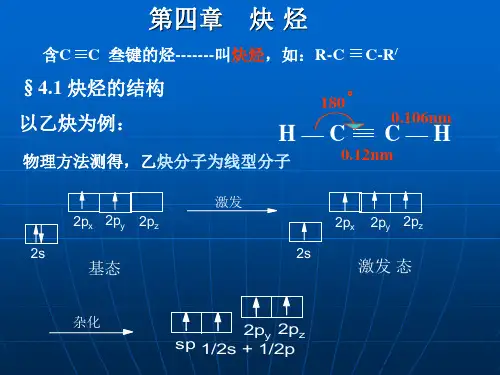
一、乙炔的结构 乙炔(CH≡CH)分子是一个直线形结构,四个原子
都排布在同一直线上。X-光衍射和电子衍射等物理方法 测定,分子中各键的键长与键角如下式所示:
4第四章 炔烃 二烯烃
RCCR` KMnO4 RCOOH + R`COOH
H2O
(2) 缓慢氧化——二酮
OO
CH3(CH2)7CC(CH2)7COOH
KMnO4 H2O
CH3(CH2)7-C-C-(CH2)7COOH
pH=7.5
92%~96%
•利用炔烃的氧化反应,检验叁键的存在及位置
•这些反应产率较低,不宜制备羧酸或二酮.
有机化学 Organic Chemistry 第四章 炔烃 二烯烃
第四章 炔烃 二烯烃
(一) 炔烃
定义:分子中含有碳碳叁键的烃叫做炔烃,它的通式:
CnH2n-2 官能团为: -CC-
4.1 炔烃的异构和命名**
(1)异构体——从丁炔开始有异构体.
•同烯烃一样,由于碳链不同和叁键位置不同所引起的.由 于在碳链分支的地方不可能有叁键的存在,所以炔烃的 异构体比同碳原子数的烯烃要少. •由于叁键碳上只可能连有一个取代基,因此炔烃不存在 顺反异构现象.
炔烃和烯烃一样,也能和卤化氢、卤素等起亲电加成反
应,但炔的加成速度比烯慢
(A) 和卤素的加成
Br2
RC CR
Br
+
RC CR
Br-
反式加成
Br
R
CC
R
Br
卤素的活性F2>Cl2>Br2>I2
Br Br Br2 R C C R
这一反应可用于炔烃的鉴别。
Br Br
控制条件也可停止在一分子加成产物上.
❖加氯必须用FeCl3作催化剂。
•含有双键的炔烃在命名时,一般 先命名烯再命名炔 .
碳链编号以表示双键与叁键位置的两个数字之和最小
为原则。在同等的情况下,要使双键的位次最小。
第4章 炔烃

大连理工大学出版社
25
第4章 炔烃
一、炔化钠的生成——炔烃的制法
有机化学(理论篇)
由表4-2可知,乙炔的酸性强度比氨大很多。乙炔和 RC≡C-H 在液态氨中与氨基钠作用生成炔化钠。
HC
CH
+
液氮 2NaNH2 液氮
RC CNa Na C CNa
+ +
2NH3
RC
CH
+ NaNH2
NH3
大连理工大学出版社
炔烃比相应的烯烃少两个氢原子,官能团为碳碳叁键 (C≡C),通式为CnH2n-2。简单的炔烃化合物有乙炔(C2H2)、丙炔 (C3H4)等。在炔烃分子中,C≡C叁键处于末端的,例如HC≡CH、 RC≡CH,叫做末端炔烃;处于中间的,例如RC≡CR′,叫做非 末端炔烃。在末端炔烃分子(R-C≡C-H)中,叁键上的氢叫 做炔氢。
20
第4章 炔烃
4.加水
有机化学(理论篇)
炔烃在汞催化剂(或铜、锌、镉等非汞催化剂)下加水, 先生成一个很不稳定的烯醇,烯醇很快转变为稳定的羰基化合 物(酮式结构)。这种异构现象称为酮醇互变异构。
C
C OH
C
C O
烯醇式(不稳定)
酮式(稳定)
大连理工大学出版社
21
第4章 炔烃
有机化学(理论篇)
在室温下,以动态平衡同时存在且相互转化的构造异构体 叫互变异构体,这种现象叫互变异构现象。
KMnO4氧化反应可以用作炔烃鉴别反应: (1)KMnO4紫色褪色,表明有不饱和键; (2)根据羧酸的结构,推断原来炔烃的结构。
大连理工大学出版社
28
第4章 炔烃
4.4.4聚合反应
有机化学(理论篇)
有机化学总结:炔烃和二烯烃

CH3
CH3
2,2,5,5-四甲基-3-己炔 2,2,5,5-tetramethyl-3-hexyne
三、炔烃的命名
Ø 同时含有碳碳叁键和
321
CH3
CH
C H
C
CH
3-戊烯-1-炔 3-penten-1-yne
[主链]: 选择含双键叁键在内的最长碳链, 并按其碳原子数称“某
Ø 停留在烯烃产物时:反式加成
Ø 过氧化物效应: 在过氧化物存在下与HBr加成符合反马氏规则。
邻二卤代物
3、加水(水合)--- 制备醛酮
加成方向符合马氏规则 Ø 互变异构(tautomerism):两种异构分子通过质子转移位置而
相互转变。
3、加水(水合)--- 制备醛酮
Hg2+
Hg2+
Hg2+
四、炔烃的物理性质 自学 五、炔烃的化学性质
加成反应、氧化反应
2个π 键
活泼H
炔氢的反应
(一)炔烃的加成反应 1、加氢还原 a、催化加氢(Catalytic Hydrogenation)
RC CH H2 Cat.
Alkyne
RHC CH2 H2 Cat.
Alkene
RCH2CH3 Alkane
Ø 催化剂:Pt、Pd、Ni(催化活性好)。 Ø 一般催化剂不能使反应停留在烯烃。(彻底氢化)
Ø 注意水合产物区别: 乙炔水合产物为乙醛,其他炔烃水合产物均为酮。
Ø 炔烃水合反应机理(了解):
(二)炔烃的氧化反应
羧酸
Ø 应用:鉴别碳碳叁键。 Ø 现象:高锰酸钾的紫色逐渐褪去。
羧酸
(三)炔烃的聚合反应
Cu2Cl2
Ø 应用:合成烯炔化合物。(合成题常考) Ø 注意催化剂条件!
第四章 炔烃
一、炔烃炔烃是分子中含有碳碳叁键的烃,炔烃比相应的烯烃少两个氢原子,通式为C n H2n-2。
4.1炔烃的异构和命名炔烃与二烯烃是同分异构体炔烃的命名同烯烃相似。
4.2炔烃的结构它炔烃中的叁键,也都是由一个σ键和两个π键组成的。
现代物理方法证明,乙炔分子中所有原子都在一条直线上,碳碳叁键的键长为0.12 nm,比碳碳双键的键长短,这是由于两个碳原子之间的电子云密度较大,使两个碳原子较之乙烯更为靠近。
但叁键的键能只有836.8 kJ•mol -1,比三个σ键的键能和(345.6 kJ•mol -1 × 3)要小,这主要是因为p轨道是侧面重叠,重叠程度较小所致。
乙炔分子的立体模型。
由于叁键的几何形状为直线形,叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象,炔烃异构体的数目比含相同碳原子数目的烯烃少。
Kekule 模型 Stuart模型乙炔的立体模型示意图炔烃的系统命名法与烯烃相同,只是将“烯”字改为“炔”字。
例如:CH3C≡CH CH3C≡CCH3(CH3)2CHC≡CH丙炔 2-丁炔 3-甲基-1-丁炔分子中同时含有双键和叁键的化合物,称为烯炔类化合物。
命名时,选择包括双键和叁键均在内的碳链为主链,编号时应遵循最低系列原则,书写时先烯后炔。
CH3-CH=CH-C≡CH CH2=CH-CH=CH-C≡CH 3-戊烯-1-炔 1,3-己二烯-5-炔双键和叁键处在相同的位次时,应使双键的编号最小。
CH≡C-CH2-CH=CH21-戊烯-4-炔(不叫4-戊烯-1-炔 )4.3 炔烃的物理性质简单炔烃的沸点、熔点以及相对密度,一般比碳原子数相同的烷烃和烯烃高一些。
这是由于炔烃分子较短小、细长,在液态和固态中,分子可以彼此靠得很近,分子间的范德华作用力很强。
炔烃分子极性略比烯烃强,不易溶于水,而易溶于石油醚、乙醚、苯和四氯化碳等有机溶剂中。
4.4 炔烃的化学性质炔烃的化学性质和烯烃相似,也有加成、氧化和聚合等反应。
第四章 炔烃和二烯烃
4.1 炔烃
二、炔烃的命名 1. 衍生物命名法
衍生物命名法只适用于简单的炔烃。以乙炔为母体,将其它的炔 烃看作乙炔的衍生物。
例如:
4.1 炔烃
2. 系统命名法
与烯烃的命名类似 ① 要选择含有 C≡C 的最长碳链为主链; ② 编号从最距离叁键最近的一端开始,并用阿位伯数字表示叁键的 位置。例:
837KJ/mol 0.120nm
611KJ/mol 0.134nm 0.108nm
( 3x347=1041)
347KJ/mol
0.154nm 0.110nm
H C C H H2C CH H
H3C C H2 H
原因: ① -C≡C-中有1个σ和2个π键; ② sp 杂化轨道中的 s 成份多。(s 电子的特点就是离核近,即 s 电子
CNa CNa + 2CH3I
CH3C CC2H5 + NaBr
CH3C CCH3 + 2NaI
炔化物作为亲核试剂,也可以与醛酮 发生亲核加成反应,得到 羟基炔化合物:
4.1 炔烃
(3) 过渡金属炔化物的生成及炔烃的鉴定
CH CH + 2Ag(NH3)2NO3 CH CH + 2Cu(NH3)2Cl
4.1 炔烃
③分子中同时含有双键和参键时,先叫烯后叫炔,编号要使双键和
参键的位次和最小。
1 2 3 45
CH C-CH=CHCH3
3-戊烯-1-炔
6 54 3 2 1
CH C-CH=C-CH=CH2
3-乙基-1,3-己二烯-5-炔
CH2CH3
④若双键、叁键处于相同的位次供选择时,优先给双键以最低编号。
4.1 炔烃
第4章 炔烃、二烯烃
碳素酸的弱酸性
Na
+ 2 HC
+
HC
CH
CH
110℃
2 HC
CNa
+H
NH3
2
NaNH2
HC
CNa
+
13
R3C CH
Ka
R3C C
CH
+
44
H
+
物质名称
pKa
HOH
HC
H2 C
CH2
H3 C
CH3
15.7
25
50
端炔酸性的解释 端炔中的碳为sp杂化, 轨道中s成分较大, 核 对电子的束缚能力强, 电子云靠近碳原子, 使分子中的C-H键极性增加, 易断裂:
HC CH
+ 2 Ag(NH3)2NO3
+ 2 Cu(NH3)2Cl
AgC
CAg
+ 2 NH4NO3 + 2 NH3
乙炔银(白色)
HC CH
CuC
CCu
+ 2 NH4Cl + 2 NH3
乙炔亚铜(砖红色)
应用: 区别端炔与非端炔、端炔与烯烃。
RC CH
16
炔化物的生成
注意:炔化银或炔化亚铜在干燥状态下, 受热或震动容易爆炸。实验完毕后 加稀硝酸使其分解。
+
RC
CH2
> RCH
+
CH
22
炔烃的亲电加成
炔烃与烯烃反应活性比较: 炔烃的加成速度比烯烃慢。
加卤素
当化合物中同时含有双键和叁键时, 首先在双键上发生加成反应。
Br2 低温
Br Br
选择性加成
基础有机化学 炔烃与二烯烃
在液氨中用Na或Li还原,主要得反式烯烃。
R C C R
Na-NH3( l ) R
H
C C
H R
烯烃和炔烃的混合物加氢,炔烃先被氢化。
CH2 CH C CH +H2
Pd-BaSO4 喹啉
CH2 CH CH CH2
(2) 亲电加成
首先生成二卤化物,为反式加成,继 加卤素: 续和卤素作用生成四卤化物。
3 共轭效应C(conjugatve effect)
(1) 共轭效应的产生 由于分子中电子离域而产生的电子效应。
共轭体系中,由于轨道间的互相交盖,使共轭
体系中电子云产生离域作用,键长趋于平均化, 分子内能降低、更稳定的现象,称为共轭效应。 静态共轭效应是分子固有的,动态共轭效应 是在发生反应时表现出来的。
CH3CH2Br CH3CH2C CNa 液NH , o CH3CH2C CCH2CH3 C , 3 -33 75%
端炔:
炔烃的鉴定
HC CH 2Ag(NH3)2NO3
AgC CAg
乙炔银(白色)
CH3CH2C CH Ag(NH3)2NO3
HC CH 2Cu(NH3)2Cl
CH3CH2C CAg
丁炔银(白色)
CH2 C CH3
2-甲基-1,3-丁二烯 2-methyl-1,3-butadiene
CH
CH2
CH2 CHCH CHCH CH2
1,3,5-己三烯 1,3,5-hexatriene
两端离双键等距时,从构型为Z的一端开始编号。
2 1 3 4 5 6 (2Z,4E)-2,4-己二烯 (2Z,4Z)-2,4-hexadiene
2p 180°
sp杂化轨道
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
使用特殊的催化剂(如林德拉催化剂,P-2催化剂等) 可使炔烃部分加氢,得到烯烃:
RC CH + H2 lindlar RCH=CH2
炔烃的部分氢化,主要得到顺式烯烃。
P-2催化剂
CH3CH2-C C-CH2CH3 + H2
CH3CH2
CH2CH3
C=C
H
H
lindlar: Pd-CaCO3/HOAc ( Pd沉淀于CaCO3上,再经HOAc处理)
CH
CH + CH3OH
20%KOH水溶液 ,P
在碱性条件下,有:
CH2=CH-OCH3
甲氧基乙烯 or甲基乙烯基醚
CH3OH + KOH
CH3OK + H2O
强亲核试剂
可离解为 CH3O- + K+
CH CH + CH3O-
HC-=CH-OCH3 CH3OH CH2=CH-OCH3 + CH3O-
CH2=CH-CH2-C
CH
+
Br2
乙醚 低温
CH2BrCHBrCH2C CH
4,5-二溴-1-戊炔
4.4.1.2 加卤化氢
X
RC CH HX
R-C=CH2 HX R-C-CH3
X
CH
CH + HCl Cu2Cl2
or HgSO4 HgCl2
H2C=CHCl
氯乙烯
HCl HgCl2
X
H3C-CHCl2
CH3CHC CH CH3
3-甲基-1-丁炔
系统命名法
炔烃的系统命名与烯烃的系统命名规则类似。
步骤:
①要选择含有C≡C的最长碳链为主链;
②编号从最距离三键最近的一端开始,并用阿位伯数字表示
三键的CH3位CH置2C。H2C例H=:CH2
CH3CH2C CCH3
1-戊烯
2-戊炔
CH3CH2CC=HC3HC2H2C CCHC3H3C=CHCH3
1,1-二氯乙烷(有机溶剂)
在过氧化物存在下,炔烃与HBr的加成,同样是按反马氏规 则的方向加成。
CH3(CH2)3C CH + HBr ROOR CH3(CH2)3CH=CHBr
4.4.1.3 加水(符合马氏规则的加成产物)
CH
CH + H2O
H g S O4,稀 H2S O4
98-105 。C
第四章 炔烃(alkyne)
教学重点
1、炔烃和烯炔命名; 2、炔烃的催化加氢、亲电加成反应,硼氢化
反应、氧化反应、臭氧化反应, 3、碱金属炔化物的生成及应用,炔烃的鉴定。
4.1 炔烃的构造异构和命名
炔烃:C4以上的炔烃只有碳链异构和位置异构,无顺反异构。 丁炔的异构体只有:
C4H6: CH C-CH2CH3 1-丁 炔
4.4.2.2 加醋酸
HC
CH
+
CH3COOH
Zn(Ac)2/活性C 170~230oC
H2C
CH
O
O C
CH3
醋酸乙烯酯
4.4.2.3 加氢氰酸
HC CH + H C N CuCl/ NH4Cl
CH2 CH C N 丙烯腈
4.4.3 炔烃的催化加氢
在适当的催化剂作用下,炔烃与氢加成生成烷烃: RC CH + H2 Ni or Pd,Pt RCH2CH3
OH H HC CH
O
重排
H-C-CH3
RC CH + H2O HgSO4,稀H2SO4
OH H RC CH
烯醇式
重排
O
R-C-CH3
酮式
炔烃与水的加成也遵循马氏规则,由于生成的烯醇不稳定, 重排为醛或酮。
乙炔加水,产物为乙醛;其余炔烃加水,产物为酮。
4.4.1.4 硼氢化反应(反马氏规则的加成产物)
CH3
。
CH3(CH2)5C
CH + [(CH3)2CHCH]2BH
0-10 C 二甘醇二甲醚
CH3
CH3(CH2)5CH=CH-B[CHCH(CH3)2]2
H2O2,H2O NaOH
CH3(CH2)5CH=CH OH
反马
CH3(CH2)5CH2CHO
烯醇式重排
辛醛 (70%)
C2H5C
CC2H5
B2H6,0 。C
1 2 3 45
CH C-CH=CHCH3
3-戊烯-1-炔
6
54 3 2 1
CH C-CH=C-CH=CH2
CH2CH3
3-乙基-1,3-己二烯-5-炔
④若双键、叁键处于相同的位次供选择时,优先给双键以最 低编号。
4 32 1
HC C CH=CH2
1-丁烯-3-炔
8 7 65 4 3 2 1
CH3C CCHCH2CH=CHCH3
力强。相对同碳数的烯烃和烷烃,熔点、沸点和密度较大
4.4 炔烃的化学性质
4.4.1 炔烃的亲电加成反应
4.4.1.1 加卤素
炔烃能与两分子卤素加成:
RC CH Cl2 RCCl=CHCl Cl2 RCCl2CHCl2
(or Br2)
(or Br2) (RCBr2CHBr2)
炔烃与卤素的加成比烯烃难。
CH3 2-戊炔
CH3
2-甲基-1-丁烯 2-甲基-2-丁烯
H3C=C2H-C甲H3基丁烯 CH3CHC CH
CH3
CH3
甲基-2-丁烯 3-甲基-1-丁炔 3-甲基丁炔
CH3CHC CH CH3
3-甲基-1-丁炔 3-甲基丁炔
③分子中同时含有双键和叁键时,先叫烯后叫炔,编号要
使双键和叁键的位次和最小。
CH3C CCH3 2-丁 炔
CH3CHC2C5H8CCH3CH3CCHH2C3CHC2CHC325CH8 CCHH3CCHH32CCHH22CC CCCHH3
1-戊炔
1-戊炔2-戊炔
2-戊1炔-戊炔
CH3CH2CH2 2-戊炔
CH3CHC CH CH3
3-甲基-1-丁炔
CH3CHC CH CH3
3-甲基-1-丁炔
CH=CH2
5-乙烯基-2-辛烯-6-炔
4.2 炔烃的结构
2p2 2s2
激发
2p3 2s1
杂化
sp
2py1 2pz1
121pm
HC 180o
CH 106pm
sp
4.3 炔烃的物理性质
HCCH
0.120 nm 08n炔Cm0烃.10分3.71子n4m8CH短nm小12、CH2.细4。窄11,9C.在8。液H态H 和固参态考普普普中化数通通通彼学据CCC此键:CC很H 靠近000键...111,长530449分nnnmmm子间作用
其他用于炔烃部分加氢的催化剂还有:
①Cram催化剂:Pd/BaSO4-喹啉 。 (Pd/BaSO4中加入喹啉); ②P-2催化剂:Ni2B (乙醇溶液中,用硼氢化钠还原醋 酸镍得到)。
二甘醇二甲醚
C2H5 C=C C2H5 B
H
3
顺加!
2C5H。3CC,O6O8H%
C2H5 H
C=C
C2H5 H
顺-3-己烯
H2O2,OHH2O,62%
C2H5CH2CC2H5 O
3-己酮
4.4.2 亲核加成
因为C≡C的电子云更靠近碳核,炔烃较易与ROH、RCOOH、氏规则的加成产物)
