primer 6.0 引物设计教程
引物设计——手把手教新手

②Analyze中,第一项为Key info,点击Selected primers,会给出两条引物的概括性信息,其中包括引物的Tm值,此值Oligo是采用nearest neighbor method计算,会比Primer5中引物的Tm值略高,此窗口中还给出引物的Delta G和3’端的Delta G.3’端的Delta G过高,会在错配位点形成双链结构并引起DNA聚合反应,因此此项绝对值应该小一些,最好不要超过9。
⑤在Primer5窗口中,若觉得某一对引物合适,可以在搜索结果窗口中,点击该引物,然后在菜单栏,选择File-Print-Current pair,使用PDF虚拟打印机,即可转换为Pdf文档,里面有该引物的详细信息。
3、用Oligo验证评估引物
①在Oligo软件界面,File菜单下,选择Open,定位到目的cDNA序列(在primer中,该序列已经被保存为Seq文件),会跳出来两个窗口,分别为Internal Stability(Delta G)窗口和Tm窗口。在Tm窗口中,点击最左下角的按钮,会出来引物定位对话框,输入候选的上游引物序列位置(Primer5已经给出)即可,而引物长度可以通过点击Change-Current oligo length来改变。定位后,点击Tm窗口的Upper按钮,确定上游引物,同样方法定位下游引物位置,点击Lower按钮,确定下游引物。引物确定后,即可以充分利用Analyze菜单中各种强大的引物分析功能了。
引物设计的详细步骤

一、引物设计step by step1、在NCBI上搜索到目的基因,找到该基因的mRNA,在CDS选项中,找到编码区所在位置,在下面的origin中,Copy 该编码序列作为软件查询序列的候选对象.2、用Primer Premier5搜索引物①打开Primer Premier5,点击File—New—DNA sequence,出现输入序列窗口,Copy目的序列在输入框内(选择As),此窗口内,序列也可以直接翻译成蛋白。
点击Primer,进入引物窗口。
②此窗口可以链接到“引物搜索"、“引物编辑"以及“搜索结果”选项,点击Search按钮,进入引物搜索框,选择“PCR primers”,“Pairs”,设定搜索区域和引物长度和产物长度.在Search Parameters里面,可以设定相应参数。
一般若无特殊需要,参数选择默认即可,但产物长度可以适当变化,因为100~200bp的产物电泳跑得较散,所以可以选择 300~500bp。
③点击OK,软件即开始自动搜索引物,搜索完成后,会自动跳出结果窗口,搜索结果默认按照评分(Rating)排序,点击其中任一个搜索结果,可以在“引物窗口”中,显示出该引物的综合情况,包括上游引物和下游引物的序列和位置,引物的各种信息等。
④对于引物的序列,可以简单查看一下,避免出现下列情况: 3'不要出现连续的3个碱基相连的情况,比如GGG或CCC,否则容易引起错配.此窗口中需要着重查看的包括:T m应该在55~70度之间,GC%应该在45%~55%间,上游引物和下游引物的T m值最好不要相差太多,大概在2度以下较好.该窗口的最下面列出了两条引物的二级结构信息,包括,发卡,二聚体,引物间交叉二聚体和错误引发位置.若按钮显示为红色,表示存在该二级结构,点击该红色按钮,即可看到相应二级结构位置图示。
最理想的引物,应该都不存在这些二级结构,即这几个按钮都显示为“None”为好.但有时很难找到各个条件都满足的引物,所以要求可以适当放宽,比如引物存在错配的话,可以就具体情况考察该错配的效率如何,是否会明显影响产物。
引物设计的详细步骤

引物设计是PCR(聚合酶链式反应)技术中的关键步骤,以下是引物设计的详细步骤:选择合适的引物长度:通常选择18-30个核苷酸长度的引物。
引物太短可能降低特异性,
而太长则可能导致非特异性结合。
选择合适的引物GC含量:通常选择40%-60%的GC含量。
GC含量过高或过低都可能
影响PCR的效率。
避免引物二聚体和发夹结构:这些结构可能导致引物自身结合,从而影响PCR的效率。
可以使用软件工具检查引物的这种可能性。
避免引物间的互补:引物之间互补的序列可能导致引物结合,从而影响PCR的效率。
选择合适的引物位置:引物应位于目标基因的特异区域,通常选择基因的编码区。
此外,应避免选择有高突变率的区域,这可能影响引物的特异性。
使用软件进行引物设计:有许多在线和离线软件可以帮助设计PCR引物,如Primer3、Oligo 等。
这些软件可以根据输入的基因序列自动设计和选择最佳的引物。
实验验证:即使通过软件设计的引物看起来很好,也需要在实验中进行验证,以确保其特异性、有效性和可靠性。
引物浓度和退火温度的优化:引物的浓度和退火温度也是PCR的重要参数,需要针对特定的反应条件进行优化。
请注意,对于具体的实验和目的,可能需要更具体和详细的设计考虑,建议咨询相关领域的专家或具有丰富经验的实验员。
引物设计的详细步骤

引物设计的详细步骤详细步骤如下:步骤一:了解引物设计的基本原理引物设计是指为特定的DNA序列设计一对合适的引物,以便在PCR反应中扩增目标DNA序列。
引物是PCR反应的关键组成部分,引物的选择和设计对于PCR扩增的成功率和特异性非常重要。
因此,了解引物设计的基本原理对于有效设计合适的引物至关重要。
步骤二:确定PCR反应的目标序列在设计引物之前,我们需要确定PCR反应的目标序列,即我们需要扩增的DNA区域。
这个目标序列可以是已知的基因序列,也可以是未知的区域。
确定目标序列后,我们可以继续设计引物。
步骤三:确定引物的一些基本参数在设计引物之前,我们需要确定一些基本的参数,以便帮助我们选择合适的引物。
这些参数包括引物的长度、GC含量、Tm值以及避免二聚体形成等。
引物长度:通常来说,引物的长度应在18-25个核苷酸之间。
过长的引物可能导致不特异的扩增产物的形成,而过短的引物则可能导致低扩增效率。
GC含量:引物的GC含量对于引物的稳定性和特异性有影响。
在正常情况下,引物的GC含量应在40%-60%之间。
Tm值:引物的Tm值是指引物在PCR反应中的解离温度。
Tm值过低可能导致非特异的扩增产物的形成,而Tm值过高则可能导致低扩增效率。
避免二聚体形成:在设计引物时,我们还需要考虑引物之间的互补性以及避免引物形成二聚体。
引物之间的互补性可能导致引物形成二聚体,从而降低PCR反应的效率和特异性。
步骤四:选择合适的引物设计工具目前有很多在线引物设计工具可供选择,例如NCBI Primer-BLAST、OligoAnalyzer等。
这些工具可以根据输入的目标序列帮助我们快速选择合适的引物。
此外,还可以使用一些商业引物设计软件,如Primer Premier等。
步骤五:进行引物特异性分析设计好引物后,我们需要进行引物特异性分析,确保引物只扩增目标序列而不扩增其他非特异性产物。
这可以通过BLAST或其他相似性工具来完成。
特异性分析的目的是排除可能存在的非特异性扩增产物,以确保PCR反应的准确性和特异性。
(完整word版)PCR引物流程设计详解
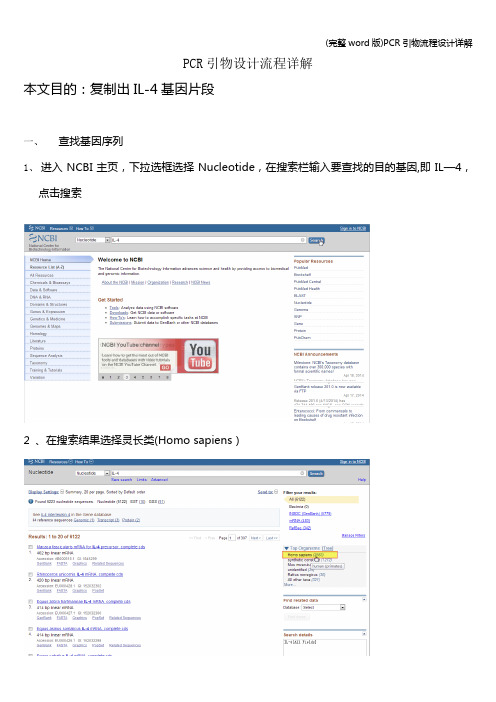
PCR引物设计流程详解本文目的:复制出IL-4基因片段一、查找基因序列1、进入NCBI主页,下拉选框选择Nucleotide,在搜索栏输入要查找的目的基因,即IL—4,点击搜索2 、在搜索结果选择灵长类(Homo sapiens)2、在灵长类IL-4基因中选择需要的mRNA序列3、查看基因的相关信息外显子区域CDs区域4、点击FASTA格式,并将序列保存到文档二、使用primer premier 5。
0设计引物1、建立新文件,将所得的序列复制进输入框内2、点击搜索按钮,搜索引物3、设置引物设计参数(因为在之前查找基因序列的时候获知,外显子区域分别为:1—200、201-248、249-425、426-618,又知在引物设计时引物位置最好跨越一个内含子,PCR产物长度通常为100—150bp,故设定上游引物位置为201—248,下游引物位置为249—425,产物长度为100-150bp)4、确认条件后,显示搜索结果4、双击选中得分最高的引物查看引物情况(上图为上游引物情况,下图为下游引物情况)5、将设计的上下游引物复制出来,保存到文档中三、使用oligo 6.0对设计的引物进行评价1、建立新文件,将从cnki上获得的cDNA复制进输入框,并点击accept接收2、接收后显示出该序列的相关信息3、点击edit按钮录入用primer设计的上游引物,每一次输入新数据后都需要点击accept按钮接收4、同理,录入下游引物5、分析上下游引物二聚体形成情况6、分析上下游引物发卡形成情况7、分析上下游引物GC%8、检测上下游引物与PCR模板其它位置错配情况9、分析PCR整体情况四、引物特异性检验(primer blast)1、进入NCBI主页,并选择blast2、选择primer blast3、在输入框内输入模板序列和上下游引物,并设定对比数据库,点击get primer进行对比4、查看blast结果Blast 结果显示,尽管IL—4与其它基因有相似区,但是引物的3’端没有完全互补。
Oligo6.0软件使用说明

Oligo使用方法介绍作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能:如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo不能直接open的文件格式,如word 文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。
一,普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
我们的目的是以Mouse 4E(2361 bp)为模板,设计一对引物来扩增出600-800bp长的PCR产物。
PrimerPremier使用技巧学习

第27页/共38页
第二十七页,编辑于星期六:十六点 五十一分 。
3个弹出窗口
Melti第n2g8页t/e共m38p页erature
第二十八页,编辑于星期六:十六点 五十一分 。
∆G Internal Stability
第29页/共38页
第二十九页,编辑于星期六:十六点 五十一分 。
Frq为邻近6至7 个碱基组成的亚单位在一个指定数据库文件 中的出现频率。该频率高则可增加错误引发的可能性。
参数选择
突变碱基
第5页/共38页
第五页,编辑于星期六:十六点 五十一分。
第6页/共38页
第六页,编辑于星期六:十六点 五十一分。
第7页/共38页
第七页,编辑于星期六:十六点 五十一分。
Premier的主要功能:
第8页/共38页
第八页,编辑于星期六:十六点 五十一分。
第9页/共38页
第九页,编辑于星期六:十六点 五十一分。
感谢您的观看!
第38页/共38页
第三十八页,编辑于星期六:十六点 五十一分 。
Accept the edit result Return to the main
第21页/共38页window
第二十一页,编辑于星期六:十六点 五十一分 。
第22页/共38页
第二十二页,编辑于星期六:十六点 五十一分 。
第23页/共38页
第二十三页,编辑于星期六:十六点 五十一分 。
第24页/共38页
第二十四页,编辑于星期六:十六点 五十一分 。
第25页/共38页
第二十五页,编辑于星期六:十六点 五十一分 。
酶切位点分析
第26页/共38页
第二十六页,编辑于星期六:十六点 五十一分 。
Oligo6.0软件教程

Oligo使用方法介绍作为目前最好、最专业的引物设计软件,Oligo的功能很强,在这里我们介绍它的一些主要功能:如:普通引物对的搜索、测序引物的设计、杂交探针的设计以及评估引物对质量等等。
在正式进行引物设计前,我们首先面临的一个任务就是向Oligo程序导入模板序列,根据不同的实验情况,导入模板有三种方法:1,直接用键盘输入:a,点击file菜单中的New Sequence 浮动命令,或直接点击工具栏中的New Sequence命令,进入序列展示窗口;b,此时即可键入DNA序列;c,如果需要的话,Oligo提供碱基回放功能,在边键入时边读出碱基,防止输入错误。
点击Edit菜单中的“Readback on”即可。
2,利用复制和粘贴:当我们序列已经作为TXT文件存在或其它oligo 不能直接open的文件格式,如word文件.html格式,这个功能就显得很有用了。
在相应文件中复制序列后在序列展示窗口粘贴,oligo 会自动去除非碱基字符。
当序列输入或粘贴完成后,点击Accept/Discard菜单中的Accept浮动命令,即可进入引物设计模式。
3,如果序列已经保存为Seq格式或者FASTA,GenBank格式时,oligo 就可以直接打开序列文件。
点击File菜单中的“Open”浮动命令,找到所需文件,打开即可。
进入引物设计模式后,oligo一般会弹出三个窗口,分别是6-碱基频率窗口,碱基退火温度窗口以及序列内部碱基稳定性窗口,其中的退火温度窗口是我们引物设计的主窗口,其它的两个窗口则在设计过程中起辅助作用,比如6-碱基频率窗口可以使我们很直观地看到所设计引物在相应物种基因组中的出现频率,如果我们的模板是基因组DNA或混合DNA时,该信息就显得有用了,而内部稳定性窗口则可以显示引物的5’端稳定性是否稍高于3’端等。
一,普通引物对的搜索:以Mouse 4E(cDNA序列)为例。
我们的目的是以Mouse 4E(2361 bp)为模板,设计一对引物来扩增出600-800bp长的PCR产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
primer 6.0 引物设计教程
首先,需要知道基因序列,如,我们要设计rat的 CK18 mRNA 检测的引物,我们先到/ 这个网站查找CK18mRNA的基因序列,
首先选择Nucleotide 然后在搜索栏输入基因序列号(如果不知道基因序列号则输入 rat CK18)如图
然后点击搜索,就会出现rat CK18 mRNA的基因序列
基因序列号现在,往下拉就会看到基因序列
将这个序列复制到primer 6.0中就可以进行引物设计,
我们先打开peimer 6.0
破解版打开会出现这个对话框,关闭即可
点击新建
将序列复制至这个对话框
点击 Add
点击这个图标
出现下面对话框,这里可以选择引物在序列哪些地方设计引物,我一般不更改,也就是引物可以设计在整个序列,你也可查一下序列有几个区,一般引物应该跨两个区。
之后点击 primer Parameters
这里可以设置退火温度、引物长度、产物长度等,我一般只是更改产物长度,我一般设为100到300bp,因为如果产物太大,在染料法中会影响扩增效率,
之后点击 Search 之后出现下面对话框点击OK 出现下面引物序列
这个时候引物设计完成,我们需要对引物进行验证,我一般到NCBI(/)上验证,进去后点击最下面菜单中的BLAST
点击这个图标
点击这个图标之后点击Primer-BLAST
将前引物复制
到图中位置
在这输入前引物
将后引物复制(注复制前引物用 Copy Sense Primer,复制后引
物用Copy Anti-sence Primer 点击右键即出现复制菜单)
后引物放到下图位置
在这输入后引物之后将图中位置的homo sapiens 删除后输入rat
出现上图对话框时选择Rattus(taxid:10114)
之后点击Get Primers
点这里
这时会出现下图情况,因为服务器在国外,请耐心等待
之后出现
他能扩增很多大鼠基因,如CK18 产物为126bp,Ahsg 产物795bp,但是除了CK18 其他基因扩增是产物较大,而且有点突
变,所以在PCR反应时这些东西是扩增不出来的,也就是说这个引物的特异性不错,在扩增时只会扩增出我们需要的CK18这个基因,所以这个引物我们就可以订出去,找公司合成。
有的时候这样的引物也不一定就可以用,所以当我们收到合成好的引物后,可以做一下预实验,看这个引物是否真的可以用,在需要引物时我们也可以到文献中查找,一般发表在全球著名杂志中的外文文献里的引物都是可以用的,查找是要注意文献中用的是染料法还是探针法,探针法的引物在染料法种效果不佳,应该舍弃,选择染料法的引物。
