九年级化学物质转化关系图
各类物质之间的相互转化关系

各类物质之间的相互转化关系天才在于勤奋,聪明在于积累。
本文将复各类物质之间的相互转化关系,包括一个知识网络、两种反应条件、四种离子检验和六种物质性质。
首先,我们需要掌握酸、碱、盐、氧化物之间相互转化关系的网络图,其中包括酸、碱、盐、氧化物、金属和非金属单质等物质之间的相互转化关系。
这个网络图可以用八圈图表示。
其次,我们需要理解两种反应条件。
复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
复分解反应发生的条件是:①对于反应物来说,盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说,要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件是:(1)金属的位记忆口诀:两条纵线通到底,四条横线相联系,六条交叉成网络,17条规律要牢记。
只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2)特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3)盐必须溶于水。
(4)铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
最后,我们需要应用以上规律,总结出制盐的十种方法,包括:(2)~(16)。
举个例子,现有石灰石、水、碳酸钠,我们可以制取烧碱的化学方程式为:CaCO3 + 2NaOH →Na2CO3 + Ca(OH)2.总之,掌握这些知识,我们就能更好地理解各类物质之间的相互转化关系,进而更好地应用于实践中。
例2:用锌粒、盐酸、氧化铁、硫酸铜为原料制取硫酸亚铁,化学方程式为:Fe2O3 + 3Zn + 6HCl → 2FeCl3 + 3ZnCl2 + 3H2OFeCl3 + Zn → Fe + ZnCl22Fe + 3H2SO4 → Fe2(SO4)3 + 3H2Fe2(SO4)3 + 6Zn → 3ZnSO4 + 2Fe + 3ZnSO4 + 3H2O例3:试用七种不同的方法制备氯化锌,化学方程式为:1.Zn + 2HCl → ZnCl2 + H22.Zn + 2HNO3 → Zn(NO3)2 + H2O3.Zn + 2H2SO4 → ZnSO4 + 2H2O + SO24.Zn + 2H3PO4 → Zn(H2PO4)2 + H25.Zn + 2CH3COOH → Zn(CH3COO)2 + H26.Zn + 2HCOOH → Zn(HCOO)2 + H27.Zn + 2HCl + 2NaCl → ZnCl2 + 2NaCl + H2例4:氯化镁、氢氧化镁、碳酸镁和硫酸镁四种物质,都可以跟某物质反应生成同一物质X,X的化学式为Mg(OH)2,化学反应方程式分别为:1.MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl2.Mg(OH)2 + 2HCl → MgCl2 + 2H2O3.MgCO3 + H2SO4 → MgSO4 + H2O + CO24.Mg(OH)2 + H2SO4 → MgSO4 + 2H2O强化试题:一.写出下列一系列变化的化学反应方程式(不得重复)1.(1) Na + Cl2 → 2NaCl2) Mg + 2HCl → MgCl2 + H23) Fe + CuSO4 → FeSO4 + Cu4) CaCO3 → CaO + CO25) H2SO4 + 2NaOH → Na2SO4 + 2H2O6) 2Na + 2H2O → 2NaOH + H27) 2H2 + O2 → 2H2O8) C2H5OH + 3O2 → 2CO2 + 3H2O2.(1) Fe + S → FeS2) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag3) 2Al + 3H2SO4 → Al2(SO4)3 + 3H24) Mg + 2H2O → Mg(OH)2 + H25) 2KClO3 → 2KCl + 3O26) 2NaHCO3 → Na2CO3 + H2O + CO27) 2FeCl3 + SnCl2 → 2FeCl2 + SnCl48) 2H2SO4 + Na2CO3 → Na2SO4 + 2CO2 + 2H2O9) CaO + H2O → Ca(OH)210) CH4 + 2O2 → CO2 + 2H2O11) 2Na + 2H2O → 2NaOH + H212) 2HCl + Mg → MgCl2 + H213) 2K + 2H2O → 2KOH + H214) 2H2 + O2 → 2H2O3.(1) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO42) CaCO3 + 2HCl → CaCl2 + CO2 + H2O3) 2KClO3 → 2KCl + 3O24) 2H2O2 → 2H2O + O25) 2Na + 2H2O → 2NaOH + H26) 2HCl + Zn → ZnCl2 + H27) 2HNO3 + Mg → Mg(NO3)2 + H2O8) Fe + 2HCl → FeCl2 + H29) 2Na + Cl2 → 2NaCl10) 2H2 + O2 → 2H2O11) 2Al + 3H2SO4 → Al2(SO4)3 + 3H212) CaO + H2O → Ca(OH)213) 2K + 2H2O → 2KOH + H214) 2H2 + O2 → 2H2O二.按照反应类型,根据给出的下列物质完成化学方程式1.现有碳酸钙、镁条、盐酸、氧气1) 2HCl + CaCO3 → CaCl2 + CO2 + H2O2) 2Mg + O2 → 2MgO3) Mg + 2HCl → MgCl2 + H24) CaC O3 → CaO + CO22.从铁、生石灰、硫酸铜溶液、烧碱溶液、水和空气中,按下列要求选择反应1) Fe + CaO → FeO + Ca2) CuSO4 + Ca(OH)2 → Cu(OH)2 + CaSO43) 2NaOH + CO2 → Na2CO3 + H2O4) 2NaOH + Fe → Na2FeO2 + H2O3.碱式碳酸铜、石灰石、盐酸、镁条、空气1) CuCO3·Cu(OH)2 + 2HCl → CuCl2 + CO2 + 3H2O2) CaCO3 → CaO + CO23) Mg + 2HCl → MgCl2 + H24) CuCO3·Cu(OH)2 → 2CuO + CO2 + H2O4.从铁、氧气、氢氧化钡、稀硫酸、碳酸钠、氯化钙和碳酸钙中选择适当的物质1) Fe + O2 → FeO22) Ba(OH)2 + H2SO4 → BaSO4 + 2H2O3) Na2CO3 + CaCl2 → CaCO3 + 2NaCl4) CaCO3 + 2HCl → CaCl2 + CO2 + H2O5.用氢、碳、氧、铜、氯五种元素组成的物质,按下列要求写出有水生成的化学方程式:1) Cu + H2SO4 → CuSO4 + H22) C + O2 → CO23) 2H2 + O2 → 2H2O4) H2 + Cl2 → 2HCl1.制取XXX的两种方法:方法一:使用氢氧化钾和稀盐酸反应制取KOHKOH + HCl → KCl + H2O方法二:使用氢氧化钾和硫酸反应制取KOH2KOH + H2SO4 → K2SO4 + 2H2O3.制取难溶性碱的方法:使用高锰酸钾和铁屑/铜粉反应制取难溶性碱2KMnO4 + 3Fe → 5Fe2O3 + K2MnO4 + 2MnO2 + 3O22KMnO4 + 5Cu → 2KOH + 5CuO + 2MnO2 + 3O24.制取可溶性碱的方法:方法一:使用生石灰和硝酸反应制取烧碱Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O方法二:使用石灰石和纯碱以及水反应制取烧碱CaCO3 + 2NaOH → Na2CO3 + Ca(OH)2Ca(OH)2 + 2NaOH → Ca(OH)2 + Na2O + H2O5.制取硫酸亚铁的方法:方法一:使用锌粒和硫酸铜反应制取硫酸亚铁Zn + CuSO4 → ZnSO4 + CuFeSO4 + Zn → ZnSO4 + Fe方法二:使用盐酸和氧化铁反应制取硫酸亚铁Fe2O3 + 6HCl → 2FeCl3 + 3H2OFeCl3 + Zn → Fe + ZnCl26.制取硫酸亚铁的三种方法:方法一:使用氢氧化钠和硫酸反应制取硫酸亚铁NaOH + H2SO4 → Na2SO4 + 2H2OFe + Na2SO4 → Na2Fe(SO4)2方法二:使用氢氧化钠和硫酸铜反应制取硫酸亚铁2NaOH + H2SO4 → Na2SO4 + 2H2OFe + CuSO4 → FeSO4 + Cu方法三:使用氢氧化钠和硫酸铁反应制取硫酸亚铁2NaOH + H2SO4 → Na2SO4 + 2H2OFe + FeSO4 → Fe2(SO4)37.制取氢氧化铁的方法:使用氧化铁和生石灰反应制取氢氧化铁Fe2O3 + 3Ca(OH)2 → 2Fe(OH)3 + 3CaO8.化学反应方程式:NaOH + Mg → Mg(OH)2 + Na2NaOH + 2SO3 → Na2SO4 + H2O2NaOH + CO2 → Na2CO3 + H2O2NaOH + O2 → Na2O2 + H2O9.化学反应方程式:水 + 硝酸银溶液→ AgNO3氯化钡溶液 + 硫酸锌溶液→ ZnSO4 + BaCl2稀硫酸 + 烧碱→ Na2SO4 + H2O纯碱 + 盐酸→ NaCl + H2O10.化学反应方程式:1)Ca(OH)2 + HCl → CaCl2 + 2H2O2)Ba(OH)2 + H2SO4 → BaSO4 + 2H2O 1.生成不支持燃烧气体的反应:2HCl + Zn → ZnCl2 + H2↑2.中和反应生成蓝色溶液:HCl + NaOH → NaCl + H2O3.生成硝酸镁的中和反应:Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O 4.可溶性碱参加的中和反应:H2SO4 + 2NaOH → Na2SO4 + 2H2O5.有沉淀生成的酸和盐的反应:2HCl + Ba(OH)2 → BaCl2↓ + 2H2O6.生成硝酸钡的酸和盐的反应:HNO3 + Ba(OH)2 → Ba(NO3)2↓ + 2H2O 7.难溶盐和酸的反应:HCl + AgCl↓ → AgCl(s) + H2O8.易溶盐和酸的反应(有气体生成):HCl + ZnS → ZnCl2 + H2S↑9.有蓝色沉淀生成的碱和盐的反应:CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO410.有红褐色沉淀生成的碱和盐的反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl11.生成烧碱的复分解反应:Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH12.生成氢氧化镁的复分解反应:MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl13.有双沉淀生成的碱和盐的反应:BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl14.生成硫酸钡的两种盐的反应:Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl15.生成氯化银的两种盐的反应:NaCl + AgNO3 → AgCl↓ + NaNO316.两种物质反应生成一种盐和一种金属:2HCl + Mg → MgCl2 + H2↑选择适当物质写出符合下列要求的一个化学方程式:1.两种物质反应,有不支持燃烧的气体生成:2HCl + Zn → ZnCl2 + H2↑2.两种物质发生中和反应,得到蓝色溶液:HCl + Cu(OH)2 → CuCl2 + 2H2O置换反应:1个复分解反应:2个1.实验室制氢气:Zn + 2HCl → ZnCl2 + H2↑2.生成碱性氧化物的分解反应:Ca(OH)2 → CaO + H2O3.有浅蓝色难溶物质生成的反应:AgNO3 + NaCl → AgCl↓ + NaNO34.生成一种剧毒气体的反应:XXX → NaCl + XXX↑生化学反应,写出有关化学方程式:1.有水生成的化合反应:2H2 + O2 → 2H2O2.氧化铜作氧化剂的置换反应:CuO + H2 → Cu + H2O3.有氯化银和硝酸生成的复分解反应:AgCl + HNO3 → AgNO3 + HClAgNO3 + NaCl → AgCl↓ + NaNO3。
物质的特殊转化关系及框图推断

物质的特殊转化关系及框图推断1.直线型转化关系 A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HClAl(OH)3――→HClAlCl 3 Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOH AlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属,用H 2、C 冶炼金属。
通过反应形式梳理化学反应,培养归纳、整理的能力。
5.抓住化学反应与反应条件的关系多数化学反应需要一定条件,条件不同化学反应也不同。
(1)“催化剂”,无机化学反应需要的催化剂不同,但是根据“催化剂”这一条件,可将氯酸钾分解、双氧水分解、工业合成氨、SO 2催化氧化、氨催化氧化联系起来,形成知识链。
(2)“通电”或“电解”,可以锁定在电解水、氯化钠、氯化镁、氯化铜、硫酸铜、硝酸盐等溶液,熔融氯化钠和氧化铝范围内。
(3)“高温”,常见的有碳酸钙分解、SiO 2和C 的置换反应、制造普通玻璃的反应、铝热反应等。
必修1_物质转化关系图及相应化学方程式

必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
初三化学复习物质转化之三角关系

汇报人:XX
目录
• 物质转化基本概念与原理 • 酸碱盐之间转化关系 • 氧化物、单质和化合物之间转化 • 有机物之间转化关系 • 无机物之间转化关系 • 总结归纳与提高训练
01
物质转化基本概念与原理
物质转化定义及意义
物质转化是指物质之间通过化学反应 相互转化的过程。
典型例题解析与练习
• 练习:下列各组物质在溶液中能大量共存且形成无色 溶液的是( )
• A. NaCl CaCl2 Na2CO3 B. KNO3 HCl Ca(OH)2 • C. H2SO4 FeCl3 NaNO3 D. NaOH HNO3 NH4Cl • 解析:A项中$Na{2}CO{3}$和$CaCl{2}$能发生复分
结构
有机物的结构复杂多样,包括链状、 环状、支链等结构。碳原子之间可以 形成单键、双键和三键,构成不同的 官能团。
有机物之间反应类型及特点
取代反应
有机物分子中的某些原子或原子团被其他原 子或原子团所取代的反应。例如,卤代烃的
水解反应、酯化反应等。
加成反应
有机物分子中加入氧或失去氢的反应。例如 ,醇的氧化生成醛或酮,烯烃的氧化生成环
02
官能团转化
利用有机物的官能团转化规律 ,设计合理的合成路线。例如 ,通过酯化反应将醇转化为酯 ,通过硝化反应将苯转化为硝 基苯等。
03
保护与去保护策略
在合成过程中,对某些敏感官 能团进行保护,以避免不必要 的副反应发生。在合成完成后 ,再通过去保护步骤恢复官能 团的活性。
04
绿色合成策略
在合成过程中,尽量使用环保 的原料和试剂,减少废弃物的 产生和排放,提高合成的原子 经济性。
化剂等。
九年级科学物质的转化规律

检查答案
完成解题后,要仔细检查答案 ,确保答案的准确性和完整性
。
拓展延伸:跨学科综合应用
物理化学综合应用
将物理和化学知识相结合,解决 涉及物质转化和能量变化的问题。
例如,利用热力学原理分析化学 反应的热效应。
生物化学综合应用
将生物和化学知识相结合,解决涉 及生物体内物质转化和代谢的问题。 例如,分析生物体内糖、脂肪和蛋 白质的代谢过程。
典型实验案例分析与讨论
1 2
氢氧化钠与盐酸的中和反应
通过实验观察反应过程中的温度变化、指示剂颜 色变化等现象,分析中和反应的实质和产物。
碳酸钠与盐酸的复分解反应
通过实验观察产生的气体能使澄清石灰水变浑浊 的现象,分析复分解反应的实质和产物。
3
铁与硫酸铜的置换反应
通过实验观察铁钉表面覆盖一层红色物质、溶液 由蓝色变为浅绿色的现象,分析置换反应的实质 和产物。
05 能量变化在物质转化过程 中影响
能量变化原理及类型概述
能量守恒定律
01
在物质转化过程中,能量不会消失也不会创生,只会从一种形
式转化为另一种形式。
能量转化类型
02
包括热能、光能、电能、化学能等多种形式的转化。
能量转化与物质状态变化
03
物质状态变化通常伴随着能量的吸收或释放,如熔化、凝固、
汽化、液化等。
吸热和放热过程对物质转化影响分析
பைடு நூலகம்吸热过程
物质吸收热量,内能增加,可能导致物质状 态变化或化学反应发生。例如,冰融化成水 吸收热量。
放热过程
物质释放热量,内能减少,同样可能导致物质状态 变化或化学反应发生。例如,水凝固成冰释放热量 。
九级化学物质转化关系图

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡1 / 32 /3 ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻CaCO3Na2CO3CO2CO2NaOHNa2CO3CO2O2H2ONaOH NH4ClNH3⑼⑽⑾⑿3 / 3。
初中化学各类物质间的转化关系
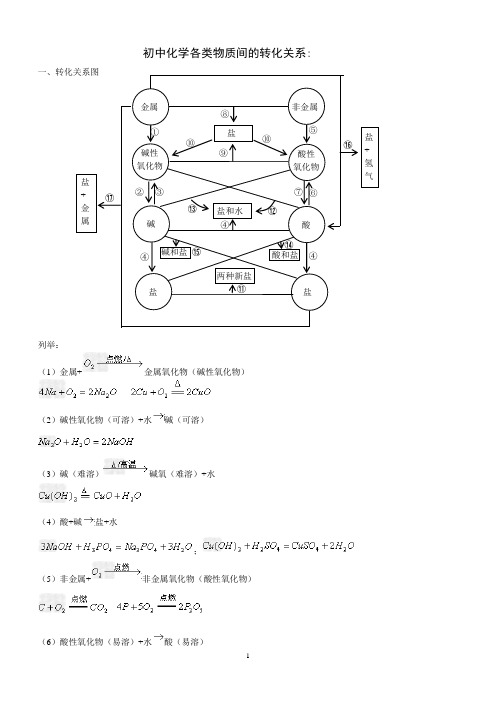
初中化学各类物质间的转化关系:
一、转化关系图
列举: (1)金属+
金属氧化物(碱性氧化物)
(2)碱性氧化物(可溶)+水
碱(可溶)
(3)碱(难溶)
碱氧(难溶)+水
(4)酸+碱
盐+水
;
(5)非金属+
非金属氧化物(酸性氧化物)
(6)酸性氧化物(易溶)+水
酸(易溶)
①
金属 非金属
碱性 氧化物 酸性 氧化物 盐 碱
盐和水 酸
盐
盐
两种新盐
碱和盐 酸和盐 盐+氢 气
盐
+ 金
属
②
③
④
④
④
⑤ ⑥
⑦ ⑧ ⑨
⑩
⑪
⑩
⑫
⑬
⑭
⑮
⑯
⑰
(7)酸(易挥发/难溶)酸氧+水(易挥发/难溶)
从纵向来看,金属碱性氧化物碱盐,其中金属元素相同。
非金属酸性氧化物酸(含氧酸)盐,其中非金属元素相同。
横向:
(8)金属+非金属(无氧酸)盐
(9)碱氧+酸氧(含氧酸)盐
(10)含氧酸盐碱氧+酸氧
(11)盐+盐两种新盐
交叉:
(12)酸+碱氧盐+水
(13)碱+酸氧盐+水
(14)酸+盐新酸+新盐
;
(15)碱+盐新碱+新盐
(16)金属+酸盐+
(17)金属+盐新盐+新金属
(18)金属+盐新盐+新金属
(置换反应)。
九年级上册科学第二章物质的转化难题梳理

物质的转化专题一、物质间的转化规律一些金属氧化物(如氧化钾、氧化钙、氧化钠、氧化钡)可以与水反应生成可溶性碱,但对应的碱不能加热分解生成金属氧化物和水。
难溶性碱(如氢氧化铜)可以加热分解生成金属氧化物和水,但对应的金属氧化物不能与水反应生成相应的碱。
两种情况不能混淆。
铁单质与溶液反应只能生成正二价铁离子(浅绿色),氧化铁与酸反应后的产物中铁元素显正三价(黄色)。
1、下表所列各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是()2、甲、乙、丙、丁四种物质在一定条件下能发生如下反应:甲+乙丙+丁(1)若甲、丙为化合物,乙、丁为单质,则上述反应的基本反应类型是,写出一个符合该反应类型的方程式:。
(2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙为烧碱,则乙的化学式为,反应发生时观察到的现象是。
(3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐,则该反应(“一定”或“不一定”)是中和反应,理由是。
(4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成元素相同的气体,该反应在工业上的用途是。
3、下列物质是初中化学中常见物质,其相互转化关系如图(气体D是一种剧毒性气体,部分生成物和反应条件省略).请回答:(1)物质D的化学式为;(2)溶液H中的溶质属于(选填“单质”、“氧化物”、“酸”、“碱”或“盐”);(3)反应①的化学方程式为,反应②的化学方程式可能是.专题二、C、H2、CO还原金属氧化物在还原金属氧化物实验中,通入的气体(如H2、CO等)要“早出晚归”,这是为了防止可燃性气体与空气混合加热发生爆炸。
酒精灯(或酒精喷灯)要“迟到早退”,这是为了防止反应得到的灼热的金属(如Cu、Fe等)被空气中的氧气重新氧化。
物质制备时要注意一是选择的反应发生的速率要适中,二是反应物是否常见易得,三是生成物易分离。
工业上还应考虑成本。
1、如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是()A. 甲实验试管口向下倾斜可防止氢气逸出B. 乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生C. 甲、乙两实验中,都应先通入气体,再使试管、玻璃管均匀受热,以防止发生爆炸D. 甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应2、用以下装置进行H2、C、CO还原CuO的实验并检验产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、初中化学物质的转化关系
1、氧气、氧化物、酸、氢气、水
H
2
O
KMnO
4↘↓↑↗CO、CO
2
↗SO2 H2SO4
H
2O
2→→P2O5 + Mg Al Zn Fe→ H2→H2O ↘MgO HCl
KClO
3↗↓↘Al
2
O
3 Fe
3
O
4
2、碳与碳的化合物
3、氢氧化钠、碳酸钠、氯化钠
+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)
(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:
↙↗―――――――↘↖
CaCO3→CaO→Ca(OH)2→CaCl2
↖CO2↙
5、氧化钡、氢氧化钡与硫酸钡
↗BaCl 2 → BaSO 4↓(白)
BaO → Ba(OH)2 ↗
↘ + CuS O 4
↘Cu(OH)2↓(蓝)
6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵
CuO ↗ CO 2
↙ ↘ Ca(HCO 3)2 → CaCO 3→CaO
CuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O
↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O
↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 3
7、铝、镁、锌、铁、铜及其化合物
↗ZnSO 4↖ ↗ AlCl 3↖
Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙
Fe Al
↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖
Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al
↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4
Fe(OH)3 Fe 2O 3 ←――――→ Fe
↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)
CO 2 CO C 或O 2 O 2 H 2O H 2O 2 Al 2O 3 AlCl 3 Al CuO CuSO 4
Cu ⑴ ⑵ ⑶ ⑷
MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2 CaCO 3 ⑸ ⑹ ⑺ ⑻ CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH
Na 2CO 3
CO 2 O 2 H 2O NaOH NH 4Cl NH 3 ⑼ ⑽ ⑾ ⑿。
