工业合成氨
31工业合成氨

第二章第四节化学反应条件的优化——工业合成氨【双基回顾】一、合成氨反应的限度合成氨反应是在298k时自发进行的热反应,同时也是气体的物质的量减小的熵反应。
因此,温度、压强将有利于化学平衡向生成氨的方向移动。
研究发现:在一定的温度、压强下,反应物氮气、氢气的体积比为时,平衡混合物中氨的含量最高。
二、合成氨反应的速率(1)在反应过程中,随着氨的浓度的__________,反应速率会逐渐________,因此为了保持足够高的反应速率应适时将_________从混合气体中分离出来。
(2)使用________可以使合成氨的反应速率提高上万亿倍。
(3)温度越高,反应速率越________。
三、合成氨的适宜条件在合成氨生产中,达到高转化率与高反应速率所需条件有时是矛盾的。
因此选择条件时应该寻找以的反应速率获得适当的的反应条件。
此外,还应该考虑原料的价格、未转化的合成气的使用、的综合利用等问题。
目前,合成氨生产一般选择做催化剂;控制反应温度在左右;根据反应器可使用的钢材质量及综合指标来选择,大致分为低压(1×107Pa)、中压(2×107Pa~3×107Pa),和高压(8.5×107Pa~1×108Pa)三种类型。
通常采用氮气与氢气物质的量之比为的投料比。
【考点精练】【考点1】合成氨反应分析【思考】从提高转化率的角度来看,合成氨应该采用什么条件?从提高化学反应速率来看应该采用什么条件?【练习1】合成氨反应的特点是()①可逆②不可逆③正反应放热④正反应吸热⑤正反应气体总体积增大⑥正反应气体总体积缩小A.①③⑤B.②④⑥C.①③⑥D.④⑤⑥【练习2】1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。
下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是()A.①②③B.②④⑤C.①③⑤D.②③④【考点2】合成氨适宜条件的选择【思考】工业上合成氨的适宜条件是什么?【练习1】合成氨工业中,常加热到700 K左右的温度,理由是()①适当提高合成氨的反应速率②提高氢气转化率③提高氨的产率④催化剂在700 K时活性最大A.①B.①②C.②③④D.①④【练习2】根据合成氨反应的特点分析,当前最有前途的研究发展方向是()A.研制耐高压的合成塔B.采用超大规模的工业生产C.研制耐低温复合催化剂D.探索不用H2和N2合成氨的新途径【课堂小测】1.有平衡体系:CO(g)+2H2(g)CH3OH(g)ΔH<0,为了增加甲醇(CH3OH)的产量,应采用的正确措施是()A.高温、高压B.适宜温度、高压、催化剂C.低温、低压D.高温、高压、催化剂2.在一定条件下,可逆反应N2+3H22NH3△H<0达到平衡,当单独改变下列条件后,有关叙述错误的是()A.加入催化剂V正、V逆都发生变化,且变化的倍数相等B.加压,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数C.降温,V正、V逆都减小,且V正减少倍数大于V逆减少倍数D.加入氩气,V正、V逆都增且V正增大倍数大于V逆增大倍数3.在一定温度和压强下,在密闭容器中充入H2、N2、NH3,开始时其物质的量之比为3:1:1,反应达平衡后,H2、N2、NH3的物质的量之比为9:3:4,则此时N2的转化率为()A.10% B.20% C.15% D.30%4.在密闭容器中进行如下反应已达平衡,N2+3H22NH3△H<0,其他条件不变时,若将平衡混合物中各物质的浓度都增大到原来的2倍,则下列说法中正确的是()A.平衡不移动 B.平衡向正方向移动 C.平衡向逆反应方向移动 D.NH3的百分含量增加【课后作业】1.在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%。
合成氨工业剖析合成氨工业的生产原理和重要性

合成氨工业剖析合成氨工业的生产原理和重要性合成氨工业的生产原理和重要性合成氨是一种重要的化工原料,在工业生产中广泛应用于农业、化学工业等领域。
本文将深入分析合成氨工业的生产原理和重要性。
一、合成氨工业的生产原理合成氨工业是通过哈伯-博士过程进行氨的合成。
该过程是将氢气与氮气通过催化剂反应生成氨气的化学反应。
具体来说,合成氨的工业生产主要包括以下步骤:1. 氮气制备:通过气体分离技术,将空气中的氮气与氧气分离,获取纯度较高的氮气,作为合成氨的原料之一。
2. 氢气制备:通常使用天然气或其他烃类作为原料,通过化学反应或水蒸气重整产生氢气,作为合成氨的另一种原料。
3. 反应器:将氮气和氢气按照一定的摩尔比例加入反应器中,使用铁、钴等金属作为催化剂,将氮气和氢气转化为氨气。
该反应需要在高压和适宜的温度下进行。
4. 分离与提纯:将反应后生成的气体混合物进行冷却和压缩,使氨气液化。
然后通过分离、蒸馏等工艺对氨气进行进一步提纯,得到纯度高的合成氨。
二、合成氨工业的重要性合成氨工业在现代化生产中具有极其重要的地位和作用。
以下是它的几个重要方面:1. 农业应用:合成氨是一种重要的化肥原料,广泛用于农业生产中。
它可以作为植物生长所必需的氮元素供给,促进作物的生长发育,提高农作物产量。
合成氨的大规模生产使得农业生产效率大大提高。
2. 化学工业:合成氨是生产化工产品的重要中间体。
它可用于制备尿素、硝酸铵、聚合物等多种化工产品。
尿素作为世界上最常用的氮肥,几乎全部由合成氨制造得来。
合成氨工业的发展与化学工业的发展密切相关。
3. 能源领域:合成氨可用作氢能源的储存和运输介质。
氨是一种高效的氢源,能够提供较高的氢储存密度和易于储存、运输的特点。
通过合成氨工业的发展,为氢能源的应用提供了可靠的支持。
4. 环保意义:合成氨工业的发展也与环境保护息息相关。
通过合成氨工业,可以实现废弃物资源化,减少氮气排放对环境的污染。
同时,合成氨也可以用作脱硫、脱氮等污染物处理的剂量,起到净化环境的作用。
【知识解析】工业合成氨适宜条件的分析
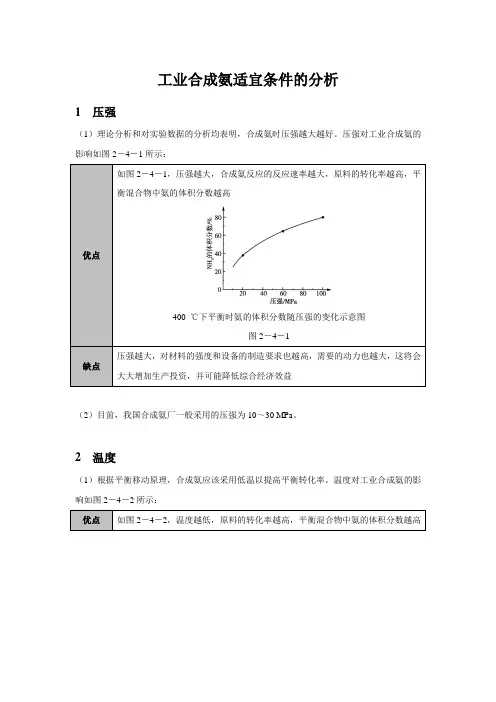
工业合成氨适宜条件的分析1 压强(1)理论分析和对实验数据的分析均表明,合成氨时压强越大越好。
压强对工业合成氨的影响如图2-4-1所示:优点如图2-4-1,压强越大,合成氨反应的反应速率越大,原料的转化率越高,平衡混合物中氨的体积分数越高400 ℃下平衡时氨的体积分数随压强的变化示意图图2-4-1缺点压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益(2)目前,我国合成氨厂一般采用的压强为10~30 MPa。
2 温度(1)根据平衡移动原理,合成氨应该采用低温以提高平衡转化率。
温度对工业合成氨的影响如图2-4-2所示:优点如图2-4-2,温度越低,原料的转化率越高,平衡混合物中氨的体积分数越高10 MPa下平衡时氨的体积分数随温度的变化示意图图2-4-2缺点温度降低会使化学反应速率减小,反应达到平衡所需时间变长,经济效益降低(2)目前,在实际生产中一般采用的温度为400~500 ℃。
3 催化剂(1)目前,合成氨工业中普遍使用的催化剂:铁触媒(以铁为主体的多成分催化剂)。
(2)催化原理:改变反应历程,降低反应的活化能。
如图2-4-3所示:图2-4-3(3)铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择400~500 ℃进行的重要原因。
注意原料气需预先净化,防止原料气中的杂质使催化剂“中毒”。
4 合成氨的生产流程(1)生产流程图2-4-4(2)流程分析①原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性。
②压缩机加压:增大压强。
③热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
④冷却:生成物NH3的液化需较低温度,采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
工业合成氨

工业合成氨
工业合成氨是指通过人工方法在工业过程中合成氨分子的过程。
合成氨是一种重要的化学原料,广泛应用于农业、化工、医药等领域。
工业合成氨的方法主要有两种,一种是哈伯-博希过程,另一种是氨压法。
哈伯-博希过程是最常用的工业合成氨方法,也被称为气相催化合成法。
该过程主要是在高压(100-300atm)和高温(400-500°C)下,使空气中的氮气和氢气通过催化剂(通常是铁或钼)反应生成氨气。
该过程具有能耗高、工艺复杂等特点,但由于其产量大、反应速度快,因此仍然是工业上合成氨的主要方法。
氨压法是另一种工业合成氨的方法,也称为氨合成压缩循环法。
该方法是通过将氮气与燃烧气混合并在高温下反应生成氨气。
反应产生的氨气会被压力吸附器吸附,再通过降压解吸器释放出来。
该方法具有能耗低、工艺相对简单等特点,但产量相对较低。
工业合成氨的应用非常广泛。
氨气可以用于合成化肥,如
尿素、硝酸铵等;还可以用于合成其他化学品,如氨水、
盐酸等;同时还可以应用于制药、冷藏、金属加工等领域。
工业合成氨课件

5、在合成氨反应中,入口气体体 积比 N2:H2:NH3 为6:18:1,出口 气体体积比为9:27:8,则H2的转
化率为___2_5_%___。
起始
N2+3H2 6 18
2NH3 1
施来提高反应速率?
2、压强的选择
①合成氨反应是气态物质系数减小的气体 反应,增大压强既可以增大反应速率,又能使 平衡正向移动,所以理论上压强越大越好。
②但是压强越大,对设备的要求高、压缩 H2和N2所需要的动力大,因此选择压强应符合 实际科学技术。
综合以上两点:根据反应器钢材质量 及综合指标,一般选择中压生产。
弗里茨·哈伯:
给人类带来丰收和 喜悦的天使,用空 气制造面包的圣人。
合成氨反应: N2(g)+3H2(g) 2NH3(g)
假如你是一个合成氨工厂的老板,对工业生 产你会考虑哪些问题?
反应的可能性要强 原料的利用率要高 单位时间内产率高
化学反应的方向性
增大化学反应限度 加快化学反应速率
另外还要考虑生产中的能源消耗、原料 来源、设备条件、环境保护等因素。
(D)合成氨工业采用20 MPa ---- 50MPa ,是因该条 件下催化剂的活性最好
4.已知2SO2(g)+O2(g)
2SO3 (g) △H<0。
催化剂的温度是_4_5_0_℃__。 (2)应采用的压强是__常__压__,理由是__因__为_常__压__下__SO2 __的__转__化_率__已__经__很__高_,__若__采__用__较_大__压__强__,__S_O_2_的__转__化_率_
工业合成氨

• 环保政策的实施对工业合成氨产业的结构调整和转型升
级具有积极推动作用
05
工业合成氨的技术创新与发展趋势
工业合成氨的技术创新方向
提高工业合成氨的环保性能
• 采用环保性能较好的生产工艺,降低环境污染
• 采用先进的污染治理技术,降低污染物排放
提高工业合成氨的生产效率
• 优化生产工艺,降低能源消耗,提高设备性能
需求将继续保持增长
• 机遇主要来自技术创新、市场需求等方面的推动
• 工业合成氨产业将通过技术创新、结构调整等措施,提
高产业竞争力
CREATE TOGETHER
谢谢观看
THANK YOU FOR WATCHING
DOCS
20世纪后期,工业合
成氨产业在全球范围内
得到了快速发展
• 通过高温、高压条件下的氮气与
• 工业合成氨成为当时化学工业的
• 新建的生产装置不断涌现,产能
大
• 这一发明为工业合成氨的大规模
• 随着技术的不断进步,工业合成
• 工业合成氨的生产技术不断创新,
生产奠定了基础
氨的生产成本逐渐降低
工业合成氨产业面临一定的挑战和机遇
• 挑战主要来自环境保护、能源消耗等方面的压力
• 机遇主要来自技术创新、市场需求等方面的推动
⌛️
02
工业合成氨的生产方法及原料
工业合成氨的主要生产方法
传统的工业合成氨生产方法
改进的工业合成氨生产方法
• 采用哈伯-博施工艺,通过高温、高压条件下的氮气与氢
• 采用甲醇制氨、天然气制氨等工艺,降低生产过程中的
• 反应器是工业合成氨生产的核心设备,用于氮气与氢气的反应
过程
工业合成氨公式
工业合成氨公式工业合成氨的化学方程式为:N_2 + 3H_2{高温、高压、催化剂}{===}2NH_3。
一、反应条件。
1. 高温。
- 较高的温度能加快反应速率。
但是温度过高会使平衡向逆反应方向移动(因为合成氨反应是放热反应,根据勒夏特列原理,升高温度平衡向吸热方向移动),所以温度不能过高,工业上一般控制在400 - 500℃左右。
2. 高压。
- 增大压强有利于反应向生成氨的方向进行(根据勒夏特列原理,增大压强平衡向气体体积减小的方向移动,反应前有1体积的氮气和3体积的氢气共4体积气体,反应后生成2体积氨气,反应后气体体积减小)。
但是压强过高对设备要求高,成本增大,工业上一般采用10 - 30MPa的压强。
3. 催化剂。
- 采用铁触媒(以铁为主体的多成分催化剂)作催化剂,可以大大加快反应速率,缩短达到平衡的时间。
二、原料气的制取。
1. 氮气的制取。
- 从空气中分离出氮气。
工业上一般采用先将空气液化,然后根据氮气和氧气沸点的不同进行分离,氮气的沸点为 - 195.8℃,氧气的沸点为 - 183℃。
2. 氢气的制取。
- 通常采用水煤气法,反应方程式为C + H_2O(g){高温}{===}CO + H_2,然后将一氧化碳进一步与水蒸气反应转化为二氧化碳和氢气,反应方程式为CO +H_2O(g){催化剂}{===}CO_2+H_2,最后通过分离除去二氧化碳得到氢气。
三、合成氨的意义。
1. 氨是一种重要的化工原料,可用于生产氮肥(如尿素、铵盐等),提高农作物的产量,对解决全球粮食问题有着重要意义。
2. 氨还可用于生产硝酸等其他化工产品,在化工生产中有着广泛的应用。
化学反应条件的优化――――工业合成氨
化学反应条件的优化――――工业合成氨[知识要点]:一、合成氨的化学平衡分析:工业合成氨是可逆反应:N2 (g) + 3 H2 (g) 2 NH3 (g) 已知298K时△H=-92.2KJ·mol-1△S=-198.2 J·K―1·mol―1可知,该反应在298K时是一个能进行的反应,同时也是气体的物质的量的减反应。
[结论] 因此温度压强将有利于化学平衡向生成的方向移动,在一定的温度、压强下,反应物氮气、氢气的体积比为时,平衡混合物的氨的含量最高。
二、合成氨的反应速率分析:特定条件下,合成氨反应的速率与参与反应的物质的浓度关系为v=kC (N2)C1.5(H2)C―1(NH3),可知,合成氨反应的速率与氨气浓度的次方成,在反应过程中,随着氨气的浓度的增大,反应速率会逐渐,因此为保持足够高的反应速率,应适时将从混和气中分离出来。
使用___________可以使合成氨反应的速率提高上万亿倍,此外温度越高,反应速率。
[结论] 有利于提高合成氨反应速率的措施有:①提高反应温度②使用催化剂③适当提高氮氢比④适时分离反应产物氨三、提高合成氨反应的平衡转化率和反应速率的措施四、实际生产中采取的措施:目前,合成氨生产中一般选择作为催化剂。
控制反应温度在左右,根据反应器可使用的钢材质量及综合指标来选择压强,大致可分为(1×107Pa)、(2×107~3×108Pa)、(8.5×107~1×108Pa)三种类型,通常采用氮气与氢气物质的量之比为的投料比。
且氮气氢气循环使用。
目前的工艺条件下,合成氨厂出口气的氨含量一般为。
五、合成氨生产流程合成氨的整个工业生产包括造气、净化、合成氨三大部分氮气来自于空气,将空气,先得液态,气体为造气氢气来自于含氢的天然气,煤、炼油产品,反应可表示为净化目的氨的分离(方法将液化)合成氨氮气、氢气的循环使用反馈练习1、合成氨工业的生产中,应采取的适宜条件是()A、高温高压B、适宜的温度,高压催化剂C、低温低压D、高温,高压催化剂2、在一定温度和压强下,合成氨反应达到平衡时,下列操作不会使平衡发生移动的是()A、恒温恒压时充入氨气B、恒温恒容时充入氮气C、恒温恒容时充入氦气D、恒温恒压时充入氦气3、工业合成氨一般采用700K左右的温度,其原因是()①适当提高氨的合成速率②提高氢气的转化率③提高氨的产率④催化剂在700K时活性最大A、①B、①②C、②③④D、①④4、在合成氨工业中,达到下列目的的变化过程中与平衡移动无关的是()A、为增加NH3的日厂量,不断将NH3分离出来B、为增加NH3的日产量,使用催化剂C、为增加NH3的日产量而采用1×107Pa~1×108Pa 的压强D、为增加NH3的日产量,采用700K左右的高温5、二氧化氮存在下列平衡:2NO2(g)N2O4(g)(正反应为放热反应)。
工业合成氨课件
c1.5(H2)]成正比关系,与生成物浓度[c(NH3)]成反比关系。
由此在一定温度、压强下,可采取增大反应物浓度、减
小生成物浓度来提高化学反应速率。另外还可采取升高温度, 使用合适的催化剂降低反应活化能来增大反应速率常数K加 快反应速率。 答案:见分析
2.合成氨工业生产中,为什么要采用分离产物,将原料气
3 0 3x 2x 3-3x 2x
1-x
2x 得: ×100%=26.4% 2x+1-x+3-3x x=0.418 0.418 mol α(N2)= 1 mol ×100%=41.8%。
(4)增大反应浓度或降低产物浓度有利于平衡右移;低 温时虽然有利于化学反应正向进行,但速率较小,为提高
化学反应速率,500℃时加入合适的催化剂(铁),既提高化
离出 NH3 。
四、反应流程
1.实验研究表明,在特定条件下,合成氨反应的速率与参
与反应的物质的浓度的关系式为:v=k· c(N2)· c1.5(H2)· c-
1(NH 3),请你根据该关系式分析,各物质的浓度对反应速
率有哪些影响?可以采取哪些措施来提高反应速率? 分析:由合成氨反应的化学反应速率公式可知,在一定 温度、压强下,化学反应速率与反应物浓度[c(N2)或
[解析]
A项,混合气进行循环利用,原子利用率高,
符合绿色化学思想;B项,分离液氨不能加快反应速率,主 要是利于平衡正向移动,提高原料利用率;C项,压缩混合
气(加压)利于平衡正向移动;D项,催化剂能加快反应速率,
对平衡无影响。 [答案] B
合成氨流程中的每个环节的总旨是:增大产率、降低成
本、增大效益。
衡混合物中NH3含量的变化情况。 达到平衡时平衡混合物中NH3的含量(体积分数)[投料 V(N2)∶V(H2)=1∶3]
工业合成氨化学方程式
工业合成氨化学方程式
工业合成氨的化学方程式:N(g)+3H(g)=2NH(g)(可逆反应)。
工业制氨绝大部分是在高压、高温和催化剂存在下由氮气和氢气合成制得。
氮气主要来源于空气;氢气主要来源于含氢和一氧化碳的合成气(纯氢也来源于水的电解)。
由氮气和氢气组成的混合气即为合成氨原料气。
n2(g)+3h2(g)=2nh3(g)
1、生产能力和产量合成氨就是化学工业中产量非常大的化工产品合成氨工业,年,世界合成氨的生产能力为mt氨,但因原料供应、市场需求的变化,合成氨的产量并不等于生产能力必须高。
合成氨产量以俄罗斯、中国、美国、印度等十国最低,占到世界总产量的.一半以上。
2、消费和用途。
合成氨主要消费部门为化肥工业,用于其他领域的(主要是高分子化工、火炸药工业等)非化肥用氨,统称为工业用氨。
3、原料。
合成氨主要原料存有天然气、石脑油、重质油和煤等。
年,世界以天然气制氨的比例约占到71%,苏联为92.2%、美国为96%、荷兰为%;中国仍以煤、焦炭为主要原料制氨,天然气制氨仅占到20%。
70年代原油涨价后,一些使用石脑油为原料的合成氨老厂转用天然气,新建厂绝大部分使用天然气并作原料。
4、生产方法。
生产合成氨的方法主要区别在原料气的制造,其中最广泛采用的为蒸汽转化法和部分氧化法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
温度 催化剂
浓度
练习 1.1913年德国化学家哈伯发明了以低成 本制造大量氨的方法,从而大大满足了当时日益增长 的人口对粮食的需求。下列是哈伯法的流程图,其中
为提高原料转化率而采取的措施是( B )
A.①②③ C.①③⑤
B.②④⑤ D.②③④
不同压强SO2的转化率(%)
1.0×105Pa 5.0×105Pa 1.0×106Pa 5.0×106Pa 1.01×107Pa
③使用催化剂
④增大CO的浓度
A. ①②③
⑤增大水蒸气的浓度
C. ①⑤ D. ⑤
B. ④⑤
三、合成氨反应的速率
影响合成氨反应的速率的因素有哪些?从反应速率角度 考虑应选择什么条件?
温度 压强 浓度 催化剂
高温 高压 增大N2、H2浓度 Fe(铁触媒)
四、合成氨的适宜条件
条件 压强 工业合成氨的适宜条件 在设备条件允许的前提下,尽量采取高 压(1×107~1×108Pa) 700K,考虑速率,催化剂的适宜温度(该 温度下催化剂活性最大) 铁做催化剂 不断的补充反应物,及时的分离出产物, N2、 H2的物质的量之比1:2.8
工业合成氨
工业合成氨: N2(g)+3H2(g)=2NH3(g) △ S=-198.2J/(K ·mol) △ H=-92.2KJ/mol
合成氨反应的特点:Βιβλιοθήκη 1.可逆反应2. 放热反应
3.气体体积减小的反应
利用所学理论分析工业合成氨的适宜条件?
一、合成氨反应的方向
△H-T△S=-92.2kJ· mol-1+298K×198.2J· K - 1· mol-1 =-33.1kJ· mol-1<0, 故该反应在298K时能自发进行
(1)从理论上分析,为了使二氧化硫尽可能转化为 三氧化硫,可控制的反应条件是 常压、450 ℃、催化 剂。 (2)实际生产中,选定400℃~500℃作为操作温度 其原因是:在此温度下催化剂的活性最高。 (3)实际生产中,采用的压强为常压,其原因是在 常压下SO2的转化率就已经很高了(97.5%),若采用高 压,平衡能向右移动,但效果并不明显,比起高压设 备,得不偿失。 (4)在生产中,通入过量空气的目是增大反应物O2 的浓度,提高SO2的转化率。 (5)尾气中有SO2必须回收是为了防止污染环境。
二、合成氨反应的限度
影响合成氨反应的限度的因素有哪些?从反应限度角度 考虑应选择什么条件?
温度
低温
压强
浓度
高压
N2:H2=1:3
练习 1.合成氨所需要的氢气可由煤与水反应制得,
其中有如下反应:CO(g)+H2O(g) ( C)
①降低温度 ②增大压强
CO2(g)+H2(g)
,△H﹤0. 欲提高CO的转化率可采用的方法是
450℃ 97.5%
98.9%
99.2%
99.6%
99.7%
500℃ 85.5%
92.9%
94.9%
97.7%
98.3%
已知2SO2(g)+O2(g) 2SO3 (g) △H<0 其实验数据见表 (1)从理论上分析,为了使二氧化硫尽可能转化为三氧 化硫,可控制的反应条件 。 (2)实际生产中,选定400℃~500℃作为操作温度其原 因是 。 (3)实际生产中,采用的压强为常压,其原因是 。 (4)在生产中,通入过量空气的目是 。 (5)尾气中有SO2必须回收是为了 。
化学反应条件的优化
——工业合成氨
【课标要求】 1.运用温度、浓度、压强和催化剂对化学反应速率的 影响规律解释生产、生活、实验室中的实际问题,能 讨论化学反应条件的选择和优化。 2.针对典型案例,能从限度、速率等角度对化学反应 和化工生产条件进行综合分析。 【学习目标】 1.掌握应用化学反应速率和化学平衡原理,选择合成 氨的适宜条件。 2.初步学会应用化学原理选择化工生产条件的思想和 方法。
