2019届二轮复习电解池的串联问题作业(全国通用)
2020届二轮复习 电化学 专题卷(全国通用) (1)

专题突破电化学一、选择题(本题包括8个小题,每小题8分,共64分)1.(2019黑龙江大庆实验中学高三上学期开学考试)有关下列四个常用电化学装置的叙述正确的是()A.图Ⅰ所示电池中,MnO2的作用是催化剂B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag2.(2019四川成都高三一诊)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。
下列分析错误的是()A.防腐原理主要是避免发生反应:2Fe+O2+2H2O2Fe(OH)2B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池C.采用外加电流的阴极保护法时需外接镁、锌等作辅助阳极D.钢构件可采用不锈钢材料以减缓电化学腐蚀3.(2018山东烟台高三诊断性测试)下列装置一定能证明2Ag++2I-2Ag+I2能否自发进行的是()4.(2019天津武清区大良中学高三月考)燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。
下列说法正确的是()A.M极生成氮气且电极附近pH降低B.负极上每消耗1 mol N2H4,会有2 mol H+通过质子交换膜C.正极的电极反应式为O2+2H2O+4e-4OH-D.电极M是原电池的正极5.(2019广东佛山普通高中教学质量检测)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。
总反应为CO(NH2)2+H2O3H2↑+N2↑+CO2↑。
下列说法中错误的是()A.a为阳极,CO(NH2)2发生氧化反应B.b电极反应为2H2O+2e-H2↑+2OH-C.每转移6 mol电子,a电极产生1 mol N2D.电解一段时间,a极区溶液pH升高6.(2019湖南衡阳高三联考)“ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示,隔开两极的陶瓷管作钠离子导体。
微专题 电化学“多池和多室”串联问题及计算(解析版)

微专题电化学“多池和多室”串联问题及计算1(2023·湖北·统考高考真题)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。
该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为xmol⋅h-1。
下列说法错误的是A.b电极反应式为2H2O+2e-=H2↑+2OH-B.离子交换膜为阴离子交换膜C.电解时海水中动能高的水分子可穿过PTFE膜D.海水为电解池补水的速率为2xmol⋅h-1【答案】D【解析】由图可知,该装置为电解水制取氢气的装置,a电极与电源正极相连,为电解池的阳极,b电极与电源负极相连,为电解池的阴极,阴极反应为2H2O+2e-=H2↑+2OH-,阳极反应为4OH--4e-=O2↑+2H2O,电池总反应为2H2O 通电=2H2↑+O2↑。
A.b电极反应式为b电极为阴极,发生还原反应,电极反应为2H2O+2e-=H2↑+2OH-,故A正确;B.该装置工作时阳极无Cl 2生成且KOH浓度不变,阳极发生的电极反应为4OH--4e-=O2↑+2H2O,为保持OH -离子浓度不变,则阴极产生的OH -离子要通过离子交换膜进入阳极室,即离子交换膜应为阴离子交换摸,故B 正确;C .电解时电解槽中不断有水被消耗,海水中的动能高的水可穿过PTFE 膜,为电解池补水,故C 正确;D .由电解总反应可知,每生成1molH 2要消耗1molH 2O ,生成H 2的速率为xmol ⋅h -1,则补水的速率也应是xmol ⋅h -1,故D 错误;答案选D 。
2(2022·山东·高考真题)设计如图装置回收金属钴。
保持细菌所在环境pH 稳定,借助其降解乙酸盐生成CO 2,将废旧锂离子电池的正极材料LiCoO 2(s )转化为Co 2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。
已知电极材料均为石墨材质,右侧装置为原电池。
下列说法正确的是A.装置工作时,甲室溶液pH 逐渐增大B.装置工作一段时间后,乙室应补充盐酸C.乙室电极反应式为LiCoO 2+2H 2O +e -=Li ++Co 2++4OH -D.若甲室Co 2+减少200mg ,乙室Co 2+增加300mg ,则此时已进行过溶液转移【答案】BD【解析】A .电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO 2气体,同时生成H +,电极反应式为CH 3COO --8e -+2H 2O =2CO 2↑+7H +,H +通过阳膜进入阴极室,甲室的电极反应式为Co 2++2e -=Co ,因此,甲室溶液pH 逐渐减小,A 错误;B .对于乙室,正极上LiCoO2得到电子,被还原为C o 2+,同时得到Li +,其中的O 2-与溶液中的H +结合H 2O ,电极反应式为2LiCoO 2+2e -+8H +=2Li ++2Co 2++4H 2O ,负极发生的反应为CH 3COO --8e -+2H 2O =2CO 2↑+7H +,负极产生的H +通过阳膜进入正极室,但是乙室的H +浓度仍然是减小的,因此电池工作一段时间后应该补充盐酸,B 正确;C .电解质溶液为酸性,不可能大量存在OH -,乙室电极反应式为:LiCoO 2+e -+4H +=Li ++Co 2++2H 2O ,C 错误;D .若甲室Co 2+减少200mg ,则电子转移物质的量为n (e -)=0.2g 59g /mol ×2=0.0068mol ;若乙室Co 2+增加300mg ,则转移电子的物质的量为n (e -)=0.3g 59g /mol×1=0.0051mol ,由于电子转移的物质的量不等,说明此时已进行过溶液转移,即将乙室部分溶液转移至甲室,D 正确;故合理选项是BD 。
专题09 串联电解池(选择题)-高考化学二轮热点题型(全国通用)(解析版)

专题09串联电解池(选择题)目录一、热点题型归纳【题型一】外接电源与电解池的串联【题型二】原电池与电解池的串联二、最新模考题组练【题型一】外接电源与电解池的串联【典例分析】例1.在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是A.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6gB.电解过程中丙中溶液酸碱性无变化C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态D.乙中左侧电极反应式:2+-Cu+2e=Cu【答案】C【解析】通电片刻即发现乙装置左侧电极表面出现红色固体,则此红色固体为Cu,即乙装置左侧为阴极,右侧为阳极;甲装置中,左侧电极为阴极,右侧电极为阳极;丙装置中,左侧电极为阴极,右侧电极为阳极。
A.标准状况下当甲中产生4.48L气体时,甲中为电解氯化钾溶液产生氢气和氯气,则各产生0.1mol,转移电子数为0.2mol,丙中Cu电极上银离子得电子产生银单质,质量增加0.2mol 108g/mol=21.6g,A正确;B.在丙装置中,阳极Ag-e-=Ag+,阴极Ag++e-=Ag,所以电解过程中丙溶液pH无变化,B正确;C.甲中阳极生成Cl2,阴极生成H2,相当于从溶液中逸出HCl气体,若向甲中加入适量的盐酸,则加入了水,溶液浓度减小,不能恢复到电解前的状态,C不正确;D.乙中左侧铜离子放电,电极反应式:Cu2++2e-=Cu,D正确。
【提分秘籍】1.与原电池正极同侧相连的电极为电解池的阳极,与负极同侧相连的电极为阴极。
2.电极反应式的书写:根据阳极材料和电解质溶液的性质进行书写。
【变式演练】变式1.如图所示的装置,C、D、E、F、X、Y都是惰性电极。
将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
则以下说法正确的A.电源B极是正极B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:1:2:2C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷【答案】D【解析】通电片刻即发现乙装置左侧电极表面出现红色固体,则此红色固体为Cu,即乙装置左侧为阴极,右侧为阳极;甲装置中,左侧电极为阴极,右侧电极为阳极;丙装置中,左侧电极为阴极,右侧电极为阳极。
高考化学大二轮复习 专题8 电化学基础

课件ppt
4错误认为电解质溶液导电的原因是电子通过了电解质溶 液,在原电池内部和电解池内部,都没有电子的流动,而是离 子的移动。实际上在闭合的电路中电子只走“陆路”导线或电 极,离子只走“水路”电解质溶液。
课件ppt
2. 电解池:
课件ppt
(1)电解时,a 极是 阴 极,电极反应式为Cu2++2e-===Cu; b 极发生氧化反应,电极反应式为 4OH--4e-===2H2O+O2↑ ; 电解总反应化学方程式为
电解 2CuSO4+2H2O=====2Cu+O2↑+2H2SO4 。
课件ppt
(2)电解完成后,若溶液的体积为 2 L,整个电解过程中共转 移 0.2 mol e-,则溶液的 pH 为 1 ,若使电解质溶液复原,需 加入 CuO 的物质的量为 0.1 mo
课件ppt
课件ppt
Z主干整合•认知盲区清
课件ppt
一、原电池和电解池 1. 原电池:
[串联拾忆]
课件ppt
(1)上述装置中能形成原电池的是 B ,该原电池工作时, 负极发生 氧化反应 ,电极反应式为 Fe-2e-===Fe2+;
正极发生 还原反应,电极反应式为2Ag++2e-===2Ag; 电池总反应式为 Fe+2Ag+===Fe2++2Ag 。
答案:A
课件ppt
电化学原理中易忽视的问题 (1)错误地根据“异性相吸”的电性理论,认为在原电池中 电解质溶液中的阳离子移向负极,阴离子移向正极。其实在原 电池工作时,阳离子移向正极,阴离子移向负极。在电解池 中,电子由电源负极流向阴极,由阳极流向电源正极。
原电池和电解池串联专题 - 含答案
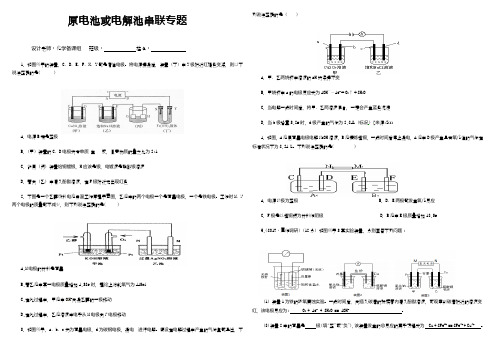
原电池或电解池串联专题设计老师:化学备课组班级:姓名:1.如图所示的装置,C、D、E、F、X、Y都是惰性电极。
将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是( )A.电源B端是正极B.(甲)装置的C、D电极均有单质生成,且其物质的量之比为2:1C.欲用(丙)装置给铜镀银,H应该是银,电镀液是硝酸银溶液D.若向(乙)中滴入酚酞溶液,在F极附近先出现红色2.下图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极。
工作时M、N 两个电极的质量都不减少,则下列说法正确的是( )A.M电极的材料是石墨B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448mlC.在此过程中,甲池中O H-向通乙醇的一极移动D.在此过程中,乙池溶液中电子从M电极向N电极移动3.如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。
假设在电解过程中产生的气体全部逸出,下列说法正确的是()A.甲、乙两烧杯中溶液的pH均保持不变B.甲烧杯中a的电极反应式为4OH――4e-=O2↑+2H2OC.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀D.当b极增重3.2g时,d极产生的气体为2.24L(标况)[来源:Zxx4.如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24 L。
下列说法正确的是( )A.电源N极为正极 B.D、E两极都发生氧化反应C.F极是以粗铜板为材料作阴极 D.B池中E极质量增加12.8g5.(2019·焦作调研)(12分)如图所示3套实验装置,分别回答下列问题:(1)装置1为铁的吸氧腐蚀实验。
一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为: O2 + 4e- + 2H2O == 4OH-。
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为 Cu + 2Fe3+== 2Fe2+ + Cu2+。
原电池、电解池串联分析(选择提升专练)

高考化学二轮复习12题题型各个击破——原电池、电解池串联分析(选择提升专练)1.一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。
该装置工作时,下列说法不正确的是()A. 甲为正极,丙为阴极B. 丁极的电极反应式为MnO42−−e−===MnO4−C. KOH溶液的质量分数:c%>a%>b%D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4mol K+移入阴极区2.某研究小组拟用惰性材料为电极,电解法处理硝酸铵废水以获得化工产品氨水、硝酸,装置如图所示。
下列说法正确的是()A. 电极b为负极,X气体为H2B. 膜1为阴离子交换膜C. 电极A的电极反应式为2H2O+NH4++2e−=2NH3⋅H2O+H2↑D. 电路上通过2mol电子,原料室中废水质量减小80g3.某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
一段时间后,断开电键K。
下列物质能使乙池恢复到反应前浓度的是()A. CuB. CuOC. Cu(OH)2D. Cu2(OH)2CO34.如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。
下列说法正确的是()A. 闭合开关K时,电极B为负极,且电极反应式为2Br−−2e−=Br2B. 装置(Ⅰ)放电时,总反应为2Na2S2+Br2=Na2S4+2NaBrC. 装置(Ⅰ)充电时,Na+从左到右通过阳离子交换膜D. 该装置电路中有0.1mol e−通过时,电极X上析出3.2g Cu5.下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72−废水,电解过程中溶液发生反应:Cr2O72−+6Fe2++14H+=2Cr3++6Fe3++7H2O。
电解池练习题及答案解析

4-3-1《电解池》课时练双基练习1.下列关于电解池工作原理的说法中,错误的是( )A.电解池是一种将电能转变成化学能的装置B.电解池中使用的液体只能是电解质溶液C.电解池工作时,阳极发生氧化反应,阴极发生还原反应D.与原电池不同,电解池放电时,电极本身不会参加电极反应答案:BD2.如图中X、Y分别是直流电源的两极,通电后发现,a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是( )液中含有不活泼金属离子。
又排除B。
b极板处有无色无臭气体放出,说明溶液中无Cl-,排除D。
答案:A3.①电解是将电能转化为化学能;②电能是将化学能转变成电能;③电解质溶液导电是化学变化,金属导电是物理变化;④不能自发进行的氧化还原反应可通过电解的原理实现;⑤任何物质被电解时,必导致氧化还原反应发生。
这五种说法中正确的是( )A.①③④⑤ B.②③⑤C.③④ D.①②解析:电解即是把电能转化为化学能,故①对②错,在电解过程中,电解质导电时会发生氧化还原反应,而这一过程需要有外加电源,金属导电时是电子的定向移动,属物理变化,故③④⑤正确。
答案:A4.电解100 mL含c(H+)= mol/L的下列溶液,当电路中通过 mol 电子时,理论上析出金属质量最大的是( )A. mol/L Ag+B. mol/L Zn2+C. mol/L Cu2+D. mol/L Pb2+解析:本题考查电解基本原理及计算。
选项A,根据离子放电能力,首先是Ag+在阴极获得电子产生 mol Ag,即1.08 g Ag。
选项B,首先是H+在阴极获得电子产生 mol H2,然后Zn2+获得 mol电子,产生 mol Zn,即0.325 g。
选项C,首先是Cu2+在阴极获得电子产生 mol Cu,即1.28 g。
选项D,首先是H+在阴极获得电子产生H2,然后析出 mol Pb,即 1.035 g。
答案:C5.用惰性电极实现电解,下列说法正确的是( )A.电解稀硫酸,实质上是电解水,故溶液pH不变B.电解稀NaOH溶液,要消耗OH-,故溶液pH减小C.电解Na2SO4溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解CuCl2溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1解析:A项错误,电解水后H+浓度增大,pH减小;B项错误,电解NaOH 溶液相当于电解水,OH -浓度增大,pH 增大;C 项错误,电解Na2SO 4溶液相当于电解水,阴极上的H 2和阳极上的O 2物质的量之比为2∶1;D 项正确,电解CuCl 2溶液,阴极上析出Cu 和阳极上析出的Cl 2物质的量之比为1∶1。
高考化学二轮题型对题必练— —原电池、电解池串并联

高考化学二轮题型对题必练———原电池、电解池串并联一、单选题(本大题共20小题,共40分)1.是一种新型绿色硝化剂,一种制备方法是用硼氢化钠燃料电池作电源,采用电解法制备得到工作原理如图:隔膜不允许水分子通过,可以通过下列说法正确的是A. Y是负极,电极反应式:B. Z是阳极,电极反应式为:C. 电流从X流出经导线流入W极D. 制备至少需要消耗硼氢化钠2.如图所示,甲池的总反应式为:,下列说法正确的是A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置B. 甲池中正极的电极反应式是C. 反应过程中,乙池的pH逐渐减小D. 甲池中消耗的体积与丙池生成气体的总体积在相同条件下的比值为1:23.下列图示与对应的叙述不相符合的是A. 图甲表示工业上用CO生成甲醇的反应,该反应的B. 图乙表示已达到平衡的某反应,在时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂C. 图丙中若闭合,石墨棒周围溶液pH逐渐升高;若闭合,电路中通过个电子时,两极理论上共产生气体D. 图丁表示盐酸滴加溶液得到的滴定曲线,该实验的指示剂最好选取酚酞4.用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是A. 燃料电池工作时,正极反应为B. 电解精炼铜时,若转移1mol电子,a极质量减少32gC. 铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuOD. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的体积相同5.用石墨电极完成下列电解实验。
下列对实验现象的解释或推测不合理的是A. a、d处:B. b处:,溶于水生成HClO,使溶液褪色C. c处发生了反应:D. 根据实验一的原理,实验二中n处能析出6.“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应.其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解池的串联问题一.电解池的串联问题1.如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。
下列说法正确的是()A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO2-3+8H+C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度D.甲池中消耗280 mL(标准状况)O2,此时丙池中理论上最多产生1.45 g固体【解析】甲池为原电池,作为电源,电解乙池丙池两个电解池,A错误;通入CH3OH的一极为负极,负电解极反应:CH3OH-6e-+8OH-===CO2-3+6H2O,B错误;应加入CuO或CuCO3,C错误;丙池中发生反应:MgCl2+2H2O=====Mg(OH)2↓+Cl2↑+H2↑,消耗0.0125mol O2,转移0.05mol电子,生成0.025mol Mg(OH)2,其质量为1.45g,D正确。
【答案】D2.下图装置闭合电键K时,电流计A的指针将发生偏转。
试回答:(1)丙池是__________(填“原电池”或“电解池”),甲中a电极的名称是__________(填“正极”或“负极”),丙中c电极的名称是__________(填“阳极”或“阴极”)。
(2)乙中Cu极的电极反应是______________________________,若电路中有0.02 mol电子通过,则甲中a电极溶解的质量为__________g。
(3)闭合电键K一段时间后,丙池中生成两种气体和一种碱,则丙池中发生的总化学方程式是_______________________________________________________(4)如果要给丙中铁片上镀上一层Cu ,则丙池应作何改进:________________________________________________________________________。
【解析】(1)甲、乙构成原电池,则丙为电解池,由电子流向可知,锌作负极,即a 为负极,c 连接b ,b 为正极,故c 为阳极。
(2)Cu 作正极,电极反应式为Cu 2++2e -===Cu ,a 极上发生反应Zn -2e -===Zn 2+,转移0.02mol 电子,消耗锌的质量为0.01mol×65g·mol −1=0.65g 。
(3)闭合K ,丙池电解饱和食盐水:2NaCl+2H 2O=====通电2NaOH+H 2↑+Cl 2↑。
(4)电镀:待镀金属作阴极,电解质溶液含镀层离子,镀层金属作阳极,故应将“C”换成“Cu”、“NaCl 溶液”换成“CuSO 4溶液”。
【答案】(1)电解池 阳极 负极(2)Cu 2++2e -===Cu 0.65(3)2NaCl+2H 2O=====通电2NaOH+H 2↑+Cl 2↑(4)将“C”换成“Cu”、“NaCl 溶液”换成“CuSO 4溶液”1.某同学按下图所示的装置进行实验。
A 、B 为两种常见金属,它们的硫酸盐可溶于水,当K 闭合时,SO 2-4从右向左通过交换膜移向A 极。
下列分析正确的是( )A .溶液中c (A 2+)减小B .B 极的电极反应:B -2e -===B 2+C .Y 电极上有H 2产生,发生还原反应D .反应初期,X 电极周围出现白色胶状沉淀【解析】根据SO 2-4从右向左通过交换膜移向A 极,则A 极为负极,故A 极的电极反应为A -2e -===A 2+,溶液中c (A 2+)增大;B 极为正极,发生还原反应;Y 电极为阳极,有Cl 2产生;右边U 形管中最初为电解AlCl 3溶液,X 电极为H +放电,c (H +)减小,c (OH -)增大,且Al 3+移向X 极,因此会产生Al(OH)3白色胶状沉淀,D 正确。
【答案】D2.如下图所示,甲池的总反应式为N 2H 4+O 2===N 2+2H 2O ,下列关于该电池工作时的说法正确的是( ) 二.对点增分集训A .该装置工作时,Ag 电极上有气体生成B .甲池和乙池中的溶液的pH 均减小C .甲池中负极反应为N 2H 4-4e -===N 2+4H +D .当甲池中消耗0.1mol N 2H 4时,乙池中理沦上最多产生6.4g 固体【解析】甲池作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N 2H 4-4e -+4OH-===N 2+4H 2O ,正极反应为O 2+4e -+2H 2O===4OH -。
乙池为电解池,银极为阴极,石墨为阳极,阴极反应为Cu 2++2e-===Cu ,阳极反应为4OH --4e -===2H 2O+O 2↑。
由以上分析可知,A 、C 错误;甲池生成水,导致溶液中KOH 浓度降低,则溶液pH 减小,乙池中氢氧根离子放电,导致溶液pH 减小,B 正确;甲池消耗0.1mol N 2H 4时,转移0.4mol 电子,乙池生成0.2mol 铜,即12.8g 固体,D 错误。
【答案】B3.图1为甲烷和O 2构成的燃料电池示意图,电解质为KOH 溶液,图2为电解AlCl 3溶液的装置,电极材料均为石墨。
用该装置进行实验,反应开始后观察到x 电极附近出现白色沉淀。
下列说法正确的是( )A .图1中电解质溶液的pH 增大B .图2中电解AlCl 3溶液的总反应为2Cl -+2H 2O=====通电Cl 2↑+H 2↑+2OH -C .A 处通入的气体为CH 4,电极反应式为CH 4+10OH --8e -===CO 2-3+7H 2OD .电解池中Cl -向x 极移动【解析】甲烷和O 2构成的燃料电池为原电池,甲烷在负极发生氧化反应,由于观察到x 电极附近出现白色沉淀说明产生氢氧化铝沉淀,x 电极为电解池的阴极,a 为原电池的负极,甲烷失电子,被氧化,C 正确;电解AlCl 3溶液应生成氢氧化铝沉淀,B 错误;图1中甲烷的燃料电池不断消耗碱,溶液的pH 减小,A 错误;电解池中Cl -向阳极移动,x 极为阴极,D 错误。
【答案】C4.下图所示的A 、B 两个电解池中的电极均为铂,在A 池中加入0.05mol·L −1的CuCl 2溶液,B 池中加入0.1mol·L −1的AgNO 3溶液,进行电解。
a 、b 、c 、d 四个电极上析出的物质的物质的量之比是( )A .2∶2∶4∶1B .1∶1∶2∶1C .2∶1∶1∶1D .2∶1∶2∶1【解析】由电解规律可知:a 、c 为阴极,b 、d 为阳极。
a 极上析出Cu ,b 极上析出Cl 2,c 极上析出Ag ,d 极上析出O 2。
由电子守恒可得出:2e -~Cu ~Cl 2~2Ag ~12O 2,所以a 、b 、c 、d 四个电极上析出物质的物质的量之比为1∶1∶2∶12=2∶2∶4∶1。
【答案】A5.以乙烷燃料电池为电源进行电解的实验装置如下图所示。
下列说法正确的是( )A .燃料电池工作时,正极反应为O 2+2H 2O+4e -===4OH -B .a 极是铜,b 极是铁时,溶液中CuSO 4浓度减小C .a 、b 两极若是石墨,在同温同压下a 极产生的气体与电池中消耗乙烷的体积之比为72D .a 极是纯铜,b 极是粗铜时,a 极上有铜析出,b 极逐渐溶解,两极质量变化相同【解析】根据图示知乙烷燃料电池中左侧电极为电源的正极,右侧电极为电源的负极,a 为电解池的阴极,b 为电解池的阳极。
该燃料电池工作时,负极产物为CO 2,说明电解质溶液呈酸性,正极反应为O 2+4H ++4e -===2H 2O ,A 错误;a 极是铜,b 极是铁时,电解总反应为Fe+CuSO 4===FeSO 4+Cu ,溶液中硫酸铜浓度减小,B 正确;a 、b 两极若是石墨,a 极反应式为Cu 2++2e -===Cu ,当硫酸铜溶液足量时没有气体产生,C 错误;a 极是纯铜,b 极是粗铜时,为铜的电解精炼,a 极上有铜析出,b 极逐渐溶解,但溶解的不只是铜,两极质量变化不相同,D 错误。
【答案】A6.如图所示的装置,X 、Y 都是惰性电极。
将电源接通后,向甲中滴入酚酞溶液,在Fe 极附近显红色。
试回答下列问题:(1)在电源中,B 电极为______极(填电极名称,下同);丙装置中Y 电极为______极。
(2)在甲装置中,石墨(C)电极上发生__________(填“氧化”或“还原”)反应;甲装置中总的化学方程式是__________________________________________________。
(3)丙装置在通电一段时间后,X 电极上发生的电极反应式是__________________。
(4)如果乙装置中精铜电极的质量增加了0.64 g ,请问甲装置中,铁电极上产生的气体在标准状况下为________L 。
【解析】(1)由于电源接通后,向甲中滴入酚酞溶液,在Fe 极附近显红色,说明在Fe 电极附近的水溶液显碱性。
则在该电极上是H +放电,所以Fe 为阴极,与直流电源的负极相连。
因此在电源中,B 电极为负极,A 电极为正极。
在丙装置中Y 电极为阴极。
(2)在甲装置中,石墨(C)电极为电解池的阳极,在阳极上发生氧化反应。
由于在NaCl 溶液中放电能力Cl ->OH -,所以在C 电极上发生氧化反应:2Cl --2e -===Cl 2↑。
甲装置中总的化学方程式是2NaCl+2H 2O=====电解Cl 2↑+H 2↑+2NaOH。
(3)丙装置在通电一段时间后,阳极X 电极上发生的电极反应式是2Cl --2e -===Cl 2↑。
(4)如果乙装置中精铜电极的质量增加了0.64 g ,n (Cu)=0.01mol 。
则n (e -)=0.02mol 。
由于在整个闭合回路中电子转移数目相等,所以铁电极上产生的氢气为0.01mol ,在标准状况下为0.224L 。
【答案】(1)负 阴(2)氧化 2NaCl+2H 2O=====电解2NaOH+H 2↑+Cl 2↑(3)2Cl --2e -===Cl 2↑(4)0.2247.如下图所示,通电5min 后,电极5的质量增加2.16g ,请回答下列问题:(1)电源:a 是________极,C 槽是________池。
A 槽的阴、阳极电极反应:____________________________________________。
C 槽的阴、阳极电极反应:________________________________________。
(2)如果B 槽中共收集到224 mL 气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu 2+的物质的量浓度为________________。
