【帮帮群】高考化学电解原电池试题汇编 (1)
高三化学一轮复习原电池电解池题汇总

原电池、电解池专题练习1、(2010·广东理综,23)铜锌原电池(如图)工作时,下列叙述正确的是()A.正极反应为:Zn-2e-===Zn2+B.电池反应为:Zn+Cu2+===Zn2++CuC.在外电路中,电子从负极流向正极D.盐桥中的K+移向ZnSO4溶液2、乙醇燃料电池中采用磺酸类质子溶剂,在一定温度下供电,电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意图如图。
下列说法中错误的是()A.电池工作时,质子向电池的正极迁移B.电池工作时,电流由b极沿导线流向a极C.a极上发生的电极反应是C2H5OH+3H2O+12e-===2CO2+12H+D.b极上发生的电极反应是4H++O2+4e-===2H2O3、(2012·四川理综,11)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。
下列有关说法正确的是()A.检测时,电解质溶液中的H+向负极移动B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气C.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2OD.正极上发生的反应为O2+4e-+2H2O===4OH-4、如图为直流电源电解稀Na2SO4水溶液的装置。
通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。
下列实验现象描述正确的是()A.逸出气体的体积,a电极的小于b电极的B.一电极逸出无味气体,另一电极逸出刺激性气体C.a电极附近呈红色,b电极附近呈蓝色D.a电极附近呈蓝色,b电极附近呈红色5、利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。
下列说法不正确的是()A.a管发生吸氧腐蚀,b管发生析氢腐蚀B.一段时间后,a管液面高于b管液面C.a处溶液的pH增大,b处溶液的pH减小D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+6、用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。
原电池电解池高考题汇编

百度文库- 让每个人平等地提升自我原电池、电解池综合训练1.(1992年全国,13)下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多B.同价态的阳离子,甲比乙的氧化性强C.甲能跟稀盐酸反应放出氢气而乙不能D.将甲乙作电极组成原电池时,甲是负极2.(1992年全国,14)用石墨作电极,电解1 mol·L-1下列物质的溶液,溶液的pH保持不变的是( )A.HCl B.NaOH C.Na2SO4D.NaCl3.(1992年上海)在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )A.锌作阳极,镀件作阴极,溶液中含有锌离子B.铂作阴极,镀件作阳极,溶液中含有锌离子C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌用阴极,镀件作阳极,溶液中含有锌离子4.(1992年三南,17)A、B、C是三种金属,根据下列①②两个实验,确定它们的还原性强弱顺序为:①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)( )A.A>B>C B.B>C>A C.C>A>B D.B>A>C5.(1993年上海,17)有A、B、C、D四种金属。
将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。
将A、D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B的盐溶液里,无明显变化。
如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是( )A.D>C>A>B B.D>A>B>CC.D>B>A>C D.B>A>D>C6.(1993年全国,12)图14-4中X、Y分别是直流电源的两极,通电后发现a极极板质量增加,b 极极板处有无色无臭气体放出,符合这一情况的是()图14—47.(1994年上海,14)下列叙述正确的是( )①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率。
2015-2021高考电化学真题(原电池、电解池、燃料电池)
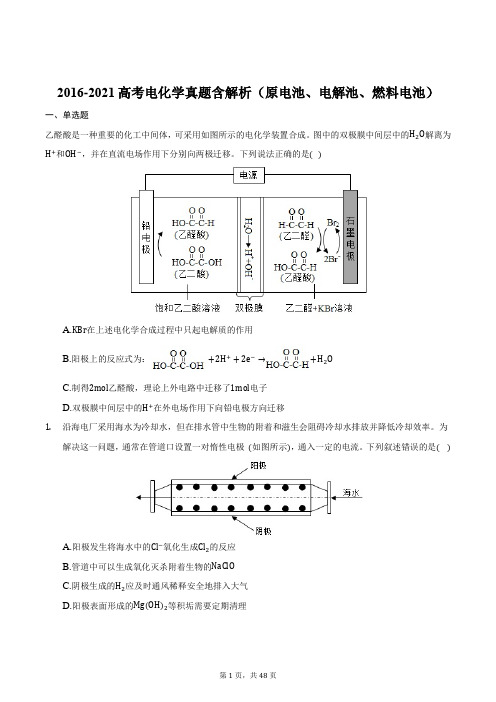
2016-2021高考电化学真题含解析(原电池、电解池、燃料电池)一、单选题乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。
图中的双极膜中间层中的H2O解离为H+和OH−,并在直流电场作用下分别向两极迁移。
下列说法正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用B.阳极上的反应式为:+2H++2e−→+H2OC.制得2mol乙醛酸,理论上外电路中迁移了1mol电子D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移1.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。
为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是( )A.阳极发生将海水中的Cl−氧化生成Cl2的反应B.管道中可以生成氧化灭杀附着生物的NaClOC.阴极生成的H2应及时通风稀释安全地排入大气D.阳极表面形成的Mg(OH)2等积垢需要定期清理2.如图所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )A.a是电源的负极B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色C.随着电解的进行,CuCl2溶液浓度变大D.当0.01molFe2O3完全溶解时,至少产生气体336mL(折合成标准状况下)3.某全固态薄膜理离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。
下列说法不正确的是()A.充电时,集流体A与外接电源的负极相连B.放电时,外电路通过amol电子时,LiPON薄膜电解质损失C.放电时,电极B为正极,反应可表示为Li1−x CoO2+xLi++xe−=LiCoO2D.电池总反应可表示为Li x Si+Li1−x CoO2Si+LiCoO24.镍镉电池是二次电池,其工作原理示意图如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。
高中化学原电池与电解池高考题大全

2、微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示;下列有关微生物电池的说法错误的是A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O2===6CO2+6H2O3、Li-SOCl2电池可用于心脏起搏器;该电池的电极材料分别为锂和碳,电解质是LiAlCl4-SOCl2;电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2↑;请回答下列问题:1电池的负极材料为________,发生的电极反应式为______________________________________________________________;2电池正极发生的电极反应为____________________________________;3SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成;如果把少量水滴到SOCl2中,实验现象是____________________,反应的化学方程式为_____________________________________________________;4组装该电池必须在无水、无氧的条件下进行,原因是_____________________________________________________________________________;4、石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2S n,有关该电池说法正确的是A. 放电时,Li+向负极迁移B.A电极上发生的一个电极反应为:2Li++6S+2e=Li2S6C. 若对该电池充电,B电极接电源正极B电极发生还原反应5、如图是锂空气电池的放电原理图隔膜只允许锂离子通过.电池放电时的反应可表示为:4Li+O2+2H2O═4LiOH;下列锂空气电池放电时的有关说法正确的是A. 正极反应式:Lie═Li+B. 每转移2mol电子,消耗的O2C.Li+不断向电池的正极移动D. 可以去掉隔膜和有机电解液,让金属锂与水性电解液直接接触6、锌溴液流电池是一种新型电化学储能装置如下图所示,电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环;下列说法正确的是A.充电时电极b连接电源的正极B.放电时正极的电极反应式为Zn-2e-=Zn2+C.阳离子交换膜可阻止Br2与Zn直接发生反应D.充电时左侧电解质储罐中的离子总浓度增大7、用固体氧化物作为电解质的氢氧燃料电池电解Na2SO4溶液,已知固体氧化物在高温下允许氧离子O2-在其间通过,其工作原理如下图所示c、d均为惰性电极;下列有关说法正确的是A.电路中电子流向为a→d→c→bB.电极b为负极,电极反应式为O2+4e-=2O2-C.电解后烧杯中溶液pH增大D.理论上b极消耗气体和c极生成气体质量相等8、根据如图,可判断出下列离子方程式中,错误的是A.2 Ags+Cd2+aq═2 Ag+aq+CdsB. Co2+aq+Cds═Cos+Cd2+aqC. 2 Ag+aq+Cds═2Ags+Cd2+aqD. 2Ag+aq+Co s═2 Ags+Co2+aq9、用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入 CuOH2恰好恢复到电解前的浓度和pH.则电解过程中转移电子的总物质的量为A.B.C.D.10、某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-Cl2↑+H2↑B.B. 断开K2,闭合K1时,石墨电极附近溶液变红C.C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl-D.D. 断开K1,闭合K2时,石墨电极作正极11、12、某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料C3H8O;下列说法正确的是A.该装置将化学能转化为光能和电能B.该装置工作时,H+从b极区向a极区迁移C.每生成1 mol O2,有44 g CO2被还原D.a电极的反应为:3CO2+18H+-18e-===C3H8O+5H2O13、14、某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料C3H8O;下列说法正确的是A.该装置将化学能转化为光能和电能B.该装置工作时,H+从b极区向a极区迁移C.每生成1 mol O2,有44 g CO2被还原D.a电极的反应为:3CO2+18H+-18e-===C3H8O+5H2O15、对下列由电极和电解质溶液构成的装置叙述不正确的是A.若X、M、Q分别是H2SO4、Pb和PbO2,a、b连接后两极都有PbSO4生成B.若X、M、Q分别是滴加酚酞的Na2SO4、C和Fe,a、b分别连接电池的正、负极,则通电后Q周围溶液颜色变红C.若X、M、Q分别是CuSO4、Cu和Fe,a、b分别连接电源的正、负极,则可在铁上镀铜D.若X、M、Q分别是NaCl、C和Fe,则a、b连接后,M电极上有气体产生16、。
高三化学电解池练习题

高三化学电解池练习题在化学学习中,电解池是一个重要的概念。
掌握电解池的基本原理和运用方法对于高三学生来说十分关键。
本文将通过化学电解池的练习题,帮助同学们更好地理解和掌握这一知识点。
练习题1:利用电解池的原理,写出下列反应的电解方程式:a) 在氯化钠溶液中,电解生成氯气和金属钠。
b) 在稀硫酸溶液中,电解生成氢气和氧气。
c) 在铜(II)硫酸溶液中,电解生成铜金属和SO4^2-离子。
练习题2:在以下电解池中,给出化学方程式和标准电位的表达式。
a) 锌-铜电池b) 银-镍电池c) 铝-镁电池练习题3:根据电解池的原理和化学知识,回答以下问题:a) 电解池中,阴极和阳极的作用分别是什么?b) 电解质是什么?为什么在电解池中需要添加电解质?c) 如何判断该电解质是否适用于某个电解池?练习题4:下列关于电解池的说法中,哪些是正确的?哪些是错误的?对于错误的说法,请进行修正。
a) 阳极是电解质被氧化的地方。
b) 阳极是电子流出的地方。
c) 金属会在电解质溶液中离子化。
练习题5:电解池与电池有何不同?举例说明。
练习题6:将下列物质进行分类,归属于电解质或非电解质:氢氧化钠、蔗糖、氯化铜、硝酸铵。
练习题7:为了保护冶金中的金属制品,常常要对它们进行电镀处理。
请描述电镀的原理以及常用的电镀方法。
练习题8:能否利用铝作为铜的负电极,铜作为正电极构建电解池?为什么?练习题9:什么是电解质溶液?什么是非电解质溶液?请给出例子。
练习题10:电解池技术在实际生活中有着广泛的应用。
请举例说明电解池在以下方面的应用:a) 冶金b) 制氢c) 电镀d) 制取氢氧化钠本文通过练习题的形式,考察了高三化学电解池相关的基本知识点。
希望同学们通过解答这些问题,加深对电解池的理解和应用能力。
同时,推荐同学们多进行实验探究,实践出真知,进一步巩固所学的知识。
祝愿同学们在化学学习中取得优异的成绩!。
高考化学【电解池和原电池】专题练习60题Word版含答案及解析

高考化学【电解池和原电池】专题练习60题1、如图,下列关于新型镁锂双离子二次电池的说法不正确的是A. 充电时,导线上每通过1mole—,理论上左室电解液质量减轻12gB. 充电时,外加电源的正极与Y相连C. 放电时,Li由左向右移动D. 放电时,正极的电极反应式为Li1 –x FePO4+xLi ++xe—=LiFePO4【答案】A【解析】A.充电时,左室电极反应式为:Mg2++2e-=Mg,导线上每通过1mol电子,电解液质量减轻12g,同时右侧极室将有1molLi+移向左室,使电解液质量增加7g,所以左极室溶液质量共减轻12g-7g=5g,A项错误;B.充电时,外加电源的正极与该电池的正极相连,所以外加电源的正极与Y相连,B项正确;C.放电时,溶液中阳离子移向正极,所以Li+由左向右移动,C项正确;D.放电时,右边是正极,发生还原反应,电极反应式为: Li1 –x FePO4+xLi ++xe—=LiFePO,D项正确。
42、科学家开发出Na-CO2电池如下图所示。
下列说法错误的是A. 电池放电时,钠发生氧化反应B. 正极的电极反应式:2CO2 + 2H2O + 2e-= 2HCO3-+ H2↑C. 理论上消耗23g钠,同时产生22.4L氢气(标准状况)D. 该装置既可以吸收二氧化碳,又能产生电能、氢燃料【答案】C【解析】【详解】A.根据图示可知Na电极失去电子,变Na+,所以电池放电时,钠失去电子,发生氧化反应,A正确;B.在正极上,CO2、H2O(碳酸电离产生的H+)获得电子,发生还原反应,产生HCO3-、H2,电极反应式是:2CO2 +2H2O+2e-= 2HCO3- + H2↑,B正确;C.23gNa的物质的量是1mol,根据电子守恒,产生H2的物质的量为0.5mol,则其在标准状况下的体积为V(H2)=0.5mol×22.4L/mol=11.2L,C错误;D.通过该装置可以吸收二氧化碳,减少温室效应,同时产生电能,和氢气,产生了清洁能源的燃料——氢燃料,D正确。
高三化学复习电解池练习题.doc

高三化学复习电解池练习题(精编原创试题)说明:(总分100分时间90分钟)Ⅰ卷一、选择题(本题包括10小题,每小题6分,共60分。
每小题只有一个....选项符合题意)1.(原创)下列有关电解原理的说法不正确的是()A.电解饱和食盐水时,一般用铁作阳极,碳作阴极B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法D.电解精炼铜时,用纯铜板作阴极,粗铜板作阳极2.在原电池和电解池的电极上所发生的反应,属于还原反应的是()A.原电池的正极和电解池的阳极所发生的反应B.原电池的正极和电解池的阴极所发生的反应C.原电池的负极和电解池的阳极所发生的反应D.原电池的负极和电解池的阴极所发生的反应3..(原创)用惰性电极在一定温度下电解某Na2SO4饱和溶液200 g。
当两极共产生标准状况下67.2L气体时,从溶液中析出64.4g Na2SO4•10H2O 晶体。
则剩余溶液的溶质质量分数约是( )A.64.7%B.47.5%C.32.2%D.28.3%4.(原创)在25℃时,将两个铜电极插入一定质量的硫酸钾饱和溶液中进行电解。
通电一段时间后,阴极上逸出a mol气体,同时有W g 无水硫酸钾晶体析出。
在温度不变条件下,下列说法不正确的是( )A.电解过程中共消耗2amol水B.剩余溶液中有大量蓝色沉淀产生C.剩余溶液中溶质的质量分数为W / (W+18a) ×100%D.剩余溶液中溶质的质量分数为W / (W+36a) ×100%5.某溶液中含有两种溶质AlCl3和H2SO4,它们的物质的量之比为2:1。
用石墨做电极电解该混合溶液时,根据电极产物,可分为若干个阶段,下列叙述不正确的是( ) A.阴极自始至终只有H2 B.阳极先析出Cl2后析出O2C.电解最后阶段为电解水D.溶液中先有白色沉淀生成后沉淀全部溶解6.(改编)关于电解NaCl水溶液,下列叙述正确的是( )A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI淀粉试液,溶液呈蓝色C.若在阴极附近的溶液中滴入酚酞试液,溶液仍无色D.电解一段时间后,将全部电解液转移到烧杯中,加入适量盐酸充分搅拌后溶液可恢复原状况7.(原创)下图是电解精炼铜装置,其中c、d为铜电极。
原电池电解池高考题综合训练[整理]
![原电池电解池高考题综合训练[整理]](https://img.taocdn.com/s3/m/09c1ec21ff00bed5b9f31d50.png)
原电池、电解池综合训练1.(1992年全国,13)下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多B.同价态的阳离子,甲比乙的氧化性强C.甲能跟稀盐酸反应放出氢气而乙不能D.将甲乙作电极组成原电池时,甲是负极2.(1992年全国,14)用石墨作电极,电解1 mol·L-1下列物质的溶液,溶液的pH保持不变的是( ) A.HCl B.NaOH C.Na2SO4D.NaCl3.(1992年上海)在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )A.锌作阳极,镀件作阴极,溶液中含有锌离子B.铂作阴极,镀件作阳极,溶液中含有锌离子C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌用阴极,镀件作阳极,溶液中含有锌离子4.(1992年三南,17)A、B、C是三种金属,根据下列①②两个实验,确定它们的还原性强弱顺序为:①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)( )A.A>B>C B.B>C>A C.C>A>B D.B>A>C5.(1993年上海,17)有A、B、C、D四种金属。
将A与B用导线连接起来,浸入电解质溶液中,B 不易腐蚀。
将A、D分别投入等浓度盐酸中,D比A反应剧烈。
将铜浸入B的盐溶液里,无明显变化。
如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是( )A.D>C>A>B B.D>A>B>CC.D>B>A>C D.B>A>D>C6.(1993年全国,12)图14-4中X、Y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无臭气体放出,符合这一情况的是()图14—47.(1994年上海,14)下列叙述正确的是( )①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
9、(2005 年上海)关于如图所示装置的叙述,正确的是
(
)
A、铜是阳极,铜片上有气泡产生
B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
10.金属有广泛的用途。粗镍中含有少量 Fe、Zn、Cu、Pt 等杂质,可用电解法制备高纯度的镍,
导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4 发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4 发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
12.(2006 年江苏卷)锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电
3eud 教育网 教学资源集散地。可能是最大的免费教育资源网!
3eud 教育网 百万教学资源,完全免费,无须注册,天天更新!
6.(2005 年江苏)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间
保持稳定的放电电压。高铁电池的总反应为 + 4KOH
C 电解后,溶液中存在的金属阳离子只有 Fe2+和只有 Cu 和 Pt
8、(2005 年全国)关于电解 NaCl 水溶液,下列叙述正确的是
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入 KI 溶液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈棕色
2.(2004 年江苏卷)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性
电池以氢氧化钾溶液为电解液,电池总反应式为:
+Mn2O3(s) 下列说法错误的是
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) C.电池工作时,电子由正极通过外电路流向负极
D.锂离子电池充电时阴极反应为 C6Li1-x+xLi++x e-===C6Li 13. (2006 年全国)把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下
通电一段时间后,析出钾、镁、铝的物质的量之比为
A.1:2:3
B.3:2:1
3eud 教育网 教学资源集散地。可能是最大的免费教育资源网!
3eud 教育网 百万教学资源,完全免费,无须注册,天天更新!
B.电池反应中,锂、锌、银、铅各失去 1mol 电子,金属锂所消耗的质量最小 C.锂离子电池放电时电池内部 Li+向负极移动
4.(2004 上海卷)下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 D
5.(2005 年广东)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂 氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导 O2—。下列对该燃料电池说法 正确的是 A.在熔融电解质中,O2— 由负极移向正极 B.电池的总反应是:2C4H10 + 13O2→ 8CO2 + 10H2O C.通入空气的一极是正极,电极反应为:O2 + 4e— = 2O2— D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e— + 13O2—== 4CO2 + 5H2O
3eud 教育网 百万教学资源,完全免费,无须注册,天天更新!
电化学高考试题
1.(2004 年广东卷)pH = a 的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶
液的 pH>a,则该电解质可能是
A、NaOH
B、H2SO4
C、AgNO3
D、Na2SO4
D.外电路中每通过 O.2mol 电子,锌的质量理论上减小 6.5g 3. (2004 年天津) 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A. a 电极是负极
B. b 电极的电极反应为: 4OH 4e 2H 2O O2
C. 氢氧燃料电池是一种具有应用前景的绿色电源 D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
D.放电时正极附近溶液的碱性增强
7.(2005 年天津卷)金属镍有广泛的用途。粗镍中含有少量 Fe、Zn、Cu、Pt 等杂质,可用电解法
制备高纯度的镍,下列叙述正确的是(已知:氧化性 Fe2+<Ni2+<Cu2+)
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li 表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2 表示含锂的过渡金属氧化物)
下列有关说法正确的是
A.锂离子电池充电时电池反应为 C6Li+Li1-xMO2===LiMO2+C6Li1-x
3Z放n电+
充电
2K2FeO4
+
8H2O
3Zn(OH)2 + 2Fe(OH)3
下列叙述不正确的是
A.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3
—3e—
+
5
OH—
=
FeO
2 4
+ 4H2O
C.放电时每转移 3 mol 电子,正极有 1mol K2FeO4 被氧化
下列叙述正确的是
()
(已知:氧化性 Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2++2e-
Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有 Fe2+和 Zn2+
D.电解后,电解槽底部的阳极泥中只有 Cu 和 Pt
11.(2006 年广东卷)某可充电的锂离子电池以 LiMn2O4 为正极,嵌入锂的碳材料为负极,含 Li+
