宝山区2017学年第二学期期中高三年级化学学科等级考质量检测试卷高三化学(二模)
2020届上海市宝山区2017级高三下学期二模考试理科综合化学试卷及答案

2020届上海市宝山区2017级高三下学期二模考试
理科综合化学试卷
★祝考试顺利★
考生注意:
1.本试卷满分 100 分,考试时间 60 分钟。
2.本试卷设试卷和答题纸两部分,试卷包括试题与答题要求;所有答案必须涂或写在答题纸上;做在试卷上一律不得分。
3.答题前,考生务必在答题纸上用钢笔或圆珠笔在答题纸正面清楚地填写姓名、准考证号。
4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:O—16 Na—23 Cl—35.5 H—1 Fe—56 S—32
C—12
一、选择题(共 40 分,每小题 2 分,每题只有一个正确选项)
1.下列不属于合金的是
A.生铁B.黄金C.硬铝D.黄铜
2.某原子的轨道表示式如下, 从中得到的信息错误的是
A.有 2 个电子层B.有 3 种能量不同的电子
C.最外层有 3 个电子D.有 7 种运动状态不同的电子
3.清洁的水对人类的生存非常重要,关于 H2O 的描述正确的是
A.含有非极性键和极性键B.纯水几乎不导电,属于非电解质
C.带静电的玻璃棒接近,水流会发生偏转D.水分子间作用力大,所以加热很难分解
4.“浓硫酸使蔗糖脱水”实验中浓硫酸没有体现出的性质是A.酸性B.吸水性C.脱水性D.强氧化性
5.把少量硫酸铜固体加入饱和硫酸铜溶液中,不可能出现的是
A.溶液颜色变浅B.有固体析出C.溶液浓度不变D.溶液体积减小
6.已知:4Al(s)+ 3O2(g) →2Al2O3 (s)+Q kJ(Q>0)。
下列能量图与该反应所体现的能量关系匹配的是
A B C D
7.硝酸是一种常见的强酸,下列关于浓、稀硝酸的描述错误的是。
上海市宝山区高三下学期期中教学质量监测化学试题 Wor

可能用到的相对原子质量:H-1 C-12 O-16 S-32一、选择题:(本题共40分,每小题2分,毎题只有一个正确选项。
)1、甲状腺大的病人需要多吃海带,这是因为海带中含有较多的A.氯元素B.钠元素C.碘元素D.铁元素2、酸雨的pH值是A. <7B. <6.5C. <6D. <5.63、属于工业固氮的是A.N2与O2反应生成NOB.由NH3转变成NH4HCO3C. N2与H2在一定条件下反应生成NH3D. 豆科植物的根瘤吸收氮4、有关HF和HC1判断正确的是A.键长:HF>HClB.键能:HF>HC1C.稳定性:HCl>HFD.共用电子对偏移程度:HCl>HF5、不能用来鉴别乙醛、乙酸的试剂是A.水B. 石蕊试液C.银氨溶液D.新制的氢氧化铜溶液6、将两种互不相溶的液体分离的方法是A.分液B.结晶C.纸层析D.过滤7、按照有机物的命名规则,下列命名正确的是A.1,2-二甲基戊烷B. 2-乙基丁烷C. 3-乙基己烷D. 3,4-二甲基戊烷8、下列试剂中,可以签别二氧化碳和二氧化硫的是A.澄清石灰水B. 品红溶液C.湿润的蓝色石蕊试纸D.硝酸银溶液9、某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的A.甲学生用电子天平称取NaOH固体1.220gB.乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5C.丙学生用红柄滴定管取25.0mL0.lmol/L的盐酸D.丁学生用50mL 量筒量取46.70mL浓盐酸10、下列事实与盐类水解无关的是A.氯化铝溶液蒸干后灼烧得不到无水氯化铝B.氯化铁溶液常用作制印刷电路板的腐蚀剂C.常用热的纯碱溶液除去油污D.长期施用硫酸铵易使土壤酸化11、下列物质的工业生产原理不涉及氧化还原反应的是A.氨气B.纯碱C. 硫酸D.烧碱12、用如右图所示装置电解氯化钠溶液(X、Y 是碳棒)。
下列判断正确的是A. X电极为阴极B. Y电极为负极C. X电极表面发生氧化反应D. Y电极表面有氯气生成13、在密闭容器中,反应2SO2(g)+O2(g)= 2SO3(g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是A. V(正)减小,V(逆)增大B. V(正)增大,V(逆)减小C. V(正)、V(逆)都减小D. V(正)、V(逆)都增大14、布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是A.布洛芬的分子式为C13H18O2B.布洛芬与苯乙酸是同系物C.1mol布洛芬最多能与3mol氢气发生加成反应D.布洛芬在苯环上发生取代反应,其一氯代物有4种15、配制一定物质的量浓度的Na2CO3溶液时,下下列因素会导致溶液浓度偏高的是A.溶解时有少量液体溅出B.洗涤液未全部转移到容量瓶中C.容量瓶使用前未干燥D.定容时液面未到刻度线16、下列溶液中氢离子浓度最小的是A. 10L0.10mol/LCH3COOH 溶液B. 2L 0.05mol/L H2SO4溶液C. lL0.10mol/LHNO3溶液D.2L0.1mol/LHCl溶液17、等量的铁扮分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的物质的量之比是A. 1:1B. 3:4C.2:3D.4:318、25℃时,将10m质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是A.纯硫酸的摩尔质量为98B.上述100mL 稀硫酸中含溶质14gC.上述稀释过程所需要的蒸馏水为90mLD.质量分数为50%的硫酸物质的量浓度为7.14mol/L19、溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,能完整表示该反应的离子方程式是A. CO32-+ Ba2+ =BaCO3B. HCO3-+OH-→H2O+CO32-C. HCO3-+ Ba2++OH-→H2O+BaCO3D. 2HCO3-+ Ba2++OH-=BaCO3 +2H2O+CO32-20、工业上常用NaHSO3处理含Cr2O72-的废液,反应的离子方程式为:5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O 。
宝山区2017学年第二学期期中高三化学等级考教学质量检测(参考答案)

2017学年第二学期期中高三年级化学学科质量监测试卷(答案) 第1页共1页浓硫酸2017学年第二学期期中高三化学质量监测试卷(参考答案)二、综合题(一)本题共15分21. ,非极性。
(共3分)22. 滴加氢氧化钠溶液,OH -和H +结合,导致H +浓度降低,平衡向右移动,溶液颜色变浅。
(共3分)23.[SiF 4][H 2O]2/[HF]4, 向正反应方向移动,减小,增大。
(共6分) 24. 0.0010mol/(L ·min) 。
(共3分) (二)本题共15分25.3Fe+8HNO 3(稀)→3Fe (NO 3)2+2NO ↑+4H 2O (共2分) 26.Fe 2(SO 4)3,KSCN 溶液,溶液变为血红色。
(合理亦给分)(共6分)27. 明矾水解生成胶状Al(OH)3,它具有很强的吸附能力,可以吸附水中的杂质并沉降,使水澄清。
Al 3++3H 2O Al(OH)3+3H +。
(共4分) 28.BaSO 4, BaSO 4,Al(OH)3。
(共3分) (三)本题共15分29.Ca(OH)2或CaO,Na 2CO 3(共4分)30.溶解, 过滤, 蒸发, 过滤(共4分)31. 因为氨气在水中的溶解度非常大,在水中形成氨的水溶液,溶液的碱性比较强,易于吸收更多的二氧化碳,这样可以生成更多的HCO 3,从而产生更多的纯碱。
(共3分) 32.有晶体析出(或出现浑浊); NH 4Cl 。
(共2分) 33.84(m1-m2)/31m1(共2分) (四)本题共15分34.羟基、羧基,取代(共3分)35.B:CH 3CH(OH)COOCH 2CH 3 和它具有相同官能团的同分异构体(合理即给分)(共2分)36. CH 3CH(OH)COOH+CH 3COOH → CH 3CH(COOH)OOCCH 3+H 2O (共3分)37.取样,加入新制氢氧化铜,煮沸,观察是否有砖红色沉淀生成,若有砖红色沉淀生成,则未全部转化;若没有砖红色沉淀生成,则已全部转化。
上海市宝山区2017年高三二模化学试卷(含解析)

2017年上海市宝山区高考化学二模试卷一、选择题:(本题共40分,每小题2分,毎题只有一个正确选项.)1.甲状腺大的病人需要多吃海带,这是因为海带中含有较多的()A.氯元素B.钠元素C.碘元素D.铁元素2.酸雨的pH值是()A.<7 B.<6.5 C.<6 D.<5.63.属于工业固氮的是()A.N2与O2反应生成NOB.由NH3转变成 NH4HCO3C.N2与H2在一定条件下反应生成NH3D.豆科植物的根瘤吸收氮4.有关HF和HCl判断正确的是()A.键长:HF>HClB.键能:HF>HClC.稳定性:HCl>HFD.共用电子对偏移程度:HCl>HF5.不能用来鉴别乙醛、乙酸的试剂是()A.水B.石蕊试液C.银氨溶液 D.新制的氢氧化铜溶液6.将两种互不相溶的液体分离的方法是()A.分液 B.结晶 C.纸层析D.过滤7.按照有机物的命名规则,下列命名正确的是()A.1,2﹣二甲基戊烷 B.2﹣乙基丁烷C.3﹣乙基己烷D.3,4﹣二甲基戊烷8.下列试剂中,可以鉴别二氧化碳和二氧化硫的是()A.澄清石灰水B.品红溶液C.湿润的蓝色石蕊试纸D.硝酸银溶液9.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的()A.甲学生用电子天平称取NaOH固体1.220gB.乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5C.丙学生用碱式滴定管取25.0mL0.lmol/L的盐酸D.丁学生用50mL 量筒量取46.70mL浓盐酸10.下列事实与盐类水解无关的是()A.氯化铝溶液蒸干后灼烧得不到无水氯化铝B.氯化铁溶液常用作制印刷电路板的腐蚀剂C.常用热的纯碱溶液除去油污D.长期施用硫酸铵易使土壤酸化11.下列物质的工业生产原理不涉及氧化还原反应的是()A.氨气 B.纯碱 C.硫酸 D.烧碱12.用如图所示装置电解氯化钠溶液(X、Y 是碳棒).下列判断正确的是()A.X电极为阴极B.Y电极为负极C.X电极表面发生氧化反应D.Y电极表面有氯气生成13.在密闭容器中,反应2SO2(g)+O2(g)=2SO3(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是()A.V(正)减小,V(逆)增大B.V(正)增大,V(逆)减小C.V(正)、V(逆)都减小 D.V(正)、V(逆)都增大14.布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是()A.布洛芬的分子式为C13H18O2B.布洛芬与苯乙酸是同系物C.1mol 布洛芬最多能与3mol 氢气发生加成反应D.布洛芬在苯环上发生取代反应,其一氯代物有4种。
【学期】上海市2017届高三化学下学期期中模拟调研试题

【关键字】学期上海市2017届高三化学下学期期中模拟调研试题考生注意:1.本试卷满分100分,考试时间60分钟。
2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择题)或写(综合分析题)在答题纸上;做在试卷上一律不得分。
3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚填写姓名、准考证号,并将核对后的条形码贴在指定位置上。
4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:H-1 C-12 N-14 O-16 Mn-55一、选择题(本题共40分,每小题2分,只有一个正确选项)1. 下列表示氮原子或氮分子的化学用语中正确的是A. 氮分子的电子式:B. 氮离子电子排布式:1s22s22p3C. 氮分子的结构式:D. 氮原子最外层电子轨道表示式:2. 下列关于人体内化学元素、粒子的功能描述错误的是A. 血液中的Ca具有促进血液凝固的作用B. Fe3+是血红蛋白的主要组成成分C. 甲状腺激素的主要成分元素是ID. HCO3-有助于调节人体内环境pH3. 设NA为阿伏伽德罗常数的值,下列说法正确的是A. 标况下,将5.6g铁片投入足量浓硝酸中生成6.72L NO2气体B. lmol FeBr2与1.2mol Cl2反应转移的电子数为2.4molC. 1L 1mol·L-1的草酸溶液中含有的H+数为2NAD. 常温下22.4L的O2含有的原子数为2NA4. 下列电子运动状态的描述中,确定一个“轨道”应包括:(1)电子层;(2)电子亚层;(3)电子云的伸展方向;(4)电子的自旋状态A. (1)(2)(3)(4)B. (1)(2)(3)C. (1)(2)D. (1)(4)5. 某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是A. Fe3+B. Mg2+C. Fe2+D. Al3+6. 将CO2通入下列溶液中,观察不到明显现象的是A. BaCl2B. 甲基橙溶液C. 氢氧化钙溶液D. 酸性KMnO4溶液7. 室温下将下列溶液等体积混合后,所得溶液的pH一定大于7的是A. pH=4的盐酸、pH=10的氨水B. pH=4的醋酸溶液、pH=10的氢氧化钠溶液C. 均为0.1mol·L-1的盐酸和氢氧化钠溶液D. 均为0.1mol·L-1的硫酸和氢氧化钡溶液8. 下列关于酸雨的说法正确的是A. 酸雨对建筑物有很强的腐蚀作用B. pH<6.5的雨水就可以视为酸雨C. 酸雨有增加土壤肥力的作用D. 二氧化碳的排放是选成酸雨的原因之一9. 乙烷在光照条件下与氯气发生取代反应,理论上得到的氯代物最多有几种A. 8B. 6C. 5D. 910. 一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl→Na2Mn5O10+2AgCl,有关该反应的说法正确的是A. 反应中MnO2是复原剂又是复原剂B. Ag的复原性比Na2Mn5O10强C. 该反应中MnO2具有催化作用D. 每生成1 mol Na2Mn5O10转移5mol电子11. 用浓盐酸配制1:1(体积比)的稀盐酸约100 ml,应选用的定量仪器是A. 量筒B. 胶头滴管C. 50 ml容量瓶D. 100 ml容量瓶12. 对于可逆反应A2(g) + 2B2(g) 2AB2(g)+Q,下图表示的关系正确的是A. B. C. D.13. 以下关于索尔维制碱法与侯氏联合制碱法的认识错误的一项是14. 在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是A. 外电路的电流方向为X→外电路→YB. 若两电极分别为铁和碳棒,则铁棒进行的电极反应式为2H++2e→H2↑C. 在X极上发生的是复原反应,Y极上发生的是氧化反应D. 若两电极都是金属,则它们的活动性顺序为X>Y15. 下列各反应对应的离子方程式正确的是A. 次氯酸钠溶液中通入少量二氧化硫:SO2 + ClO- + H2O → SO42- + Cl- + 2H+B. 在NaHCO3溶液中加过量澄清石灰水: 2HCO3- + Ca2+ + 2OH- → CaCO3 ↓ + CO32- + 2H2OC. 氢氧化钡溶液与硫酸反应得到的中性溶液:Ba2+ + OH- + SO42- + H+ → BaSO4↓ + H2OD. 在50ml 1mol/L的氢氧化钠溶液中通入0.03mol H2S:5OH- + 3H2S → HS- + 2S2- +5H2O16. 短周期元素X、Y、Z三种原子核外电子总数为32,都可形成常温下气体单质。
上海市宝山区2017届高三下期期中教学质量监测化学试题

可能用到的相对原子质量: H-1 C-12 O-16 S-32一、选择题:(本题共40分,每小题2分,毎题只有一个正确选项。
)1.甲状腺大的病人需要多吃海带,这是因为海带中含有较多的A.氯元素 B.钠元素 C.碘元素 D.铁元素【答案】C【解析】海带中含有的碘元素能预防甲状腺肿大,故选C。
2.酸雨的pH值是A.<7 B.<6.5 C.<6 D.<5.6【答案】D【解析】二氧化硫能和水反应生成亚硫酸,当雨水的pH<5.6时就形成酸雨,故选D。
3.属于工业固氮的是A.N2与O2反应生成NO B.由NH3转变成 NH4HCO3C.N2与H2在一定条件下反应生成NH3 D.豆科植物的根瘤吸收氮【答案】C4.有关HF和HC1判断正确的是A.键长:HF>HCl B.键能:HF>HC1C.稳定性:HCl>HF D.共用电子对偏移程度:HCl>HF【答案】B【解析】A.F的原子半径比Cl原子小,则键长:HF<HCl,故A错误;B.键长越短,键能越大,则键能:HF>HC1,故B正确;C.非金属性越强,氢化物越稳定,F的非金属性比Cl强,则稳定性:HCl<HF,故C错误;D.电负性差异越大,共用电子对偏移程度越大,F的电负性最大,则共用电子对偏移程度:HCl<HF,故D错误;答案为B。
5.不能用来鉴别乙醛、乙酸的试剂是A.水 B.石蕊试液 C.银氨溶液 D.新制的氢氧化铜溶液A【答案】A.分液 B.结晶 C.纸层析 D.过滤【答案】A【解析】互不相溶的两种液体,可用分液漏斗,用分液的方法分离,故A正确,答案为A。
【点睛】常见物质分离与提纯方法小结:7.按照有机物的命名规则,下列命名正确的是A.1,2-二甲基戊烷 B.2-乙基丁烷C.3-乙基己烷 D.3,4-二甲基戊烷【答案】C【点睛】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:(1)烷烃命名原则:①长:选最长碳链为主链;②多:遇等长碳链时,支链最多为主链;③近:离支链最近一端编号;④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;(2)有机物的名称书写要规范;(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。
2017-2018学年上海各区高三化学二模II卷大题专题汇编——有机化学((精校Word含答案版))
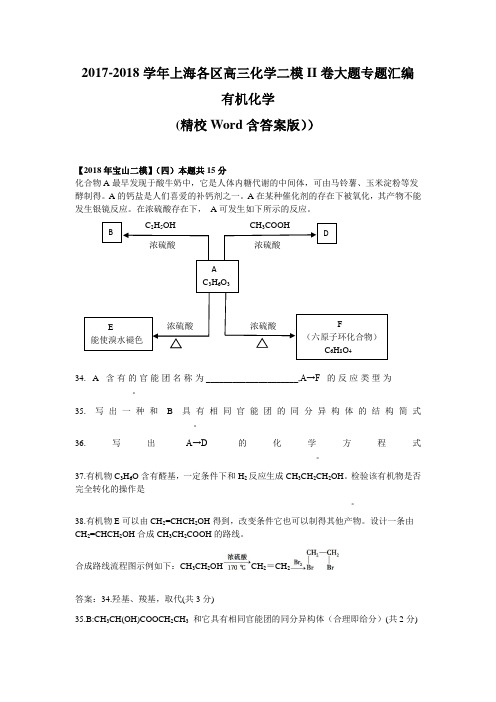
B DAC3H6O3E能使溴水褪色F(六原子环化合物)C6H8O42017-2018学年上海各区高三化学二模II卷大题专题汇编有机化学(精校Word含答案版))【2018年宝山二模】(四)本题共15分化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。
A的钙盐是人们喜爱的补钙剂之一。
A在某种催化剂的存在下被氧化,其产物不能发生银镜反应。
在浓硫酸存在下,A可发生如下所示的反应。
C2H5OH CH3COOH浓硫酸浓硫酸浓硫酸浓硫酸34. A含有的官能团名称为_____________________,A→F的反应类型为____-_____________。
35. 写出一种和B具有相同官能团的同分异构体的结构简式___________________________。
36.写出A→D的化学方程式_______________________________________________________。
37.有机物C3H6O含有醛基,一定条件下和H2反应生成CH3CH2CH2OH。
检验该有机物是否完全转化的操作是_______________________________________________________________。
38.有机物E可以由CH2=CHCH2OH得到,改变条件它也可以制得其他产物。
设计一条由CH2=CHCH2OH合成CH3CH2COOH的路线。
合成路线流程图示例如下:CH3CH2OH CH2=CH2答案:34.羟基、羧基,取代(共3分)35.B:CH3CH(OH)COOCH2CH3和它具有相同官能团的同分异构体(合理即给分)(共2分)浓硫酸36. CH3CH(OH)COOH+CH3COOH →CH3CH(COOH)OOCCH3+H2O (共3分)37.取样,加入新制氢氧化铜,煮沸,观察是否有砖红色沉淀生成,若有砖红色沉淀生成,则未全部转化;若没有砖红色沉淀生成,则已全部转化。
2017年上海市普通高中等级性考试化学试卷及答案解析

化学试卷 第1页(共8页) 化学试卷 第2页(共8页)绝密★启用前2017年上海市普通高中学业水平等级性考试化 学满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1— C 12— O 16— S 32— Cl 35.5— Na 23—Mg 24— Fe 56—一、选择题(本题包括25小题,每小题2分,共50分,每小题只有一个选项符合题意) 1.世界气候大会与2009年12月在丹麦首都哥本哈根召开,商讨2012至2020年全球温室气体减排协议。
下列物质属于温室气体的是( )A .2NB .2HC .2COD .2O 2.海洋是一个巨大的宝藏,期待着人们的开发和利用。
下列物质不经过化学变化就能从海水中获得的是( ) A .单质溴 B .单质镁 C .烧碱D .食盐3.下列行为不是..健康文明的生活方式的是( )A .不偏食,注意营养均衡B .每天坚持适度锻炼C .沉迷网络聊天、游戏D .不吸烟、不酗酒,远离毒品4.垃圾处理无害化、减量化和资源化逐渐被人们所认识。
垃圾的分类收集是实现上述理念的重要措施。
某垃圾箱上贴有如下图所示的标志,向此垃圾箱中丢弃的垃圾是( )A .危险垃圾B .可回收物C .有害垃圾D .其他垃圾5.当光束通过下列分散系时,能观察到丁达尔效应的是( )A .盐酸B .()3Fe OH 胶体C .氯化钠溶液D .4CuSO 溶液6.实验室制取下列气体时,不能用排气法收集,而只能用排水法收集的是( ) A .3NHB .2ClC .2COD .NO 7.实验室中,有关试剂的保存方法错误的是( )A .烧碱溶液保存在带玻璃塞的试剂瓶中B .液溴用水封保存C .少量金属钠保存在煤油中D .浓硝酸保存在棕色细口瓶中 8.下列实验操作或装置正确的是( )点燃酒精灯蒸馏 过滤 稀释浓硫酸ABC D9.据报载我国最近合成新的同位素,其中一种是18572Hf (铪),它的质子数是( ) A .72 B .113C .185D .257 10.下列物质中,只含..共价键的是( )A .NaClB .2Na OC .HClD .NaOH11.23Na CO 俗名纯碱,下面是对纯碱采用不同分类法的分类。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
宝山区2017学年第二学期期中 高三年级化学学科等级考质量检测试卷相对原子质量:H —1 O —16 F —19 Si —28 Na —23 C —12 一、选择题(本题共40分,每小题2分,每题只有一个正确选项) 1. 下列物质属于纯净物的是( )A. 硬铝B. 胆矾C. 生铁D. 钢2. 下列离子在稳定人体血液的pH 中起作用的是( )A. Na +B. 2Fe+C. 3HCO -D. Cl -3. 属于人工固氮的是( ) A. 分离液态空气制氮气 B. 工业合成氨C. 闪电时N 2转化为NOD. 豆科作物根瘤菌将N 2转化为NH 34. 下列不属于煤干馏产物的是( )A. 焦炭B. 煤焦油C. 焦炉气D. 人造石油5. 下列微粒中,互为同位素的是( )A. 12C 和14CB. O 2和O 3C. H 2和H +D. 冰和干冰6. 配制500mL 0.1mol/L 的Na 2CO 3溶液时,不需要用到的仪器是( )A. 烧杯B. 干燥器C. 玻璃棒D. 500mL 容量瓶7. 下列关于Fe 的性质错误的是( )A. 有银白色光泽B. 能被磁铁吸引C. 遇硫酸钝化D. 能和水蒸气反应8. 下列固体溶于水时吸热的是( )A. 氯化铵B. 氢氧化钠C. 氧化钙D. 过氧化钠9. 关于乙烯的说法错误的是( ) A. 含有两种共价键B. 能使溴水褪色C. 形成的晶体是原子晶体D. 可作果实催熟剂10. 已知1mol 氢气和氧气完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是( ) A. 2222H (g)O (g)2H O(g)241.8kJ +? B. 222H (g)1/2O (g)H O(s)241.8kJ +?C. 222H (g)1/2O (g)H O(g)241.8kJ +?D. 222H O(g)H (g)1/2O (g)241.8kJ ?-11. 不能鉴别乙醇和乙酸的方法是( )A. 观颜色B. 闻气味C. 加石蕊试液D. 用pH 试纸12. 工业制硫酸的适宜条件不包括( ) A. 矿石粉碎成粉末可加快反应速率B. 原料气进入接触室之前需净化处理C. SO 2转化为SO 3时用铁触媒作催化剂D. 用98.3%的浓硫酸吸收SO 313. S 、Cl 是常见的两种非金属元素,下列判断错误的是( ) A. 最外层电子数:S < Cl B. 原子半径:r(S) < r(Cl)C. 热稳定性:H 2S < HClD. 非金属性:S < Cl14. 在海带提碘的实验中可做萃取剂的是( )A. 四氯化碳B. 水C. 乙醇D. 乙酸15. 下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是( ) A. 均采用水浴加热B. 均采用边反应边蒸馏的方法C. 制备乙酸乙酯时乙醇过量D. 制备乙酸丁酯时正丁醇过量16. 右图是电解CuCl 2溶液的装置,其中c 、d 为石墨电极,则下列判断正确的是( )A. a 是阳极,b 是阴极B. c 是正极,d 是负极C. d 电极上发生还原反应D. 通电一段时间后,溶液pH 值减小17. 漂粉精的有效成分是Ca(ClO)2,它会和空气中的CO 2发生反应,生成具有消毒作用的HClO 。
下列表示该过程的离子方程式正确的是( ) A. 2223Ca 2ClO CO H O CaCO 2HClO +-B. 223ClO CO H O HCO HClO --++?C. 22232Ca 2ClO 2CO 2H O Ca(HCO )2HClO +-+++?D. 22223Ca(ClO)2CO 2H O Ca 2HCO 2HClO +-++?+18. 有学生为了证明SO 2是一种酸性氧化物,做了以下实验:向滴有酚酞的氢氧化钠溶液中通入过量的SO 2气体,溶液褪色。
关于该实验下列说法错误的是( ) A. 该实验一定能证明SO 2是一种酸性氧化物B. 若SO 2是一种酸性氧化物,溶液中可能发生的反应是:2232SO 2NaOH Na SO H O +?C. 若SO 2是一种酸性氧化物,溶液中可能发生的反应是:2233SO Na SO 2NaHSO +?D. 若要证明SO 2是一种酸性氧化物,还需在实验结束后再加酚酞或氢氧化钠溶液19. 实验室用KMnO 4和浓盐酸反应制取Cl 2:42222KMnO 16HCl()2KCl2MnCl 5Cl 8H O +?+?浓。
下列判断错误的是( )A. HCl 既作还原剂,又作酸B. 氧化剂和还原剂的物质的量之比为1:8C. Cl 2是氧化产物D. 1mol KMnO 4完全反应,转移电子5mol20. 中和相同体积,相同pH 的Ba(OH)2、NaOH 和NH 3·H 2O 三种稀溶液,所用相同浓度的盐酸的体积分别为V 1、V 2、V 3,则三者关系式为( ) A. V 3 > V 2 > V 1 B. V 3 = V 2 > V 1C. V 1 = V 2 > V 3D. V 3 > V 2 = V 1二、综合题 (一)本题共15分海洋是资源的宝库。
占地球上储量99%的溴分布在海洋中,我国目前是从食盐化工的尾料中提取溴,反应原理是:22Cl 2Br 2Cl Br --+?。
21. 氯原子最外层电子轨道表示式是______________,氯气属于__________分子(填写“极性”或“非极性”)。
22. 已知溴水中存在如下化学平衡:22Br H O H Br HBrO +-+++ƒ。
取少量溴水于一支试管中,向试管中滴加氢氧化钠溶液,溶液颜色变浅。
请用平衡移动的观点解释颜色变浅的原因。
________________________________________________________________。
氟和溴都属于卤族元素,HF 和地壳内SiO 2存在以下平衡:2424HF(g)SiO (s)SiF (g)2H O(g)148.9kJ +++ƒ23. 该反应的平衡常数表达式K=____________。
如果上述反应达到平衡后,降低温度,该反应会_____________(填写“向正反应方向移动”或“向逆反应方向移动”),在平衡移动时逆反应速率先_________后__________(填写“增大”或“减小”)。
24. 若反应的容器容积为2.0L ,反应时间8.0min ,容器内气体的质量增加了0.24g ,在这段时间内HF 的平均反应速率为_________________________。
铝、铁是常见的两种金属,它们的单质及化合物在生活生产中处处可见。
25. 过量的铁和稀硝酸发生反应,产物是Fe(NO 3)2和NO ,写出该反应的化学方程式。
_____________________________________________________________。
26. 实验室配制FeSO 4溶液时,如果没有隔绝空气,FeSO 4会被氧化为_________(填写化学式)。
在该溶液中加入____________试剂,看到____________________________现象,证明溶液变质。
27. KAl(SO 4)2·12H 2O 俗称明矾,常用作净水剂,请述其原因并写出有关的离子方程式。
______________________________________________________________。
28. 已知Ba(AlO 2)2可溶于水,下图表示的是向Al 2(SO 4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y 与加入Ba(OH)2的物质的量x 的关系。
由图可知c 点的沉淀是________(填化学式),已知a-b 时存在的沉淀是Al(OH)3和BaSO 4,两者的物质的量:_________比__________多。
(三)本题共15分工业生产纯碱的工艺流程示意图如下:完成下列填空:29. 粗盐水加入沉淀剂A 、B 除杂质(沉淀剂A 来源于石灰窑厂),写出A 、B 的化学式。
A_____________________ B_____________________30. 实验室提纯粗盐的实验操作依次为:取样→_______→沉淀→________→________→冷却结晶→________→烘干。
31. 工业生产纯碱的工艺流程中,先通氨气,再通二氧化碳的原因是____________________。
32. 碳酸化时产生的现象是________________________________________,碳酸化后过滤,滤液D 最主要的成分是____________(填写化学式)。
33. 产品纯碱中含有碳酸氢钠。
如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数(已知:样品质量为1m ,加热后固体质量为2m ),纯碱中碳酸氢钠的质量分数可表示为3(NaHCO )W =_______________________________。
化合物A 最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。
A 的钙盐是人们喜爱的补钙剂之一。
A 在某种催化剂的存在下被氧化,其产物不能发生银镜反应。
在浓硫酸存在下,A 可发生如下所示的反应。
34. A 含有的官能团名称为__________________,A→F 的反应类型为____________________。
35. 写出一种和B 具有相同官能团的同分异构体的结构简式____________________________。
36. 写出A→D 的化学方程式________________________________________________________。
37. 有机物C 3H 6O 含有醛基,一定条件下和H 2反应生成CH 3CH 2CH 2OH 。
检验该有机物是否完全转化的操作是___________________________________________________________________。
38. 有机物E 可以由CH 2=CHCH 2OH 得到,改变条件它也可以制得其他产物。
设计一条由CH 2=CHCH 2OH合成CH 3CH 2COOH 的路线。
合成路线流程图示例如下:CH 3CH 2OH 170−−−→浓硫酸℃CH 2=CH 22Br −−→参考答案一、选择题二、综合题(一)本题共15分21. ,非极性。
(共3分)22. 滴加氢氧化钠溶液,OH-和H+结合,导致H+浓度降低,平衡向右移动,溶液颜色变浅。
(共3分)23. [SiF4][H2O]2/[HF]4,向正反应方向移动,减小,增大。
