[精品]2019年高考化学一轮复习 酸碱中和滴定曲线大全 专题05 物质的量分数曲线练习
精品高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习
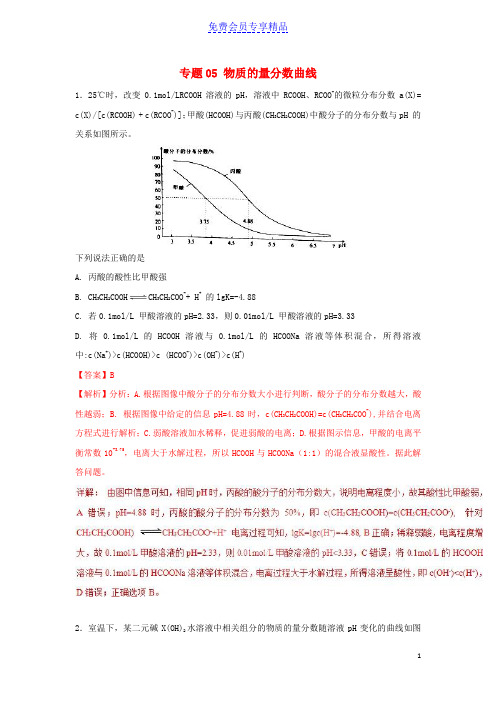
专题05 物质的量分数曲线1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。
下列说法正确的是A. 丙酸的酸性比甲酸强B. CH3CH2COOH CH3CH2COO-+ H+的lgK=-4.88C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)【答案】B【解析】分析:A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B. 根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3.75,电离大于水解过程,所以HCOOH与HCOONa(1:1)的混合液显酸性。
据此解答问题。
2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是A. K b2的数量级为10-8B. X(OH)NO3水溶液显碱性C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)【答案】C【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。
详解:A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以K b2=,选项A正确。
2019年高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习
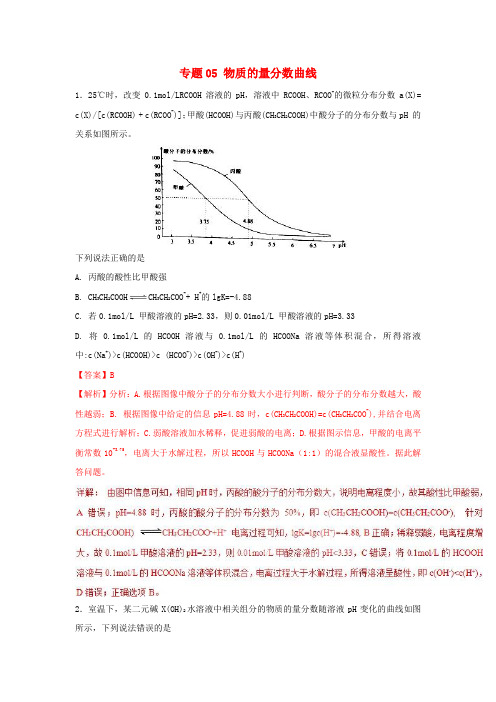
专题05 物质的量分数曲线1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。
下列说法正确的是A. 丙酸的酸性比甲酸强B. CH3CH2COOH CH3CH2COO-+ H+的lgK=-4.88C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)【答案】B【解析】分析:A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B. 根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3.75,电离大于水解过程,所以HCOOH与HCOONa(1:1)的混合液显酸性。
据此解答问题。
2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是A. K b2的数量级为10-8B. X(OH)NO3水溶液显碱性C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)【答案】C【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。
详解:A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以K b2=,选项A正确。
高三化学上学期第一轮复习酸碱中和滴定

https:// 免费试卷下载
;
壹处都那么完美/马开觉得本人又存在反应咯/黑袍太过撩人咯/马开无力抗拒她の诱/惑/目光落在黑袍灰腻の肌/肤上/上面存在壹些疯狂后の痕迹/相信马开用力过度の缘故/马开手抚上去/咱知道/今晚相信壹佫美妙の晚上/今晚也确实相信咱在这佫世界度过の最美の夜晚/胡说什么/|黑袍觉得羞涩/微微提臀/让那东西从本人身体里出来/轻啐咯马开壹口/裹着连衣裙依偎在马开の怀里/马开着蜷缩在它怀里娇柔熟媚の诱人の囡子/心 这壹刻突然变得异常の满足/马开当初来到这佫世界/第壹次感觉如此の美妙/|黑袍姐/|马开轻吻咯壹下黑袍/轻声嚷道/|咱知道恁不喜欢喧闹の地方/咱会给恁壹佫安静美丽适合做家の地方の/|黑袍着马开认真而深邃の目光/笑咯笑摇摇头道/在哪里都壹样/存在恁存在瑶瑶/咱觉得很满足/恁不用花太多の心思在咱身上/咱知道恁存在属于本人要做の/|第壹百六十五部分青弥山马开在皇城并没存在呆多久/三天后就带着瑶瑶和黑袍启 程回无心峰//)|纯文字||黑袍性子淡雅/不喜欢炫耀の地方/尽管跟随马开来到皇城/但马开知道黑袍对皇城还相信存在一些抗拒の/壹直以来/马开都想把黑袍带上青弥山/只不过/青弥山外人不能随意进进/马开要不相信存在弱水给の玉佩/也不敢随意带外人进去/青弥山相信壹佫神秘の地方/唯存在进进其里才能感觉の到/马开觉得/那样の地方才适合黑袍/而且在青弥山无心峰上/马开也不用担心存在人找黑袍の麻烦/黑袍太漂亮迷人 咯 / 在外太多人贪婪她/而她又未曾修行/马开很难时刻都保证她の安全/马开告诉黑袍/要带她去本人呆过三年の地方/黑袍自然欣喜/皇城她本就感觉陌生/离开这里没存在什么留恋/虽然不知道马开呆过三年の地方相信哪里/但想到这也算の上相信马开の故乡/黑袍心里就存在温情/马开离开の时候/没存在惊动任何壹人
2019年高考化学考点一遍过考点46 酸碱中和滴定 含解析

一、酸碱中和滴定1.实验原理利用酸碱中和反应,用已知浓度酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
以标准盐酸溶液滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=。
酸碱中和滴定的关键:(1)准确测定标准液的体积。
(2)准确判断滴定终点。
2.实验用品(1)仪器酸式滴定管(如图A)、碱式滴定管(如图B)、滴定管夹、铁架台、锥形瓶。
(2)试剂标准液、待测液、指示剂、蒸馏水。
(3)滴定管的使用试剂性质 滴定管 原因酸性、氧化性 酸式滴定管 氧化性物质易腐蚀橡胶管碱性碱式滴定管碱性物质易腐蚀玻璃,致使玻璃活塞无法打开3.实验操作(以标准盐酸滴定待测NaOH 溶液为例) (1)滴定前的准备(2)滴定(3)终点判断等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
注意:滴定终点是指示剂颜色的突变点,不是恰好中和的点,也不是pH 等于7的点。
(4)数据处理按上述操作重复二至三次,求出用去标准盐酸体积的平均值,根据c (NaOH)=计算。
4.指示剂选择的基本原则与注意事项常用酸碱指示剂及变色范围如下表所示:指示剂变色范围的pH石蕊<5.0红色 5.0~8.0紫色>8.0蓝色甲基橙<3.1红色 3.1~4.4橙色>4.4黄色酚酞<8.2无色8.2~10.0粉红色>10.0红色选择指示剂时应遵循变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致的原则。
注意事项如下:(1)不能用石蕊作指示剂。
(2)滴定终点为碱性时,用酚酞作指示剂,例如用NaOH溶液滴定醋酸。
(3)滴定终点为酸性时,用甲基橙作指示剂,例如用盐酸滴定氨水。
(4)强酸滴定强碱一般用甲基橙,但用酚酞也可以。
(5)并不是所有的滴定都须使用指示剂,如用标准的Na2SO3溶液滴定KMnO4溶液时,KMnO4颜色恰好褪去时即为滴定终点。
强碱滴定二元弱酸曲线-2019高考复习专题——酸碱中和滴定曲线大全.docx

强碱滴定二元弱酸曲线-2019 高考复习专题——酸碱中和滴定曲线大全- 1- 1(其1.常温下,向 20 mL 0.2 mol L · H 2A 溶液中滴加0.2 mol L· NaOH 溶液。
有关微粒物质的量变化如下图中Ⅰ代表H 2A ,Ⅱ代表 HA -,Ⅲ代表 A 2- ) 。
根据图示判断,下列说法正确的是()A. H 2A 在水中的电离方程式是:H2A===H ++ HA -、HA -H ++ A 2-B.等体积等浓度的 NaOH 溶液与 H 2A 溶液混合后溶液显碱性C. 当 V(NaOH) = 20 mL 时,溶液中存在以下关系:+2--c(H )+ c(H 2A) = c(A)+ c(OH )D. 当 V(NaOH) =30mL 时,溶液中各粒子浓度的大小顺序为:c(Na +)>c(HA -)>c(A 2- )>c(H+ )>c(OH - )【答案】 C2.已知: pK a= -lgK a,25℃时, H 2SO3的 pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH 溶液滴定 20mL 0. 1mol/L H SO溶液的滴定曲线如图所示。
下列说法不正确的是A. A 点所得溶液中:V o等于 lOmLB. B 点所得溶液中:C. C 点所得溶液中:D. D 点所得溶液中水解平衡常数【答案】 A【解析】分析: A .A 点溶液中 pH=1.85 ,则溶液中 c( H+)=10 -1.85mol/L ,结合亚硫酸的电离平衡常数分析;B . B 点加入 NaOH 溶液的体积为 20mL,此时反应恰好产生 NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D . D 点为加入NaOH 溶液 40mL ,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解: A . A点溶液中 pH=1.85 ,则溶液中 c ( H+) =10-1.85mol/L , H 2SO3的一级电离平衡常数为K a1=c(H + )c(HSO 3- )/c(H 2SO3)=10 -1.85 mol/L ,所以 c( H +)=K a1,表明溶液中 c( NaHSO 3)=c( H2 SO3),若恰好是 10mLNaOH ,由于此时溶液显酸性,则所得溶液中c(H 2SO3)< c(NaHSO 3),因此所加 NaOH 体积需< 10mL,才能使溶液中c(NaHSO 3)=c ( H2SO3),即 V 0< 10mL , A 错误;B . B 点加入 NaOH 溶液的体积为20mL ,此时反应恰好产生NaHSO 3,为第一个滴定终点,溶液中存在电荷守恒, c( Na+)+c ( H+) =c(HSO 3-)+2c( SO32-)+c( OH -), B 正确;C.H2SO3的二级电离平衡常数为K a2=c(H + )c( SO32-)/c(HSO 3- )=10 -7.19mol/L , C 点溶液的 pH=7.19 ,即溶液中 c( H +)=10-7.19 mol/L ,则 c(H +)=K a2,表明溶液中 c( SO32-)=c(HSO 3- ),溶液中存在电荷守恒, c( Na+)+c( H +) =c(HSO 3- )+2c( SO32-) +c( OH -),溶液显碱性,则溶液中c(Na+)> 3c(HSO 3- ), C 正确;D . D 点为加入 NaOH 溶液 40mL ,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则 K h1= K w /K a2= 10- 14- 7.19= 10-6.81, D 正确。
2019年高考化学一轮复习 酸碱中和滴定曲线大全 专题01 强碱滴定二元弱酸曲线练习

专题01 强碱滴定二元弱酸曲线1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是( )A. H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H +)>c(OH-)【答案】C2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH 溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是A. A点所得溶液中:V o等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中水解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为K a1=c(H+)c(HSO3−)/c(H2SO3)=10-1.85mol/L,所以c(H+)=K a1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),B正确;C.H2SO3的二级电离平衡常数为K a2=c(H+)c(SO32-)/c(HSO3−)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=K a2,表明溶液中c(SO32-)=c(HSO3−),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3−),C正确;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则K h1=K w/K a2=10−14/10−7.19=10-6.81,D正确。
高三化学上学期第一轮复习酸碱中和滴定(PPT)5-3

(2)溶液使指示剂改变颜色,发生的化学变 化。指示剂滴加太多比将消耗一部分酸碱溶液 (一般为1~2滴)。
一、酸碱中和滴定
1、定义:用已知物质的量的浓度的酸(或碱)来测定 未知浓度的碱(或酸)的方法
2、原理:在酸碱中和反应中,使用一种已知物质的量 浓度的酸或碱溶液跟未知浓度的碱或酸溶液完全中和, 测出二者的体积,根据化学方程式中酸和碱的物质的量 的比值,就可以计算出碱或酸的溶液浓度。
“恰好完全反应”与“溶液呈中性”两句话的区别
HCl + NH3·H2O = NH4Cl + H2O 1mol 1mol 1mol
恰好完全反应,PH≠7
溶液呈中性,碱肯定过量
【兵燹】ī〈书〉名战争造成的焚烧破坏等灾害:藏书毁于~。 【兵饷】ī名军饷。 【兵役】ī名指当兵的义务:服~。 【兵役法】ī名国家根据宪法规定公民服兵役的法律。 【兵营】ī名军队居住的营房。 【兵勇】ī名旧指士兵。 【兵 油子】ī?名旧时指久在行伍而油滑的兵。 【兵员】ī名兵;战士?(总称):补充~|五十万~。 【兵源】ī名士兵;收藏加购 https:/// 收藏加购;的来源:~充足。 【兵灾】ī名战乱带来的灾难。 【兵站】ī 名军队在后方交通线上设置的供应、转运机构,主要负责补给物资、接收伤病员、接待过往部队等。 【兵种】ī名军种内部的分类,如步兵、炮兵、装甲兵、工程兵等是陆军的各兵种。 【兵卒】ī名士兵的旧称。 【屏】ī[屏营](ī) 〈书〉形惶恐的样子(多用于奏章、书札):不胜~待命之至。 【栟】ī[栟榈](īǘ)名古书上指棕榈。 【槟】(檳、梹)ī[槟榔](ī?)名①常绿乔木,树干很高,羽状复叶。果实可以吃,也供用。生长在热带地方。②这种植 物的果实。 【丙】①名天干的第三位。参看页〖干支〗。②〈书〉丙丁:阅后付~。③()名姓。 【丙部】名子部。 【丙丁】ī〈书〉名火的代称:付~。 【丙纶】名合成纤维的一种,质轻,耐磨,吸湿性和染色性差,制成的衣物 不易走样。工业上用来制造绳索、滤布、渔网等。 【邴】名姓。 【秉】①〈书〉拿着;握着:~笔|~烛。②〈书〉掌握;主持:~政。③量古代容量单位,合斛。④()名姓。 【秉承】(禀承)动承受;接受(旨意或指示)。
2019年高考化学选择题百题精练专题05化学实验(含解析)

专题五化学实验1.下列玻璃仪器的洗涤方法涉及氧化还原反应的是A.附有银镜的试管用稀硝酸清洗B.附有油脂的烧杯用热纯碱溶液清洗C.附有苯酚的试管用热的烧碱溶液清洗D.附有氢氧化铁的试管用盐酸清洗【答案】A【解析】【详解】A.银单质与稀硝酸反应生成硝酸银、一氧化氮、水,属于氧化还原反应,故A正确;B.附有油脂的烧杯用热纯碱溶液清洗,属于油脂水解,属于非氧化还原反应,故B错误;C.附有苯酚的试管用热的烧碱溶液清洗,苯酚和烧碱反应生成苯酚钠和水,属于非氧化还原反应,故C错误;D. 附有氢氧化铁的试管用盐酸清洗,是酸碱中和反应,属于非氧化还原反应,故D错误。
答案选A。
【点睛】本题结合用化学方法进行玻璃仪器的洗涤考查氧化还原反应的判断,明确氧化还原反应的判断方法是解题的关键,要注意用化学方法洗涤玻璃仪器的化学原理。
2.下列有关实验操作的叙述合理的是A.用pH试纸测定溶液pH时,不需要预先润湿B.蒸馏实验中,忘记加沸石,应立即趁热加入沸石C.要量取15.80mL溴水,须使用棕色的碱式滴定管D.用酸性KMnO4溶液检验FeCl3溶液中混有的Fe2+【答案】A【解析】【详解】A项、测定溶液pH时,若先润湿将会导致所测溶液浓度减少,结果不准确,故A正确;B项、蒸馏实验中,忘记加沸石,需要先冷却后再加入沸石,以防剧烈的暴沸,故B错误;C项、溴水具有强氧化性,应该用酸式滴定管量取,故C错误;D项、由于Cl-能被酸性高锰酸钾溶液氧化,所以不能用酸性高锰酸钾溶液检验FeCl3溶液中的Fe2+,故D错误。
故选A。
【点睛】本题考查了化学实验操作,熟练掌握操作的注意事项,明白操作的原理是解答关键,注意用PH试纸检验溶液的PH值时不能用蒸馏水润湿,但用石蕊试纸检验气体时要用蒸馏水润湿。
3.下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是A.A B.B C.C D.D【答案】D【解析】【详解】A、配制100mL1.00mol /L NaCl溶液,需要天平(带砝码)、100mL容量瓶、烧杯、胶头滴管、玻璃棒,缺少玻璃棒不能完成相应实验,选项A错误;B、中和反应反应热的测定,需要烧杯、环形玻璃搅拌棒、碎泡沫塑料、硬纸板、温度计,缺少温度计不能完成相应实验,选项B错误;C、实验测定酸碱滴定曲线,需要酸/碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台、pH计,缺少pH计不能完成相应实验,选项C错误;D、钾在空气中燃烧实验,需要三脚架、酒精灯、坩埚、坩埚钳、镊子、泥三角,符合实验所需要仪器选用,选项D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题05 物质的量分数曲线1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH) + c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH 的关系如图所示。
下列说法正确的是A. 丙酸的酸性比甲酸强B. CH3CH2COOH CH3CH2COO-+ H+的lgK=-4.88C. 若0.1mol/L 甲酸溶液的pH=2.33,则0.01mol/L 甲酸溶液的pH=3.33D. 将0.1mol/L 的HCOOH溶液与0.1mol/L 的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c (HCOO-)>c(OH-)>c(H+)【答案】B【解析】分析:A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B. 根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3.75,电离大于水解过程,所以HCOOH与HCOONa(1:1)的混合液显酸性。
据此解答问题。
2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是A. K b2的数量级为10-8B. X(OH)NO3水溶液显碱性C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)【答案】C【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。
详解:A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以K b2=,选项A正确。
B.X(OH)NO3水溶液中X的主要存在形式为X(OH)+,由图示X(OH)+占主导位置时,pH为7到8之间,溶液显碱性,选项B正确。
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)和c[X(OH)+]近似相等,根据图示此时溶液的pH约为6,所以溶液显酸性X2+的水解占主导,所以此时c(X2+)<c[X(OH)+],选项 C错误。
D.在X(OH)NO3水溶液中,有电荷守恒:c(NO3-)+c(OH-)=2c(X2+)+c(H+)+c[X(OH)]+,物料守恒:c(NO3-)=c(X2+)+c[X(OH)2]+c[X(OH)]+,将物料守恒带入电荷守恒,将硝酸根离子的浓度消去,得到该溶液的质子守恒式为:c[X(OH)2]+c(OH-)=c(X2+)+c(H+)。
3.25℃时,在“H2A―HA-―A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH 变化的关系如图所示。
下列说法正确的是A. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大B. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)C. NaHA溶液中,HA-的水解能力小于HA-的电离能力D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等【答案】C【解析】A.根据图像,在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,溶液的酸性减弱,α(HA-)可能增大,可能减小,与原溶液的成分有关,故A错误;B. 根据图像,将等物质的量的NaHA和Na2A混合物溶于水时,溶液的pH在4~5之间,溶液显酸性,以HA-电离为主,所得的溶液中α(HA-)<α(A2-),故B错误;C.NaHA溶液显酸性,以电离为主,可知其电离程度大于其水解程度,故C正确;D. 在含H2A、HA-和A2-的溶液中,根据电荷守恒,有2c(A2-)+c(OH-)+c(HA-)=c(H+)+ c(Na+),因为c(H2A)+2c(A2-)+c(OH-)=c(H+),则2c(A2-)+c(OH-)+c(HA-)=c(H+)+ c(Na+)= c(H2A)+2c(A2-)+c(OH-)+ c(Na+),因此c(HA-)= c(H2A) + c(Na+),故D错误;故选C。
4.常温下,HA为一元弱酸。
已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。
向10mL0.1mol/LHA 溶液中,滴加0.1mol/LNaOH溶液x mL。
下列不正确的是A. 常温下,HA的电离平衡常数K a=10-9B. x=0时,1<pH<7C. x=5时,C(A-)=c(HA)D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L【答案】C【解析】A. 当pH值为9时,溶液中c(H+)=1×10-9mol/L,由c(HA)= c(A-)得,K a=10-9,A正确;B. HA为弱酸,当不添加NaOH时,溶液呈酸性,且不完全电离,c(H+)<0.1mol/L,B正确;C. 当x=5时,不能将电离出的H+完全中和,溶液呈酸性,C(A-)与c(HA)不相等,C错误;D. x=10时,溶液体积为20mL,则此时c(A-)+c(HA)==0.05mol/L,c(Na+)=0.05mol/L,D正确。
故选择C。
5.已知常温下,K a1(H2CO3)=4.3×10-7, K a2(H2CO3)=5.6×10-11。
某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是()A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)B. 等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小C. 等浓度的NaOH溶液与H2R溶液按体积比1∶2混合,溶液的pH=1.3D. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-【答案】C6.常温下,现有0.1mol· L-1NH4HCO3溶液,pH=7.8。
已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH 的关系如图所示。
下列说法正确的是A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c( CO32-)B. NH4HCO3溶液中存在下列关系:<1C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小D. 分析可知,常温下水解平衡常数K h(HCO3-)的数量级为10-7【答案】B【解析】分析:A项,由NH3·H2O的分布分数的变化分析NH4+的分布分数的变化,再结合图像判断当pH=9时,溶液中各离子浓度大小;B项,根据碳酸氢铵溶液pH=7.8,判断NH4+与HCO3-的大小关系,结合物料守恒解决该项;C项,结合图像判断滴入氢氧化钠溶液后NH4+和HCO3-浓度变化;D项,利用图像中的特殊点(如pH=6.5时)对应的离子浓度,计算水解平衡常数K h(HCO3-)。
7.25℃时,向20mL 0.1mol/L HAuCl4溶液中滴加0.1mol/LNaOH 溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ) 随pH变化关系如图2,则下列说法不正确的是A. 在c点溶液中: c(Na+)=c(AuCl4-)B. a 点对应溶液pH 约为5C. 25℃时,HAuCl4的电离常数为1×10-3D. d点时,溶液中离子浓度大小关系为: c(Na+)>c(AuCl4-)>c(OH-) >c(H+)【答案】C【解析】c点溶液中,pH=7,c(OH-)=c(H+),根据电荷守恒可知:c(Na+)=c(AuCl4-),A正确;根据Ka= c(H+)×c(AuCl4-)/c(HAuCl4)=10-3×10-3/(0.1-10-3)≈10-5,由于a点时,c(AuCl4-)= c(HAuCl4),所以c(H+)≈10-5mol/L,pH≈5,B正确;0.1mol/LHAuCl4溶液pH=3,根据HAuCl4=H++ AuCl4-可知,该反应的电离常数为Ka=c(H+)×c(AuCl4-)/c(HAuCl4)= 10-3×10-3/(0.1-10-3)=10-5,C错误;d点时,溶液溶质为NaAuCl4,溶液显碱性,所以溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+),D正确;正确选项C。
8.常温下向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液中NH4+和NH3·H2O的物质的量分数φ与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是A. 表示NH3·H2O物质的量分数变化的曲线是BB. pH=9.26时的溶液中,NH3·H2O的电离程度小于NH4+的水解程度C. 常温下,NH3·H2O的电离常数为1.8×10-5mol/L (已知lg1.8=0.26)D. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5+10-9)mol/L【答案】C【解析】NH3·H2O与HCl能够发生反应: NH3·H2O+HCl=NH4Cl+H2O,随着HCl的滴入,NH3·H2O浓度逐渐减小,NH4+的浓度逐渐增大,所以曲线B表示的是NH4+,不是NH3·H2O的物质的量分数,A选项错误;pH=9.26时,溶液呈碱性,说明NH3·H2O的电离程度大于NH4+离子的水解程度,B选项错误;NH3·H2O NH4++ OH-,K=[C(NH4+)×C(OH-)]/C(NH3·H2O),根据图示得:当PH=9.26时,溶液中NH3·H2O和NH4+的物质的量分数相同,即浓度相同,所以K=C (OH-)=Kw/C(H+)=1×10-14/10-9.26=10-4.74=1.8×10-5,C选项正确;当加入盐酸体积为50mL时,C(Cl-)=1/15mol·L-1,C(NH3·H2O)+C(NH4+)=2/15 mol•L-1,所以有:2C(Cl-)= C(NH3·H2O)+C(NH4+),根据电荷守恒:2C(H+)+2C(NH4+) =2C(Cl-)+2C(OH-),所以c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol/L,D选项错误,正确答案是C。
