新版人教版九年级下册化学【盐的化学性质复分解反应课件】
合集下载
人教九下化学11.1 生活中常见的盐—— 复分解反应实质 课件(共42张PPT)
NO3-
NO3-
K+
K+
NO3-
K+
NaCl+KNO3 ——
K+ NO3-
Cl-
Na+
Na+ Cl-
K+
NO3-
NO3-
NO3K+
K+
NaCl+KNO3 ——
Cl-
Na+
K+ NO3-
NO3-
Na+
Cl-
NO3K+
K+
NO3-
K+
NaCl+KNO3——
K+ NO3-
ClNa+
NO3-
K+
Na+
Ca2+
HO-
HO-
HO-
Ca2+
HO-
Ca(OH)2+CuCO3 ——
Ca2+
CO3C2u- 2+CuC2O+ 32C-O3C2u- 2+ CuC2O+ 32C-O3C2u- 2+CuC2O+ 32-
HO-
Ca2+ HO-
HOHO-
Ca(OH)2+CuCO3 ——
HOCa2+
HO-
CO3C2u- 2+CuC2O+ 32C-O3C2u- 2+
⑹HCl + ⑺H2SO4 ⑻CaO +
NaOH == NaCl +CuO==CuSO4 H2O =Ca(OH)2
+ H2O +H2O
⑼BaCl2 + Na2SO4 == BaSO4↓+ 2NaCl
人教版初三化学九下第十一单元盐化肥课件ppt课题1常见的盐《复分解反应条件和盐的化学性质》知识点归纳

复
③(可溶)盐+(可溶)碱——新盐+新碱
分
解
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
反
④(可溶)盐+(可溶)另一盐→新盐+新的另一盐 应
AgNO3+NaCl=AgCl↓+ NaNO3
判断下列复分解反应能否发生:
不能
H2SO4 + NaNO3—Ba—SO4↓+ 2NaCl Na2SO4 + BaCl2—2K—NO3 + CO2↑+H2O 2HNO3 + K2CO不3—能— KNO3 + NaOH——
化学基本反应类型的比较
化合反应分解反应 置换反应复分解反应
由两种或 由一种物质 由一种单质 由两种化
复分解反应和盐的化学性质
学习目标 1.知道复分解反应的概念、发生的条件和实 质,能判断复分解反应是否能发生。 2.掌握盐的化学性质
(可溶)盐 + (可溶)碱 = 新盐 + 新碱 (可溶)盐 + (可溶)盐 = 新盐 +另一种新盐
产生蓝色絮状沉淀 产生白色沉淀
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ 增加实验:烧碱溶液和氯化铁溶液 FeCl3 + 3NaOH = 3NaCl +Fe(OH)3↓
产生白色沉淀 (可溶)盐+ (可溶)碱= 新盐 + 新碱
工业上用来制取氢氧化钠
复分解反应发生的条件 (满足一条即可) ①生成水;②生成气体;③生成沉淀。
复分解反应的实质:
离子之间反应生成沉淀、气体或水
复分解反应的条件
可溶性酸+可溶性碱=可溶性盐+水 需要加酸碱指示剂
11.1生活中常见的盐(第2课时 盐的化学性质、复分解反应)课件-九年级化学人教版下册

BaCl2+H2SO4= BaSO4 +2HCl 2NaOH+H2SO4= Na2SO4 + 2H2O Na2CO3+H2SO4= Na2SO4 + H2O + CO2 BaCl2+ Na2CO3= BaCO3 + 2NaCl BaCl2+ NaOH =不反应 Na2CO3 + NaOH =不反应
Fe
+
H2
SO4
=
FeSO4
+
H2
↑
C.酸+碱==盐+水
CuO + H2SO4 ==== CuSO4 + H2 O
D.酸+盐==新盐+新酸 2HCl + Ca(OH) 2 ==== CaCl2 + 2H2 O ×EFG...碱碱盐+++非盐盐金====属新盐氧盐+盐化+新物碱==盐3+N水HaOCHl +2+NAFageONCHOl33+===C==O==2AF=ge=C(O=l↓=H)N+3a↓H2CN+OO333N+aHC2lO
沉淀
气体
水
×
√ ×
复分解反应发生的条件
复分解反应要发生,且能够进行到底,一般应考虑两方面的条件:
1.反应物要求的条件:有酸酸溶,无酸两溶
2.生成物的条件要求:
气体、沉淀、水一种 难电离的物质
两者缺 一不可
下列酸碱盐的性质中属于复分解反应的有( )
A.×酸+金属==盐+氢气 B.酸+金属氧化物==盐+水
√
×
专题盐的化学性质和复分解反应精品PPT课件

2.(2011·临沂)下列各组物质中,在通常情况下不能发生化学反应 的是( )
b.生成物至少一种为沉淀、气体或水。 ④盐+金属=新盐+新金属 发生条件:a.盐必须可溶或微溶。 b.金属单质除____钾__、__钙__、__钠_____。 c.金属的活动性比盐中金属的活动性___强_____。
考点二 复分解反应 1.概念:两种化合物相互交换成分,生成另外两种化合物的反应。 反应表示为:AB+CD―→AD+CB。 发生条件:生成物中有__气__体__放出、有___水__生成或有__沉__淀__析出。 2.复分解反应的类型 ①盐+盐=新盐+新盐 ②盐+碱=新盐+新碱 ③盐+酸=新盐+新酸 ④酸+碱=盐+水 ⑤酸+金属氧化物=___盐___+____水____
(3)利用K2CO3溶液和______溶液反应,可制取KOH。
【解析】(1)②是盐和氢氧化钠的反应属于盐和碱的反应;(2)根据发 生复分解反应的条件分析,①和②都能反应的原因是生成物中都有沉淀( 难溶物或不溶物);(3)制取一种新碱要考虑K2CO3溶液与可溶性碱反应,并 且反应后生成的碳酸盐是不溶于水的沉淀物,故应填氢氧化钙[或Ca(OH)2 或氢氧化钡或Ba(OH)2]。
考点一 盐的化学性质 ①盐+盐=___新__盐___+____新__盐___ 发生的条件:a.反应物必须____可__溶__或__微__溶____。 b.生成物至少一种为_____沉__淀____。 ②盐+酸=__新__酸___+__新__盐____ 发生的条件:a.反应物盐除去AgCl、BaSO4。 b.生成物至少一种为_沉__淀__、_气__体__或_水____。 ③盐+碱=_新__碱__+_新__盐__ 发生的条件:a.反应物必须___可__溶__或__微__溶____。
最新人教版九年级下册化学PPT教学课件11.1.2复分解反应和盐的化学性质
、CO32
、SO24
7.(1分)(2020·南阳模拟)用括号内的物质不能区分的一组是( A ) A.NaOH、NaCl、Na2SO4三种溶液(酚酞) B.Na2CO3、AgNO3、BaCl2三种溶液(稀盐酸) C.铁粉、碳粉、氧化铜粉末(稀硫酸) D.NaCl、NaOH、NH4NO3三种固体(水)
A.该溶液是一种碱的溶液
B.该溶液中含有 SO24 离子 C.该溶液中的溶质可能是Na2CO3 D.该溶液能使紫色石蕊溶液变红色
加入的物 酚酞溶 BaCl2
质
液
溶液
稀盐酸
实验现象 变红色
白色沉 淀
产生气 体
6.(3分)(2020·满洲里模拟)如图是生成盐的五种化学反应,请回答下列问题。
(1)若反应②中生成的盐是BaSO4,则所用的酸是___H_2S__O_4 __(写化学式); (2)若反应③用氢氧化钙与硫酸铜溶液反应,则生成的盐名称是___硫__酸__钙____;
(2)向第二支试管的滤液中滴入适量的___B_a_(_O_H_)_2 __溶液,反应方程式为 ___B_a_(_O_H_)_2+_K_2_C_O_3_=_=_=_=_B_a_C_O_3↓__+_2_K_O_H___,再经过滤、蒸干滤液,得到白色固 体氢氧化钾。
3.复分解反应发生的条件: 当两种化合物互相交换成分,生成物中有___沉__淀____、___气__体____或___水____生 成时,复分解反应才可以发生。
二、盐的化学性质 1.与某些金属发生置换反应生成另一种金属和另一种盐: 如铁与硫酸铜溶液反应的化学方程式为 ___F_e_+_C_u_S_O_4_=_=_=_=_C_u_+_F_e_S_O_4 __。 2.与某些酸发生复分解反应生成另一种盐和酸: 如氯化钡与硫酸溶液反应的化学方程式为 ___B_a_C_l_2+_H_2_S_O_4_=_=_=_=_B_a_S_O_4↓__+_2_H_C_l___。
人教版九年级化学下册第11单元复习课件2盐的化学性质与复分解反应(共43张PPT)
A.加入AgNO3溶液和几滴稀硝酸 B.加入紫色的石蕊试液 C.加入BaCl2溶液和几滴稀硝酸 D.先加入紫色的石蕊试液,再另取溶 液加入AgNO3溶液和几滴稀硝酸
A、产生白色AgCl沉淀只能鉴定有Cl-
B、紫色石蕊变红色只能鉴定有H+
C、不反应 D、紫色石蕊变红色鉴定有H+,产生白色 AgCl沉淀鉴定有Cl-
B.在氢氧化钠溶液中:H+、Mg2+、Cl-
C.在氯化钠溶液中:K+、Ca2+、NO3D.在硫酸铵溶液中:Na+、Cu2+、OH-
H+ OH-
NH4+
物质或离子共存题
2、下列各组物质分别加入足量的水中,能得到
无色透明溶液的是( )
D
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2 C.CuSO4、KCl 、HCl D.Na2CO3、NaCl、Na2SO4
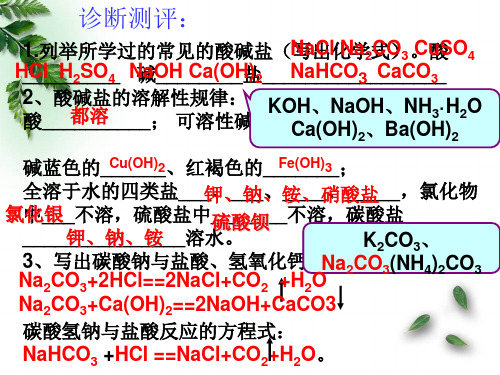
诊断测评:
1.列举所学过的常见的酸碱盐(N写a出Cl化N学a2式CO)3。Cu酸SO4 H_C_l__H_2_S_O_4_ N碱aO__H_C__a_(O__H盐)2___N_a_H__C_O_3__C_a_C__O_3_ 2酸、__酸_都碱__溶盐__的__溶_解;性可规溶律性:碱有K5O种CHa_、(_ON_H_a)_O2_、H_、B__aN,(OH不H3·)溶H22性O
A、Ca(OH)2
B、CaO
C、CaCO3
D、AgNO3
AgNO3+HCl=AgCl +HNO3
Ca(OH)2+2HCl=CaCl2+2H2O
复分解反应的产物--沉淀、气体或水
八大沉淀
不共存离子对
A、产生白色AgCl沉淀只能鉴定有Cl-
B、紫色石蕊变红色只能鉴定有H+
C、不反应 D、紫色石蕊变红色鉴定有H+,产生白色 AgCl沉淀鉴定有Cl-
B.在氢氧化钠溶液中:H+、Mg2+、Cl-
C.在氯化钠溶液中:K+、Ca2+、NO3D.在硫酸铵溶液中:Na+、Cu2+、OH-
H+ OH-
NH4+
物质或离子共存题
2、下列各组物质分别加入足量的水中,能得到
无色透明溶液的是( )
D
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2 C.CuSO4、KCl 、HCl D.Na2CO3、NaCl、Na2SO4
诊断测评:
1.列举所学过的常见的酸碱盐(N写a出Cl化N学a2式CO)3。Cu酸SO4 H_C_l__H_2_S_O_4_ N碱aO__H_C__a_(O__H盐)2___N_a_H__C_O_3__C_a_C__O_3_ 2酸、__酸_都碱__溶盐__的__溶_解;性可规溶律性:碱有K5O种CHa_、(_ON_H_a)_O2_、H_、B__aN,(OH不H3·)溶H22性O
A、Ca(OH)2
B、CaO
C、CaCO3
D、AgNO3
AgNO3+HCl=AgCl +HNO3
Ca(OH)2+2HCl=CaCl2+2H2O
复分解反应的产物--沉淀、气体或水
八大沉淀
不共存离子对
人教九年级化学下册第十一单元课题1 生活中常见的盐 第2课时 复分解反应(共24张PPT)

Cl
SO42- OH- CO32-
K+ Na+ ①钾,钠,铵,硝酸盐 4+ NH 都易溶 Ba2+ Ca2+ 碱溶
NO3Ba2+ Ca2+ Mg2+
. . . . . .
Cl- SO42- CO32- OH不溶
全 溶
不溶
不 溶
不 溶
Ag+
小口决
钾钠氨盐硝酸盐, 均能溶于水中间。 硫酸盐中钡不溶, 氯化盐中银不溶。 碳酸钾钠氨盐溶, 氢氧钾钠钙钡溶。
③盐+碱→ 新盐+新碱 条件:反应物两者均可溶; 生成物有沉淀或气体或水 ④盐+盐→ 新盐+新盐 条件:反应物两者均可溶; 生成物有沉淀或气体或水
OH-
NO3溶、挥
溶 溶 溶
Cl溶、挥
溶 溶 溶
SO42溶
溶 溶 溶
CO32溶、挥
溶 溶 溶
酸 、 碱 、 盐 的 溶 解 性 ( 20℃ )
H+
NH4+ K+ Na+ 溶、挥 溶 溶
分析
向盛有少量BaCl2溶液的试管 滴入硫酸钠溶液,观察现象。
现象 化学方程式
溶液产生白色沉淀
BaCl2 +Na2SO4=BaSO4↓+2NaCl
含有SO42--的溶液与BaCl2反应产生 白色沉淀,且沉淀不溶于硝酸,证明含 有SO42--
分析
Na2CO3 + 2 HCl === 2NaCl + CO2↑+H2O NaHCO3 + HCl === NaCl + CO2↑+H2O
溶液产生白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
人教九年级化学下册第11单元1生活中常见的盐——复分解反应发生的条件(共21张PPT)

——复分解反应发生的条件
这些反应有什么共同特点?
2Fe2O3 + 6HCl == 2FeCl3 + 3H2O Ca(OH)2 + H2SO4 == CaSO4 + 2H2O CaCO3 +2HCl == CaCl2 +H2OCO+3CO2 ↑ Ca(OH) 2 + Na2CO3 == CaCO3 ↓ + 2NaOH
是什么基本反应类型?
复分解反应的概念:
两种化合物互相交换成分, 生成另外两种化合物的反应, 叫做复分解反应 。
表达式:AB + CD→ AD + CB
特 点:里应外合,价不变
酸、碱、盐之间的反应都属复 分解反应,但是不是任何酸、碱、 盐之间都能发生复分解反应。
探究复分解反应发生的条件
演示实验: 向两支分别盛有少量氢氧化钠溶液和氯
实质:
CO2
Na+
Na+
CO32-
CO2 旁观者: Cl- 和 Na+
H+
H2O
Cl-
H+
Cl-
结论: 有气体生成时,
复分解反应能够发生。
硫酸钠和稀盐酸
Na+
SO42-
Na+
Cl-
H+
反应前后离子种类没有改变
结论: 该反应没有发生,
不满足复分解反应发 生的条件。
复分解反应才发可生以的发条生件 至
复分解反应的类型:
① 金属氧化物+酸→盐+水 Fe2O3 + HCl → FeCl3+ H2O
② 碱+酸→盐+水(中和反应)
NaOH + HNO3 → NaNO3 +H2O
这些反应有什么共同特点?
2Fe2O3 + 6HCl == 2FeCl3 + 3H2O Ca(OH)2 + H2SO4 == CaSO4 + 2H2O CaCO3 +2HCl == CaCl2 +H2OCO+3CO2 ↑ Ca(OH) 2 + Na2CO3 == CaCO3 ↓ + 2NaOH
是什么基本反应类型?
复分解反应的概念:
两种化合物互相交换成分, 生成另外两种化合物的反应, 叫做复分解反应 。
表达式:AB + CD→ AD + CB
特 点:里应外合,价不变
酸、碱、盐之间的反应都属复 分解反应,但是不是任何酸、碱、 盐之间都能发生复分解反应。
探究复分解反应发生的条件
演示实验: 向两支分别盛有少量氢氧化钠溶液和氯
实质:
CO2
Na+
Na+
CO32-
CO2 旁观者: Cl- 和 Na+
H+
H2O
Cl-
H+
Cl-
结论: 有气体生成时,
复分解反应能够发生。
硫酸钠和稀盐酸
Na+
SO42-
Na+
Cl-
H+
反应前后离子种类没有改变
结论: 该反应没有发生,
不满足复分解反应发 生的条件。
复分解反应才发可生以的发条生件 至
复分解反应的类型:
① 金属氧化物+酸→盐+水 Fe2O3 + HCl → FeCl3+ H2O
② 碱+酸→盐+水(中和反应)
NaOH + HNO3 → NaNO3 +H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析
碳酸钠(或碳酸氢钠)与盐酸反应生 成了CO2气体
讲授新课
请同学们写出上述反应的化学方程式:
Na2CO3 + 2HCl = 2NaCl + H2COO+3CO2 ↑ NaHCO3 + HCl = NaCl + H2OCO+3 CO2 ↑
综上所述:含有碳酸根离子(CO32-)或碳酸氢根离子 (HCO3-)的盐都能与盐酸反应,产生CO2 气体。
根据所提供的四种溶液,设计实验证明溶液两两之 间是否能发生反应。√表示反应,×表示不反应。
H2SO4 BaCl2 NaOH Na2CO3
H2SO4
√ √ √
BaCl2
√
× √
NaOH
√ ×
×
Na2CO3
√
√ ×
(1)BaCl2+H2SO4= (2)NaOH+H2SO4= (3)Na2CO3+H2SO4=
(4)BaCl2+ Na2CO3= (5)BaCl2+ NaOH = (6)Na2CO3 + NaOH =aSO4 +2HCl 有白色沉淀生成 2NaOH+H2SO4= Na2SO4 + 2H2O 有水生成 Na2CO3+H2SO4= Na2SO4 + H2O + CO2 有气体生成 BaCl2+ Na2CO3= BaCO3 + 2NaCl 有白色沉淀生成 BaCl2+ NaOH =不反应 Na2CO3 + NaOH =不反应
CaCO3
讲授新课
2.与碱溶液反应
【实验11-2】向盛有少量碳酸钠溶液 的试管中滴入澄清石灰水,观察现象。
现象: 试管里出现白色沉淀。 分析: 碳酸钠与氢氧化钙反应,
生成一种难溶物碳酸钙。
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
澄清石灰水 碳酸钠
这个原理常用作两种碱之间的相互转化
九年级化学(RJ) 教学课件
第十一单元 盐 化肥
课题1 生活中常见的盐 第2课时 盐的化学性质 复分解反应
导入新课
讲授新课
课堂小结
随堂训练
导入新课
【回顾】 请书写出实验室制取CO2的方程式。
CaCO3 + 2 HCl === CaCl2 + H2CO3
CO2↑+H2O
【讨论】 根据上述反应,请
问Na2CO3和NaHCO3能 否与稀盐酸反应?如果 能反应,请问它们又会 生成什么物质?
反应物为多种 特 而生成物只有 征 一种,即“多
变一”
反应物只有一 种而生成物有 多种,即“一 变多”
反应物与生成物 反应物和生成物都 都是两种,且都 为化合物 是单质和化合物
讲授新课
我们已经学过,盐能与金属发生置换反应,如: Fe+CuSO4=Cu+FeSO4
今天学到了,盐能与酸发生复分解反应,如: Na2CO3+2HCl=2NaCl+CO2↑+H2O
没发生改变
Na+、SO42- K+、NO3- K+、SO42- Na+、NO3-
反应前
反应后
讲授新课
盐在水中的溶解性各不相同
这些你都记 住了吗?
➢ 钾盐、钠盐、铵盐、硝酸盐都可溶; ➢ 盐酸盐只有氯化银不可溶; ➢ 硫酸盐只有硫酸钡不可溶; ➢ 碳酸盐只溶钾、钠、铵,剩下都不溶。
注意:AgCl、BaSO4既不溶于水,也不溶于稀硝酸。
复分解反应发生的条件 ①生成水;②生成气体;③生成沉淀。(满足一条即可)
讲授新课
复分解反应发生时的离子变化
实质
2HCl+Na2CO3 ——√—— Na2SO4+ CO2↑+ H2O
H+、Cl- Na+、CO3 2 - Na+、SO42-
反应前
反应后
溶液中离子种类 发生改变
Na2SO4 + KNO3 —×— K2SO4 + NaNO3 溶液中离子种类
复分解反应
由两种或
由一种物质
定 两种以上物质 生成两种或两种
义 生成另一种物 以上其它物质的
质的反应
反应
由一种单质
与一种化合物反 应,生成另一种 单质与另一种化 合物的反应
由两种化合物
互相交换成分生成 另外两种化合物的 反应
类 型 A+B→AB
AB→A+B+ …. AB + C→A +BC AB + CD→ AD+ BC
①观察:上述几个反应有什么特点? ②讨论:由此,你又有哪些新发现? ③归纳:复分解反应的概念、一般形式与特点。
讲授新课
二 复分解反应
酸、碱、盐
复分解反应:由两种化合物互相交换成分,生成另 外两种化合物的反应。
+
+
AB + CD → AD + CB
思考:什么条件下复分解反应才能发生呢???
讲授新课
讲授新课
练一练
判断下列复分解反应能否发生: H2SO4 + NaNO3—— 不能 Na2SO4 + BaCl2—— BaSO4↓+ 2NaCl 2HNO3 + K2CO3—— 2KNO3 + CO2↑+H2O KNO3 + NaOH—— 不能
讲授新课 化合反应
化学基本反应类型的比较
分解反应
置换反应
讲授新课
怎样检验这 些物质中含 有碳酸呢?
讲授新课
以检验碎蛋壳为例
实验用品 实验步骤 实验现象 实验结论
试管、导管 1.将碎蛋壳 1 .
。
连单孔塞、
。
铁架台 2 .
。 2.
。
。
讲授新课
小结
碳酸根或碳酸氢根离子检验方法:
某物质 +稀盐酸
(含碳酸根或碳 酸氢根离子)
+澄清石灰水
产生气体
变浑浊
CO2
盐酸腐蚀含CaCO3的建材
导入新课
学习目标
1.掌握盐的化学性质; 2.知道复分解反应的概念、发生的条件和实质,能 判断复分解反应是否能发生。
讲授新课
一 盐的化学性质
1.与酸反应 【实验11-1】碳酸钠、碳酸氢钠分别与 盐酸反应,是否都能产生CO2 ?
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现象
白色固体溶解,放出使澄清石灰水 变浑浊的无色气体
讲授新课
观察与思考
(1)CaCO3 +2HCl==CaCl2 + H2CO3
(2)Na2CO3
+
2HCl==2NaCl
+
H2O+CO2↑ H2COO+C3 O2↑
(3)NaHCO3 + HCl==NaCl + H2COO+C3 O2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
盐能与碱发生复分解反应,如: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
盐还能与盐发生复分解反应,如: Na2SO4+BaCl2=BaSO4↓+2NaCl
讲授新课
小结
盐的化学性质
1.盐溶液的酸碱性不确定。(如NaCl溶液呈中性, Na2CO3溶液呈碱性,NH4Cl溶液呈酸性)
