2018溶液复习 学案答案
2017-2018学年下学期人教版九年级化学一轮复习第九单元学案-精选学习文档

第九单元 《溶液》复习学案一、考点梳理考点一 溶液1. 知识回顾(1)概念:____________物质分散到______物质里,形成的______、______的 物。
(2)特征:① 性(溶液中任一部分的组成、性质完全相同),② 性(外界条件——温度、气体压强等不变时,溶质不会从溶剂中分离出来)。
(3)组成:①溶质(________的物质),②溶剂( 的物质,最常用的溶剂是 , 、 等也可以作溶剂)。
(4)形成(溶解时的放热、吸热现象:升温的有 、 等,降温的有______等,不变的有 等。
)(5)配制(仪器的选用及其作用,操作步骤,误差分析):①仪器(烧杯、 、 、_______、药匙、胶头滴管等),②步骤(_____、_____、_____、溶解、装瓶、贴签)。
2.跟踪练习(1)用汽油和酒精去除油污时,是利用其 作用,而洗涤剂洗涤衣服、餐具上的油污时是利用其 作用。
(2)下列各组物质不能用水鉴别的是( )A .硫酸铜和氯化钠B .烧碱和纯碱C .硝酸钾和硝酸铵D .碳酸钙和碳酸钡(3)在NaOH 溶液中含有H 2O 、 和 (填符号)这三种微观粒子,该溶液显 性,pH 7,滴加几滴无色酚酞溶液后会变 色。
考点二 饱和溶液与不饱和溶液1(1下,向_________溶剂里加入某种溶质,当溶质______继续溶解时,_____继续溶解的溶液,叫做这种溶质的不饱和溶液。
(2)转化: (3)与浓稀的关系:①溶液的浓稀是指溶液中溶质质量分数的 ,它与溶液是否饱和 (填“有或没有”)关系;即饱和溶液 (填“一定或不一定”)是浓溶液,如饱和的石灰水溶液 (填“可能或不可能”)是稀溶液。
②当然,在相同温度时同种溶质的饱和溶液 (填“一定或不一定”)比其不饱和溶液浓。
2.跟踪练习:★请仔细观察下面溶液的变化并回答问题。
(1)A 中的试管 (填“能或不能”)把水加入浓硫酸中。
(2)B 中溶液变浑浊的原因是 。
(3)把A 中试管内试剂改为镁和稀盐酸, (填“会或不会”)出现与上图相同的现象。
鲁教版2018年中考化学复习九年级第一单元溶液课件鲁教版含答案

溶液质量=溶质质量+溶剂质量
溶液的体积不一定等于溶质体积与溶剂体积之和
2.物质的溶解通常伴随着_____ 能量 的变化。 几种常见物质在水中溶解时溶液温度变化
物质名称
氢氧化钠固体
生石灰
浓硫酸
氯化钠固体
硝酸铵固体
温度变化
升高 _____
升高 _____
升高 _____
不变 _____
降低 _____
7.饱和、不饱和溶液与浓、稀溶液的关系
考点二 溶质质量分数
溶质质量分数
溶质质量 1.溶质质量分数=_________ 溶液质量 ×100%, 溶质 的质量+_____ 溶剂 的质量。 溶液的质量=_____
2.溶质的质量=_________ 溶液质量 ×_____________ 溶质质量分数 =溶液密度×
液为黄色,FeSO4溶液为浅绿色。
(3)溶质可以是固体、液体或气体。
溶液概念的辨析
讲:在中考中,关于溶液的概念,易触雷的地方是混淆液 体和溶液。 练:链接“随堂演练”P51T1
4.乳化现象:洗洁精、洗衣粉等物质可以使食用油以
细小液滴 的形态分散在水中,形成不易分层、比较稳 _______分数氯化钠溶液的配制 (1)实验装置
烧杯
托盘天平 量筒 玻璃棒
量筒
玻璃棒
考点四 溶解度与溶解度曲线 一定温度 下,某种固 1.定义:通常所说的溶解度是指在_________ 100 g 溶剂(通常为水)里达到_________ 饱和状态 时所能溶 体物质在______ 固体物质的质量 。 解的_______________
第一单元 溶 液
考点一 溶液的组成与性质 1.溶液及其组成
定义 特征 均一 稳定 混合物 一种或几种物质分散到另一种物质里,形成的_______、_______的_______
江苏省南通市海安县2018届中考化学复习 第九讲 溶液学案

第九讲溶液【学习目标】1.了解溶液的形成和饱和溶液2.掌握溶解度曲线信息和应用3.学会溶质质量分数的计算【课前预习】【基础知识梳理】【思考1】判断可口可乐是溶液依据是什么?说出其中的溶质、溶剂各有哪些?【思考2】如何判断甲乙烧杯内的NaCl溶液是否是饱和溶液?若是不饱和溶液,怎么转化成变饱和溶液?【思考3】如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:(1)t2℃时,物质a的溶解度与物质_____的相等。
(2)t3℃时,把8g物质a加入到20g水中充分搅拌,形成的是_______溶液(填“饱和”或“不饱和”)。
(3)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体多的是_______。
【思考4】配制50g6%氯化钠溶液,操作过程如图所示,回答下列问题:(1)配制溶液的正确操作顺序为______________(填序号,下同),其中操作错误的是____。
(2)需称取氯化钠 _____g。
(3)选用量筒的量程最合适的是()A.10 ml B.25 ml C.50ml D.100ml(4)装瓶时有溶液洒出,则配好的溶液溶质质量分数 ____(填“偏小” “偏小”和“不变”)。
【典型问题分析】例1:下列关于溶液说法不正确的是()A.将氯化钠放入水中,搅拌后能形成溶液B.硝酸铵固体溶于水时温度下降C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解D.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数仍为20%例2:根据下图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)温度为_____℃时,甲、乙物质的溶解度相等。
(2)三种物质中,______的溶解度受温度影响最小。
(3)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的()A.甲、丙都是饱和溶液 B.所含溶剂质量:甲=丙C.溶液的质量:甲>丙 D.溶质的质量分数:甲>丙例3:某课外实验要配置150g溶质质量分数为2.0%的硝酸钾溶液。
2018年中考化学真题分类汇编溶液(有答案解析)
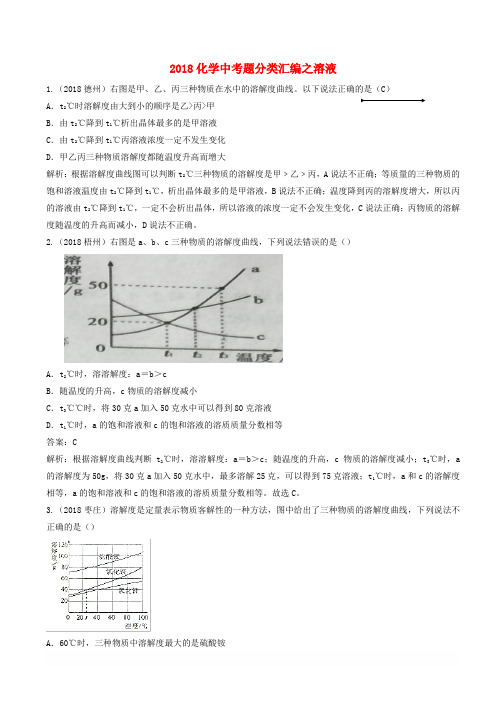
2018化学中考题分类汇编之溶液1.(2018德州)右图是甲、乙、丙三种物质在水中的溶解度曲线。
以下说法正确的是(C)A.t2℃时溶解度由大到小的顺序是乙>丙>甲B.由t2℃降到t1℃析出晶体最多的是甲溶液C.由t2℃降到t1℃丙溶液浓度一定不发生变化D.甲乙丙三种物质溶解度都随温度升高而增大解析:根据溶解度曲线图可以判断t2℃三种物质的溶解度是甲﹥乙﹥丙,A说法不正确;等质量的三种物质的饱和溶液温度由t2℃降到t1℃,析出晶体最多的是甲溶液,B说法不正确;温度降到丙的溶解度增大,所以丙的溶液由t2℃降到t1℃,一定不会析出晶体,所以溶液的浓度一定不会发生变化,C说法正确;丙物质的溶解度随温度的升高而减小,D说法不正确。
2.(2018梧州)右图是a、b、c三种物质的溶解度曲线,下列说法错误的是()A.t2℃时,溶溶解度:a=b>cB.随温度的升高,c物质的溶解度减小C.t3℃℃时,将30克a加入50克水中可以得到80克溶液D.t1℃时,a的饱和溶液和c的饱和溶液的溶质质量分数相等答案:C解析:根据溶解度曲线判断t2℃时,溶溶解度:a=b>c;随温度的升高,c物质的溶解度减小;t3℃时,a 的溶解度为50g,将30克a加入50克水中,最多溶解25克,可以得到75克溶液;t1℃时,a和c的溶解度相等,a的饱和溶液和c的饱和溶液的溶质质量分数相等。
故选C。
3.(2018枣庄)溶解度是定量表示物质客解性的一种方法,图中给出了三种物质的溶解度曲线,下列说法不正确的是()A.60℃时,三种物质中溶解度最大的是硫酸铵B.三种物质的溶解度均随温度升高而增大C.t℃时,将30g氯化铵加入50g水中,最终所得溶液溶质质量分数为37.5%D.80℃时氯化钾和氯化铵的饱和溶液分别降温至20℃,析出晶体的质量后者大解析;A、据图可以看出,60℃时,三种物质中溶解度最大的是硫酸铵,正确;B、据图可以看出,三种物质的溶解度均随温度升高而增大,正确;C、t℃时,氯化铵的溶解度为40g,将30g氯化铵加入50g水中,只能溶解20g,最终所得溶液溶质质量分数为37.5%,错误;D、80℃时氯化钾和氯化铵的饱和溶液分别降温至20℃,由于不知道饱和溶液的质量,故不能确定析出晶体质量的大小,错误;故选:CD。
2018年广东省普通高中化学学业水平测试复习-专题四-溶液与胶体

考纲原文5年考题考情分析2013年2014年2015年2016年2017年1.了解溶液的含义。
从近五年广东学业水平考试考题分布可知, 考点分布较为均匀, 知识覆盖面较广。
单项选择题Ⅰ、单项选择题Ⅱ、多项选择题均有涉及, 重点考查的知识点有:溶解度、配制一定物质的量浓度的溶液的方法、胶体性质等。
2.了解溶解度、饱和溶液的概念。
了解溶液的组成。
理解溶液中溶质的质量分数的概念。
T13溶解度、饱和溶液、溶质的质量分数T8溶质、溶剂、溶质的质量分数T6溶质的质量分数T24饱和溶液T25(1)溶解度T63(1)饱和溶液、溶解度、溶质的质量分数T22溶解度、饱和溶液3.了解配制一定溶质的质量分数、物质的量浓度溶液的方法。
T60配制一定物质的量浓度的溶液所需仪器T36配制一定物质的量浓度的溶液的误差分析4.了解胶体是一种常见的分散系。
T23分散系T21分散系T29(1)分散系T30胶体性质注: (1)表示1月学业水平考题。
考点1溶液1.溶液(1)定义: 一种或几种物质分散到另一种物质里, 形成均一的、稳定的混合物。
(2)特征: 均一性、稳定性。
(3)组成①溶质: 被溶解的物质叫溶质。
可以是固体、液体或气体。
②溶剂: 能溶解其他物质的物质叫溶剂。
可以是固体、液体或气体。
常见的溶剂有水、酒精等。
2. 饱和溶液和不饱和溶液(1)定义:在一定温度下, 向一定量溶剂里加入某种溶质, 当溶质不能继续溶解时, 所得到的溶液叫饱和溶液;还能继续溶解的溶液叫不饱和溶液。
(2)饱和溶液和不饱和溶液的相互转化不饱和溶液饱和溶液①升高温度;②增加溶剂①降低温度;②增加溶质;③蒸发溶剂温度对Ca(OH)2等少数物质的溶液的影响与上述规律相反。
[温馨提示](1)“饱和”与“不饱和”是相对的, 随溶剂的质量、溶质的质量和温度的变化而变化。
(2)某物质的饱和溶液只是不能继续溶解这种物质, 但是还可以继续溶解其他物质。
(多选)分别将下列各组物质等体积混合, 在室温下振荡一会, 静置后, 能够形成溶液的是()A. 四氯化碳、水B. 乙醇、水C. 汽油、水D. 乙酸乙酯、乙酸[解析]乙醇能溶于水形成均一、稳定的混合物;乙酸乙酯和乙酸都是有机物, 能够相互溶解形成均一、稳定的混合物。
中考一轮复习《溶液》复习学案

《溶液》复习学案一、溶液的形成1、溶液(1)定义:溶液是______________分散到___________里,形成___________的、___________的____________。
(一种或几种物质, 另一种物质,均一,稳定,混合物)(2)特征:具有__________性、__________性,属于__________物。
(均一,稳定,混合物)溶质:________的物质,可以是_______________。
(被溶解,固体、液体或气体)溶剂:______________的物质。
_______是最常用的溶剂。
(能溶解其他物质,水)2、乳浊液与乳化现象(1)乳浊液:_____________分散到液体里形成的____________;其特征是:_____________、 ____________________。
(小液滴,混合物,不均一,不稳定)(2)乳化作用:洗涤剂使植物油在水中分散成无数细小的液滴,形成______________的现象;其特点是能______________存在。
(乳浊液,稳定)3、溶解时的吸热或放热现象 (1)溶于水时,溶液温度明显升高的物质有:_________、________等。
(浓硫酸,氢氧化钠)(2)溶于水时,溶液温度明显降低的物质有:___________________等。
(硝酸铵)(3)溶于水时,溶液温度无明显变化的物质有:_________________等。
(氯化钠)【思考感悟】1、均一、稳定、无色透明的液体一定是溶液吗?提示:不一定。
均一、稳定的液体可能是纯净物,如水;而溶液属于混合物;溶液不一定是无色的,如硫酸铜溶液就是蓝色溶液。
2、用汽油清洗衣服上的油污和用洗涤剂清洗油污的原理相同吗?为什么?提示:不相同。
汽油清洗油污属于溶解现象,洗涤剂清洗油污属于乳化现象。
二、饱和溶液和不饱和溶液1、判断依据。
2、转化的条件和方法。
3、溶液的浓、稀与饱和、不饱和溶液的关系(1)溶液浓、稀的含义溶液的浓、稀是指一定量溶液中含溶质的多少,溶质质量分数大的是浓溶液,反之是稀溶液。
2018年中考化学真题——溶液含解析
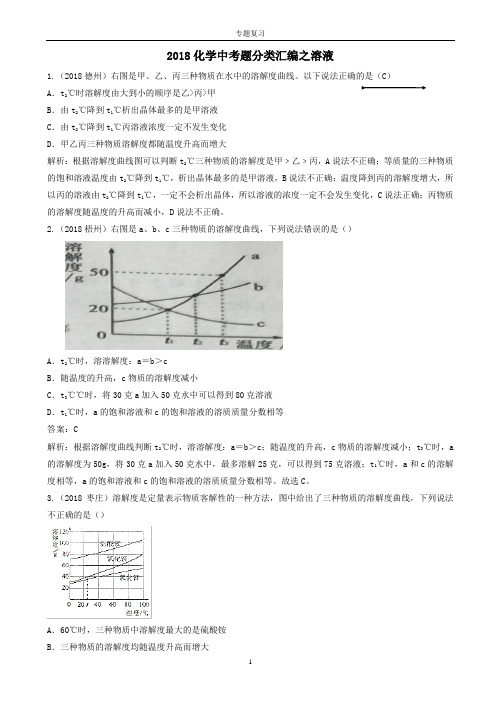
2018化学中考题分类汇编之溶液1.(2018德州)右图是甲、乙、丙三种物质在水中的溶解度曲线。
以下说法正确的是(C)A.t2℃时溶解度由大到小的顺序是乙>丙>甲B.由t2℃降到t1℃析出晶体最多的是甲溶液C.由t2℃降到t1℃丙溶液浓度一定不发生变化D.甲乙丙三种物质溶解度都随温度升高而增大解析:根据溶解度曲线图可以判断t2℃三种物质的溶解度是甲﹥乙﹥丙,A说法不正确;等质量的三种物质的饱和溶液温度由t2℃降到t1℃,析出晶体最多的是甲溶液,B说法不正确;温度降到丙的溶解度增大,所以丙的溶液由t2℃降到t1℃,一定不会析出晶体,所以溶液的浓度一定不会发生变化,C说法正确;丙物质的溶解度随温度的升高而减小,D说法不正确。
2.(2018梧州)右图是a、b、c三种物质的溶解度曲线,下列说法错误的是()A.t2℃时,溶溶解度:a=b>cB.随温度的升高,c物质的溶解度减小C.t3℃℃时,将30克a加入50克水中可以得到80克溶液D.t1℃时,a的饱和溶液和c的饱和溶液的溶质质量分数相等答案:C解析:根据溶解度曲线判断t2℃时,溶溶解度:a=b>c;随温度的升高,c物质的溶解度减小;t3℃时,a 的溶解度为50g,将30克a加入50克水中,最多溶解25克,可以得到75克溶液;t1℃时,a和c的溶解度相等,a的饱和溶液和c的饱和溶液的溶质质量分数相等。
故选C。
3.(2018枣庄)溶解度是定量表示物质客解性的一种方法,图中给出了三种物质的溶解度曲线,下列说法不正确的是()A.60℃时,三种物质中溶解度最大的是硫酸铵B.三种物质的溶解度均随温度升高而增大C.t℃时,将30g氯化铵加入50g水中,最终所得溶液溶质质量分数为37.5%D.80℃时氯化钾和氯化铵的饱和溶液分别降温至20℃,析出晶体的质量后者大解析;A、据图可以看出,60℃时,三种物质中溶解度最大的是硫酸铵,正确;B、据图可以看出,三种物质的溶解度均随温度升高而增大,正确;C、t℃时,氯化铵的溶解度为40g,将30g氯化铵加入50g水中,只能溶解20g,最终所得溶液溶质质量分数为37.5%,错误;D、80℃时氯化钾和氯化铵的饱和溶液分别降温至20℃,由于不知道饱和溶液的质量,故不能确定析出晶体质量的大小,错误;故选:CD。
中考化学总复习教案【第26讲】专题五-溶液(含答案)

第26讲专题五溶液, 溶液的概念、组成、特征)1.溶液的定义:一种或几种物质分散到另一种物质里,形成_均一、稳定__的混合物。
2.溶液的组成:溶质和溶剂。
固体、气体溶于液体时,_固体、气体__是溶质,_液体__是溶剂;如:碘溶于酒精里,其中_碘__是溶质,_酒精__是溶剂;氯化氢气体溶于水中形成盐酸,其中_氯化氢气体__是溶质,_水__是溶剂。
两种液体互相溶解时,通常量多的是_溶剂__,量少的是_溶质__;当溶液中有水存在时,不论水量多少,习惯上把水称作溶剂,通常不指明溶剂的溶液,一般指水溶液;溶液中的溶质可能是一种或几种,溶剂只有一种。
在溶液中,溶液的质量=_溶质__的质量+_溶剂__的质量。
注意:溶液中未溶解的固体的质量不能算作溶质的质量。
溶液是不同液体混合而成,溶液的体积则小于溶质和溶剂的体积之和,如:50 mL酒精和50 mL水混合后酒精溶液的体积_小于__(填“大于”“小于”或“等于”)100 mL,因为分子_之间有间隔__。
3.溶液的特征:溶液的_均一__性、_稳定__性。
均一性是指溶液中任意一部分的_组成、性质、浓度、密度__都相同;稳定性是指只要外界条件不变,溶液久置不分层,也不会析出固体物质。
液态纯净物均一、稳定却不是溶液,如:蒸馏水。
, 溶解时的吸热或放热现象)溶解时的吸热或放热现象:有的物质溶于水,溶液温度降低,如:_NH4NO3__溶于水_吸__热;有的物质溶于水,溶液温度升高,如:_NaOH、浓硫酸__溶于水_放__热;有的物质溶于水,溶液温度不变,如:_NaCl__溶于水,溶液温度不变。
, 饱和溶液与不饱和溶液的转换)1.饱和溶液与不饱和溶液概念:在_一定温度下__,_一定量的溶剂里__,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液;还能继续溶解该种溶质的溶液,叫做这种溶质的不饱和溶液。
判断溶液是否饱和的方法:在一定温度下,看该溶液能不能继续溶解物质,如果加入少量同种溶质,溶质没有减少,说明溶液已达到饱和状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液复习一、中考考点1、认识溶解现象,了解溶液的组成2、了解饱和溶液、不饱和溶液;了解结晶的常用方法。
3、了解溶解度和溶解度曲线;了解溶质质量分数的概念。
二、必备知识(一)、饱和溶液与不饱和溶液.1、t℃时,甲为饱和溶液,保持温度不变蒸发溶剂析出晶体,余下的溶液是______溶液(填“饱和”或“不饱和”);1蒸发出的溶剂和析出的晶体在t℃时_____配成饱和溶液“恒温蒸发结晶可视为取出部分饱和溶液”)””或“否(填“能12、t℃时,甲为饱和溶液,降温到t℃时析出晶体,余下的溶液是t℃时的_______溶液(填“饱和”或“不饱和”)1213、t℃时,甲溶解度为50g。
t℃时,甲的饱和溶液都有溶质:溶剂=_________。
114、不饱和溶液转为饱和溶液一定可行的方法是______________5、饱和溶液转为不饱和溶液一定可行的方法是______________(二)、溶质质量、溶剂质量、结晶质量的比较1、溶质、溶剂质量比较(溶质、溶剂质量任意一个改变,溶液质量才会变)(1)、甲、乙溶液质量都为100g,甲的质量分数为20%、乙为10%,甲中的溶质质量____乙中的溶质质量(填“大于”或“小于”)。
质量相等的溶液,质量分数大者所含溶质________溶剂归纳1:两份或两种_____(填“多”或“少”)(2)、甲、乙溶液质量都为100g且在t℃时都饱和,甲的溶解度为100g,乙的溶解度为50g,甲中的溶质1质量____乙中的溶质质量;两种溶液各自改变温度后一定不变的是________的质量(填小于”)“溶”(填“大于或“质”或“溶剂”或“溶液”)质量相等的饱和溶液,溶解度大者所含溶质________2:两份或两种溶剂_____ 归纳温度不需要相同)(注:改变温度后一定不变的是________的质量(填“溶质”或“溶剂”或“溶液”)”(填“多”或“少)2、结晶质量比较(3)、t℃时甲的饱和溶液溶解度为50g,t℃时乙的饱和溶液溶解度为30g,各自保持温度不变蒸发10g21水,甲析出晶体多(填“甲”或“乙”) 3 ) 50/100=x/10 30/100=y/101、(提示:看必备知识(一)饱和溶液,各自恒温蒸发等质量的水,溶解度大者析出晶体归纳3:两份或两种多温度不需要相同)(注:(填“多”或“少”)(提示:看必备知识(一)1 )(4)、t℃时,两份甲的饱和溶液,一份保持温度不变蒸发10 克水析出晶体M克,另一份保持温度不变1蒸发30克水,析出晶体为3Mg (提示:看必备知识(一)1、3 )饱和溶液,溶解度相同时,一份保持温度不变蒸发a 归纳4:两份或两种克水析出温度不需要相同)(注:晶体M克,另一份保持温度不变蒸发b克水,析出晶体N克则有M / a=N / b (填a、b、M、N的关系)(5)、t℃时,两份甲的饱和溶液,一份100 g,另一份300g,第一份降温到t℃时析出晶体M克,另一12份也降温到t℃,析出晶体为3Mg (可这样理解:300g液相当于3份100g液)1归纳5:温度相同时,同一物质的两份饱和溶液,一份a g、另一份bg,降温到同一温度结晶,第一份析出晶体Mg,另一份析出晶体Ng 则有M / a=N / b (填a、b、M、N的关系)(三)、固体溶解度:1、在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量2、某些物质溶解放热,其溶解度会随温度升高而增大或者减小。
3、曲线的交点表示两种物质在某温度下的溶解度相同,曲线下方的点表示某温度下溶液的不饱和状态。
(四)、溶液质量分数的比较(溶质、溶剂质量任意一个改变,溶液质量分数才会变)页 1 第。
两种饱和溶液改变温度后:未析出晶体者其质量分数%×100 1、饱和溶液的质量分数=S/(S+100)不变,等于原饱和溶液质量分数;析出晶体者其质量分数减小,等于新温度下饱和溶液质量分数。
)的溶解度曲线。
下列说法正确的是(乙两种固体物质例: C ((2019)深圳改编)不含结晶水下图是甲、A、甲的溶解度大于乙的溶解度B、a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出C、a2℃时,甲、乙饱和溶液降温到a1℃后,甲溶液的质量分数大于乙D、a2℃时,M点是甲的饱和溶液2、溶液质量分数的比较:(1)、用质量分数比较比值比值越大越大质量分数(2)、用溶质与溶剂的(3)、等质量的溶剂中溶质越多质量分数越大;两种饱和溶液,可用溶解度(对应的溶剂为100g)比较,溶解度越大质量分数越大,溶解度相同质量分数相等。
特别说明:方法(2)和(3) 仅用于质量分数比较,不能用于溶液质量分数的计算。
(五)、两种可溶物质提纯:溶解度受温度影响大用降温结晶,溶解度受温度影响小用蒸发结晶。
以量多的物质的溶解为依据,三、我要尝试练习1:两个烧杯中分别盛装 X、Y 的饱和溶液,两只试管中分别装有 NaOH 和NHNO固体,向34两只试管中分别滴加适量水,现象如图一所示,结合图二信息回答下列问题。
(1)X 的溶解度曲线为 b (填“a”或“b”)(2)Y 的饱和溶液从 t℃降温到 t℃,溶质的质量分数将 B (填序号)【必备知识:(四) 1 】.变大 B.变小 C.不变 D.无法确定12A(3)t℃时,配制相同质量的 X、Y饱和溶液,则所需溶剂质量 X A Y(填序号)【必备:归纳2】3A.大于 B.小于 C.相等 D.无法确定分析:等质量的饱和液溶解度大的溶质多。
(4)t2℃时,有 X、Y 的饱和溶液,X 为 100 g,Y 为 200g,保持温度不变,将 X 的饱和溶液蒸去10 g 水析出晶体 m g,将 Y 的饱和溶液蒸发去 20 g 水析出晶体 n g,则 m 和 n 的数值关系表示正确的是 A (填序号) 10g/20g =mg/ng 【必备:归纳4 】A.n = 2m B.m = n C.M= 2n D.无法确定(5)将某温度下 X 溶液 200g,保持温度不变,蒸发掉 20g 水后,析出 A g 晶体,又蒸发 20g 水后析出晶体 B 克且 A ≠ B,则此温度下 X 的溶解度为 5Bg (用字母表示)【必备:(一) 1、3】练习2:t℃时,将一定量KNO的不饱和溶液平均分为三份,分别恒温蒸发出水的质量为5g、10g,析出3KNO晶体的质量依次为2g、5g,第三份蒸干得到KNO的晶体质量为12.5g,则每份溶液中所含水的量33为多少?【必备:(一) 1 归纳4 】解析:①蒸发5 g水析出2g晶体后是饱和的溶液. ②蒸发10 g水析出5g克晶体,一二次蒸发比较3克页 2 第第三次蒸干与第二次蒸发比较:设每份溶液中水的质量为X 溶质对应则5 克水是饱和的溶液.③g )X-10 所以3g/5g=(12.5-5)g/()(12.5-5)g溶质对应(X-10)g水是饱和的。
四、课外练习:孝感)甲、乙两种固体物质(均不含结晶水)的溶解度曲线如右图所示。
下列说法正确的(2019练习3.( B )是 A. t1℃时,甲的溶解度大于乙的溶解度 t2℃时,乙的饱和溶液升温或降温均会析出晶体B. t1℃,乙溶液中的溶质质量分数会发生改变C.乙溶液从t3℃降温到甲的饱和溶液水中加入℃时,50g40g的甲物质充分溶解可得到90gD. t3 ).(2019苏州)氯化钠和硝酸钾两种固体的溶解度曲线如右图所示。
下列说法正确的是( C 练习4硝酸钾的溶解度大于氯化钠的溶解度A..常用冷却结晶的方法从氯化钠溶液中获得其晶体B水中,充分搅拌后,所得溶液的溶50 g40℃时,将35 g硝酸钾晶体放入C.39.0%质质量分数为℃,溶液的溶质质量分数增大(忽略水.将D20℃的硝酸钾饱和溶液升温至60分蒸发)两份等质量的硝酸钾和氣化钾2019泰安)t1℃时,练习5.(充分搅拌后现象如分别加入到各盛有100g水的两个烧杯中,所示。
则下1所示,硝酸钾和氣化钾的瑢解度曲线如图2图列说法正确的是(D ) A.烧杯①的溶液一定是不饱和瑢液 B.烧杯①的溶液是硝酸钾溶液B.,烧杯底部还有部分物质不溶解C.烧杯②的溶液升温到t2℃时溶质的质量分数相等℃时D.若烧杯①和烧杯②的溶液都升温到t2,做了如下实验,图一中甲、乙、丙、丁是充分搅拌后M6.(2019重庆B)张老师在讲授溶液时,用固体练习:静置的现象,请回答相关问题(忽略水的挥发))上述烧杯中,溶液质量最大的是_______填序号).1( _____(填序号).)上述实验可以判断物质(2M的溶解度曲线是图中对应的(填序号).3()甲、乙、丙烧杯中的溶液一定呈饱和状态的是______ 固体.)根据下图,若要使丁烧杯中的溶液恰好达到饱和状态,还需要加入(4________g的M8.4)3))丁;(2A;()乙;(1【答案】(水的两个烧杯中,充分溶解100g80g.t22019.练习7(呼和浩特改编)℃时,将甲,乙各分别放到盛有页 3 第t2℃,现象如图一。
甲和乙的溶解度曲线如图二。
请结合图示回答下列问题:后,恢复到”b)。
1)固体甲对应的溶解度曲线是__________ (填“a”或“(点的含义______________。
(2)M一段时间后又有部分固体充分搅拌,发现固体先全部溶解,15g(3)向烧杯①的溶液中继续加入甲物质, _____________。
甲析出.你认为“全部溶解”的原因是(填t1℃等质量的甲、乙饱和溶液分别降温到℃时,所得溶液的有关说法正确的是___________(4)将t2 字母)。
b.两溶液质量甲<乙a.甲溶液仍为饱和溶液 >乙甲.两溶液中溶剂质量甲c=乙 d.两溶液溶质质量乙>e.溶质的质量分数甲;【答案】(1)a(2)t1℃时,甲乙两物质的溶解度相等;abe (4)3)甲物质溶解放热,甲的溶解度随温度升高而增大(三种固体物质(不含结晶水)的溶解度曲线,请回答下列Y、Z(8.2019达州改编)如图所示为X、练习问题:X。
,应采用的方法提纯X⑴中含有少量Y降温结晶⑵t2℃时,三种物质的溶解度的大小关系是 Y>X=Z⑶t3℃时,溶质质量分数为25%的X溶液降温到t1℃,所得溶液中溶质质量分数是 20% 。
⑷t3℃时,等质量X、Y、Z的饱和溶液分别降温到t1℃,溶液质量没有变化的是 Z 。
(5)t3℃时, X、Y、Z的饱和溶液都为1OOg分别降温到t1℃,所得溶液中溶剂的质量由大到小依次为 Z Y X页 4 第。
