结构化学第六章习题
结构化学-Ch6-复习习题-杨媛

5Es 0
3.分裂能(△o 或10Dq)(P186): 金属原子或离子的5个d轨道在球形场作用 下分裂成2个高能级eg轨道和3个低能级t2g 轨道,高能的d轨道与低能的d轨道的能量 之差即是分裂能。
Eeg=6Dq(或0.6Δ0) Et2g=-4Dq(或-0.4Δ0)
eg
6 q D
CFSE1-CFSE2=4Dq-(24Dq-2P)=-20Dq+2P
=2(-Δ0+P )<0 (Δ0 > P) ∴Co3+采用t2g6 的排布方式,低自旋,没有未 配对电子,反磁性。
P203-8. 试判断下列两组配位化合物顺磁性大小的次序: (1) A. [Co(NH3)6]3+ B. [Co(NH3)6]2+ C. [Co(NO2)6]3D. [Co(CN)6]4 A. NH3为中场配体,Co3+(d6)为强场离子,总体上 [Co(NH3)6]3+属强场配合物,d电子处于低自旋,组态为 t2g6eg0,没有未配对电子。 B. NH3为中场配体,Co2+(d7)为弱场离子,总体上 [Co(NH3)6]2+属弱场配合物,d电子处于高自旋,组态为 t2g5eg2,有3个未配对电子。 C.NO2-属于强场配体, [Co(NO2)6]3- 属强场配合物,d电 子处于低自旋,组态为t2g6eg0,没有未配对电子。 D. CN-属于强场配体, [Co(CN)6]4-属强场配合物,d电 子处于低自旋,组态为t2g6eg1,有1个未配对电子。 ∴顺磁性大小:B>D>A=C
P202-7. 已知[Co(NH3)6]2+的Δ0 < P,而[Co(NH3)6]3+的 Δ0 > P ,试解释此区别的原因,并用稳定化能推算出 二者的d电子构型和磁性。 解:Co3+比Co2+价态高,ΔCo3+ > ΔCo2+ 电子成对能不变,所以出现题目中出现情况。 [Co(NH3)6]2+中 Co2+的d7有两种排布方式: ①t2g5eg2 ② t2g6eg1 ①CFSE=-[5(-4Dq)+26Dq]=8Dq ②CFSE=-[6(-4Dq)+16Dq+3P-2P]=18Dq-P
结构化学 习题答案 1-10章习题及答案

其中,1 kcal = 4.184 J,E 是以 10 为底的指数。
kJ/mole 2.62550E+03 4.18400E+00 9.64853E+01 1.19627E-02 1.00000E+00
第二章习题
kcal/mole 6.27510E+02 1.00000E+00 2.30605E+01 2.85914E-03 2.39006E-01
eV 2.721138E+01 4.33641E-02 1.00000E+00 1.23984E-04 1.03643E-02
cm-1 2.1947463137E+05
sin n 2
1, wmax
1 1 4 6
(3) w 1 4
8 根据态叠加原理,(x) 是一维势箱中粒子一个可能状态。
能量无确定值。平均值为 25 h2 104 ml 2
9
和
2 的本征函数,其相应的本征值分别为 dx2
-m2和-1。11
Dˆ Xˆ XˆDˆ 1
值。
(a) eimx (b) sinx (c) x2+ y2 (d) (a-x)e-x 11有算符 Dˆ d dx, Xˆ X , 求 DˆXˆ XˆDˆ 。 参考答案
1 象电子等实物粒子具有波动性被称作物质波。物质波的
波动性是和微粒行为的统计性联系在一起的。对大量粒子
而言,衍射强度(即波的强度)大的地方,粒子出现的数
现在 2h 2 的概率?(c) 角动量 z 分量的平均值?
2.4 已知类氢离 子 He+的某 一状态波函 数为: =
结构化学__南开大学(5)--第六章分子对称性课堂测验

Chap6 测验
1. 写出下面分子所属点群,判断其有无极性和旋光性
1) 三乙二胺合钴离子 2) 氯仿CHCl 3 3) 六氟化硫SF 6
4) 环辛四烯 5) 1,2-二氯丙二烯 6) 氯乙烯
7) 四氟乙烯 8) 乙炔
9) 1,2-二氯丙烷 CH 3CHCH 2Cl Cl 10) 2,6-二氯萘 Cl
Cl
2. 下面几个分子中,有偶极矩的分子是?
A. 间三氯苯
B. 对二氯苯
C. 环己烷(船式)
D. 1,3,5,7-四甲基环辛四烯
3. 下面那个分子有对称中心?
A. 间三氯苯
B. 乙醛
C. 环己烷(椅式)
D. 氯乙烯 4. 环己烷(椅式)、乙烯、三乙二胺合钴离子和六氟化硫共同具有的对称元素是 A. C 2
B. C. i D. 以上都不对 5. 下面哪个分子有旋光性?
A. 间三氯苯
B. 氯乙烯
C.三乙二胺合钴离子
D. 1,3,5,7-四甲基环辛四烯。
《结构化学第六章》
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
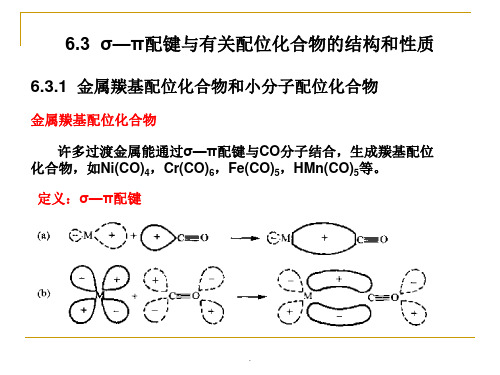
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
结构化学章节习题(含答案!)

结构化学章节习题(含答案!)第⼀章量⼦⼒学基础⼀、单选题: 13x lπ为⼀维势箱的状态其能量是:( a ) 22229164:; :; :; :8888h h h hA B C D ml ml ml ml2、Ψ321的节⾯有( b )个,其中( b )个球⾯。
A 、3B 、2C 、1D 、03、⽴⽅箱中2246ml h E ≤的能量范围内,能级数和状态数为( b ).A.5,20B.6,6C.5,11D.6,174、下列函数是算符d /dx的本征函数的是:( a );本征值为:( h )。
A 、e 2xB 、cosXC 、loge xD 、sinx 3E 、3F 、-1G 、1H 、2 5、下列算符为线性算符的是:( c )A 、sine xB 、d 2/dx 2 D 、cos2x6、已知⼀维谐振⼦的势能表达式为V = kx 2/2,则该体系的定态薛定谔⽅程应当为( c )。
A [-m 22η2?+21kx 2]Ψ= E ΨB [m 22η2?- 21kx 2]Ψ= E Ψ C [-m 22η22dx d +21kx 2]Ψ= E Ψ D [-m 22η-21kx 2]Ψ= E Ψ 7、下列函数中,22dxd ,dx d的共同本征函数是( bc )。
A cos kxB e –kxC e –ikxD e –kx28、粒⼦处于定态意味着:( c )A 、粒⼦处于概率最⼤的状态B 、粒⼦处于势能为0的状态C 、粒⼦的⼒学量平均值及概率密度分布都与时间⽆关系的状态.D 、粒⼦处于静⽌状态9、氢原⼦处于下列各状态 (1)ψ2px (2) ψ3dxz (3) ψ3pz (4) ψ3dz 2 (5)ψ322 ,问哪些状态既是M 2算符的本征函数,⼜是M z 算符的本征函数?( c )A. (1) (3)B. (2) (4)C. (3) (4) (5)D. (1) (2) (5) 10、+He 离⼦n=4的状态有( c )(A )4个(B )8个(C )16个(D )20个 11、测不准关系的含义是指( d ) (A) 粒⼦太⼩,不能准确测定其坐标; (B)运动不快时,不能准确测定其动量(C) 粒⼦的坐标的动量都不能准确地测定;12、若⽤电⼦束与中⼦束分别作衍射实验,得到⼤⼩相同的环纹,则说明⼆者( b ) (A) 动量相同 (B) 动能相同 (C) 质量相同13、为了写出⼀个经典⼒学量对应的量⼦⼒学算符,若坐标算符取作坐标本⾝,动量算符应是(以⼀维运动为例) ( a )(A) mv (B) i x ??h (C)222x ?-?h14、若∫|ψ|2d τ=K ,利⽤下列哪个常数乘ψ可以使之归⼀化:( c )(A) K (B) K 2 (C) 1/K15、丁⼆烯等共轭分⼦中π电⼦的离域化可降低体系的能量,这与简单的⼀维势阱模型是⼀致的,因为⼀维势阱中粒⼦的能量( b )(A) 反⽐于势阱长度平⽅ (B) 正⽐于势阱长度 (C) 正⽐于量⼦数16、对于厄⽶算符, 下⾯哪种说法是对的( b )(A) 厄⽶算符中必然不包含虚数 (B) 厄⽶算符的本征值必定是实数(C) 厄⽶算符的本征函数中必然不包含虚数17、对于算符?的⾮本征态Ψ( c )(A) 不可能测量其本征值g . (B) 不可能测量其平均值.(C) 本征值与平均值均可测量,且⼆者相等18、将⼏个⾮简并的本征函数进⾏线形组合,结果( b )(A) 再不是原算符的本征函数(B) 仍是原算符的本征函数,且本征值不变 (C) 仍是原算符的本征函数,但本征值改变19. 在光电效应实验中,光电⼦动能与⼊射光的哪种物理量呈线形关系:( B )A .波长B. 频率C. 振幅20. 在通常情况下,如果两个算符不可对易,意味着相应的两种物理量( A)A .不能同时精确测定B .可以同时精确测定C .只有量纲不同的两种物理量才不能同时精确测定A .λ=E /h B. λ=c /ν C. λ=h /p 22. 将⼏个⾮简并的本征函数进⾏线形组合,结果( A) A .再不是原算符的本征函数B .仍是原算符的本征函数,且本征值不变C .仍是原算符的本征函数,但本征值改变23. 根据能量-时间测不准关系式,粒⼦在某能级上存在的时间τ越短,该能级的不确定度程度ΔE (B)A .越⼩ B. 越⼤ C.与τ⽆关24. 实物微粒具有波粒⼆象性, ⼀个质量为m 速度为v 的粒⼦的德布罗意波长为:A .h/(mv)B. mv/hC. E/h25. 对于厄⽶算符, 下⾯哪种说法是对的 ( B )A .厄⽶算符中必然不包含虚数B .厄⽶算符的本征值必定是实数C .厄⽶算符的本征函数中必然不包含虚数 26. 对于算符?的⾮本征态Ψ (A ) A .不可能测得其本征值g. B .不可能测得其平均值.C .本征值与平均值均可测得,且⼆者相等 27. 下列哪⼀组算符都是线性算符:( C )A . cos, sinB . x, logC . x d dx d dx,,22⼆填空题1、能量为100eV 的⾃由电⼦的德布罗依波波长为( 122.5pm )2、函数:①xe ,②2x ,③x sin 中,是算符22dxd 的本征函数的是( 1,3 ),其本征值分别是( 1,—1;)3、Li 原⼦的哈密顿算符,在(定核)近似的基础上是:(()23213212232221223222123332?r e r e r e r e r e r e mH +++---?+?+?-=η)1.计算波长为600nm(红光),550nm(黄光),400nm(蓝光)和200nm(紫光)光⼦的能量。
结构化学习题答案(5)

《结构化学》第六章习题答案6001分裂成两组, d22yx 和2zd处于高能级,d xy,d yz,d xz处于低能级。
6002X-为弱场配体,CN-为强场配体, NH3介于两者之间。
6003(A)6004否6005(C)6006-2△06007此结论仅在O h场中,中心离子 d 电子数n=4--7 时才成立。
6008-0.4△0×6 =-2.4△06009假设填T d空隙LFSE(Td)=[4×(-0.267△)+4×0.178△] = -0.356△假设填O h空隙LFSE(Oh)=[6×(-0.4△)+2×0.6△] = -1.2△Ni2+倾向填入稳定化能大的空隙中,所以NiAl2O4为反尖晶石。
6010小 6011参看《结构化学基础》 (周公度编著) p.2756012(1) t 2g 4 e g 2(2) - 0.4△ (3) │M s │=6π2h(4) μ= 26μβ6013(D) 6014能级次序: d 22y x -最高, 2d z 次之,d xy 再次之,d yz ,d xz 最低。
理由:①因z 方向拉长,相应xy 平面上的 4 个L 靠近,所以d 22y x -能级升高,d z2能级下降; ②因为 d xy 在xy 平面内,受L 的影响大,所以d xy 能级上升,而d yz , d xz 受xy 平面上的 4 个L 排斥小,所以能级下降。
③但因z 方向上方还有 1 个L,加之2z d 的"小环"在xy 平面上,可受到L 的直接作用,所以2d z 能级高于 d xy 能级。
6015O h 点群,说明Jahn-Teller 效应为 0,按强场排:( t 2g )6(e g )0LFSE =-2.4△06016(B), (D)6017否6018(B)6019(1) [Fe(CN)6]3-: μ= [n(n+2)]1/2μβ; n1= 1[FeF6]3-: n2= 5(2) 中心离子Fe3+为d5结构,配位场为八面体场。
《结构化学》第六章 金属的结构和性质

6.2 金属单质的晶体结构
金属单质晶体结构比较简单, 这与金属键密切相关: 由 于金属键没有方向性和饱和性,大多数金属元素按照等径 圆球密堆积的几何方式构成金属单质晶体,主要有立方面 心最密堆积、六方最密堆积和立方体心密堆积三种类型.
6.2.1 等径圆球最密堆积与A1、A3型结构
等径圆球以最密集的方式排成一列(密置列),进 而并置成一层(密置层),再叠成两层(密置双层), 都只有一种方式:
非最密堆积方式中最重要的是立方体心堆积A2 , 还有A4和少数的A6、A7、A10、A11、A12等.
A2 立方体心密堆积
布鲁塞尔的原子球博物馆 9个直径18米的球形展厅构成一个立方体心模型
A4 金刚石型结构
A4中原子以四面体键相连. 晶胞中虽然都是同种原子, 但所处的环境不同(球棍图中用两色颜色来区分). 一个浅蓝 色球与一个深蓝色球共同构成一个结构基元.
A1最密堆积形成立方面心(cF)晶胞
ABCABC……堆积怎么会形成立方面心晶胞? 请来个逆向思维:
取一个立方面心晶胞:
体对角线垂直方向就是密置层, 将它们设成3种色彩:
从逆向思维你已明白, 立方面心晶胞确实满足 ABCABC……堆积。
那么, 再把思路正过来: ABCABC……堆积形成立 方面心晶胞也容易理解吧?
晶胞 六方P
四、 金刚石型晶体(A4型)
C原子的配位数为4, 2套等同点 结构基元:2个C 空间点阵型式:立方F 每个晶胞中有8个C原子, 其坐标分别为:
(0,0,0), (1/2,1/2,0),
(1/2,0,1/2),(0,1/2,1/2),
(1/4,1/4,1/4),(1/4,3/4,3/4),
(为看得清楚,绿 球和蓝球层各有3 个球未画出)
北师大_结构化学课后习题答案Word版

北师大 结构化学 课后习题 第一章 量子理论基础习题答案1 什么是物质波和它的统计解释?参考答案:象电子等实物粒子具有波动性被称作物质波。
物质波的波动性是和微粒行为的统计性联系在一起的。
对大量粒子而言,衍射强度(即波的强度)大的地方,粒子出现的数目就多,而衍射强度小的地方,粒子出现的数目就少。
对一个粒子而言,通过晶体到达底片的位置不能准确预测。
若将相同速度的粒子,在相同的条件下重复多次相同的实验,一定会在衍射强度大的地方出现的机会多,在衍射强度小的地方出现的机会少。
因此按照波恩物质波的统计解释,对于单个粒子,ψψ=ψ*2代表粒子的几率密度,在时刻t ,空间q 点附近体积元τd 内粒子的几率应为τd 2ψ;在整个空间找到一个粒子的几率应为 12=ψ⎰τd 。
表示波函数具有归一性。
2 如何理解合格波函数的基本条件? 参考答案合格波函数的基本条件是单值,连续和平方可积。
由于波函数2ψ代表概率密度的物理意义,所以就要求描述微观粒子运动状态的波函数首先必须是单值的,因为只有当波函数ψ在空间每一点只有一个值时,才能保证概率密度的单值性;至于连续的要求是由于粒子运动状态要符合Schrödinger方程,该方程是二阶方程,就要求波函数具有连续性的特点;平方可积的是因为在整个空间中发现粒子的概率一定是100%,所以积分⎰τψψd *必为一个有限数。
3 如何理解态叠加原理? 参考答案在经典理论中,一个波可由若干个波叠加组成。
这个合成的波含有原来若干波的各种成份(如各种不同的波长和频率)。
而在量子力学中,按波函数的统计解释,态叠加原理有更深刻的含义。
某一物理量Q 的对应不同本征值的本征态的叠加,使粒子部分地处于Q 1状态,部分地处于Q 2态,……。
各种态都有自己的权重(即成份)。
这就导致了在态叠加下测量结果的不确定性。
但量子力学可以计算出测量的平均值。
4 测不准原理的根源是什么? 参考答案根源就在于微观粒子的波粒二象性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《结构化学》第六章习题6001 试述正八面体场中,中心离子 d 轨道的分裂方式。
6002 试用分子轨道理论阐明 X -,NH 3 和 CN -的配体场强弱的次序。
6003 按配位场理论,在 O h 场中没有高低自旋络合物之分的组态是:---------------- ( )(A) d 3 (B) d 4 (C) d 5 (D) d 6 (E) d 76004 凡是中心离子电子组态为d 6的八面体络合物,其 LFSE 都是相等的,这一说法是否正确?6005 络合物的中心离子的 d 轨道在正方形场中,将分裂成几个能级:---------------- ( )(A) 2 (B) 3 (C) 4 (D) 56006 Fe(CN)63-的 LFSE=________________。
6007 凡是在弱场配位体作用下,中心离子 d 电子一定取高自旋态;凡是在强场配位体作用下,中心离子 d 电子一定取低自旋态。
这一结论是否正确?6008 Fe(CN)64-中,CN -是强场配位体,Fe 2+的电子排布为6g 2t ,故 LFSE 为_____________。
6009 尖晶石的一般表示式为 AB 2O 4, 其中氧离子为密堆积,当金属离子A 占据正四面体T d 空隙时,称为正常尖晶石,而当A 占据O h 空隙时,称为反尖晶石, 试从晶体场稳定化能计算说明 NiAl 2O 4 晶体是什么型尖晶石结构( Ni 2+为d 8结构)。
6010 在 Fe(CN)64-中的 Fe 2+离子半径比 Fe(H 2O)62+中的 Fe 2+离子半径大还是小?为什么?6011 作图证明 CO 是个强配位体。
6012 CoF 63-的成对能为 21?000 cm -1,分裂能为 13?000 cm -1,试写出:(1) d 电子排布 (2) LFSE 值 (3) 电子自旋角动量 (4) 磁矩6013 已知 ML 6络合物中(M 3+为d 6),f =1,g = 20?000 cm -1,P = 25?000 cm -1,它的LFSE 绝对值等于多少?------------------------------------ ( )(A) 0 (B) 25?000 cm -1 (C) 54?000 cm -1 (D) 8000 cm -16014 四角方锥可认为是正八面体从z 方向拉长,且下端没有配体 L 的情况。
试从正八面体场的 d 轨道能级图出发,作出四角方锥体场中的能级分裂图,并简述理由。
6015 某 AB 6n -型络合物属于O h 群,若中心原子 A 的d 电子数为6,试计算配位场稳定化能,并简单说明你的计算方案的理由。
6016 下列络合物哪些是高自旋的?------------------------------------ ( )(A) [Co(NH 3)6]3+ (B) [Co(NH 3)6]2+ (C) [Co(CN)6]4-(D) [Co(H 2O)6]3+6017 凡是低自旋络合物一定是反磁性物质。
这一说法是否正确?6018 Fe 的原子序数为26,化合物K 3[FeF 6]的磁矩为5.9玻尔磁子,而K 3[Fe(CN)6]的磁矩为1.7玻尔磁子,这种差别的原因是:------------------------------------ ( )(A) 铁在这两种化合物中有不同的氧化数(B) CN -离子比 F -离子引起的配位场分裂能更大(C) 氟比碳或氮具有更大的电负性(D) K 3[FeF 6]不是络合物6019 已知[Fe(CN)6]3-,[FeF 6]3-络离子的磁矩分别为1.7B μ,5.9B μ (B μ为玻尔磁子)( Fe 原子序数26),(1)请分别计算两种络合物中心离子未成对电子数;(2)用图分别表示中心离子 d 轨道上电子排布情况 ;(3)两种络合物其配位体所形成的配位场,是强场还是弱场?6020 [FeF 6]3-络离子的磁矩为:------------------------------------ ( )(A) 3B μ (B) 5B μ (C) 2.5B μ (D) 5.9B μ6021 已知:CoF 63- △0= 13?000 cm -1Co(CN)63- △0= 34?000 cm -1P = 21?000 cm -1确定上述两种络合物的磁性,并计算其 LFSE (以 cm -1为单位)。
6022 试分别用价键理论和晶体场理论推测下列络合物的磁性,并计算其未成对电子数目:[Fe(CN)6]4-, [Fe(CN)6]3-, [Mn(CN)6]4-, [Co(NO 2)6]3-, [Fe(H 2O)6]3+, [CoF 6]3- 6023 下列配位离子中磁性最大的是:------------------------------------ ( )(A) Mn(H 2O)63+ (B) Fe(H 2O)63+ (C) Fe(CN)64- (D) Co(NH 3)63+(E) Cr(H 2O)62+6024 下列哪个络合物的磁矩最大?------------------------------------ ( )(A) 六氰合钴(Ⅲ)离子(B) 六氰合铁(Ⅲ)离子(C) 六氨合钴(Ⅲ)离子(D) 六水合锰(Ⅱ)离子(E) 六氨合钴(Ⅱ)离子6025 铁的两种络合物:(A) Fe(CN)6,(B) Na 3FeF 6,它们的摩尔磁化率大小关系为χA ___χB ,它们的紫外可见光谱d-d 跃迁的波长大小关系为λA ___λB 。
6026 具有平面正方形结构的Cu 2+络合物可能会发生多少种能量不同的d-d 跃迁?6027 配位体 CN -, NH 3, X -在络离子光谱化学序列中的顺序是____________。
(A) X -<CN -<NH 3 (B) CN -<NH 3<X - (C) X -<NH 3<CN -6028 某同学测定了三种络合物d -d 跃迁光谱,但忘了贴标签,请帮他将光谱波数和络合物对应起来。
已知三种络合物为 [ CoF 6]3-, [Co(NH 3)6]3+, [Co(CN)6]3-,它们的三个光谱波数分别为 34?000 cm -1,13?000 cm -1,23?000 cm -1。
6029 推测下列三种络合物的d -d 跃迁频率大小顺序:------------------------------------ ( )(1)六水合铁(Ⅲ) (2)六水合铁(Ⅱ) (3)六氟合铁(Ⅱ)(A) ν1>ν2>ν3 (B) ν1>ν3>ν2 (C) ν3>ν2>ν1(D) ν3>ν1>ν2 (E) ν2>ν1>ν36030 络合物的光谱(d-d 跃迁)一般在什么区域?------------------------------------ ( )(A) 远紫外 (B) 红外 (C) 可见-近紫外 (D) 微波6031 络化合物中的电子跃迁属 d-d 跃迁,用________光谱研究最为合适。
6032 在 Fe(H 2O)62+和 Fe(CN)64-中,Fe 2+的有效离子半径哪个大?为什么?6033 在 [PtCl 3(C 2H 4)]-中,哪些因素的影响使得 C 2H 4 分子络合前后 C —C 键键长发生什么样的变化?6035 Jahn-Teller 效应的内容为_____________。
6036 在过渡金属络合物中,由于Jahn-Teller 效应使构型发生畸变,若为强场配位体,畸变发生在d 7,d 9,若为弱场配位体,发生在____________。
6037 络离子 [Re 2Cl 8]2-具有重叠式构型,实验测定的 Re —Re 键较正常单键短( 224pm )。
(1)说明该络离子的对称点群;(2)试由金属原子价轨道的成键情况(作图表示),说明Re—Re 键为什么较短;(3)说明该络离子为什么不是交叉构型。
(Re的原子序数为75,电子组态为6s25d5)6038 请画出[Re2Cl8]2-的结构,并讨论:(1) [Re2Cl8]2-的成键情况;(2) [Re2Cl8]2-中存在的对称元素和所属点群。
6039 下列八面体络合物的电子结构中哪个将发生较大的畸变?-------------------- ( )(A) (t2g)5(e g)2(B) (t2g)3(e g)2(C) (t2g)4(e g)2(D) (t2g)6(e g)36040 下列络合物的几何构型哪一个偏离正八面体最大?-------------------------------- ( )(A) 六水合铜(Ⅱ) (B) 六水合钴(Ⅱ) (C) 六氰合铁(Ⅲ)(D) 六氰合镍(Ⅱ) (E) 六氟合铁(Ⅲ)6041 下列配为位离子中,哪个构型会发生畸变?------------------------------------ ( )(A) Cr(H2O)63+(B) Mn(H2O)62+(C) Fe(H2O)63+(D) Cr(H2O)62+6042 下列八面体络合物中,哪些会发生畸变?为什么?Ni(H2O)62+,CuCl64-,Cr(CN)63-,Co(NH3)62+6043 根据Jahn-Teller 效应,说明下列配位离子的几何构型:Fe(H2O)62+,Fe(CN)64-,CuCl64-,FeF64-,Ni(CN)64-6044 Ni2+的低自旋络合物常常是平面正方形结构,而高自旋络合物则多是四面体结构,试用杂化轨道理论解释之。
6045 为什么Mn3+的六配位络离子为变形八面体,而Cr3+的配位络离子为正八面体构型?6046 下列四种过渡金属络离子中,具有理想正八面体构型的有:------------------------ ( )(A) [Cr(NH3)6]3+(B) [Cu(NH3)6]2+(C) 高自旋[Mn(H2O)6]2+(D) 低自旋[Fe(CN)6]3-6047 Ni2+有两种络合物,根据磁性测定知[Ni(NH3)4]2+是顺磁性,[Ni(CN)4]2-为反磁性,试推测其空间结构。
( Ni 的原子序数为28)6048 写出八面体形的Co(en)33+及[Co(NH3)4Cl2]+可能出现的异构体。
6049 写出八面体形的[Co(en)(NH3)2Cl2]+可能出现的异构体。
6050 指出ZnCl42-,Ni(CN)42-,Mn(H2O)42+,TiCl4,Ni(CN)53-的配位多面体的结构型式。
6051 正八面体络合物MA6中的三个配位体A 被三个B 取代,所生成的络合物MA3B3有多少种异构体?这些异构体各属什么点群?6052 单核羰基络合物Fe(CO)5的立体构型为:------------------------------------ ( )(A) 三角双锥(B) 四面体(C) 正方形(D) 八面体(E) 三角形6053 四羰基镍的构型应为:------------------------------------ ( )(A)正八面体(B)平面三角形(C)四面体(D)正方形6054 CO 与过渡金属形成羰基络合物时,CO 键会:------------------------------------ ( )(A)不变(B)加强(C)削弱(D)断裂6055 Ni(CO)4中Ni 与CO 之间形成:------------------------------------ ( )(A)σ键(B) π键(C) σ-π键6066 Mn(CO)4NO 是否符合18 电子规律?6067 羰基络合物中,CO 键的键长比CO 分子键长应:----------------------------------- ( )(A) 不变(B) 缩短(C) 变长6068 Re Re四重键中,δ键由__________轨道迭加而成(键轴为z轴)。
