第12章---多步骤有机合成路线设计
有机合成路线的设计与实施课件下学期高二化学人教版选择性必修3

知识储备3:由反应条件确定官能团
看碳架(比对原料与产物), 巧切断
对点训练
2.用2-丁烯、乙烯为原料设计 的合成路线。
逆合成分析:
+
对点训练
恒压滴液漏斗
球形冷凝管
三颈烧瓶
温度计
作用是
冷凝回流
左图是实验室进行有机合成的常用装置,它能够在加热时进行搅拌、 温度监测、加料和冷凝回流等实验操作。规模化的工业生产中多使用体积较大的反应釜。
取代反应
消去反应
—
2
CH3COOH
取代反应
消去反应
加成反应
对点训练
缩聚反应
含羧基和羟基、含羧基和氨基
知识储备2:根据有机反应中定量关系推断
(1)烃和卤素单质取代:取代1mol氢原子,消耗1mol卤素单质X2;(2)碳碳双键 的加成:与H2、Br2、HCl、H2O等加成时按物质的量比1:1加成;(3)含有机化合物与Na反应时:2mol—OH生成1molH2;(4)银镜反应时1mol—CHO对应生成2molAg;与新制Cu(OH)2反应时1mol—CHO对应生成1molCu2O;(5)2mol—COOH与Na2CO3反应时生成1molCO2;1mol—COOH与NaHCO3反应时生成1molCO2
网
科
第五节 有机合成
第三章 烃的衍生物
3.5.3 有机合成路线的设计与实施
学习目标
教材内容:P84-89
1.了解有机合成的基本过程和基本原则。2.认识逆向合成法的思维方法理解逆向合成法在有机合成中的应用,知道“绿色合成”原则。3.体会有机合成在创造新物质、提高人类生活质量及促进社会发展方面的重要贡献。培养科学态度与社会责任的化学核心素养。
逆合成分析法
(高中段)专题十五微专题15.2有机化学基础之难点题目——有机合成路线设计2

分析③:由分析②可知,有 3 个顺序需要确定,一是引入—CH2Cl,二 是除去溴原子,三是酯化反应。从有机物 G 的合成路线中 C→E 看,会误认 为可以先除去溴原子,再引入—CH2Cl,出现这样的错误是由于没有弄清反 应的原理,D 物质中—OH 的邻、对位已部分被其他基团占据,故再引入
—CH2Cl,不会出现大量副产物,而若先除去化合物
的
路线。
解析:根据由 A 生成 B 的反应条件,结合 A、B 的分子式和物质 C 的结构简
式,可推知 A 是
、B 是
,对比 E、F 的分子组成及题给转
化关系可推知由 E 生成 F 的反应是取代反应,E 分子中的 Cl 原子被—N(C2H5)2
取代,可知 F 的结构简式为
中溴原子,则得到 ,
此时再引入—CH2Cl,会产生大量的副产物,故应引入—CH2Cl 之后再除去
溴原子。由题给信息知在引入—CH2Cl 之后,可在 NaOH 溶液中水解(此时苯
环上的溴原子不水解),使—CH2Cl 转变为—CH2OH,再进行酯化反应和除去
溴原子即可。
[答案]
解析:
根据题中涉及的反应①②制备生成物的工艺流程为:苯环上的
(3)F 的结构简式是________________________________________________。 (4)C 与 F 反应生成 G 的化学方程式是________________________________ _________________________________________________________________。
(2)逆推法 即从目标分子着手,分析目标分子的结构,然后由目标分子逆推出原料 分子,并进行合成路线的设计,其思维程序为 目标有机物 ⇨ 中间产物 ……⇨ 中间产物 ⇨ 基础原料
高中化学-有机合成路线的分析与设计

有机合成路线的分析与设计一、有机合成中官能团的衍变1、官能团的引入(或转化)方法(1)引入或转化为碳碳双键的三种方法①醇的消去反应引入②卤代烃的消去反应引入③炔烃与H2、HX、X2的不完全加成反应(2)引入卤素原子的三种方法①烷烃、苯及其同系物与卤素单质发生取代反应②不饱和烃与卤素单质、卤化氢的加成反应③醇与氢卤酸的取代反应(3)引入羟基的四种方法①烯烃与水加成生成醇②卤代烃的碱性水解成醇③醛或酮与氢气加成生成醇④酯水解生成醇(4)引入醛基(或羰基)的方法①醇的催化氧化(5)引入羧基的四种方法①醛被氧化成酸②酯在酸性条件下水解③含侧链的芳香烃被强氧化剂氧化④醇被强氧化剂氧化2、官能团的保护:有机合成过程中,为了避免有些官能团发生变化,必须采取措施保护官能团,待反应完成后再使其复原。
有时在引入多官能团时,需要选择恰当的顺序保护特定官能团被保护的官能团被保护的官能团性质保护方法酚羟基易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化碳碳双键易与卤素单质加成,易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化醛基易被氧化3、官能团的消除(1)通过加成消除不饱和键双键或三键(2)通过加成或氧化等消除醛基(—CHO)(3)通过消去、氧化、与氢卤酸取代或酯化反应等消除羟基(—OH)(4)通过水解反应消除酯基、肽键、卤素原子三、有机合成中碳骨架的衍变1、使有机物碳链增长的反应①乙炔自身加成②卤代烃与NaCN的反应③卤代烃与炔钠的反应④卤代烃和钠反应⑤醛、酮与氢氰酸的加成反应⑥醛、酮与格氏试剂反应⑦羟醛缩合反应⑧烯烃、炔烃加聚反应⑨苯环与卤代烃反应(傅克反应)⑩苯环与酰卤反应⑪缩聚反应2、使有机物碳链缩短的反应①脱羧反应②氧化反应③水解反应④烃的裂化或裂解反应3、使有机物碳链的成环的反应①二烯烃成环反应(双烯合成)②羟基酸酸的酯化成环③多元羧酸与多元醇的酯化成环④氨基酸的成环⑤二元羧酸与二氨基化合物成环⑥形成环醚4、使有机物碳链的开环的反应①环酯水解开环②环烯烃氧化开环四、有机合成路线的设计与分析1、常见有机物的转化关系2、有机合成路线设计思路3、常见的有机合成路线 (1)一元化合物合成路线:R —CH===CH 2−→−HX R —CH 2—CH 2X ∆−−−→−溶液NaOH R —CH 2—CH 2OH []−→−O R —CH 2—CHO []−→−OR —CH 2—COOH −−−−→−∆醇、浓硫酸、酯 (2)二元化合物合成路线CH 2===CH 2−→−2X CH 2X —CH 2X ∆−−−→−溶液NaOH HOH 2C —CH 2OH []−→−O OHC —CHO []−→−O HOOC —COOH −−−→−一定条件链酯、环酯、聚酯(3)芳香化合物合成路线 ①∆−−−→−溶液NaOH②光照−→−2Cl ∆−−−→−溶液NaOH −−−−→−∆醇、浓硫酸、芳香酯4、有机合成的分析方法(1)正向合成分析法: (2)逆向合成分析法: (3)正、逆合成分析:(4)逆合成分析法设计有机合成路线的思维程序(5)逆向合成分析法应用例析:利用“逆合成分析法”分析由乙烯合成草酸二乙酯的过程逆合成分析思路,概括如下 具体步骤如下5、解决有机合成题的基本步骤第一步:要正确判断合成的有机物属于何种有机物,它带有什么官能团,它和哪些知识、信息有关,它所在的位置的特点等第二步:根据现有原料、信息和有关反应规律,尽可能合理地把目标有机物解剖成若干片段,或寻找官能团的引入、转换、保护方法,或设法将各片段(小分子化合物)拼接衍变,尽快找出合成目标有机物的关键和突破点。
专题12 有机合成(教材深讲)-23学年高二化学知识整合讲练(人教版2019选择性必修3)(解析版)
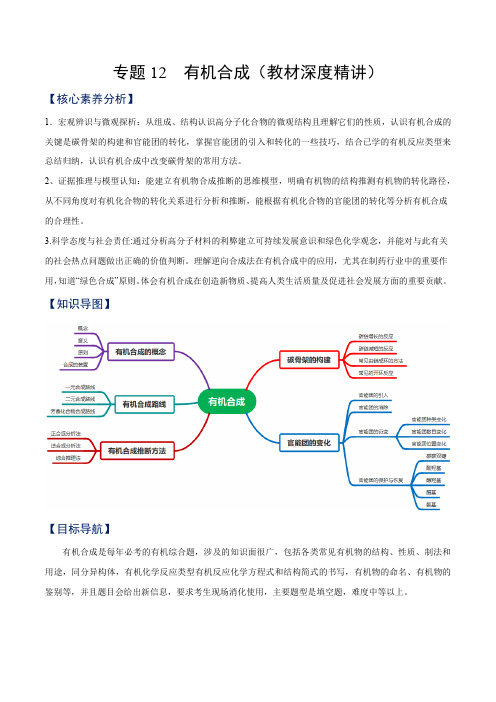
专题12 有机合成(教材深度精讲)【核心素养分析】1.宏观辨识与微观探析:从组成、结构认识高分子化合物的微观结构且理解它们的性质,认识有机合成的关键是碳骨架的构建和官能团的转化,掌握官能团的引入和转化的一些技巧,结合已学的有机反应类型来总结归纳,认识有机合成中改变碳骨架的常用方法。
2、证据推理与模型认知:能建立有机物合成推断的思维模型,明确有机物的结构推测有机物的转化路径,从不同角度对有机化合物的转化关系进行分析和推断,能根据有机化合物的官能团的转化等分析有机合成的合理性。
3.科学态度与社会责任:通过分析高分子材料的利弊建立可持续发展意识和绿色化学观念,并能对与此有关的社会热点问题做出正确的价值判断。
理解逆向合成法在有机合成中的应用,尤其在制药行业中的重要作用,知道“绿色合成”原则。
体会有机合成在创造新物质、提高人类生活质量及促进社会发展方面的重要贡献。
【知识导图】【目标导航】有机合成是每年必考的有机综合题,涉及的知识面很广,包括各类常见有机物的结构、性质、制法和用途,同分异构体,有机化学反应类型有机反应化学方程式和结构简式的书写,有机物的命名、有机物的鉴别等,并且题目会给出新信息,要求考生现场消化使用,主要题型是填空题,难度中等以上。
【重难点精讲】一、有机合成的主要任务1.有机合成的概念及意义(1)概念:有机合成指利用简单、易得的原料,通过有机反应生成具有特定结构和功能的有机化合物的过程。
(2)意义:①制备天然有机物,弥补自然资源的不足;②对天然有机物进行局部的结构改造和修饰,使其性能更加完美;③合成具有特定性质的、自然界并不存在的有机物,以满足人类的特殊需要。
2.有机合成的任务有机合成的任务包括目标化合物分子骨架的构建和官能团的转化。
3.有机合成遵循的原则(1)起始原料要廉价、易得、低毒、低污染。
(2)尽量选择步骤最少的合成路线,使得反应过程中副反应少、产率高。
(3)符合“绿色化学”的要求,操作简单、条件温和、能耗低、易实现、原料利用率高、污染少,尽量实现零排放。
高中《化学》有机合成思路与方法
(2).官能团的消除 (1)消除双键:加成反应。 (2)消除羟基:消去、氧化、酯化反应。 (3)消除醛基:还原和氧化反应。 (3).官能团的保护 在引入一个新官能团或将某一官能团加以转换时,若反应会影响分子中原有的官能 团,则应对这一官能团进行保护。例如在含有碳碳双键的分子中,欲将羟基氧化时, 应先把碳碳双键保护起来,以防被破坏。为了保护其他官能团而人为引入的基团, 称为保护基。保护基的选择应满足以下条件:①易于引入且不影响分子中其他部位 结构;②形成的保护基在后续反应中保持稳定;③在保持分子其他部位结构不被破 坏的情况下易于除去。试题中出现的大多是对(酚)羟基、醛基、氨基、碳碳双键 等易于被氧化的官能团进行保护。
(3)成环的方法
①二元醇脱水成环醚; ②二元醇与二元羧酸成环酯; ③羟基酸分子间成环酯; ④氨基酸分子间成环等。 ⑤ 双烯合成[狄(弟)尔斯-阿尔德反应]
4. 有机合成路线的设计
能力要求:能利用不同类型有机化合物之间的转化关系及能
够从题给合成路线中选用必要的合成方法,设计合理路线
合成目标化合物。 综合能力要求高,是考查的难点! 一般是3分,也是拉开差距的部分!!!
和
为原料制备
的路线(无机试剂任选)。
(1)合成路线为:
(1)
(2)已知 :
。设计以
的路线(无机试剂任选)。
和
为原料制备
理解信息中给出的成环反应, 虚线左边来自于二烯烃,虚线右边来自于单烯烃,结合原
料中有含醛基物质,可推出
可由
与氢气加成反应得到,而
可
由 CH2=CHCH=CH2 和 CH2=CHCHO 加成得到。而 CH2=CHCH=CH2 可由 CH3CH=CHCH3 与溴发生加成反应,然后再发生卤代烃的消去反应得到,进而得到合成路线图。
有机化合物合成优秀教案(高二有机)
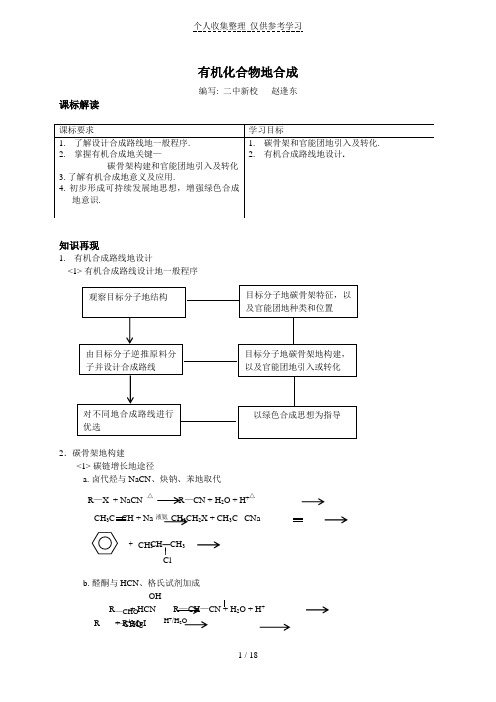
有机化合物地合成编写: 二中新校 赵逢东课标解读知识再现1. 有机合成路线地设计<1> 有机合成路线设计地一般程序2.碳骨架地构建<1> 碳链增长地途径a. 卤代烃与NaCN 、炔钠、苯地取代R —X + NaCN △ R —CN + H 2O + H +△CH 3C CH + Na 液氨 CH 3CH 2X + CH 3C CNaCH —CH 3b. 醛酮与HCN 、格氏试剂加成OHR + HCN R —CH —CN + H 2O + H + R + R 1MgI H +/H 2O CH 3— Cl—CHO—CHO△c. 羟醛缩合 CH 3CHO + CH 3CHO OH - CH 3—CH —CH 2CHO △OH<2> 减短碳链a. 烯烃、炔烃地氧化RR-CH=CH 2KMnO4/H+KMnO4/H+ R 1b. 羧酸或其盐脱羧CH 3COONa + NaOH3. 官能团地引入与转化<1> 引入碳碳双键,通过加成、消去、羟醛缩合等a CH 3CH 2CH 2OH 浓H 2SO 4 170℃b CH CH + HCl 催化剂OH c CH 3CH 2Br NaOH/C 2H 5OH d HCHO + CH 3CHO OH -CH 2-CH 2CHO △<2> 引入卤原子,通过取代、加成反应等a CH 4+ Cl 2光 + Br 2Feb CH 3—CH=CH 2 + Cl 2催化剂c CH 3CH 2H +△ d CH 3CH 2CH=CH 2 + Cl 2500-600℃<3> 引入羟基,通过加成、取代反应等a CH 2=CH 2 + H 2O 催化剂△b CH 3CH 2Cl + H 2O NaOHc CH 3CHO + H 2Ni<4> 引入羰基或醛基,通过醇或烯烃地氧化等a CH 3CH 2OH + O 2C u △b CH 3CHCH 3 + O 2Cu △CH 3 OHc CH 3—C=CH —CH 3KMnO 4/H +<5> 引入羧基,通过氧化、取代反应等a CH 3CHO + O 2催化剂b CH 3CHO + C u (O H )2△c KMnO 4/H +d CH 3COOCH 2— + H 2O H +e CH 3CH 2Br + NaCN △ CH 3CH 2CN + H 2O + H +典题解悟:CH=CH-R—CH 3 △知识点一碳骨架地构建例1. 以丙酮.甲醇为原料,以氢氰酸.硫酸为主要试剂合成a—甲基丙烯酸甲酯.O解析:目标分子地结构简式为 CH2=C—C—OCH3,它是由a—甲基丙烯酸CH3(CH2=C—COOH )和甲醇(CH3OH)经酯化反应而得,因此,要得到目标分子,CH3 O主要是考虑将原料分子丙酮(CH3—C—CH3)转化为a—甲基丙烯酸,比较丙酮与 a—甲基丙烯酸地结构可以看出:丙酮比a—甲基丙烯酸少一个碳原子,且碳氧双键转化为碳碳双键,能满足这个要求地反应是丙酮与氢氰酸加成反应,CH3 CH3产物CH3—C—CN 经水解得到 CH3—C—COOH ,然后在浓硫酸作用下,脱去一OH OH分子水,从而得到目标产物.答案:用化学方程式表示如下:O OH(1)CH3—C—CH3 + HCN NaOH CH3—C—CNCH3CH3 CH3(2)CH3—C—CN + 2H2O + H+水解 CH3—C—COOH + NH4+OH OHCH3(3)CH3—C—COOH 浓硫酸△ CH2=C—COOH + H2OOH CH3O(4)CH2=C—COOH + CH3OH 浓硫酸△CH2=C—C—OCH3 + H2OCH3 CH3例2. 乙烯是有机化工生产中最重要地基础原料,请以乙烯和天然气为有机原料,任选无机材料,合成1,3—丙二醇,(1,3—丙二醇地结构简式为 HO—CH2—CH2—CH2—OH)写出有关反应地化学方程式.解析:目标产物分子中有一个三碳原子链,而原料乙烯分子中只有2个碳原子,自己要增加一个碳原子,方法很多:乙醛与HCN加成.氯乙烷与NaCN反应、乙醛与甲醛发生羟醛缩合等.由于前二者涉及到后续反应中氰基转化地问题,比较麻烦,而目标产物多元醇跟羟醛缩合产物比较接近,可以尝试羟醛缩合.答案:① 2CH2=CH2 + O2催化剂 2CH3CHO②CH4 + Cl2光照CH3Cl + HCl③CH3Cl + H2O NaOH△CH3—OH + HCl④ 2CH3OH + O2催化剂,△2 HCHO + 2 H2O⑤ H2C=O + H—CH2CHO HO—CH2—CH2CHO⑥ HO—CH2CH2CHO + H2Ni,△ HO—CH2CH2CH2—OH知识点二:官能团地引入与转化例 3.乙酸苯甲酯对花香和果香地香韵具有提升作用,故常用于化妆品工业和食品工业.乙酸苯甲酯可以用下面地设计方案合成.A Cl2,光照 B(C7H7Cl)稀碱溶液 C CH3COOH,稀H2SO4△①②③D 2OOCCH4(1)写出A ,C地结构简式;A:,C:.(2)D有很多同分异构体,含有酯基和一取代苯结构地同分异构体有五个.其中三个结构简式是:COOCH2CH3—CH2—CH2CH2请写出另外两个同分异构体结构简式:①②解析:本题可采用逆推地方法确定A、C 地结构.由D(乙酸苯甲酯)可推得C为苯甲醇,—可由B分解得到,故B应为—CH A为甲苯.(2)由酯地结构特点和书写规则,适当移动酯基地位置可得到:答案:(1)A::—CH2(2)—3和—CH2知识点三.有机合成例4 502瞬间强力胶是日常生活中常用地黏合剂,它是由a —氰基丙烯酸乙酯 (CH 2=C —COOC 2H 5)聚合后地产物中加入适当地填料加工制成地,请设计a —氰基丙 CN 烯酸乙酯地合成路线.解析:利用逆推法,由a —氰基丙烯酸乙酯地结构分析,其中含有明显地三个官能团“碳碳双键”,“—CN ”,“—COO —”.从如何形成官能团地角度考虑,a —氰基丙烯酸乙酯可以由乙醇和a —氰基丙烯酸(CH 2=C —COOH )经酯化而成,然后,在推断 CN合成a —氰基丙烯酸地原料,合成它地方法有多种,其一可由丙烯酸经卤代后,再与氢氰酸取代.答案:用化学方程式表示如下:(1)CH 2=CH —COOH + Br 2 催化剂 CH 2=C —COOH + HBr Br (2)CH 2=C —COOH + HCN CH 2=C —COOH + HBrBr CN(3)CH 2=C —COOH + C 2H 5OH CH 2=C —COOC 2H 5 + H 2O CN CN 夯实基础:1. 以苯为原料不能通过一步反应制得地有机物是( )A 溴苯B 苯磺酸C TNTD 环己烷E 苯酚2. 将A 与Na OH 溶液共热后通足量CO 2B 溶解,加热通足量SO 2C 与稀硫酸共热后加入足量Na OHD 与稀硫酸共热后加入足量NaHC O 3O O3. 链状高分子化合物 [ C —C —O —CH 2—CH 2—O ]n 可由有机化工原料R 和其他有机试剂通过加成、水解、氧化、缩聚反应得到则R 是( ) A 1—丁烯 B 2—丁烯 C 1,3—丁二烯 D 乙烯ONO 2 ONO 2ONO 24.由CH 3CH= CH 2合成CH 2—CH —CH 2时,需要经过下列那几步反应( )A 加成→取代→取代→取代B 取代→加成→取代→取代C 取代→取代→加成→取代D 取代→取代→取代→加成5.化合物丙由如下反应制得C 4H 10O(甲) 浓硫酸△C 4H 8(乙) Br 2,溶剂CCl 4C 4H 8Br 2(丙),丙地结构简式不可能是 ( )A CH 3CH 2CHBrCH 2Br B CH 3CH (CH 2Br )2 C CH 3CHBrCHBrCH 3 D (CH 3)2CBrCH 2Br COONa 转变成 OOCCH 3 COONa 地正确方法是( ) OH △6 某有机物甲经氧化后得乙(C2H3O2Cl),而甲经水解可得丙,1mol丙和2mol乙反应可得一种烃氯酯(C6H8O4Cl2),由此推断甲地结构简式为:()A CH2Cl—CH2OHB HCOOCH2ClC CH2ClCHOD CH2—CH2OH OHB HCl C7 有机物A可发生如下变化:A(C6H12O2)D Cu△E已知C、E 都不发生银镜反应,则AA 1种B 2种C 3种D 4种8 下列反应中,不可能在有机化合物分子里引入—COOH地是()A 醛催化氧化B 卤代烃水解C 腈酸性条件下水解D 酮催化氧化9 在一定条件下,下列几种生产乙苯地方法中,原子经济性最好地是()Cl —C2H5 + HCl5OH —C2H5 + H5=CH2—C2H5D —CH3—CH=CH2 + HBr—2—C2H510 已知苯磺酸在稀酸中可以水解而除去磺酸根3H + H2O稀酸 150℃ + 4又知苯酚与浓硫酸已发生取代反应2SO4△ OH——SO3BrSO3H现以苯、水、溴、浓硫酸及碱为原料,合成,写出有关各步反应地方程式.11 香豆素分子式为 C9H6O2 ,分子中除有一个苯环外,还有一个六元环,已知有机物AO O(C7H6O2)可以发生银镜反应,由A 和乙酸酐 CH3—C—O—C CH3在一定条件下经下图一系 O O OH O O列反应制得C7H6O2(A)+CH3C—C—CH3一定条件—CH2—C—O—C—CH3反应(1)OH+H2O(H+)CHCOOH + C9H10O4(B) △C9H8O3(C)-H2O C9H6O2 ( D )3反应(2)消去反应△(1)写出A,B,C,D地结构简式A B C D(2)1属于反应,2属于反应.12 从环己烷可制备1,4—环己二醇地二醋酸酯,下面是有关地8步反应(其中所有无机产物均已不见光 B ④⑤Br —⑥ C ⑦ D ⑧ CH 3COO ——OOCCH 3 其中有3醋酸,醋酸酐反应,2步属于消去反应,3步属于加成反应.反应 ① 、 和属于取代反应,其中③、和 属于加成反应,化合物结构简式为B C .④所用试剂和条件13 已知 ①O 3—C=C — —C=O+O=C —②Zn/H 2O现有以下转换关系:①O 3H 2①O 3O OC 8H 16(A ) 仅一种产物(B ) CD CH 3—C —CH 3+H —C —H ②Zn/H 2O Ni /△②Zn/H 2O(1)写出A 地结构简式(2)完成下列变化地化学方程式:B CC DD 形成高分子化合物:14 某酯A 地化学式为C 6H 8O 4Cl 2,与有机物A ,B ,C ,D 地变化关系如下图:C 2H Cu (OH )2E Cu ,O 2C 6H 8O 4Cl 2(A △1molA 经水解生成根据上述变化关系填空:① 写出物质地结构简式:ABC D②B 地水解产物经醇化可得F (C 2H 4O 3),两个F 分子发生酯化反应可有两种不同地有机产物,写出这两种产物地结构简式 , .③F 可以聚合成高分子化合物,写出该反应地化学方程式.—Br15 已知C H 3 [O —C —C] nC 3H 7Br NaOH 溶液△A Cu/O2B ①与HCN 加成H 2O/H +CO 浓硫酸 D C 4H 6O 2引发剂△浓硫酸△ ①写出B ,C ,D 地结构简式:BCD②写出下列转化地方程式:C D :B C : E F : 16(1)现有一化合物A ,是由B ,C ,两种物质通过羟醛缩合反应生成地,是根据A 地结构写出B ,C 地结构简式 AB C(2)已知CH 3CH 2Br+Mg 乙醚 CH 3CH 2MgBr ,可得格氏试剂,它可与羰基发生加成反应,其中“-MgBr ”部分加到羰基氧上,可得产物经水解可得醇,今欲通过上述反应合成CH 3—CHOH —CH 2—CH 3时,选用地试剂和 或和.17 本节利用所学地羟醛缩合反应以乙烯为初始反应物和必要地无机试剂制备正丁醇(CH 3CH 2CH 2CH 2OH ),写出各步反应地化学方程式.18 以乙烯为原料合成CH 3CH 2OOC —CH 2CH 2COOCH 2CH 3(无机试剂可自选),试写合成路线19 以1-溴丙烷为初始反应物(无机试剂自选)合成4-甲基-2-戊炔,写出各步反应地化学方程式.20 写出合成下列物质各步化学方程式并注明反应类型CH 3 CH 3(1)由 CH 3—C —CH 2Cl 合成CH 3—CH —CH 3C H 3 CH 3CH 2OH E CH 3-C-CH 2-CHO C H 3CH 3O(2)由CH 2=CH 2合成 [ O —CH —C ] n CH 3能力提高:1 已知卤代烃与镁可反应生成格氏试剂,如:R—X + Mg R —MgX,利用格氏试剂与羰基化合物(醛、酮)等地反应可以用来合成醇类. R R 如:>C=O + R —MgX >CR —OMgX ;—C —OMgX+H 2O —C —OH + Mg(OH)X 据以上信息,以苯、溴、乙烯为主要原料,首先合成CH —CH 3OH然后由此合成CH2 已知:① 同一碳原子上有两个双键(如C=C=C 和C=C=O )地化合物不稳定;② 2R —X Na R —R (X 表示卤素原子),水解聚马来酸酐(代号HPMA )普通用于锅炉用水作阻垢剂,按下图所示步骤可以从不饱和烃A 合成HPMAA ①B Na ②C (C 4H 6) Br 2③D ④E 水解⑤ CH 2—CH 2—CH 2—CH 2 OH OH⑥ F Br 2⑦G ⑧H 分子内脱水⑨ I 加聚反应⑩ J [(C 4H 2O 3)n ]水解 HPMA①写出下列物质地结构简式:A D② 反应③属于 反应,反应⑦属于 反应(填反应类型)③ 写出反应⑨地化学方程式C3 环己烯可以通过丁二烯与乙烯发生环化加成反应得到:CH 2=CH —CH=CH 2 + CH 2=CH 2实验证明,下列反应物分子地环外双键比环内双键更容易被氧化:—CHO某些醇类可以通过发生如下反应引入碳碳双键:C 2H 5OH 浓硫酸170℃CH 2=CH 2 + H 2O现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:丁二烯—CH 3C 7H 14O(1)A 地结构简式是 B 地结构简式是(2)写出下列反应地化学方程式和反应类型:④ 反应类型⑤ 反应类型4 已知有机物在一定条件下能发生脱氢反应:CH 3 CH 3CH 3CH —COOR -H 2,催化剂 CH 2=C COOR ,再以丙烯为原料,经下列各步反应,合成一种有机高分子化合物E ,请按下图各步反应:CH 3—CH=CH 2H 2、CO 高压 A O 2 催化剂 B CH 3OH 浓硫酸、△ C 催化脱氢D (甲基丙烯酸甲酯) 加聚反应E (高分子化合物)写出各物质地结构简式:A 、B 、C 、D 、E 、5、以 HO 为原料制取 ,其他无机试剂自行选用,试设计出有 ––Br|BrBr –– OH |机合成路线,并写出有关地化学反应方程式.O O OH O6、已知下列反应可以发生:R—C—H + R1 —C—OH R—CH—O—C—R1又知:醇、氨都有似水性,酯可以水解,也可以氨解或醇解.维纶可以由石油产品乙烯为起始原料进行合成,主要步骤如下:D+CH3OHCH2=CH2O2 A +CH3COOH -H2O B 加聚 C E +HCHO 缩聚 G 维纶+NH3F[ CH—CH2—CH—CH2 ]nO— CH2—O回答下列问题:(1)写出A、C地结构简式:A、C、(2)写出C转化为E地两种途径地化学方程式.①C+CH3OH D+E ② C+NH3 E+F高考聚焦1.(2006年全国)绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物地质量与生成物总质量之比.在下列制备环氧乙烷地反应中,原子利用率最高地是2.(2005年全国)2,4,5 三氯苯酚和氯乙酸反应可制造除草剂2,4,5 三氯苯氧乙酸.某生产该除草剂地工厂曾在一次事故中泄漏出一种有毒地二恶英,简称TCDD.有关物质地结构式如下:请写出:(1)生成2,4,5 三氯苯氧乙酸反应地化学方程式(2)由2,4,5 三氯苯酚生成TCDD反应地化学方程式3.(2005上海)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成之:已知:合成路线:上述流程中:(ⅰ)反应 A→B仅发生中和反应,(ⅱ)F与浓溴水混合不产生白色沉淀.(1)指出反应类型:反应②反应④.(2)写出结构简式:Y F.(3)写出B+E→J地化学方程式.(4)写出E地属于芳香烃衍生物地同分异构体地结构简式:、、.4.(03年全国)(1)1mol丙酮(CH3COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸地结构简式是.(2)与乳酸具有相同官能团地乳酸地同分异构体A在酸性条件下,加热失水生成B,由A生成B地化学反应方程式是.(3)B地甲酯可以聚合,聚合物地结构简式是.5.(06年上海)自20世纪90年代以来,芳炔类大环化合物地研究发展十分迅速,具有不同分子结构和几何形状地这一类物质在高科技领域有着十分广泛地应用前景.合成芳炔类大环地一种方法是以苯乙炔(CH≡C-)为基本原料,经过反应得到一系列地芳炔类大环化合物,其结构为:(1)上述系列中第1种物质地分子式为.(2)已知上述系列第1至第4种物质地分子直径在1~100nm之间,分别将它们溶解于有机溶刑中,形成地分散系为.(3)以苯乙炔为基本原料,经过一定反应而得到最终产物.假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物地质量比为.(4)在实验中,制备上述系列化合物地原料苯乙炔可用苯乙烯(CH2=CH-)为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔地化学方程式(所需地无机试剂自选)6. (03年上海)已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如:+H2O某酯类化合物A是广泛使用地塑料增塑剂.A在酸性条件下能够生成B、C、D.(1)CH3COOOH称为过氧乙酸,写出它地一种用途.(2)写出B+E→CH3COOOH+H2O地化学方程式.(3)写出F可能地结构简式.(4)写出A地结构简式.(5)1摩尔C分别和足量地金属Na、NaOH反应,消耗Na与NaOH物质地量之比是.(6)写出D跟氢溴酸(用溴化钠和浓硫酸地混合物)加热反应地化学方程式:.7.(05江苏)6-羰基庚酸是合成某些高分子材料和药物地重要中间体.某实验室以溴代甲基环己烷为原料合成6-羰基庚酸.请用合成反应流程图表示出最合理地合成方案(注明反应条件)提示:①合成过程中无机试剂任选,②如有需要,可以利用试卷中出现过地信息,③合成反应流程图表示方法示例如下:夯实双基答案:1.CE2.A3.D4.B5.B6. A7.B8.BD9.D2Fe -Br + HBr -Br + H 2溶液△ -OH + HBr2SO 4△ -SO 3H + 2 H 2OSO 3HSO2 HO - -SO 3H +SO 3 Br SOHO SO 3H + 2 H 2O 稀酸 150℃ -2SO 4Br11. (1) A -CH -COOH C -CH=CHD - O C=O(2) 1. 加成 2.取代(水解)12. ⑥⑦; ⑤⑧; B -- -醇溶液\加热 -Cl13.①CH 3CH -CH=CH -CH -CH 3②B C ; CH 3CHCHO + H 2催化剂△ CH 3CHCH 2OH CH 33 CH 33 CH 3 CH 3CH 3C D; CH 3CHCH 2OH 浓硫酸△ CH 3C=CH 2 + H 2O [ C -CH 2 ]n CH 314. (1) A.CH 2COOCH 2CH 2OOCCH 2Cl B. CH 2COOH C. HO -CH 2CH 2OH D.CH 2CH 2OHO(2) HOCH 2COOCH 2COOH CH 2 CO -C -CH 2-OOO(3) n HOCH2-COOH 引发剂 [ OCH2-C ]n + n H2OO CH3 CH315①B CH3—C—CH3 C HO—C—COOH D CH2=C—COOHOH CH3②CH3—C—COOH 浓硫酸△ CH2=C—COOH + H2OCH3O OHB C CH3—C—CH3 + HClO CH3—C—CH3CH3OHCH3—C—CN + 2 H2O + H+ CH3—C—COOH + NH4+CH3COOCH2CH3E F:[ CH2 C ]nCH3O16(1) CH3 C CH3 CH2CHO (2)CH3MgBrCH3CH2CHO或CH3CHO,CH3CH2MgBr17 2CH2=CH2+O2催化剂△ 2CH3CHOOH OH2CH3CHO CH3CH—CH2CHO CH3CH—2CHO △ CH3CH=CH—CHO+H2OCH3CH=CHCHO + 2H2催化剂△ CH3CH2CH2CH2OHHCl CH3CH2Cl NaOH水溶液 CH3CH2OH18 CH2=CH2 Cl2CH2ClCH2Cl NaClO△CH2—CH2H2O/H+HOOC—CH2CH2—COOH CN CN浓H2SO4△CHCH2OOCCH2CH2COOCH2CH3319 CH3CH2CH2Br NaOH醇溶液△CH3CH=CH2+HBrBrCH3CH=CH2+HBrCH3CH—CH3BrCH3CH=CH2+HBr CH3CH—CH2BrBrCH3CH—CH2Br NaOH醇溶液△CH3C≡CH+2HBr2CH3C≡CH+2Na2CH3C≡CNa+H2↑CH3 CH320 (1) CH3C—CH2CL+H2O NaOH溶液△ CH3C—CH2OH+HCl CH3 CH32 (CH3)3CCH2OH+O2Cu△ 2(CH3)3CCHO+2H2O2 (CH3)3CCHO+O2催化剂△ 2 (CH3)3CCOOH(CH3)3CCOOH + NaOH(CH3)3CCOONa + H2O(CH3)3CCOONa + NaOH△(CH3)3CH(2) 2CH2=CH2+O2催化剂△2CH3CHOOHCH3CHO+HCNCH3CH—CNOH OHCH3CH—CN + 2H2O + H+CH3—CH—COOH + NH4+Rn CH3CHCOOH引发剂 [ O—CH—C ] n+nH2OCH3能力提高答案—Br + HBrO2CH2=CH2+O2催化剂2CH3—C—HOCH3—C—H + MgBr CH—CH3OMgCH3 + H2OCH—CH3 +Mg(OH)BrOMgBr OHO(2) 2—CH3 + O2催化剂2—C—CH3 + 2H—3 + ——C3OMgBr OH—C O—+ Mg(OH)BrCH3 CH3OH CH2—2SO—+ H2O32 (1) CH≡CH BrCH2—CH=CH—CH2Br (2) 加成、取代O O HC = CH(3) HO—C—CH=CH—C—OH △ O=C C=O + H2OO3 (1) A —CHO(2)④—浓H2SO4 =CH2 + H2⑤催化剂—CH3加成4 A CH3—CH—CHO B CH3—CH—COOH C CH3CH—COOCH3CH3 CH3 CH3COOCH3D CH2=C—COOCH3E [ CH2—C ]nCH3 CH35 合成路线:HO——NaOH CO2浓溴水 BrHO——△—O—2+ H2O —OH + NaHCO—2Br——B r↓ + 3HBr6 (1) A CH3CHO B [ CH2—CH ]nOOCOH3(2) ① [ CH2—CH ] n + nCH3 + nCH3COOCH3OOCCH 3 OHO② [ CH 2—CH ]n + WNH 3 [ CH 2—CH ] n + nCH 3—C —NH 2 OOCCH 3 OH高考聚焦答案:1.C 2.( 1)(2)3. (1)取代酯化(2) (3)+−−→−催化剂+NaCl (4)4.(1)(2)HOCH 2CH 2COOH −−→−∆+,H CH 2=CHCOOH +H 2O (3) 5. (1)C 24H 12(2)胶体(3)51︰50(4)-CH =CH 2+Br 2→-CHBr -CH 2Br-CHBr -CH 2Br +2NaOH-C ≡CH +2NaBr +2H 2O(分二步完成也给分)6.(1)杀菌消毒(2)CH 3--OH +H 2O 2→CH 3--O -OH +H 2O (3)(4)(5)4︰3(6)CH 3CH 2CH 2CH 2OH +HBr CH 3CH 2CH 2CH 2Br +H 2O。
2022化学第12章有机化学基础第1节认识有机化合物教案

第一节认识有机化合物考纲定位要点网络1.能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
2.了解常见有机化合物的结构。
了解有机化合物分子中的官能团,能正确地表示它们的结构。
3.了解确定有机化合物结构的化学方法和物理方法(如质谱、红外光谱、核磁共振氢谱等).4.能正确书写有机化合物的同分异构体(不包括手性异构体).5.能够正确命名简单的有机化合物。
有机物的分类与基本结构知识梳理1.有机物的分类(1)根据元素组成分类(2)根据碳骨架分类(3)根据官能团分类①烃的衍生物:烃分子里的氢原子被其他原子或原子团所代替,衍生出一系列新的有机化合物。
②官能团:决定化合物特殊性质的原子或原子团.③有机物的主要类别、官能团和典型代表物有机物类别官能团名称官能团结构典型代表物(结构简式)烯烃碳碳双键CH2===CH2炔烃碳碳三键CH≡CH卤代烃卤素原子-X CH3CH2Cl醇醇羟基—OH CH3CH2OH 酚酚羟基-OH醚醚键CH3CH2OCH2CH3醛醛基CH3CHO、HCHO酮羰基(酮基)羧酸羧基酯酯基CH3COOCH2CH3氨基酸氨基、羧基-NH2、—COOH2。
有机物的基本结构(1)有机化合物中碳原子的成键特点(2)有机物的同分异构现象a.同分异构现象:化合物具有相同的分子式,但结构不同,因而产生了性质上的差异的现象。
b.同分异构体:具有同分异构现象的化合物互为同分异构体。
(3)同系物命题点有机物的分类、官能团及基本结构1.(2020·南阳模拟)下列叙述正确的是()D[A项,不是芳香烃,不是烃,错误;B项,属于酚,属于醇,二者不是同系物关系,错误;C项,属于酯类,错误。
]2.下列物质的类别与所含官能团都正确的是()A.①②③④⑤B.②③④C.②④⑤ D.仅②④C[①为醇类,③为酯类。
]3.(2020·唐山模拟)烃(甲)、(乙)、(丙),下列说法正确的是()A.甲、乙均为芳香烃B.甲、乙、丙互为同分异构体C.甲与甲苯互为同系物D.甲、乙、丙中甲、乙的所有原子可能处于同一平面B[乙不含苯环,不是芳香烃,A错误;甲、乙、丙的分子式均为C8H8,互为同分异构体,B正确;甲为烯烃含,甲苯中不含,二者结构不相似,C错误;乙中含有饱和碳原子,所有原子不可能共面,D错误。
高考化学总复习 第12章 有机化学基础 第2讲 烃和卤代烃配练习5高三5化学试题

目夺市安危阳光实验学校第2讲 烃和卤代烃【2019·备考】最新考纲:1.掌握烷烃、烯烃、炔烃和芳香烃的结构与性质。
2.掌握卤代烃的结构与性质,以及与其他有机物的相互转化。
3.了解烃类及衍生物的重要应用以及烃的衍生物合成方法。
考点一 烷烃、烯烃、炔烃的结构与性质 (频数:★☆☆ 难度:★★☆)1.烷烃、烯烃、炔烃的组成、结构特点和通式 2.脂肪烃的物理性质性质变化规律状态常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态沸点随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低相对密度 随着碳原子数的增多,相对密度逐渐增大,但密度均比水小 水溶性均难溶于水3.脂肪烃的化学性质 (1)烷烃的化学性质 ①取代反应如乙烷和氯气生成一氯乙烷:CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
②分解反应:CH 4―——―→高温隔绝空气C +2H 2③燃烧反应燃烧通式为C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(2)烯烃的化学性质①与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应。
②燃烧反应燃烧通式为C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O 。
③加成反应CH 2==CH —CH 3+Br 2―→。
CH 2==CH —CH 3+H 2O ――→催化剂△。
CH 2==CH —CH==CH 2+2Br 2―→。
CH 2==CH —CH==CH 2+Br 2―→(1,4-加成)。
④加聚反应如n CH 2===CH —CH 3――→催化剂。
(3)炔烃的化学性质①与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应。
如: CH≡CH――→KMnO 4H 2SO 4CO 2(主要产物)。
②燃烧反应燃烧通式为C n H 2n -2+3n -12O 2――→点燃n CO 2+(n -1)H 2O 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
我们世界上每年合成的近百万个新化合物中约 70%以上是有机化合物。
(1)1828年Wohler用典型的无机物合成了尿素。开始 了近代有机化学以及有机合成的历程。 (2)1917年,Robinson合成了托品酮。开创了系统的 有机合成方法,反应机制和化学结构关系等的研究。 并第一次开设了有机合成课程。 (3)20世纪50年代NMR技术开始应用于有机化合物结 构测定。
例1 分析:
+
+
因Grignard试剂不应有活泼氢 存在,所以制备Grignard试剂 前必须将羟基 保护起来。
保护羟基的常用试剂还有氯化三甲基硅、氯甲醚(MOMCl),保 护羟基的依据 是将活泼的羟基转变成不活泼的醚链或缩醛。
末端炔烃由于具有酸性,在合成中常常需要保护。末端 炔常用于有机金属合成及氧化偶合反应,若不进行保护, 在强碱性介质中会发生金属化或聚合反应。保护末端炔 烃的最有效基团为三烷基硅基。它极易由炔负离子与三 烷基氯硅烷反应得到。RC≡C—SiR3键对有机金属试剂 是稳定的,它可以定量地用稀碱或AgNO3醇溶液和 NaCN水溶液处理除去。对溴苯乙炔不能直接与金属镁 反应制备Grignard试剂,但用三甲硅基保护后就可以。 即:
目前已有不少极性转换试剂,常见的具有重要实用价值的是 1,3—二噻烷试剂,它容易与羰基形成硫缩醛,与丁基锂作用 后生成1,3—二噻烷基锂在0℃以下是稳定的,并具有较高的 活性, 与各种亲电 试剂反应后, 1,3—二噻烷也容易水解除 去 。特别适合于某些醛酮 的合成。例如:
1,3—二噻烷基锂与氯化三甲硅烷 反应后,再经丁基锂除去氢 原子,可得一负离子产物。
有机反应的进步,尤其是各种有机金属和有机 金属络合物(如Na、Mg、Zn、Al、Li、Si、P、 S、B,过度金属等)试剂的广泛应用,使有机 合成中反应选择性这一当今的核心问题取得了 突出的进展。人们已能有效地使合成反应在化 学选择性、区域选择性和立体选择性,亦即从 一维到三维空间上得到控制。 此外,利用光、电、声等物理因素的有机合成 反应和利用微生物和酶催化的不对称有机合成 反应特别引人注目,展现了广阔的发展前景。
1,3—二官能团产物的典型合成方法是各种分子间或分子内的 缩合反应、 烯胺与酰卤 的反应、乙酰乙酸乙酯与酰卤的反应、 Mannich 反应、瑞弗尔马茨基反应等。
1,4—二官能团,如1,4—二酮、γ —羟基酸及其酯、 γ —羰基酸 及其酯,则主要通过α —卤代酮 与烯胺 或 乙酰乙酸乙酯 ,α —卤代酮 与环氧乙烷等 反应得到。
例 1:
TM
例2 :
A B
TM
例 3:
TM
例4 :
TM
例5 :
TM
例6 :
TM
割的方法。如:
(NaNH2/NP3 或 LDA/THF)
上述通过切断而产生的一些想象中的碎片,通常为一个正 离子或负离子、卡宾及合成等价物,通常称其为合成子。 它有时也包括一些简单的起始原料或试剂。如:
例2
通过保护醛基的方法将 转化成
合成:
12 . 5 立体化学的控制
当目标分子含有n 个手性中心时, 在合成过程中就有可能 产生 个立体异构体。因此在考虑合成程序时, 就必须 采用立体专一的或立体有选择的反应,以保证正确的构型。 立体化学控制的主要反应及其伴随的构型转化有 以下几种。 ①SN2 反应过程发生构型转化。 ②碳碳双键的亲电加成,其立体化学过程为反式加成。 ③碳碳不饱和键的催化加氢是顺式加成,而且通常是从位阻 较小的一边加氢。如炔烃在Lindlar催化下的加氢反应,通常 生成顺式烯烃。
1,4—二官能团化合物,如1,4—二酮、γ —羟基酸及其酯, 则主要通过α —卤代酮与烯胺或乙酰乙酸 乙酯,α —卤代酮 与环氧乙烷等反应得到。如:
1,5 —二官能团目标分子 的典型切断方法是采用逆向 Micheal 型变换。如:
对于合成子
, 则需找到一个与正常极性颠倒的羰基
化合物作为合成等价物, α —卤代酮就是一个理想的对象。 此外 也是此合成子 的合成等价物。 1,6 —二官能团目标分子可由 环已烯或其衍生物氧化来制备, 已烯衍生物来源于 DielsAlder 反应、Birch还原、醇脱水等反应。
第12章 多步骤有机合成路线设计
主讲人:中德科技学院 杨秀英教授
有机合成是有机化学的中心,是有机化学也 是整个化学中最具创造性的领域之一。 有机合成是利用天然资源或工业生产中形 成的简单有机分子,通过一系列化学反应 合成得到各种复杂结构的天然或非天然的 有机化合物的过程。
它是向现代人类社会提供医药、农药、染 料和各种有机材料的基本源泉。 合成天然产物以探讨生物活性,或合成结 构不确定的天然产物以确定其复杂结构。 合成供探讨反应机理用的化合物,化学和 生物过程中的可能中间体,以探讨其化学 和生物功能。
著名美国有机化学家E.J.Corey在1967 年提 出了具有严密逻辑的逆合成分析法 (retrosynthesis)。它的中心思想是对合成 的目标化合物(TM)按可再结合的原则在合 适的健上进行分割,使其成为合理的、较简 单的各种可能前体或结构单元(合成子)。 再进一步剖析一直推导出合成时所需的基本 化学原料。即:目标分子 中间体 中间 体 起始原料。这种理性推倒可以设计出 各种复杂目标化合物的合成路线。
反应前哌啶仲胺上的氮原子带负电荷,反应中生成的N—亚 硝基哌啶使氮原子通过极性转换而带正电荷。这才使 N—亚 硝基邻位活化 ,很容易通过LDA 引入亚丙基。
在逆合成分析中,要讲究切断策略,即: ①一般在目标分子(TM)中有官能团的地方切断; ②在带支链的地方切断; ③切断后得到的合成分子应试合理的(包括电荷合理); ④一个好的切断 应同时满足有合适的反应机理,最大可能 的简化, 给出认可的原料等 第三个条件 。
例 1:
设计
的合成 路线
—NH2 在这里 起活化、导向作用。
例2 :
合成
若用丙 酮 ,产率低 , 还可能有二取代产物,即:
若要解决此困难,在于设法使丙酮 的两个甲基 有明显的活性 差异,可用β —酮酸,即:
例3:
合成
引如乙酰基后降低反应活性 ,只生成单溴代产物 。
例4:
合成
若采用下列方法,即:
这个负电子产物可以和醛、酮发生相应的反应。 如与苯甲醛反应:
又如:
经极性 装换后,将本不是亲电或亲核 的试剂,转变为 相当于亲电或亲核的试剂,称为合成等价基(equivalent) 。 如下列反应是不能一步完成的。
将反应物进行极性转换为合成等价基可得到产物。即:
一些仲 胺化合物也容易通过极性转换作用生成产物,而且 选择性好,如果哌啶合成毒芹碱 :
TM(赤式)
+ Li C — = CH
在逆合成分析中,有时需将化合物中碳原子上的电荷发生 变化,这一过程为极性转换(umpilung)。 例如下面的反应:
假如 要让亲核试剂(如RMgX)进攻 C2 ,而让亲电试剂(如 RX)进攻C1,这似乎不可能发生。 但是可以利用改变与其 连接或相邻的杂原子,来改变碳原子的电荷使反应发生。如:
b.p:159℃ 162℃
因两产物沸点相近,很难提纯。引入磺酸基封闭一个反应活性 部位,则做到了产物的专一性。即:
12 . 4 保护基
在合成中,常遇到目标分子含有多官能团的化合物的合成问 题。如果官能团活性相近,只使其中某一官能团发生反应显 然是困难的。 解决这个问题的办法之一是将不期望发生反应的官能团用某 一试剂保护起来 ,即让该官能团同特定试剂先反应,合成 完成后,再除去这个试剂 ,因此,人们常把这一试剂称为保 护基.保护基团保护的官能团不同而不同。羟基 常采用2, 3—二氢—4—吡啶喃保护,氨基常用乙酰基保护,羰基常用 二醇保护,羧基常用醇保护,双键用卤素保护。
虽然许多有机化合物可以从天然物质中提取和分 离出来,但是从天然物质中提取有机物是有限的, 所以人工合成药物是医药的主要来源之一。 如可的松,用2万只牛的肾上腺作原料,才可以 分离出200mg。 又如抗癌药紫杉醇(Taxol) ,需砍伐约11吨红豆 杉树木(约4800棵),才可得到紫杉醇1kg。 1965年中国科学院在世界上第一次用人工方法合 成出具有生物活性的蛋白质——结晶牛胰岛素。 人工牛胰岛素的合成,标志着人类在认识生命、 探索生命奥秘的征途上迈出了重要的一步。
如:
在多步 骤有机合成中,路线 的选择非常重要,一般有汇总合成 和一条合成两种途径,如下所示。
一条线合成:A+B→C→G→G—E→H→G—H→G—H—I
D
E
F
I
汇总合成优于一条线合成。如对于一条线合成: A→B→C→D→E→TM(目标分子)
若每步得率为90 %,则五步总收率为59%。 而对于汇总合成:
和
都是合成子,其中
可为
或
(最适用的试剂)。
合成子,带负电的碎片称电子给予体,用“d_— 合成子”表示, 带正电荷的碎片称电子接受体,用“a—合成子”表示。
易得的手性前体中衍生出来的带有自然手性 结构的合成子 称为 手性合成子(chiron)。 这种手性 元的组合,能产生高 度的立体化学特征。例如:
Elias James Corey—— 科里,美国哈佛大学教授, 因发展有机逆合成分析理 论,获1990 年诺贝尔化 学奖。1967年,科里 (E.J.Corey)和威普基 (W.T.Wipke)等人设计形 成了第一个计算机辅助合 成设计程序——LHASA。
伍德沃德设计了一个综合拼接式合 成方案,即先合成维生素B12的各 个局部,然后再把它们对接起来。 这种方法后来成了合成所有有机大 分子普遍采用的方法。 伍德沃德合成维生素B12时,组织 了14个国家的110位化学家,协同 攻关,探索维生素B12的人工合成 问题。共做了近千个复杂的有机合 成实验,历时11年,终于在他谢世 前几年实现了。
