常见离子的检验方法
常见离子的检验方法

常见离子的检验方法Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998常见离子的检验方法一、常见阳离子的检验1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。
2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。
3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。
②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。
5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。
②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
6、 Fe3+:①加入KSCN溶液,溶液变为血红色。
②加入NaOH溶液,生成红褐色沉淀。
7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。
②插入铁片或锌片,有红色的铜析出。
8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察)12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色二、常见阴离子的检验1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。
2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。
该沉淀不溶于稀硝酸,能溶于氨水3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。
初中化学常见离子的检验及离子反应的观察

初中化学常见离子的检验及离子反应的观察化学是我们生活中不可或缺的一部分,而离子则是化学反应中的重要组成部分。
在初中化学学习中,了解常见离子的检验方法和观察离子反应是非常重要的。
本文将介绍一些常见离子以及它们的检验方法和离子反应的观察结果。
一、阳离子1. 铁离子(Fe³⁺)检验及观察:铁离子可以通过加入硫化氢气(H₂S)来检验。
观察到黑色沉淀形成,则可以确认铁离子的存在。
此外,当铁离子与次氯酸钠(NaClO)反应时,观察到橙色沉淀,进一步证实了铁离子的存在。
2. 铜离子(Cu²⁺)检验及观察:铜离子可以通过加入氨水(NH₃·H₂O)来检验。
观察到深蓝色沉淀形成,则可以确认铜离子的存在。
与铁离子类似,铜离子与次氯酸钠反应时,会形成蓝绿色沉淀。
3. 铵离子(NH₄⁺)检验及观察:铵离子可以通过加入氢氧化钠(NaOH)和加热来检验。
若产生氨气(NH₃)并用红色湿润的红色试纸接近观察到转蓝色或转红色,则可以确认铵离子的存在。
二、阴离子1. 氯离子(Cl⁻)检验及观察:氯离子可以通过加入银离子(Ag⁺)来检验。
观察到白色沉淀(氯化银)形成,则可以确认氯离子的存在。
此外,氯化钠(NaCl)溶液加入过量的硝酸银(AgNO₃)后,观察到白色沉淀继续产生。
2. 硫酸根离子(SO₄²⁻)检验及观察:硫酸根离子可以通过加入钡离子(Ba²⁺)来检验。
观察到白色沉淀(硫酸钡)形成,则可以确认硫酸根离子的存在。
此外,硫酸钠(Na₂SO₄)和硝酸银反应时,会生成白色沉淀。
3. 碳酸根离子(CO₃²⁻)检验及观察:碳酸根离子可以通过加入盐酸(HCl)来检验。
观察到有气体释放,并用氢氧化钠溶液吸入气体,观察到产生气泡,则可以确认碳酸根离子的存在。
综上所述,通过对常见离子的检验及观察,我们可以准确地判断其存在与否。
这些离子的反应观察结果提供了实验依据,有助于我们深入理解化学反应过程和离子之间的相互作用。
常见离子检验方法

常见离子检验方法
以下是常见的离子检验方法:
1. 氨基酸法检验离子:将待检样品与酸进行加热,使其发生迁移反应,将生成的离子通过氨基酸溶液进行显色反应,从而确定离子的存在与浓度。
2. 沉淀法检验离子:将待检样品与特定试剂反应,生成沉淀,根据沉淀的形状、颜色和溶解性等进行判定,从而确定离子的存在与浓度。
3. 滴定法检验离子:使用滴定试剂,根据反应的等当点(化学反应的完全实现),确定离子的浓度。
常见的滴定法有酸碱滴定法、氧化还原滴定法等。
4. 荧光探针法检验离子:利用荧光探针与待检样品中的离子发生化学反应,观察荧光的强度或颜色的变化来判断离子的存在与浓度。
5. 分光光度法检验离子:利用不同离子对特定波长的光的吸收或透过性的差异,测定样品中离子的浓度。
这些方法在实验室中常被用于离子的检测与分析。
高中化学常见离子检验大全
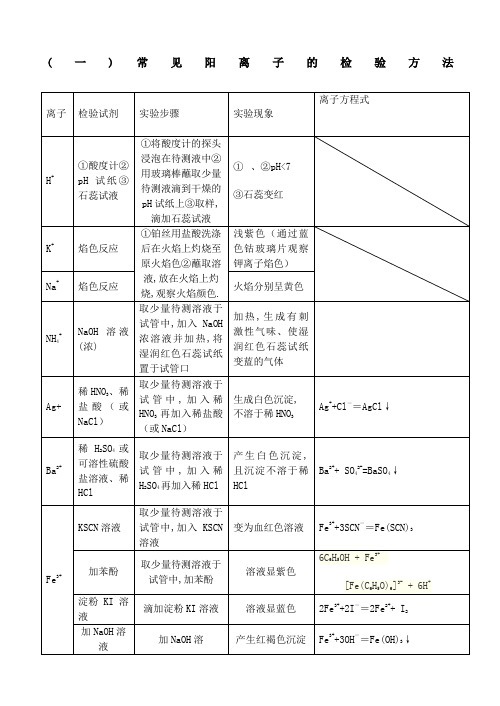
(一)常见阳离子的检验方法离子检验试剂实验步骤实验现象离子方程式Fe2+①KSCN溶液,新制的氯水取少量待测溶液于试管中,加入KSCN溶液,新制的氯水加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色.2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3②NaOH溶液取少量待测溶液于试管中,加入NaOH溶液并露置在空气中开始时生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀.Fe2++2OH - =Fe(OH)2↓4Fe(OH)2十O2+2H2O=4Fe(OH)3③酸性高锰酸钾(无其它还原性物质)取少量待测溶液于试管中,加入酸性高锰酸钾溶液加入酸性高锰酸钾溶液紫色褪去5Fe2+ + MnO4-+8H+5Fe3+ +Mn2++4 H2O④铁氰化钾K3[Fe(CN)6]取少量待测溶液于试管中,加入铁氰化钾溶液产生蓝色沉淀3 Fe2++2[Fe(CN)6] 3- ═Fe2 [Fe(CN)6] 3↓Al3+NaOH溶液取少量待测溶液于试管中,逐滴加入NaOH溶液至过量加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+ 2H2OCu2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成蓝色沉淀Cu2++2OH-=Cu(OH)2↓Mg2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成白色沉淀,该沉淀不溶于过量NaOH溶液中Mg2++2OH-=Mg(OH)2↓(仅用于鉴别Mg2+和Al3+)(二)常见阴离子的检验方法离子检验试剂实验步骤实验现象离子方程式注意:1.若SO42-与Cl-同时检验,需注意检验顺序.应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-.2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸.因为稀硝酸能把SO32-氧化成SO42-.3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+.4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出5.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-。
高中常见离子检验方法

高中常见离子检验方法高中常见离子检验方法主要包括酸碱中性离子检验、金属离子检验和非金属离子检验等。
下面将从这三个方面逐一介绍。
一、酸碱中性离子检验1. 酸碱中性离子的灼烧法:将待检物质灼烧,观察它的灼烧现象来判断其离子成分。
如钠离子的存在可以通过灼烧后火花变亮、扑灭的现象来判定。
2. 酸碱指示剂法:通过将待检物质与酸碱指示剂反应,观察颜色的变化来判断其离子成分。
如酚酞指示剂在酸性溶液中呈现红色,在碱性溶液中呈现无色。
3. 气体的放出法:通过加热待检物质,观察有无气体产生来判断其离子成分。
如将一些金属碳酸盐加热,可以释放出二氧化碳气体,从而判定其中含有碳酸根离子。
二、金属离子检验1. 阳离子的碳酸盐沉淀法:通过加入碳酸盐试剂,观察是否产生沉淀来判断钙、镁、锌等金属离子的存在。
如加入碳酸钠试剂,若产生白色沉淀,则说明存在钙离子。
2. K2CrO4沉淀法:通过加入铬酸钾试剂,观察是否产生沉淀来判断铁、铜、银等金属离子的存在。
如加入铬酸钾试剂,若产生红棕色沉淀,则说明存在铁离子。
3. Na2S沉淀法:通过加入硫化钠试剂,观察是否产生沉淀来判断铅、汞、铅等金属离子的存在。
如加入硫化钠试剂,若产生黑色沉淀,则说明存在铅离子。
三、非金属离子检验1. 阴离子的沉淀法:通过加入适当的反应剂,观察是否产生沉淀来判断氯离子、碳酸根离子等的存在。
如加入银离子试剂,在存在氯离子的溶液中产生白色沉淀。
2. 离子溶液的颜色法:一些离子溶液具有显色性,可以通过颜色变化来判断其离子成分。
如硫酸铜溶液是蓝色的、硫酸钴溶液是红色的,可以通过观察其颜色来判断其中是否含有铜离子和钴离子。
3. 离子溶液的电导率法:通过测量离子溶液的电导率来判断其离子成分。
一般来说,含有离子的溶液的电导率较高,可以通过测定电导率的大小来判断其离子是否存在。
以上是高中中化学常见的离子检验方法。
通过这些方法,可以对样品中的离子成分进行准确的判断和分析,帮助搞懂化学中的一些问题。
常见离子的检验方法

常见离子的检验方法一、常见阳离子的检验1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。
2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。
3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。
②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。
5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。
②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
6、 Fe3+:①加入KSCN溶液,溶液变为血红色。
②加入NaOH溶液,生成红褐色沉淀。
7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。
②插入铁片或锌片,有红色的铜析出。
8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察)12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色二、常见阴离子的检验1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。
2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。
该沉淀不溶于稀硝酸,能溶于氨水3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。
②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。
4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。
常见的离子检验方法

常见的离子检验方法
常见的离子检验方法主要有以下几种:
1. 氯离子检验方法:用银离子溶液与待检样品反应,生成白色的氯化银沉淀。
2. 硝酸根离子检验方法:用银离子溶液与待检样品反应,在阳光照射下,生成红棕色的亚硝酸银沉淀。
3. 硫酸根离子检验方法:将待检样品与钡离子溶液反应,观察是否生成白色的硫酸钡沉淀。
4. 碳酸根离子检验方法:用盐酸处理待检样品,观察是否产生气泡,表示有碳酸根离子存在。
5. 铁离子检验方法:将待检样品与硫氰酸盐反应,生成红色的五配位络合物。
6. 高锰酸钾检验方法:将待检样品与稀硫酸和高锰酸钾反应,观察溶液颜色变化,从紫色到无色表示有有机物存在。
这些方法对于常见的离子如氯离子、硝酸根离子、硫酸根离子等都可以比较准确地进行检验,但对于其他离子如硫离子、钙离子等则需要使用其他特定的检验方
法。
高中化学常见离子检验篇

高中化学常见离子检验篇WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】常见物质性质小结之离子检验篇下面这些,完全可以在化学推断题、实验设计题中直接使用。
像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等(如实验条件限制,原溶液中所含离子颜色干扰等)一、阳离子1.氢离子(H+):取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子。
2.钠离子(Na+):焰色反应,火焰呈黄色。
3.钾离子(K+):焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色。
4.钡离子(Ba2+):取少量溶液,加稀盐酸酸化,无明显现象(排除Ag+),再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子。
5.镁离子(Mg2+):取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于NH4Cl溶液,则可证明溶液中含有镁离子。
6.铝离子(Al3+):取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子。
7.银离子(Ag+):取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子。
8.铵离子(NH4+):取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子。
9.亚铁离子(Fe2+):①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变为灰绿色,最后沉淀变为红褐色,则可证明溶液中含有亚铁离子。
(请注意“先”“迅速”“最后”,不要更改) ②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色(或血红色),则可证明溶液中含有亚铁离子。
10.三价铁离子(Fe3+):①取少量黄色溶液,滴加KSCN溶液,溶液变为血红色,则可证明溶液中含有三价铁离子。
②取少量黄色溶液,滴加NaOH溶液,生成红褐色沉淀,则可证明溶液中含有三价铁离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《生活中常见的化合物》初四化学专题复习
教学目标:
1、通过复习常见离子的检验方法,提高学生分析问题的能力。
2、进一步复习常见化肥的名称和作用、有机物相关知识。
3、培养科学的阅读、分析、解答问题的能力。
教学教程
一、常见离子的检验方法
是。
二、碳酸钙、氧化钙、氢氧化钙三种物质间的转化。
1、复习阅读P73页3
2.练习:1)《石灰吟》中的化学知识。
古诗《石灰吟》“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清白在人间。
”从化学视角看,它描述了“石灰”的生产使用过程。
请你指出诗句中所涉及到的化学变化,并写出反应方程式。
思考在系列变化中“石灰”的主要成份及俗称。
2)(2006•威海)某化工厂用石灰石制取碳酸钙,流程图为
(1)请写出上述方案中所依据反应的化学方程式
①______ ___;
②_______ __;
③.
(2)请你仍然用石灰石为原料,其他试剂任选,设计另外一种制备碳酸钙的实验方案,将你的实验方案用流程图的形式表示出来:
三、常见化肥的名称和作用。
1、阅读复习P73
2、练习
1)、(2015•兰州)下列属于复合肥的是()
A.NH4Cl B.KCl C.CaHPO4 D.KNO3
2)、(2015•孝感)下列对某一主题的知识归纳,有错误的一组是()
A、物质鉴别
硫酸钾和硫酸铵﹣﹣熟石灰混合研磨、闻气味
羊毛纤维与合成纤维﹣﹣灼烧、闻气味
B、物质除杂
盐酸中混有硫酸﹣﹣加适量氯化钡溶液过滤
木炭粉中混有铁粉﹣﹣磁铁吸引
C、安全知识电器着火﹣﹣切断电源,再用干粉灭火器灭火
居室装修﹣﹣常开窗通风,防止甲醛中毒
D、物质与微粒构成
水﹣﹣由氢原子和氧原子构成
氯化钠﹣﹣由钠离子和氯离子构成
A.A B.B C.C D.D
3)、(2015•x疆)古丽同学发观校园中的玫瑰花生长不茂盛,叶子发黄.需要施加下列肥料中的()A.K2CO3B.NH4Cl C.Ca(H2PO4)
4)、某化学兴趣小组进行了识别化肥的探究活动.他们对氯化铵、碳酸氢铵、硫酸钾、磷矿粉四种化肥的实验探究步骤如下:
(1)步骤一:在装有四种化肥的试管中,分别加入少量稀盐酸,有气体产生的是_____.
(2)步骤二:再分别取少量未区分出的另外三种化肥于研钵中,各加入少量熟石灰粉末,混合、研磨,有刺激性气味气体放出的是_____.由此可知,在使用该类化肥时,要避免与_____(填“酸”或“碱”)性物质混合使用,以防降低肥效.
有同学提出,氯化铵、硫酸钾也可用下列某种物质进行区分,你认为可行的是_____.
A.硝酸钡溶液;B.氯化钠溶液;C.酚酞溶液;D.稀盐酸.
四、生活中的有机物。
1、阅读复习P74
2、练习:
1)(2014.威海)8.人体就像一个复杂的“化学工厂”。
在下列食物中,不能给这个“化学工厂”提供能量的是
A. 鸡蛋
B.花生油
C.矿泉水
D.馒头6.(2分)2)(2015•威海)在①糖类②油脂③蛋白质④维生素⑤纤维素⑥无机盐⑦水⑧二氧化碳中,属于人体必须
3)2008.威海8.人类从环境中摄取的物质,通过化学反应为生命活动提供物质和能量。
下列物质是人的正常生命活动所必需的,且作为反应物参加了化学反应的是
①蛋白质;②淀粉;③油脂;④维生素;⑤食盐;⑥水;⑦空气;⑧黄曲霉素;⑨二氧化铅;⑩纤维素。
A.①②③④⑤⑥⑦B.①②③④⑤⑥⑦⑧
C.①②③④⑤⑥⑦⑨D.①②③④⑤⑥⑦⑩
4)2009.威海4.下列说法中,不正确的是 ( )
A.油脂和维生素是人体中重要的供能营养素
B.玻璃钢是日常生活中应用广泛的复合材料之一
C.氮肥、磷肥、钾肥及复合肥是农业生产中主要的化学肥料
D.浓硝酸、重金属盐等可使蛋白质发生化学变化,失去生理功能。
