3_5_二硝基水杨酸_DNS_比色法测定马铃薯还原糖含量的研究
生化实验 二硝基水杨酸比色法测还原糖含量

3,5-二硝基水杨酸比色法测量还原糖含量一.实验目的1、掌握用制作标准曲线的方法来测量还原糖的含量.2、学会使用721精密型分光光度计。
3、熟练容量瓶、移液管等简单仪器的使用方法。
二.原理1、还原糖是指含有醛基或者酮基的糖类,单糖都是还原糖,多糖中有乳糖和麦芽糖等是还原糖,而淀粉和蔗糖是非还原糖。
DNS即3,5-二硝基水杨酸中含有的硝基使其有较强的氧化性,与醛基在加热的条件下发生氧化还原反应,生成红色物质3-氨基-5硝基水杨酸。
反应方程式如下:2、不同浓度的还原糖液与DNS反应时,生成的3-氨基-5硝基水杨酸的浓度不同,导致反应后液体颜色深浅不同。
在分光光度计下测量标准梯度浓度的葡萄糖溶液与DNS反应后液体的OD540(波长为540nm条件下样液的光密度值),做出OD540——还原糖含量标准曲线,对于未知样品的测量,只需将OD540带入图像,找到相应的还原糖含量值即可。
3、本实验总糖的测量步骤中,因为样品(面粉)主要由淀粉构成不能与DNS直接反应,所以需要用酸水解法将淀粉降解为单糖进行测量。
淀粉由单糖缩合产生,在降解过程中会引入水分子,所以计算总糖的质量时,应除去水的质量。
M葡萄糖=180,M水=18,由于淀粉的=0.9倍。
碳链极长,忽略链末端本身含有的一个水分子,则淀粉的质量为还原糖质量的180−18180三.试剂(配制方法)提前配制试剂DNS(3,5-二硝基水杨酸试剂):6.3g 3,5-二硝基水杨酸和262ml 2mol/L NaOH加到热酒石酸钾钠的热溶液中(182g酒石酸钾钠溶液溶于500蒸馏水中),再加5g重结晶酚和5g亚硫酸氢钠于其中,搅拌溶解,冷却后定容到1000ml,储存于棕色瓶中。
碘化钾—碘试剂:称取5g碘10g碘化钾溶于100ml蒸馏水中。
酚酞试剂:0.1g酚酞溶于250ml 85%的乙醇中,棕色瓶储存。
6mol/L HCl 溶液10% NaOH 溶液面粉样品0.5mg/mL葡萄糖溶液:精确称取105℃烘至恒重的葡萄糖0.5g,用水定容到1000ml。
3_5_二硝基水杨酸_DNS_法测定甘蔗茎节总糖和还原糖含量

甘蔗糖业2008年第5期 Sugarcane and Canesugar 2008年10月3,5 - 二硝基水杨酸(DNS)法测定甘蔗茎节总糖和还原糖含量*王俊刚张树珍杨本鹏陈萍吴转娣胡军喻(中国热带农业科学院热带生物技术研究所,海口571101)摘要对DNS法测定甘蔗茎秆总糖和还原糖的影响因素进行了比较研究。
确定了最佳检测条件:检测波长510nm,显色剂用量0.8mL,显色时间7min,显色液放置时间20min以上,能够获得好的检测结果。
关键词甘蔗茎节;DNS;还原糖;总糖;测定0前言还原糖的测定对于甘蔗茎秆的综合利用研究具有十分重要的意义。
有关总糖和还原糖含量的测定有多种方法,如旋光法[1]、气相色谱法[2]、液相色谱法[2]、分光光度法[3-5]等。
旋光法测量准确性较差;气相色谱法和液相色谱法测量过程较复杂;3,5-二硝基水杨酸法(DNS)具有准确性高、重现性好、特别适用于大批量样品的测定等特点而被广泛采用;在植物糖的测定中,仍未见到有同时用DNS法测定总糖和还原糖的报道。
然而DNS 法过程中的诸多因素如吸收光谱、显色剂用量、显色时间等均对测定结果的准确性有直接影响,为了能准确的测定甘蔗总糖和还原糖含量,我们对用3,5-二硝基水杨酸比色法测定甘蔗茎节总糖和还原糖含量的反应条件进行一系列的试验,试图摸索出最佳的试验条件以保证试验的最佳精确度,以期获得可靠的数据为甘蔗品质育种的实践提供参考。
1 材料与方法 1.1 试验材料中国热带农业科学院试验田取生长11个月拔地拉果蔗1.1.1 样品还原糖的制备拔地拉果蔗从生长点依次向下数取23节,榨汁,放4℃备用。
1.1.2样品总糖的制备分别取0.2mL的甘蔗汁加6mo1/mL HCl 0.4mL,沸水浴30min[6]。
取出溶液1~2滴于白瓷板上,加1滴I-KI溶液检查水解是否完全,若水解完全则不呈现黄色。
冷却后加入1滴10%酚酞指示剂,用6mol/mL NaOH溶液中和到微红色,定容至2mL后备用。
3_5_二硝基水杨酸比色法测定溶液中还原糖的研究

第12卷第3期2004年9月纤维素科学与技术Journal of Cellulose Science and TechnologyVol.12 No.3Sept. 2004文章编号:1004-8405(2004)03-0017-043,5-二硝基水杨酸比色法测定溶液中还原糖的研究齐香君,苟金霞,韩戌珺,闫博(陕西科技大学生命科学与工程学院,陕西咸阳 712081)摘要:据相关资料报道,在碱性溶液中3,5-二硝基水杨酸被还原糖还原生成的氨基化合物在540 nm波长下具有最大吸收,在此条件下该方法可测糖的适合浓度为3~4 mg/mL。
而对其吸收光谱的测定研究发现,生成的氨基化合物在483 nm处有最大吸收,在该波长下测糖范围是0.1~1.0 mg/mL,并且测量的相对误差为2.2%。
关键词:3,5-二硝基水杨酸;还原糖;最大吸收波长;测量范围中图分类号:Q53 文献标识码:A众所周知,还原糖测定在我们生产细菌纤维素的发酵过程中具有十分重要的意义。
由于3,5-二硝基水杨酸比色法(DNS法)具有准确性高、重现性好、尤其适用于大批量样品的测定等特点,而广泛地被用来测定发酵液中的残余糖量,从而得出细菌在繁殖和合成纤维素的过程中的耗糖量。
据相关资料报道[1,2],在碱性溶液中3,5-二硝基水杨酸被还原糖还原生成的氨基化合物在540 nm波长下具有最大吸收,在沸水浴中显色时间2 min,在此条件下该方法可测糖的适合浓度为3~4 mg/mL。
而我们对其生成的氨基化合物的吸收光谱进行了研究,发现其λmax 不是540 nm,因此本文对3,5-二硝基水杨酸测定还原糖的方法进行探讨与研究。
1 原理与方法1.1 原理在氢氧化钠和丙三醇的的存在下,还原糖能将3,5-二硝基水杨酸中的硝基还原成氨基,生成氨基化合物。
此化合物在过量的氢氧化钠碱性溶液中呈橘红色,在一定波长下具有最大吸收,并且吸光度与还原糖含量有线性关系。
1.2 适用范围及特点此法适用于各类食品中的还原糖的测定,具有准确度高、重现性好、操作简便、快速等优点,尤其适用于大批量样品的测定。
DNS法测定总糖和还原糖

实验九总糖和还原糖的测定(二)之马矢奏春创作──3,5-二硝基水杨酸法一、目的要求:掌握还原糖和总糖的测定原理, 学习用比色法测定还原糖的方法.二、实验原理:在NaOH和丙三醇存在下, 3,5-二硝基水杨酸(DNS)与还原糖共热后被还原生成氨基化合物.在过量的NaOH碱性溶液中此化合物呈桔红色, 在540nm波长处有最年夜吸收, 在一定的浓度范围内, 还原糖的量与光吸收值呈线性关系, 利用比色法可测定样品中的含糖量.黄色桔红色三、试剂和器材1、试剂(1)1 mg/ml葡萄糖标准溶液:准确称取干燥恒重的葡萄糖100mg, 加少量蒸馏水溶解后, 以蒸馏水定容至100ml, 即含葡萄糖为1.0mg/ml.(2)3,5—二硝基水杨酸试剂:称取 6.3 g 3,5—二硝基水杨酸并量取262 ml 2mol/L NaOH加到酒石酸钾纳的热溶液中(182 g 酒石酸钾纳溶于500 ml水中), 再加5 g结晶酚和5 g亚硫酸氢钠溶于其中, 搅拌溶解, 冷却后定容到1000 ml贮于棕色瓶中.(3)碘-碘化钾溶液:称取5g碘, 10g碘化钾溶于100ml蒸馏水中.(4)6N NaOH:称取120g NaOH溶于500ml蒸馏水中.(5)0.1% 酚酞指示剂.(6)6 mol/L HCl溶液2、资料小麦淀粉或玉米淀粉.3、器材分光光度计, 天平, 水浴锅, 电炉, 试管若干等.四、把持方法1、葡萄糖标准曲线制作取8支15mm×180mm试管, 按下表加入1.0mg/ml葡萄糖标准液和蒸馏水.管号试剂0 1 2 3 4 5 6 7 8葡萄糖标准液(ml)0蒸馏水(ml)水杨酸溶液(ml)葡萄糖含量(mg)0将各管溶液混合均匀, 在沸水中加热5 min, 取出后立即用冷水冷却到室温, 再向每管加入21.5 ml蒸馏水, 摇匀.λ=540nm处测定吸光度以葡萄糖含量(mg)为横坐标, 光吸收值为纵坐标, 绘制标准曲线.2、样品中还原糖的提取准确称取小麦(淀)粉, 放在100ml烧杯中, 先以少量蒸馏水(约2 ml)调成糊状, 然后加入40ml蒸馏水, 混匀, 于50℃恒温水浴中保温20min, 不时搅拌, 使还原糖浸出混.过滤, 将滤液全部收集在50ml的容量瓶中, 用蒸馏水定容至刻度, 即为还原糖提取液.3、样品总糖的水解及提取准确称取小麦(淀)粉, 放在锥形瓶中, 加入6mol/L HCl 10ml, 蒸馏水15ml, 在沸水浴中加热, 取出1~2滴置于白瓷板上, 加1滴I-KI溶液检查水解是否完全.如已水解完全, 则不出现蓝色.水解毕, 冷却至室温后加入1滴酚酞指示剂, 以6N NaOH 溶液中和至溶液呈微红色, 并定容到100ml, 过滤取滤液10ml于100ml容量瓶中, 定容至刻度, 混匀, 即为稀释1000倍的总糖水解液, 用于总糖测定.4、样品中含糖量的测定试剂空白还原糖总糖样品溶液(ml)0蒸馏水(ml)水杨酸(ml)将各管溶液混合均匀, 在沸水中加热5 min, 取出后立即用冷水冷却到室温, 再向每管加入21.5 ml蒸馏水, 摇匀.λ=540nm处测定吸光度样品溶液中还原糖和总糖测定后, 取样品的光吸收值在标准曲线上查出相应的糖量.五、结果处置按下式计算出样品中还原糖和总糖的百分含量:式中:C──还原糖或总糖提取液的浓度, mg/ml;V──还原糖或总糖提取液的总体积, ml;m──样品重量, g;1000──mg换算成g的系数.思考题1. 比色时为什么要设计空白管?2. 比力费林试剂比色法与3,5-二硝基水杨酸比色法测定可溶性淀粉中还原糖和总糖的结果, 这两种方法各有何优点?。
3,5—二硝基水杨酸(DNS)比色法测还原糖

实验步骤:
1.可溶性糖的提取:准确称取烟叶样品0.100g,置于离心管中,加入8ml80%乙醇,于80℃水浴浸提30min,冷却后于4000转离心5min收集上清液,残渣再加入8ml80%乙醇,再次浸提,重复两次,将三次提取的上清液合并于100ml容量瓶中并定容至100ml。
2.还原糖的测定:取提取液1ml于试管中(空白中用1ml蒸馏水代替),加入DNS试剂1.5ml,摇匀,于沸水浴中加热5min,取出后立即浸入冷水冷却至室温定容至25ml,摇匀,然后在540nm波长处比色 。
3.标准曲线的绘制:取干洁25ml试管6支,依次加入葡萄糖标准液(1mg/ml)0、0.2、0.4、0.6、0.8、1.0ml和蒸馏水1.0、0.8、0.6、0.4、0.2、0ml,再分别加入DNS试剂1.5ml,于沸水浴中加热5min,取出后立即浸入冷水冷却至室温,再用蒸馏水定容至25ml刻度处,摇匀,然后在540nm波长处比色 。
3,5—二硝基水杨酸(DNS)比色法测还原糖 仪器与用具:
25ml刻度试管;离心管;100ml玻璃烧杯;100ml三角瓶;刻度吸管1ml、2ml、10ml;沸水浴;离心机;电子天平;分光光度计。
试剂:
1. 1mg/ml葡萄糖标准液:准确称取100mg分析纯葡萄糖(预先在80℃烘至恒重),在小烧杯中用蒸馏水溶解后定容至100ml,摇匀,冰箱中保存备用。
4.计算:还原糖(%)=〔(C×V/a)/(W×1000)〕×100
C—标准曲线方程求得的还原糖含量mg数;
3,5-二硝基水杨酸比色法测定糖的含量

实验五 3,5-二硝基水杨酸比色法测定糖的含量一:目的了解3,5-二硝基水杨酸比色法测定糖的原理 掌握总糖定量测定的操作方法 二:原理还原糖是指含自由醛基或酮基的单糖(如葡萄糖)和某些具有还原性的双糖(如麦芽糖)。
它们在碱性条件下,可变成非常活泼的烯二醇。
遇氧化剂时,具有还原能力,烯二醇本身则被氧化成糖酸及其他产物。
黄色的3,5-二硝基水杨酸(DNS )试剂与还原糖在碱性条件下共热后,自身被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,反应液里棕红色的深浅与还原糖的含量成正比,在波长为540nm 处测定溶液的吸光度,查对标准曲线并计算,便可求得样品中还原糖的含量。
对于非还原性的双糖(如蔗糖)以及还原性很小的多糖(如淀粉),应先用酸水解法将它们彻底水解成单糖。
再借助于测定还原糖的方法,可推算出总糖的含量。
由于多糖水解时,在每个单糖残基上加了一分子水,因而在计算时,须扣除加入的水量,当样品里多糖含量远大于单糖含量时,则比色测定所得总糖含量应乘以COOHOHNO 2O 2N 还原糖COOHOHO 2N NH 23,5-二硝基水杨酸(黄色)3-氨基-5-硝基水杨酸(棕红色)C C H O OH OH C H C H 2OH OH( )n ( )n C H C OH OHC H H 2OH OH糖酸折算系数(1-18018= 0.9),即得比较接近实际的样品中总糖含量。
三:实验材料及设备 1、材料:面粉2、仪器:分光光度计 电子天平 沸水浴3、器材:刻度试管: 25mL ×8 容 量 瓶: 100mL ×2 锥 形 瓶: 100mL ×1移 液 管: 1mL ×2 2mL ×2 10mL ×2 烧 杯: 250mL ×1 50mL ×1 滴 管: 2 洗 耳 球: 2 滤 纸: 11cm 坐 标 纸漏斗、洗瓶、白瓷板、试管架、移液管架、试管夹、玻棒:各1 四:试剂的配制1、葡萄糖标准液(1mg/mL )预先将分析纯葡萄糖置80℃烘箱内约12小时。
3,5-二硝基水杨酸(DNS)法测定还原糖
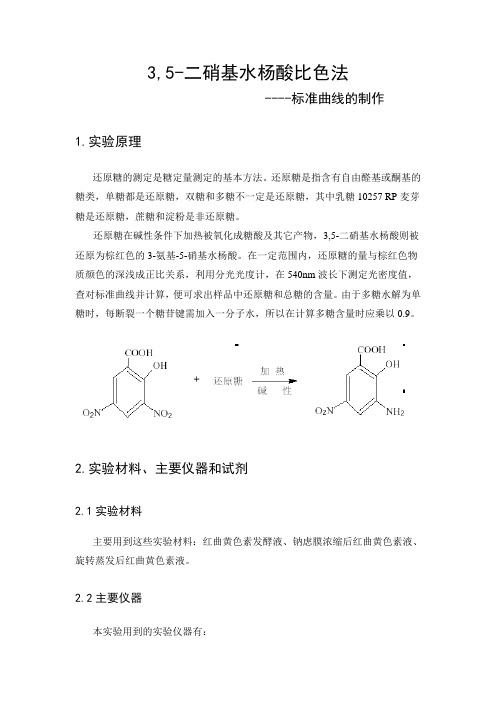
3,5-二硝基水杨酸比色法----标准曲线的制作1.实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖10257 RP麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
2.实验材料、主要仪器和试剂2.1实验材料主要用到这些实验材料:红曲黄色素发酵液、钠虑膜浓缩后红曲黄色素液、旋转蒸发后红曲黄色素液。
2.2主要仪器本实验用到的实验仪器有:1)具塞玻璃刻度比色管:25mL×19;2)烧杯:100mL×4;3)三角瓶:100mL×1;4)容量瓶:100mL×3,50mL×3;5)刻度吸管:1mL×4;2mL×3;10mL×1;6)沸水浴;7)冰浴;8)扭力天平;9)UV—2802SH型紫外可见分光光度计尤尼柯(上海)仪器有限公司;2.3实验试剂1)1mg/mL葡萄糖标准液准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
2)3,5-二硝基水杨酸(DNS)试剂将6.3g DNS和262mL 2M NaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
3.实验步骤制作葡萄糖标准曲线取7支25mL具塞刻度试管编号,按表1分别加入浓度为1mg/mL的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。
dns测定还原糖含量原理

dns测定还原糖含量原理宝子!今天咱来唠唠DNS测定还原糖含量的原理呀。
你知道吗,还原糖可是一群很有趣的小家伙呢。
像葡萄糖、果糖这些都属于还原糖。
那DNS是啥呢?DNS就是3,5 - 二硝基水杨酸啦。
这个DNS可厉害了,它就像是一个超级侦探,专门去探寻还原糖的秘密。
当我们把含有还原糖的样品和DNS试剂放在一起的时候,就像是一场奇妙的聚会开始了。
还原糖这个小调皮,它有一些特殊的化学性质哦。
它能够把DNS试剂中的硝基还原成氨基。
这一还原呀,整个化学环境就发生了大变化。
原本的DNS试剂是有颜色的,但是经过还原糖这么一折腾,颜色就变得更深啦。
你可以想象成还原糖给DNS试剂化了个浓妆呢。
而且呀,这个颜色变化的程度和还原糖的含量是有关系的。
如果还原糖的含量多,那它能还原的DNS就多,颜色就变得更深;要是还原糖少呢,颜色变化就相对小一些。
这就像是一场比赛,还原糖的数量就决定了它在这场和DNS的反应比赛中能把DNS改变多少。
我们就可以根据最后溶液呈现出来的颜色深浅,来判断还原糖到底有多少啦。
咱再往细里说说哈。
这个反应其实是在一定的条件下进行的。
比如说温度啦,pH 值啦,这些都像是比赛的规则一样。
要是温度不合适,就像比赛的场地环境不好,那这个反应可能就不能好好进行了。
同样的,如果pH值不对,那还原糖和DNS之间的“互动”也会受到影响。
在实验室里呀,我们会先制作一个标准曲线。
这就好比是给这场颜色和还原糖含量的关系建立一个参照系。
我们会用已知浓度的还原糖溶液和DNS试剂反应,然后测量它们反应后的颜色对应的吸光度。
把这些已知浓度和对应的吸光度数据画成一条曲线。
然后呢,当我们要测量未知样品中的还原糖含量的时候,就把这个样品和DNS反应,测量它的吸光度。
再根据之前做好的标准曲线,就能找到这个吸光度对应的还原糖浓度啦。
是不是很神奇呢?这整个过程就像是一场有趣的化学游戏。
还原糖和DNS试剂在特定的环境下玩耍,然后给我们留下了颜色这个线索,我们通过这个线索就能找到还原糖含量这个小秘密啦。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 mg·mL-1 葡萄糖标准液:准确称取 1 g 的无 水葡萄糖,待溶解后定容至 1 000 mL。
DNS 显色液:准确称取无水的 3,5- 二硝基水杨 酸 6.5 g 溶解待用。无水氢氧化钠 40 g 溶解后移入 500 mL 容量瓶,冷却后定容。将水杨酸溶解液移 入 1 000 mL 容量瓶并加入 325 mL 的氢氧化钠,再 加入 15 mL 丙三醇溶解定容至 1 000 mL 贮存于棕 色试剂瓶中。以上试剂均为分析纯。水为蒸馏水。 1.2 试验方法 1.2.1 吸收光谱的测定
量瓶中加水约 25 mL,步骤同上。
1.2.4 显色时间的确定
准确吸取 1、2、4 mL 葡萄糖标准液分别加入
到 50 mL 的容量瓶中,各加 5 mL DNS,并在沸水
浴中煮 2、3、4、5、6、7、8、10、12、14、16、
18、20 min,步骤同上。
1.2.5 稳定时间的确定
任意选择一个马铃薯样品提取液,准确吸取葡
的比较 [J]. 中国马铃薯,2004, 6: 337- 33. [ 5 ] 罗志刚,曾满枝,凌晨,等. 3,5- 二硝基水杨酸比色法测定烟
草中水溶性总糖. 中国烟草科学,2000, 2:34- 36. [ 6 ] 齐香君,苟金霞,韩戌环君,等. 3,5- 二硝基水杨酸比色法测定
收稿日期:2005- 08- 12 作者简介:朱海霞(1979- ),女,东北农业大学硕士研究生, 从事马铃薯遗传育种研究。 基金项目:国家“863”计划项目(2004AA241133)资助 !通讯作者:E- mail: potato@mail.neau.edu.cn
1 材料与方法
1.1 试验材料 1.1.1 马铃薯样品
·266·
中国马铃薯,第 19 卷,第 5 期,2005
中图分类号:S532 文献标识码:A 文章编号:1672- 3635(2005)05- 0266- 04
3 ,5 - 二硝基水杨酸(DNS)比色法测定 马铃薯还原糖含量的研究
朱海霞,石 瑛,张庆娜,陈伊里 *
( 东北农业大学,黑龙江 哈尔滨 150030 )
X2 0.176 1.02 0.458 1.968 0.331 1.674 3.316 1.02 1.628 0.223 9.108 0.466 21.388
S= 0.7299,Sx= 0.2107,|t| = 5.408,t0.01,11= 3.106
3讨论
应用 3,5- 二硝基水杨酸比色法测定还原糖含量, 对最佳吸收光谱的确定,不同的作物就有不同的选 择。罗志刚等[5]在烟草还原糖测定中确定的 λmax=474 nm,齐香君等[6]在细菌纤维素发酵的还原糖测定中确 定的 λmax=483 nm,范玲等[7]在棉花还原糖测定中确定 的 λmax=510 nm,这些均与一般方法[3]中的 λmax=540 nm
图 5 沸水浴显色时间的吸光度变化及趋势
图 6 显色液放置时间与吸光度关系及趋势
图 4 不同显色剂用量的吸光度变化及趋势
2.4 显色时间 由图 5 可以看出,还原糖含量不同的 3 个葡萄
糖标准液在沸水浴中 12 min 后,显色基本完全, 吸光度趋于稳定一致,因此本试验确定的最佳沸水 浴显色时间范围是 12~15 min。 2.5 显色液放置时间
对照图 2 可见,马铃薯样品的吸光度曲线与葡萄糖 标准液的吸光度曲线相一致,不同的浓度可形成梯 度间隔曲线,没有其它吸收峰,这表明马铃薯还原 糖含量完全可采用 DNS 比色法测定。
图 3 葡萄糖标准曲线
2.3 显色剂用量 为了确保显色完全进行,笔者选择最高浓度的
葡萄糖标准液进行显色剂用量试验。由图 4 可知, 吸光度随着显色剂用量的增加而增加,6~7 mL 趋 于稳定,所以确定 DNS 的最佳用量是 6 mL。
定容摇匀,空白调零。20 min 后在所确定的吸收
光谱波长下测定吸光值。
1.2.3 显色剂用量的选择
为了保证显色完全,我们采用高浓度葡萄糖的
标准液来进行 DNS 用量的选择。准确吸取 4 mL 的
葡萄糖标准液加入 50 mL 容量瓶中,并分别加入
3、3.5、4、4.5、5、5.5、6、6.5、7 mL DNS 于容
并采用成对数据比较和 t 测验法进行差异显著性
分析。
2 结果与分析
2ቤተ መጻሕፍቲ ባይዱ1 吸收光谱 波长在 400~600 nm 范围内对 DNS 液以及葡萄
糖标准液反应生成的氨化合物 (蒸馏水调零) 的吸 收光谱进行了扫描,由于所使用的分光光度计灵敏 度低,DNS 用量大等原因,图 1 未能测得 400~480 nm 的吸光值,图 2 未得到 510 nm 之前的吸光值, 所以均未得到二者的完整吸收峰度曲线,但从图 1 可以看出,3 mL、5 mL、7 mL 的 DNS 在 480~500 nm 有较高的吸光值,由于显色剂本身具有颜色而 获得的吸光值将会影响显色液吸光值的可靠性,因 此分析波长的选择应避开此范围可消除显色剂对分 析的干扰,从图 2 可以看出 510 nm 具有最大的吸 光值,在本实验仪器的基础上,根据图 1、图 2 可 确定 λmax=510 nm。
关键词:马铃薯;还原糖;比色法;3,5- 二硝基水杨酸
马铃薯薯片和薯条油炸色泽是评价马铃薯油炸 食品质量优劣的重要指标,还原糖含量则是影响油 炸色泽的重要因素[1]。因此,国内外马铃薯育种家 把还原糖含量作为选育油炸加工型马铃薯品种或材 料的重要品质指标。
测定马铃薯块茎还原糖含量的常规方法是 容量分析法如铜还原- 碘量法。近年来,用比 色法测定马铃薯块茎中的还原糖含量因具有方 法简便、测定速度快等优点得到广泛应用,如 砷 钼 酸 比 色 法 和 3,5 - 二 硝 基 水 杨 酸(DNS)比 色 法[2]。
马铃薯新型栽培种轮回选择群体后代材料 320 份,收获后一个月内,用脲糖试纸对块茎还原糖进 行初步测定,筛选还原糖含量有一定差异的材料 40 份。挑选中等大小的块茎清洗、烘干、粉碎待用。 1.1.2 马铃薯提取液的制备
准确称取马铃薯样品粉末(称前烘干至恒重) 1 g 左右放入 50 mL 容量瓶中,其它步骤见文献[3]。 1.1.3 仪 器
任意选取 12 个还原糖含量不同的马铃薯样品
提取液,在本文所确定的波长和相关文献报道的波
长(540 nm)下进行扫描,根据所获得的吸光值,
在不同波长下的标准曲线中分别查出相对应的浓
度,并计算总糖含量[4]。
还原糖 mg×样品稀释倍数 还原糖含量=
×100
样品质量 mg
1.2.8 数据处理
试 验 数 据 用 EXCEL2000 进 行 处 理 和 作 图 ,
[参考文献]
[ 1 ] 王春英,陈伊里,石 瑛. 影响马铃薯油炸品质的研究进展 [J]. 中国马铃薯,2003, 4: 232- 236.
[ 2 ] 梅文泉,隋启君,佴注,等. 马铃薯块茎中还原糖测定的一 种方法 [J]. 云南农业科技,2003, 3: 23- 24.
[ 3 ] 宇正祥. 食品分析手册 [M]. 北京:中国轻工业出版社,1998. [ 4 ] 许庆芬,吕文河,石瑛,等. 马铃薯块茎还原糖的测定方法
有所不同。这可能由于最佳波长的确定受到仪器性 能、灵敏度、试验对象中还原糖含量、可溶性物质种 类及 DNS 用量等因素的影响,因此我们应根据自己 的试验对象和仪器设备来确定试验所需的最佳条件。
通过对应用 3,5- 二硝基水杨酸比色法测定马铃 薯还原糖含量的影响因素,如吸收光谱、显色剂用 量及显色时间等条件进行试验筛选,确定马铃薯块 茎还原糖含量测定的最佳波长为 510 nm,DNS 用 量为 6 mL,沸水浴时间 12~15 min。这与 540 nm 下测定的还原糖含量存在极显著差异。方便快捷、 安全、准确、低成本 DNS 比色法,适合于马铃薯 块茎还原糖含量的批量和定量测定。
图 6 说明,无论是标准液的显色液还是马铃薯 样品的显色液在显色之后的 6 h 内,其吸光度逐渐 减小,可根据对还原糖含量精确度的要求选择测定 时间,即精确度要求高应及早测定,若进行大批量 样品的还原糖筛选,则可将显色液样品集中测定以 提高工作效率。 2.6 样品 DNS 显色液吸光度曲线
把不同马铃薯样品的 DNS 吸光度绘成图 7。
准确吸取 3、5、7 mL 的 DNS 于 50 mL 容量
3,5- 二硝基水杨酸(DNS)比色法测定马铃薯还原糖含量的研究———朱海霞,石 瑛,张庆娜,等
·267·
瓶 中 并 定 容 。 取 1、 3、 5、 7 mL 葡 萄 糖 标 准 液
于 50 mL 容量瓶中并加入 5 mL DNS,加水至 25
摘 要:试验针对 3,5- 二硝基水杨酸(DNS)比色法测定马铃薯还原糖含量的吸收光谱及其对测定值可靠性的 影响因素进行了研究。找到了分析马铃薯还原糖的最佳条件:! 射波长为 510 nm,显色剂用量为 6 mL,在沸水 浴的显色时间范围为 12~15 min,结果表明该方法的灵敏度得到了提高。由于该方法具有方便、安全、成本低等 优点,适合于常规实验室马铃薯还原糖批量和定量的测定。
42.546
540 nm 2.879 5.5.32 4.582 8.149 1.863 3.039 5.028 4.582 6.103 2.005 9.541 2.897
56.2
X - 0.419 - 1.005 - 0.677 - 1.403 - 0.576 - 1.294 - 1.821 - 1.01 - 1.276 - 0.472 - 3.018 - 0.683 - 13.65
萄糖标准液 2 mL 和样品提取液 4 mL 加入容量瓶,
步骤同上。显色后放置 20 min、1、2、3、4、5、
6 h 后测定吸光值。
1.2.6 马铃薯样品 DNS 显色吸光度曲线
