复旦大学——物理化学III-统计热力学基础(ppt 85)
统计热力学基础PPT课件
.
33
用Stiring公式展开:
ln max N ln
i
ei / kT U kT
S(定位)
k ln max
kN ln ei / kT
U T
A(定位) U TS NkT ln ei / kT
i
2019/7/7
.
34
(2)对于定位系统,简并度为 g i
2019/7/7
.
38
g ei / kT i
q
i
e 求和项中 i / kT 称为Boltzmann因子。配分函数
q是对系统中一个粒子的所有可能状态的Boltzmann 因子求和,因此q又称为状态和。
2019/7/7
.
39
将q代入最概然分布公式,得:
Ni
g ei / kT i
N
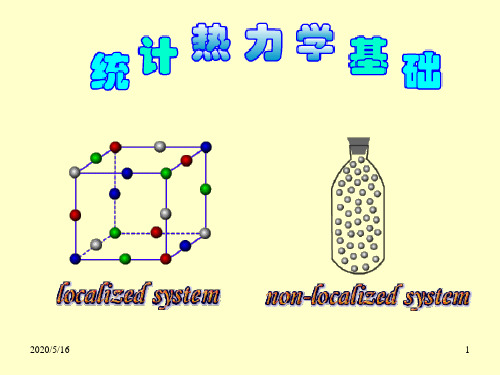
非定位系统又称为离域子系统,基本粒子 之间不可区分。例如,气体的分子,总是处于 混乱运动之中,彼此无法分辨,所以气体是非 定位系统,它的微观状态数在粒子数相同的情 况下要比定位系统少得多。
2019/7/7
.
9
1.4 独立粒子系统和相依粒子系统
独立粒子系统(assembly of independent particles)
i
Nii U
i
2019/7/7
.
19
2.2 定位系统的最概然分布
每种分配的 i 值各不相同,但其中有一项最 大值 max ,在粒子数足够多的宏观系统中,可 以近似用 max 来代表所有的微观数,这就是最
概然分布。
Ni* N
e-i / kT e-i / kT
i
max
只多了gi 项。
统计热力学基础

ni是布居在能级上的粒子数;Pε,i是粒子分布在各能级εi上的概率 概率; 概率
(4)分布的微态数WD与系统的总微态数 任何一种分布,只指出在每个能级(或状态)上有多少个粒子, 实现这一分布尚有不同的方式,每一种可区别的方式代表分布 (或系统)的一个可区别的微观状态,简称微态 微态。WD表示分布D 微态 的微态数,用表示系统总的微态数。 (5)分布的概率 计算分布的概率用古典概型的计算公式。 ①古典概型 古典概型又叫等概率模型,既是概率的定义,又是计算概率 古典概型 的基本公式,其特征是: (i)只有有限个基本事件; (ii)所有基本事件发生都是等概率的。
②振动配分函数 对一维谐振子
1 q = 1 e hv kT e hv 2 kT qv = 1 e hv kT
0 v
定义
Θ v
def
hν/ k
式中Θv——振动特征温度,代入上式,则
0 qv =
1 1 e Θ v T
e hv 2kT 1 e Θ v T
qv =
③转动配分函数 对于直线型双原子分子,转动配分函数为
i i
i
(ni + g i 1)! ≈ g in (g >> n ) 离域子系统: WD = ∏ ∏ n! i i n!×( g i 1)! i i i
i
(6)最概然分布与平衡分布 热力学概率最大的分布称为最概然分布 最概然分布。 最概然分布 对于热力学系统N≥1024,N,V,E确定的系统达平衡时(即系 统的热力学态),粒子的分布方式几乎将不随时间而变化,这种分 布称为平衡分布 平衡分布。 平衡分布 当系统的N→∞时,最概然分布可以代表平衡分布,从而最概 然分布的微观状态数可以代替系统的总微观状态数。这就是摘取 摘取 最大项原理。 最大项原理。
统计热力学初步PPT课件

第九章 统计热力学初步
Statistical Thermodynamics
学习要求:
明确统计热力学的基本假设,理解最概然分布与平衡 分布及摘取最大项原理 掌握 Boltzmann 分布律及其各物理量的意义与适用条 件;理解粒子配分函数、体系配分函数的意义与表达 式,配分函数的析因子性质。 理解不同独立子体系的配分函数,q 及Θ与热力学函 数间的关系。 重点掌握平动能与平动配分函数,转动能与转动配分 函数,振动能与振动配分函数的计算。 理解系统的热容、熵及其他热力学函数与配分函数的 关系。
能 级 : 1 , 2, , i
一 种 分 配 方 式 :N 1 , N 2, , N i
W DCN N1CN N 2N1 N 1!(N N !N 1)!N 2!((N N N N 1 1 )! N 2)!
N! N!
N1!N2 !
Ni !
(能级Ⅰ、Ⅱ)
i
各能级的简并度是g1,g2, …,能级的 分布数是n1,n2,…,由于同一能级的粒 子可处于不同量子态,则
定域子系统和离域子系统
独立子系统和相依(倚)子系统
按粒子间相互作用情况不同,可分为: 独立子系统( system of independent particles)
——粒子之间除弹性碰撞之外,无其它相互作用 (理想气体)。 相依(倚)子系统( system of interacting particles)
3.一维谐振子
v(1 2)h 0,1,2,
ν——粒子的振动频率,与结构有关,数值 可由光谱数据获得。 υ——振动量子数 υ= 0,1,2,
gV , 1
一维谐振子
4.电子和原子核
电子运动及核运动的能级差一般都很大,一 般的温度变化难以产生能级的跃迁或激发,所以 本章只讨论最简单的情况,即一般认为系统中各 粒子的这两种运动处于基态。
复旦大学——物理化学III-化学平衡体系的热力学(ppt 60)

2018/8/20
复旦大学化学系
1
物理化学 II
第十四章 化学平衡体系的热力学
§14−1 化学反应的自由能降低原理
已介绍:任意过程,恒温恒压,不作其它功
化学势降低至极小。 问题: 现有1mol D,在标准压力下 D( g ) E ( g )
如
D > E 方向如何?限度如何?
是否1mol D最后全部变为1mol E? 因为 D > E
2018/8/20
复旦大学化学系
4
物理化学 II
第十四章 化学平衡体系的热力学
yE=nE/(nD+nE)= /(1- + )= , yD=1- 带入:G(T,p) =[(1-)D+ E] +RT [(1-)RTln(1- )+ ln] = D+ (E- D)+RT [(1-)RTln(1- )+ ln]
2018/8/20 复旦大学化学系 6
物理化学 II
第十四章 化学平衡体系的热力学
rG>>0, 1+exp(rG/RT)]=, m=0 rG =0, 1+exp(rG/RT)]=2, m=1/2 rG<<0, 1+exp(rG/RT)]=1, m=1
复旦大学化学系
2018/8/20
2018/8/20 复旦大学化学系 11
物理化学 II
第十四章 化学平衡体系的热力学
化学平衡等温式: rGm = rGm *+RT ln (aGgaHh/aDdaEe) 当化学平衡:G=Gmin rGm=(G/)T,p = 0 0 = rGm* +RT ln (aGgaHh/aDdaEe)平衡 ln (aGgaHh/aDdaEe)=-rGm */RT = f(T,p) 则在恒温恒压下, ln (aGgaHh/aDdaEe)平衡=常数
热力学统计物理第三章PPT课件

S
U
pV
T
n
S
U
pV
T
n
根据熵的广延性,整个系统的熵变
SSS
UT 1T 1VT p T p nT T
CHENLI
14
整个系统达到平衡时,总熵有极大值,必有
δS = 0
因为δUα、δVα、δnα是可以独立改变的,这要求
T 1 T 1 0 ,
T p T p 0 ,
T T 0
G n
T , p
由于吉布斯函数是广延量,系统的吉布斯函数等于物 质的量n与摩尔吉布斯函数Gm(T,p)之积
因此
G(T,p,n) = nGm(T,p)
G n
T
,
p
Gm
即是说,化学势μ等于摩尔吉布斯函数。
由上面开系吉布斯函数的全微分可知,G是以T、p、n
为独立变量的特性函数。若已知G(T,p,n) ,则
即
Tα = Tβ(热平衡条件)
pα = pβ(力学平衡条件)
μα =μβ(相变平衡条件)
上式指出,整个系统达到平衡时,两相的温度、压强和化 学势必须分别相等。
这就是单元复相系达到平衡所要满足的平衡条件。
整个系统孤立,则总内能等应是恒定的,即 Uα + Uβ = 常量 Vα + Vβ = 常量 nα + nβ = 常量
设想系统发生一个虚变动。在虚变动中两相的内能、 体积和物质的量均有变化,但孤立条件要求
CHENLI
13
δUα + δUβ = 0
δVα + δVβ = 0
δnα + δnβ = 0
由上节内能全微分知,两相的熵变分别为
CHENLI
3
热力学与统计物理第三章PPT课件

24.07.2020
2
• 熵判据
一个系统在内能和体积都保持不变的情况下, 对于各种可能的变动,以平衡态的熵为最大。
孤立系统处在稳定平衡状态的必要且充分条件为: Δ~S0
泰勒级数展开为: Δ~S δS1δ2S 2
根据数学知识可知,熵S有极大值的条件应为:
δS0
熵函数有极值
δS0 δ2S 0
24.07.2020
CV 0,
p VT
0
稳定性条件
平衡满足稳定性条件时,系统对平衡发生偏离时,系
统将自发产生相应的过程,以恢复系统的平衡。适用于均 匀系统的任何部分。
24.07.2020
10
气体的范德瓦耳斯方程: pVa2 VbRT
p
V 气体的等温曲线
24.07.2020
11
§3.2 开系热力学基本方程
一、单元复相系平衡性质的描述及特点
24.07.2020
T U
p
U
U
S V , n
V S, n
n S,V
14
3、开系的焓
HGT SUpV
d H T d S V d p d n HH(S,p,n)
T H S p, n
V
H p
S,n
4、开系的自由能
H
n S, p
FGpV UTS
d F S d T p d V d n
16
§3.3 单元系的复相平衡 1.由熵判据推导平衡条件
考虑一单元两相系统( 相与 相 )组成一孤立系,则有:
24.07.2020
17
由开系的基本热力学方程知: d U T d Sp d V d n
SUpTV n SUpTV n 由熵的广延性质: SSS
《统计热力学基础》课件

分布函数的定义
分布函数是描述系统微观状态分布的函数,它表示在某一时刻, 系统中的粒子在各个状态上的概率分布情况。
微观状态数的概念
微观状态数是描述系统内部可能的状态数量的一个概念,它与系统 的宏观状态和微观状态有关。
分布函数的应用
通过分析分布函数,可以了解系统的微观结构和性质,从而更好地 理解系统的宏观行为和变化规律。
02
概率分布
概率分布用于描述粒子集合中不同微观状态的概率分布情况。最常见的
概率分布有玻尔兹曼分布和麦克斯韦-玻尔兹通过概率分布可以计算各种物理量的平均值,如粒子的平均速度和平均
动能。同时,涨落描述了粒子集合中物理量的偏离平均值的情况。
统计热力学的发展历程
早期发展
经典统计热力学
统计热力学的重要性
在科学研究和工程应用中,统计热力学提供了理解和预测物质性质、能量转换 和热力学过程的基础理论框架。它对于化学工程、材料科学、环境科学等领域 具有重要意义。
统计热力学的基本概念
01
微观状态和宏观状态
微观状态是指单个粒子的状态,如位置和速度;宏观状态是指大量粒子
集合的整体状态,如温度、压力和体积。
05
02
详细描述
热力学的第二定律指出,在一个封闭系统中 ,自发过程总是向着熵增加的方向进行,即 熵总是向着增加的方向变化。
04
详细描述
根据热力学的第二定律,热机的效率 不可能达到百分之百,因为总会有一 些能量以热的形式散失到环境中。
06
详细描述
热力学的第二定律还排除了第二类永动机的存 在,即不能从单一热源吸收热量并将其完全转 化为机械功而不产生其他影响。
熵的概念和性质
1 2
熵的定义
统计热力学课件

统计热力学课件1. 引言统计热力学是热力学的一个分支领域,它通过统计方法来研究物质的宏观性质。
统计热力学在物理学、化学等领域都有着广泛的应用。
本课件将介绍统计热力学的基本概念和主要内容。
2. 统计热力学基本概念2.1 系综统计热力学的基本概念之一是系综(Ensemble)。
系综是指一个包含一组相同物理性质的系统的集合。
常见的系综有微正则系综、正则系综、巨正则系综等。
2.2 平衡态在统计热力学中,平衡态是指系统的宏观性质不随时间改变或在长时间内保持不变的状态。
平衡态的性质可以通过统计平均值来描述。
2.3 统计力学统计力学是统计热力学的基本方法,它通过建立系统与外界的相互作用关系,研究宏观性质与微观粒子运动规律之间的关系。
统计力学的核心是概率论和统计学的应用。
3. 统计热力学的主要内容3.1 玻尔兹曼分布玻尔兹曼分布是统计热力学中最基本的分布函数之一,它描述了自由粒子在一定温度下的分布状态。
3.2 能量与熵能量和熵是统计热力学中两个重要的物理量。
能量是系统状态的核心属性,熵则是系统的无序程度。
统计热力学通过研究能量和熵的关系来揭示物质的宏观行为。
3.3 统计平均值统计平均值是描述系统平衡态性质的基本指标,例如内能、熵等。
通过对系统微观状态进行统计,可以得到系统宏观性质的平均值,从而揭示系统的宏观行为。
3.4 相变与临界现象相变和临界现象是统计热力学的一个重要研究内容。
相变是指物质在一定条件下从一个相向另一个相的转变。
临界现象则是相变过程中出现的特殊现象,例如临界点和临界指数等。
4. 应用领域4.1 物理学在物理学领域,统计热力学被广泛应用于凝聚态物理、磁学、高能物理等研究中。
例如,统计热力学可以用来解释物质的相变行为、电磁波的统计行为等。
4.2 化学在化学领域,统计热力学可以用来研究化学平衡、化学反应速率等问题。
例如,通过统计方法可以计算出化学反应的平衡常数和反应速率常数。
4.3 生物学统计热力学在生物学领域的应用越来越广泛。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
等概率原理
在大量偶然(随机)事件中起作用的规律称为统计规律
2020/8/11
复旦大学化学系
9
物理化学 II
第十章 统计热力学基础
(二) 微观态和宏观态
四个分子在两个等容器中的分布情况
2020/8/11
复旦大学化学系
10
物理化学 II
第十章 统计热力学基础
分布方式 第一种方式 第二种方式
第三种方式
✓ 宏观态概率 P i ✓ 微观态概率 P微
某个宏观态含微观态数目
✓
P i = P微W i =
总的微观态数目()
✓ 上例 = 24 = 16;W = 1,4,6,4,1
2020/8/11
复旦大学化学系
12
物理化学 II
第十章 统计热力学基础
(三) 热力学概率和熵 N 分子在两个等容器中的分布情况
N=100 W(50,50)=1.00891029=W* =2100=1.27 1030
最可几分布 W(N/2,N/2) —— 热力学概率最大 ✓ 体系 不平衡 平衡 ✓ 热力学概率小 大 ✓ 系统熵小 大
热力学概率 W 熵 S 存在关系
2020/8/11
复旦大学化学系
14
物理化学 II
S ln
S = kB ln
kB Boltzmann常数
S (U,V,N) (U,V,N)~W*(U,V,N)
2020/8/11
复旦大学化学系
16
物理化学 II
第十章 统计热力学基础
(四) 独立等同可辨和不可辨粒子
独立 没有能量交换 等同 同一种粒子 可辨 晶体(位置不同) 不可辨 气体(自由运动) ❖ 理想晶体对应于独立等同可辨粒子 ❖ 理想气体对应于独立等同不可辨粒子
第四种方式
第五种方式
左边容器 abcd abc abd adc bcd ab ac ad bc bd cd a b c d 0
右边容器 0 d c b a cd bd bc ad ac ab bcd acd abd abc abcd
分布性质 四个分子均在一边 三个分子在左边,一个分子在右边, 共有四种方式。
B
N
A
M
2020/8/11
复旦大学化学系
5
物理化学 II
第十章 统计热力学基础
福利彩票(35 选 7 )
➢ 一等奖 选对 7 个 ➢ 二等奖 选对 6 个 ➢ 问:选中一、二等奖的概率 ?
(希望有多大 ?)
2020/8/11
复旦大学化学系
6
物理化学 II
第十章 统计热力学基础
35 选 7 的可能性 35343332313029/(7654321) = 6724520
ln W 与 ln 更接近
2020/8/11
复旦大学化学系
15
物理化学 II
第十章 统计热力学基础
热力学概率与熵的关系 S = f ()
两个独立体系 S1 = f (1)
体系合并
S2 = f (2) S = S1 + S2 = f (1) + f (2)
= 1 2
f () = f (1 2) = f (1) + f (2)
第十章 统计热力学基础
N 很大时,W(均匀分布) 与 十分接近
W* = ———N—!—— = ———N—! ——
(N/2)!(N/2)!
[(N/2)!]2
Stirling 公式,N! = NN e-N (N 很大)
W* = ————N—N—e-N——— = 2N = [ (N/2)N/2 e-N/2 ]2
投分币: Buffun 4040次 Pearson 24000次
正面出现 2048次 正面出现12012次
50.69% 50.05%
2020/8/11
复旦大学化学系
8
物理化学 II
第十章 统计热力学基础
独立偶然事件同时出现的频率是各自频率的乘积
P(Ai,Bj) = Pi (A)Pj (B)
PI,I= PI(A) PI(B) =(1/2)×(1/2)=1/4 PI,II= PI(A) PII(B) =(1/2)×(1/2)=1/4 PII,I= PII(A) PI(B) =(1/2)×(1/2)=1/4 PII,II= PII(A) PII(B) =(1/2)×(1/2)=1/4
物理化学 II
第十章 统计热力学基础
物理化学
2020/8/11
复旦大学化学系
1
物理化学 II
第十章 统计热力学基础
三大力学
量子力学 (微观性质) 热力学 (热力学函数) 统计力学
(热力学与量子力学的联系)
如何进行统计 ???
桥梁
2020/8/11
复旦大学化学系
2
物理化学 II
第十章 统计热力学基础
2020/8/11
复旦大学化学系
17
物理化学 II
第十章 统计热力学基础
总能量为 3h 的三个谐振子(晶体中)的分布方式
=10
P1 = 1/10, P2 = 3/10, P3 = 6/10
经典统计方法
M-B 统计
量子统计
F-D 统计
B-E 统计
2020/8/11
复旦大学化学系
3物理Biblioteka 学 II§14-1 基本概念
㈠ 概率
第十章 统计热力学基础
B
N
A
M
从 A到 B 有几种走法 ?
2020/8/11
复旦大学化学系
4
物理化学 II
第十章 统计热力学基础
CM M N
=(M+N)!/M!×N!
ni
N-n i
W
i
=
C
ni N
=
N
n! (N-n)!
2020/8/11
复旦大学化学系
13
物理化学 II
第十章 统计热力学基础
N = 10 W(5,5)=252=W* =210=1024
宏观态 n左 0 1 2 3 4 5 6 7 8 9 10 n右 10 9 8 7 6 5 4 3 2 1 0
微观态 Wi 1 10 45 120 210 252 210 120 45 10 1 数
二个分子在左边,二个分子在右边, 共有六种方式。
一个分子在左边,三个分子在右边, 共有四种方式。
四个分子均在右边
2020/8/11
复旦大学化学系
11
物理化学 II
第十章 统计热力学基础
每一个具体分布 微观态 每一种分布方式(宏观可区分) 宏观态 每一种宏观态内微观态数目
热力学概率 W(>1)
➢ 一等奖 选对 次数 1 概率 = 1.49 10 -7
➢ 二等奖 选对 次数 7 (35-7) = 196 概率 = 1.49 10 –7 196 = 2.9 10 –5
什么是概率?怎么定义概率?
2020/8/11
复旦大学化学系
7
物理化学 II
第十章 统计热力学基础
偶然事件出现的频率(N ) =该事件出现的概率
