大学热力学第二定律(李琳丽)
热力学第二定律CAI子课件用户手册

热力学第二定律CAI子课件用户手册第一章讲解演示CAI单元1.1基本概念热力学第二定律:开尔文说法:只冷却一个热源而连续不断作功的循环发动机是造不成功的;克劳修斯说法:热不可能自发地、不付代价地从低温物体传到高温物体。
第二类永动机:从单一热源取得热量,并使之完全转变为机械能而不引起其他变化的循环发动机,称为第二类永动机。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
孤立系统熵增原理:若孤立系统所有部分的内部以及彼此间的作用都经历可逆变化,则孤立系的总熵保持不变;若在任一部分内发生不可逆过程或各部分间的相互作用伴有不可逆性,则其总熵必定增加。
定熵过程:系统与外界没有热量交换情况下所进行的可逆热力过程,称为定熵过程。
可逆过程:当系统进行正、反两个过程后,系统与外界均能完全回复到初始状态,这样的过程称为可逆过程。
热机循环:若循环的结果是工质将外界的热能在一定条件下连续不断地转变为机械能,则此循环称为热机循环。
制冷:对物体进行冷却,使其温度低于周围环境温度,并维持这个低温称为制冷。
制冷机:从低温冷藏室吸取热量排向大气所用的机械称为制冷机。
热泵:将从低温热源吸取的热量传送至高温暖室所用的机械装置称为热泵。
理想热机:热机内发生的一切热力过程都是可逆过程,则该热机称为理想热机。
卡诺循环:在两个恒温热源间,由两个可逆定温过程和两个可逆绝热过程组成的循环,称为卡诺循环。
卡诺定理:在两个不同温度的恒温热源间工作的所有热机,以可逆机的热效率为最高。
自由膨胀:气体向没有阻力空间的膨胀过程,称为自由膨胀过程。
不可逆作功能力损失:不可逆过程作功能力损失等于环境温度与孤立系统熵增的乘积。
1热力学第二定律CAI 子课件用户手册2作功能力:作功能力是指从某状态的热源中吸取一定量的热量或对于一定状态的闭口系统工质或开口系统流动工质,可逆地过度到环境状态所能转换最大有用功。
1.2公式及适用条件熵的定义式:⎰=∆21T qs δ J/kg K工质熵变计算:12s s s -=∆,⎰=0ds工质熵变是指工质从某一平衡状态变化到另一平衡状态熵的差值。
热力学第二定律

热力学第二定律热力学是研究能量转化和能量传递的学科,而热力学第二定律是其中最重要的基本定律之一。
它提供了关于能量转化的方向性和限制性的基本原理,对于理解自然界中的能量变化过程具有重要的意义。
本文将对热力学第二定律进行详细讨论和解释。
1. 热力学第二定律的表述热力学第二定律有多种不同的表述方式,其中包括开尔文表述、卡诺表述和统计热力学表述等。
这些表述方式虽然从不同的角度出发,但都涉及到能量传递和转化的方向性问题。
开尔文表述认为任何一个永动机都无法制造,即能量无法从自然界中被完全转化为有用的功。
这是因为在能量转化过程中总会产生一定的热量损失,而热量是无法完全转化为功的。
卡诺表述将热力学第二定律与热机的效率联系起来。
卡诺定理指出,在相同的温度下,所有工作于制冷剂和热源之间的热机中,卡诺热机的效率是最高的。
这说明热能无法完全转化为功,必然会有一部分热量被排放到冷源中。
统计热力学表述则从微观粒子的概率分布出发,将热力学第二定律与系统的熵变联系起来。
熵是系统的无序程度的度量,热力学第二定律表明自然界中的系统熵趋于增大。
2. 热力学第二定律的意义热力学第二定律揭示了自然界中一种普遍存在的趋势,即能量从高温热源流向低温热源。
这种趋势不仅在宏观尺度上成立,也在微观尺度上成立。
热力学第二定律的意义在于它提供了一个能量转化的方向性标准,使我们能够理解和预测自然界中的各种能量转化过程。
3. 熵的概念与热力学第二定律的关系熵是热力学中一个重要的概念,它用来衡量系统的无序程度。
熵的增加意味着系统的无序程度增加,而热力学第二定律指出,自然界中系统的熵总是趋于增大的。
从微观角度看,系统中微观粒子的运动状态具有无序性,而能量转化过程中总会使得系统的微观粒子趋于更多的运动状态,因此系统的熵趋于增大。
这也解释了为什么自然界中的能量转化过程总是存在能量损失和热量排放的现象,而无法实现全部转化为有用功的理想状态。
4. 热力学第二定律的应用热力学第二定律不仅是理论上的基础,也是工程和实际应用中的重要依据。
大学物理热力学第二定律知识点总结

大学物理热力学第二定律知识点总结热力学第二定律是大学物理热学部分的重要内容,它揭示了热现象过程中的方向性和不可逆性。
理解和掌握热力学第二定律对于深入研究热学以及相关领域具有重要意义。
以下是对热力学第二定律相关知识点的详细总结。
一、热力学第二定律的表述1、克劳修斯表述热量不能自发地从低温物体传向高温物体。
这意味着热传递的过程具有方向性,如果没有外界的干预,热量只会从高温物体流向低温物体,而不会反向流动。
2、开尔文表述不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
也就是说,第二类永动机是不可能制成的。
第二类永动机是指一种能够从单一热源吸热,并将其全部转化为功,而不产生其他变化的热机。
二、热力学第二定律的微观解释从微观角度来看,热力学第二定律反映了大量分子热运动的无序性。
在一个孤立系统中,分子的热运动总是从有序趋向无序,这是一个自发的过程。
比如,将不同温度的气体混合在一起,它们会自发地达到温度均匀分布的状态,而不会自动地分离成原来的不同温度区域。
这是因为分子的无规则运动使得它们更容易趋向无序的分布。
三、熵熵是描述系统无序程度的热力学概念。
熵的增加表示系统的无序程度增加。
对于一个绝热过程,系统的熵永不减少。
如果是可逆绝热过程,熵不变;如果是不可逆绝热过程,熵增加。
熵的计算公式为:$dS =\frac{dQ}{T}$,其中$dQ$ 是微元过程中的吸热量,$T$ 是热力学温度。
四、卡诺循环与卡诺定理1、卡诺循环卡诺循环由两个等温过程和两个绝热过程组成,是一种理想的热机循环。
通过卡诺循环,可以计算出热机的效率。
卡诺热机的效率为:$\eta = 1 \frac{T_2}{T_1}$,其中$T_1$ 是高温热源的温度,$T_2$ 是低温热源的温度。
2、卡诺定理(1)在相同的高温热源和低温热源之间工作的一切可逆热机,其效率都相等,与工作物质无关。
(2)在相同的高温热源和低温热源之间工作的一切不可逆热机,其效率都小于可逆热机的效率。
大学物理学第二版下册热力学第二定律
S 0( 孤 立 系 , 自 然 过 程 )
--热力学第二定律的数学表述
孤立系统处于非平衡态时,将以完全压倒优势的可 能性向平衡态过渡。 熵减少的过程并不是原则上不可能,而是在实际上 它发生的概率非常小,以致一般不会出现或观测不 到。
23
例: 试用玻尔兹曼熵计算理想气体在绝热自由膨胀过
S 程 中的熵变(熵增量) 解: 在体积为V的容器中找到一个分子的概率为1,
一切与热现象有关的实际宏观过程都是不可逆的!
可逆过程只是一种理想过程,我们所能做到的 只能是使实际过程尽量接近可逆过程。 无摩擦的准静态过程是可逆过程。
2
#1a0901015a
关于可逆过程与不可逆过程指出下列说法正确的是: A.不可逆过程是系统不能恢复到初状态的过程 B.不可逆过程是外界有变化的过程 C.不可逆过程一定找不到另一过程使系统和外界同时 复原 D.不可逆过程就是不能向反方向进行的过程
9
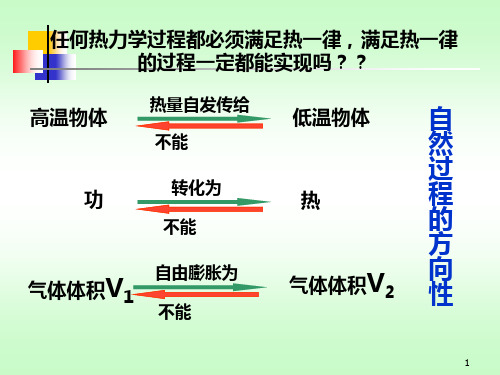
气体绝热自由膨胀
气体体积V1 气体分子由占据较 小的空间
自由膨胀为
气体体积V2
不能自由压缩为
气体分子由占据较大 的空间
结论是:向更加无序的状态方向进行!
热力学第二定律的微观意义(统计意义):
一切自然过程总是沿着分子运动的无序性增大的 方向进行。
说明:它涉及大量分子的运动的无序性变化的规 律,因此热力学第二定律是一条统计规律。
C
3
#1a0901015b
关于可逆过程与不可逆过程指出下列说法错误的是:
A.可逆的热力学过程一定是准静态过程
B.一切与热现象有关的实际过程是不可逆的
C.一切自发的过程都是不可逆的
D.准静态过程一定是可逆的
E.凡是有摩擦的过程一定是不可逆的
大学物理热力学第定律

不可能从单一热源吸取热量并使它完全变为有用的功而不引起其它变化。
外界需对系统作功,就属“其它变化”。此表述说明热传导过程的不可逆性。
等温膨胀时系统体积增大亦属“其它变化”。此述说明功变热过程的不可逆性。
%
企图制造单一热源且
的热机称为第二类永动机。
等价于
凡例
热力学第二定律不但在两种表述上是等价的,而且它在表明一切与热现象有关的实际宏观过程的不可逆性方面也是等价的。历史上的两种表述只是一种代表性的表述。
用热力学第二定律证明绝热线与等温线不能相交于两点
等温线
绝热线
若 图上绝热线与等温线相交于两点
则可作一个由等温膨胀和绝热压缩准静态过程组成的循环过程。
系统只从单一热源(等温过程接触的恒定热源)吸热 。
完成一个循环系统对外作的净功为 ,并一切恢复原状。
这违背热力学第二定律的开尔文表述,故绝热线与等温线不能相交于两点。
非自发传热
自发传热
高温物体
低温物体
热传导
要使过程可逆: 过程要无限缓慢进行,即:准静态过程; 没有摩擦力、粘滞力或其他耗散力作功
一个热力学系统由某一初态出发,经过某一过程到达末态后,如果不存在另一过程,它能使系统和外界完全复原,则原过程称为不可逆过程。 (如:有摩擦的单摆)
可逆过程只是一种理想模型。无耗散的准静态过程可视为可逆过程。
开尔文另一表述为:第二类永动机是不可能造成的。
并不违背热力学第一定律,但违背热力学第二定律。
表述的等价性
假如热量可以自动地从低温热源传向高温热源,就有可能从单一热源吸取热量使之全部变为有用功而不引起其它变化。
低温热源
热力学第二定律
热力学第二定律
热力学第二定律CoFra bibliotektentschapter 5
热力学第二定律李琳丽

热力学第二定律(李琳丽)————————————————————————————————作者:————————————————————————————————日期:第二章 热力学第二定律与化学平衡1. 1mol 理想气体由298 K 、0.5 dm3膨胀到5 dm 3。
假定过程为 (1) 恒温可逆膨胀; (2) 向真空膨胀。
计算各过程系统的熵变∆S 及总熵变孤立S ∆。
由此得到怎样结论? 解:(1) 恒温可逆过程12lnV V nR S =∆=3.385.05ln 314.82=⨯⨯ J .K -13.38lnln 1212-=-=-=-==∆V V nR TV V nRT T Q T Q S 环系统环环境环境 J .K-1 0=∆∆∆环境孤立+=S S S 说明过程是可逆的。
(2) S ∆只决定于始、终态,与过程的具体途径无关,过程(2)的熵变与过程(1)的相同,因此有S ∆=38.3 J .K -1。
理想气体在向真空膨胀过程中,0=外p ,W=0,Q =0,说明系统与环境无热量交换,所以0=∆环境S3.38=∆∆∆环境孤立+=S S S J .K -1 >0 由于0>∆孤立S ,说明向真空膨胀过程是自发过程。
2. 1 mol 某理想气体(11m ,mol K J 10.29--⋅⋅=p C ),从始态(400 K 、200kP a)分别经下列不同过程达到指定的终态。
试计算各过程的Q 、W 、∆U 、∆H 、及∆S 。
(1) 恒压冷却至300 K; (2) 恒容加热至600 K; (3) 绝热可逆膨胀至100 kPa ;解:(1) ==111p nRT V L 63.16m 1063.1610200400314.81333=⨯=⨯⨯⨯- 1122V T V T = 47.1263.164003001122=⨯=⨯=V T T V L 832)63.1647.12102003-=-⨯⨯=∆=(外V P W kJ)400300()314.810.29(1m ,-⨯-⨯=∆=∆T nC U VkJ 08.2-=)400300(314.810.291m ,-⨯⨯⨯=∆=∆T nC H pkJ 2.24-=kJ 830=-∆=W U Q⎰=∆21d T T PT TC S =37.810.29300400-=⨯⎰TdT J ∙K-1 (2) 0=W)400600()314.810.29(1m ,-⨯-⨯=∆=∆T nC U VkJ 16.4=)400600(314.810.291m ,-⨯⨯⨯=∆=∆T nC H pkJ 4.48=kJ 16.4=-∆=W U Q⎰=∆21d T T VT TC S =43.8)314.810.29(600400=⨯-⎰T dT J ∙K -1 (3) 40.1314.810.2910.29,,=-==mV m P C C γ,γγγγ--=122111P T P T40.1140.1240.1140.1100200400--=T3282=T K0=Q)400328()314.810.29(1m ,-⨯-⨯-=∆-=∆-=T nC U W VkJ 50.1=)400328(314.810.291m ,-⨯⨯⨯=∆=∆T nC H pkJ 4.17-=0==∆TQ S R3. 1 mo l 0℃、0.2 kPa 的理想气体沿着p/V =常数的可逆途径到达压力为0.4 kP a的终态。
《大学物理AII》作业热力学第二定律(参考答案)

《大学物理AII》作业热力学第二定律(参考答案)《大学物理AII》作业No.12 热力学第二定律班级________ 学号________ 姓名_________ 成绩_______ ------------------------------------------------------------------------------------------------------- ****************************本章教学要求**************************** 1、理解实际宏观过程不可逆性的意义,并能举例说明各种实际宏观过程的不可逆性是相互关联的。
2、理解热力学第二定律的典型表述、微观意义以及规律的统计性质。
3、理解热力学概率及其和实际过程进行方向的关系。
4、理解玻耳兹曼熵公式及熵增加原理。
5、掌握可逆过程条件,理解克劳修斯熵公式的意义并能利用它来判断熵变的正负。
-------------------------------------------------------------------------------------------------------一、填空题1、各种实际宏观过程都是不可逆,并且它们的不可逆性是相互关联的。
(选填:可逆或不可逆)2、热力学第二定律的克劳修斯表述为:不可能使热量从低温物体传到高温物体而不产生其他的影响;热力学第二定律的开尔文表述为:不可能从单一热源吸热完全转变为有用功而不产生其他影响。
这两种表述表述反映的共同本质是:一切与热现象有关的实际宏观过程都是不可逆的。
3、热力学概率是指某种宏观态所包含的微观状态数目,自发进行的热力学过程总是向着热力学概率增大的方向进行(选填:增大或减小)。
热力学平衡态就是一定宏观条件下热力学概率最大的状态。
4、玻耳兹曼熵公式定义为WS,熵越大意味着系统包含的可能微观状态数=lnk越多(选填:多或少),系统就越无序(选填:有序或无序)。
热力学第二定律具体内容

热力学第二定律具体内容:热力学第二定律是热力学定律之一,是指热永远都只能由热处转到冷处.热力学第二定律是描述热量的传递方向的分子有规则运动的机械能可以完全转化为分子无规则运动的热能;热能却不能完全转化为机械能.此定律的一种常用的表达方式是,每一个自发的物理或化学过程总是向著熵(entropy)增高的方向发展.熵是一种不能转化为功的热能.熵的改变量等于热量的改变量除以绝对温度.高、低温度各自集中时,熵值很低;温度均匀扩散时,熵值增高.物体有秩序时,熵值低;物体无序时,熵值便增高.现在整个宇宙正在由有序趋于无序,由有规则趋于无规则,宇宙间熵的总量在增加.克劳修斯表述不可能把热量从低温物体传到高温物体而不引起其他变化.开尔文表述不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响.开尔文表述还可以表述成:第二类永动机不可能造成.若要简捷热能不能完全转化为机械能,只能从高温物体传到低温物体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 热力学第二定律与化学平衡1. 1mol 理想气体由298 K 、0.5 dm 3膨胀到5 dm 3。
假定过程为 (1) 恒温可逆膨胀; (2) 向真空膨胀。
计算各过程系统的熵变∆S 及总熵变孤立S ∆。
由此得到怎样结论? 解:(1) 恒温可逆过程12lnV V nR S =∆=3.385.05ln 314.82=⨯⨯ J .K -1 3.38lnln 1212-=-=-=-==∆V V nR TV V nRT T Q T Q S 环系统环环境环境 J .K -1 0=∆∆∆环境孤立+=S S S 说明过程是可逆的。
(2) S ∆只决定于始、终态,与过程的具体途径无关,过程(2)的熵变与过程(1)的相同,因此有S ∆=38.3 J .K -1。
理想气体在向真空膨胀过程中,0=外p ,W =0,Q =0,说明系统与环境无热量交换,所以0=∆环境S3.38=∆∆∆环境孤立+=S S S J .K -1 >0由于0>∆孤立S ,说明向真空膨胀过程是自发过程。
2. 1 mol 某理想气体(11m ,mol K J 10.29--⋅⋅=p C ),从始态(400 K 、200kPa )分别经下列不同过程达到指定的终态。
试计算各过程的Q 、W 、∆U 、∆H 、及∆S 。
(1) 恒压冷却至300 K ; (2) 恒容加热至600 K ; (3) 绝热可逆膨胀至100 kPa ;解:(1) ==111p nRT V L 63.16m 1063.1610200400314.81333=⨯=⨯⨯⨯- 1122V T V T = 47.1263.164003001122=⨯=⨯=V T T V L 832)63.1647.12102003-=-⨯⨯=∆=(外V P W kJ)400300()314.810.29(1m ,-⨯-⨯=∆=∆T nC U VkJ 08.2-=)400300(314.810.291m ,-⨯⨯⨯=∆=∆T nC H pkJ 2.24-=kJ 830=-∆=W U Q⎰=∆21d T T PT TC S =37.810.29300400-=⨯⎰TdT J ∙K -1 (2) 0=W)400600()314.810.29(1m ,-⨯-⨯=∆=∆T nC U VkJ 16.4=)400600(314.810.291m ,-⨯⨯⨯=∆=∆T nC H pkJ 4.48=kJ 16.4=-∆=W U Q⎰=∆21d T T VT TC S =43.8)314.810.29(600400=⨯-⎰TdT J ∙K -1 (3) 40.1314.810.2910.29,,=-==mV m P C C γ,γγγγ--=122111P T P T40.1140.1240.1140.1100200400--=T3282=T K0=Q)400328()314.810.29(1m ,-⨯-⨯-=∆-=∆-=T nC U W VkJ 50.1=)400328(314.810.291m ,-⨯⨯⨯=∆=∆T nC H pkJ 4.17-=0==∆TQ S R3. 1 mol 0℃、0.2 kPa 的理想气体沿着p /V =常数的可逆途径到达压力为0.4 kPa 的终态。
已知R C V 25m ,=,求过程的Q 、W 、∆U 、∆H 、∆S 。
解:==111p nRT V L 35.11m 1035.11102.015.273314.81336=⨯=⨯⨯⨯- 1122V p V p = 70.2235.112.04.01122=⨯=⨯=V p p V (L) K 1092314.811070.22104.036222=⨯⨯⨯⨯==-nR V p T⎰⎰-⨯⨯-=-=-=2121)(2121222111V V V V V V V p VdV V p pdV W )(211122V p V p --= 310)35.112.070.224.0(21⨯⨯-⨯⨯-=kJ 405.3-=)2731092(314.8251m ,-⨯⨯⨯=∆=∆T nC U V J 1002.173⨯= kJ 02.17=)2731092(314.8271m ,-⨯⨯⨯=∆=∆T nC H pJ 1083.233⨯= kJ 83.23=kJ 43.20=-∆=W U Q1212m ,ln lnp p nR T T nC S p -=∆ 2.04.0ln 314.85.2731092ln314.8)125(1⨯-⨯⨯+⨯=1K J 56.34-⋅=4. 在绝热容器中,将0.5 dm 3 、343 K 水与0.1 dm 3、303 K 水混合,求混合过程的熵变。
设水的平均恒压热容为40.75m ,=p C J ∙K -1∙mol -1。
解:设混合后温度为T K0)303(18101.0)343(18105.0m ,3m ,3=-⨯+-⨯T C T C p p 3.336=T K3033.336ln18101.03433.336ln 18105.0m ,3m ,3p p C C S ⨯+⨯=∆ 35.2=J ∙K -15. 在373 K 、100 kPa 时,将1mol 水与373 K 的热源接触,使它在真空器皿中完全蒸发为水蒸气。
已知水的气化热为40.7 kJ ∙mol -1。
试计算此过程的∆S 体系、∆S 环境、和∆S 总,并判断该过程是否自发。
解:3101373314.81=⨯⨯==≈-=nRT V P V V P W g l g R 外外)( J 7.40=R Q kJW =0R R W Q W Q U -=-=∆6.3703101107.403=+-⨯=+-=W W Q Q R R kJ∆S 体系=109373107.403=⨯=T Q R J ∙K -1 ∆S 环境=8.100373106.373-=⨯-=-环T Q J ∙K -1∆S 总=∆S 体系+∆S 环境=109-100.8=8.2 J ∙K -16. 有一系统如图所示。
将隔板抽去,使气体混合,求达平衡后的∆S 。
设气体的C p 均为28.03 J ⋅K -1⋅mol -1。
1 mol O 2 1 mol H 2283 K, V 293 K, V 解:设混合后温度为T K0)293(1)283(1m ,m ,=-⨯+-⨯T C T C P pK T 288=VV nR T T nC S V 212m ,O ln ln2+=∆ VV nR 2ln 283288ln)31.803.28(1+-⨯=11.6= J ⋅K -1⋅mol -11212m ,H ln ln2V V nR T T nC S V +=∆ VV 2ln 31.81293288ln)31.803.28(1⨯+-⨯=42.5= J ⋅K -1⋅mol -153.1122H O =∆+∆=∆S S S J ⋅K -1⋅mol -17. 由绝热壁构成的容器中间用导热隔板分成两部分(体积均为V ),各盛1 mol 同种理想气体。
开始时左半部温度为T A ,右半部温度为T B (<T A )。
经足够长时间两部分气体达到共同的热平衡温度)(21B A T T T +=。
试计算此热传导过程初终两态的熵差。
解:左右两侧开始都处于平衡态初态:左半部气体有右半部气体有整个系统终态:000ln lnV V R T T C S S A v A +=-000ln lnV V R T T C S S B v B +=-00212ln 2lnS V VR T T T C S S S B A v B A ++=+=00lnlnV VR T T C S S v A +=-整个系统所以热传导为不可逆过程的典型例子,此题证实不可逆过程的熵增加。
8. 一绝热容器用隔板分成如图所示的两部分,分别盛温度、压力相同的32mol 甲烷和31mol 氢气,抽去隔板,使两气体混合。
设两者皆为理想气体。
(1) 试计算∆S 和终态与始态的热力学几率之比12ΩΩ;(2) 如果将2Ω当作1,那么甲烷全部集中在左边2V 中,同时氢气全部集中在右边V 中的几率有多大?32mol CH 4 31mol H 2 P T 2V P T V 解:(1) 由理想气体恒温恒压混合熵公式)ln ln (B B A A mix x n x n R S +-=∆)3ln 3132ln 32(314.8V VV V +-==5.3 J ⋅K -1 根据玻耳兹曼公式,有)ln(12mix ΩΩ=∆k S 故 2323mix 1068.1103807.13.51210⨯⨯∆===ΩΩ-e ekS(2) 当2Ω=1,则23231068.11068.1110101⨯-⨯==Ω这说明混合后再自动分离成混合之前的状态,从统计的角度来看几率小到几乎为0。
0lnlnV V R T T C S S v B +=-0020222ln 2ln S V VR T T C S S S v B A ++=+=04)(ln ln 2212>+==-BA B A v B A v T T T T C T T T C S S9. 实验室有一大恒温槽的温度为370 K ,室温为300 K ,经过相当时间后,因恒温槽绝热不良有4184 J 的热传给室内的空气,试求:(1) 恒温槽的熵变; (2) 空气的熵变;(3) 试说明此过程是否可逆。
解:31.113704184-=-==∆J T Q S 槽 J ⋅K -195.133004184==-=∆环空T Q S J ⋅K -164.2=∆+∆=∆空槽总S S S J ⋅K -10>该过程自发进行。
10. 某溶液中化学反应,若在298.2 K 、100 kPa 下进行,当反应进度为1 mol 时放热40 kJ ,若使该反应通过可逆电池来完成,则吸热4 kJ 。
试计算: (1) 该化学反应的∆S 。
(2) 当该反应自发进行(即不作电功)时,求环境的熵变及总熵变。
(3) 该系统可能作的最大功。
解:(1)4.1315.2984000R ===∆T Q S J∙K -1(2) 13415.2981044=⨯=-=∆T Q S 环J∙K -14.147=∆+∆=∆环总S S S J∙K -1(3) 4104.4⨯=W J11. 乙醇脱水制乙烯的反应为:C 2H 5OH (g )→C 2H 4(g )+H 2O (g )。
已知298 K 时的下列数据,试求该温度下的θm r S ∆。
物 质 C 2H 5OH(g) C 2H 4(g) H 2O(g)θmS J ⋅K -1⋅mol -1 282.70 219.56 188.83解:70.282)83.18856.219(θm r -+=∆S69.125= J ⋅K -1⋅mol -112. 1 mol He(g)在400 K 、 0.5 MPa 下恒温压缩至1 MPa ,试计算其Q 、W 、∆U 、∆H 、∆S 、∆A 、∆G 。
