image J 软件分析双标及多标格免疫荧光共表达操作步骤2
如何使用ImageJ测量荧光强度
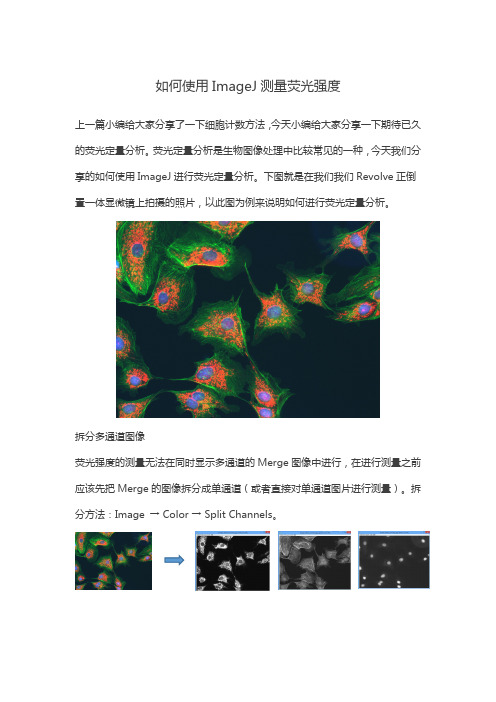
如何使用ImageJ 测量荧光强度上一篇小编给大家分享了一下细胞计数方法,今天小编给大家分享一下期待已久的荧光定量分析。
荧光定量分析是生物图像处理中比较常见的一种,今天我们分享的如何使用ImageJ 进行荧光定量分析。
下图就是在我们我们Revolve 正倒置一体显微镜上拍摄的照片,以此图为例来说明如何进行荧光定量分析。
拆分多通道图像荧光强度的测量无法在同时显示多通道的Merge 图像中进行,在进行测量之前应该先把Merge 的图像拆分成单通道(或者直接对单通道图片进行测量)。
拆分方法:Image →Color →Split Channels。
图像分割在图像计算的角度而言,图像分割(Image Segmentation)便是将图片分割为多个片段的过程,其目的是简化图像不同部分的象征意义以便于图像分析。
常用的图像分割技术主要用来定位图像中的目标物体并勾画出其边界。
ImageJ中可通过多种方法实现图像分割,在此我们先介绍一下最基本的一种-手动图像分割。
此种方法主要通过控制图像直方图中的强度阈值来实现,分割出阈值范围内的图像区域,并进行后续的测量分析。
实现方法:Image→Adjust→Threshold,红色蒙版即代表选中区域。
测量荧光强度实现方法:Analyse→Measure。
注意:默认数值显示的是整张图片的荧光强度和面积,我们需要进行参数设定才可以显示所选区域的统计值。
如果需要导出数据或者设定测量参数,点击右键(也可以通过Analyse→Set Measurement实现),选中Limite to threshold和Area fraction。
好啦,现在进行Analyse→Measure,就可以得到想要的统计值了。
免疫荧光双标操作方法及注意事项

免疫荧光双标操作方法及注意事项以下是免疫荧光双标操作方法及注意事项的详细介绍:方法:1.样品制备:a.细胞:将培养皿中的细胞用磷酸盐缓冲液洗涤,并以适当浓度悬浮于PBS(磷酸盐缓冲液)中。
b.组织:从动物体内取出组织样本,用PBS洗涤并切成适当大小的块。
2.固定:a.细胞:用适当浓度的乙醛在室温下固定细胞。
b.组织:用适当浓度的乙醛固定组织样本,然后在PBS中冲洗。
3.渗透:a.细胞和组织:将样本浸泡在PBS-T(含0.2%的肌凝蛋白酶)中,进行渗透处理,以增强抗体的渗透性。
4.阻断:a.使用几何草酸或明胶作为非特异性蛋白质的抗原来阻止非特异抗体的结合。
5.主抗体孵育:a.加入适当稀释倍数的一抗(特异抗体),孵育样本,可以在室温或4°C条件下进行。
6.洗涤:a. 用PBS-T或TBST(含0.1%的Tween 20)进行多次洗涤,以去除未结合的一抗。
7.次抗体孵育:a.加入适当稀释倍数的二抗(荧光标记的抗体),与一抗结合后,通过固定区域与目标蛋白进行特异结合。
8.洗涤:a.用PBS-T或TBST进行多次洗涤,以去除未结合的二抗。
9.核染色/细胞膜染色:a.加入DNA染色剂(如DAPI)或细胞膜标记(如细胞膜标记染料),用于定位目标蛋白。
10.显微镜观察:a.将样本放置在玻片上,用荧光显微镜观察并拍照或记录图像。
注意事项:1.温度控制:孵育和洗涤过程中,适当控制温度可以提高抗体结合的特异性和效率。
2.抗体稀释倍数:需要根据实验要求和试剂手册推荐的稀释倍数来使用抗体。
3.阻断剂的选择:根据实验要求选择适当的非特异性蛋白质抗原来阻断非特异抗体的结合。
4.试剂保存:将抗体和荧光标记物保存在适当的低温条件下,避免暴露在光和高温下。
5.孵育时间:一抗和二抗的孵育时间需要根据试剂手册推荐的时间来进行。
6.具体细胞/组织类型的处理:不同的细胞或组织在样品制备和处理过程可能需要略微不同的方法,可以参考试剂手册或已发表的方法。
imagej的使用方法

imagej的使用方法
ImageJ是一款功能强大的图像处理软件,可以帮助用户轻松地进行图像的测量、分析、编辑等操作。
本文将指导用户如何使用ImageJ来处理图像。
首先,用户需要下载ImageJ软件,然后将图像导入ImageJ中。
用户可以选择从本地文件夹中导入图像,也可以从网络中导入图像,比如URL、FTP等。
接下来,用户可以通过ImageJ的图像处理功能对图像进行处理。
用户可以根据自己的需要调整图像的亮度、对比度、饱和度等参数。
此外,ImageJ还支持用户对图像进行滤镜处理、裁剪、旋转和缩放等操作。
同时,ImageJ还支持用户对图像进行测量和分析。
用户可以通过ImageJ的测量工具来测量图像中的面积、长度和角度等信息。
此外,ImageJ还拥有强大的图像分析功能,可以帮助用户分析图像中的细节信息,提取出图像中的特征和目标。
最后,用户可以通过ImageJ对图像进行编辑。
ImageJ提供了大量的编辑工具,可以帮助用户轻松添加文字、图标、标签等内容,以增加图像的可读性。
总之,ImageJ是一款强大的图像处理软件,可以帮助用户轻松地
进行图像的测量、分析、编辑等操作。
通过本文的指导,用户可以轻松地使用ImageJ来处理图像。
imagej荧光定量方法

1、安装后首先打开ImageJ:2、打开要分析图片:File>open(热键为Ctrl+O)3、转换成8bit的灰度图:Image>Type>8-bit4、黑白反转(因为对于光密度(OD)来说越白数值越小,纯白为0;越黑数值越大,纯黑理论上是无限大。
因此我们需要将上一步所转换的灰度图进行黑白反转,不然的话测出来的数值就会荧光越亮反而数值越小):Edit>Invert(热键为Ctrl+Shift+I)5、校正光密度(软件默认为测量灰度,因此我们要改为更加适用的光密度,其中原理不是一两句话能说得清的,这里忽略):Analyze>Calibrate在弹出来的界面的Function选择Uncalibrated OD,并下界面左下方勾选Global calibration,然后点击右下角的OK点击OK后会跳出校正后的光密度曲线:如不勾选Global calibration,光密度的校正只对这张图片有效,一般分析都要分析多张图片,所以需要勾选,勾选后在打开另一图片时会提示是否将此校正应用于所有图片,不勾选Disable Global Calibration,勾选Disable these Messages6、选择测量单位(一般选择象素,如有明确的比例,也可以选择相应单位):Analyze>Set scale点击后在弹出的界面里点击中间的click to Remove Scale,并勾选下面的Global(同样的,如不选Global这个测量单位的选择只对这张图片有效),最后点击OK7、选择测量项目:Analyze>Set Measurements在弹出界面中选择我们需要测量的项目Area、Integrated density,并勾选下面的Limit to threshold (这个选项是指只测量我们选中的范围,如不勾选侧会测量整张图片数据),选择后点击OK8、选择测量域值:Image>Adjust>Threshold(热键为Ctrl+Shift+T)滑动弹出界面中间的滑块选择适合的域值,以使的你图片中的细胞或待测目标刚好全部被选中,选好之后点击右下角的Set在弹出来的界面点击OK9、测量:Analyze>Measure(热键为Ctrl+M或直接按M)10、记录数据并计算:结果中的Area为选择范围的面积,如果是测量的是细胞的话就是细胞在图中的面积;IntDen就是所选范围的IOD(光密度的总和)。
软件Image J使用教程

作图软件:Image J介绍:该软件可以计算选定区域内分析对象的一系列几何特征,分析指标包括:长度,角度,周长,面积,长轴,短轴,圆度等。
参考:解螺旋-套路课01-第三章-第3节两种应用:免疫组化定量分析,计数免疫组化定量分析3种方法:手动、自动1、自动2【1】手动定量1.打开图片File –open –找到图片2.选择完所有阳性结果后,再同一进行计算Analyze –tools –ROI manger(感兴趣区域)然后标签栏选择第3个标签(以任意形状选取感兴趣区域)【2】自动定量11. 打开图片File –open –找到图片2. 彩图转换为8bit灰度图Image –type –8-bit3. 设定阈值Image –adjust –threshold系统会自动设定一个阈值,并将阈值之上的面积进行统计,此时打开免疫组化原始图片,手动调节阈值大小,当我们设定的阈值能够比价好的反应免疫组化的生物学意义时,就使用此时的阈值统计4. 统计Analyze –measure得到4个参数:area(阳性区域总面积),mean(平均光密度),min(最小光密度),max(最大光密度),后续作图用。
【3】自动定量21. 打开图片File –open –找到图片2. 彩图转换为RGBImage –type –RGB stack在得到的图片中,通过拖动下方的进度条,选取对比度最显著的那张3. 设定阈值Image –adjust –threshold系统会自动设定一个阈值,并将阈值之上的面积进行统计,此时打开免疫组化原始图片,手动调节阈值大小,当我们设定的阈值能够比价好的反应免疫组化的生物学意义时,就使用此时的阈值统计4. 统计Analyze –measure得到4个参数:area(阳性区域总面积),mean(平均光密度),min(最小光密度),max(最大光密度),后续作图用。
计数例如:克隆形成实验定量分析两种方法:手动计数、自动计数【1】手动计数1. 打开图片File –open –找到图片2. 点击工具栏第7个按钮“多点计数工具”在每个克隆上进行点击,每点一下,图上就会多一个软件加上的点3. 所有的点都选上之后,点击analyze –measure软件会生成一个结果图拉到最下面,就可以看到一共有多少点【2】自动计数1. 打开图片File –open –找到图片2. 彩图转换为8bit灰度图Image –type –8-bit3. 设定本张图中最大克隆和最小克隆设置最大克隆:点击工具栏第3个按钮,然后圈出本图中最大的克隆,再analyze –measure,看这个克隆的面积,例如area = 276设置最小克隆:点击工具栏第3个按钮,然后圈出本图中最小的克隆,再analyze –measure,看这个克隆的面积,例如area = 544. 设定阈值Image –adjust –threshold系统会自动设定一个阈值,并将阈值之上的面积全部用红色标记如果不合适,可手动调节因为阴影的存在,软件把这些阴影也识别为阳性结果,我们需要通过对克隆大小的限定,从而将阴影排除在阳性结果之外5. 通过对克隆大小的限定,从而将阴影排除Analyze –analyze particles在size(pixel^2)处填入克隆的大小范围,结合第3步的结果设置:30---300,点击“OK”这样,阴影就被排除了6. 拉到最低,便可以看到克隆的数量。
image j中文使用方法
ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
step 1.首先打开软件后,开启图档ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
step 1.首先打开软件后,开启图档step 2.请先做校正,选择Analyze底下的Calibrate选项,再选择校正的模式,使用Uncalibrate OD,再按ok按下ok之后会出现校正的图形Step 3.在要分析的第一条(first lane)加上一个长型框(工具列第一个选项),再按下Analyze/Gels/select first Lane快速键(Ctr+1),此时框架中会出现一个号码1,之后可以移动框架到第二个lane再选择Analyze/Gels/select second Lane快速键(Ctr+2),当然可以一直加下去,最后按Analyze/Gels/plot Lanes快速键(Ctr +3)。
Step 4.分析以后会出现图型表示你刚选择的框内的影像强度,此时可以看到有几个比较高的区段,就是我们想定量的band,使用直线工具(工具列第五个选项)先将图形中高点为有band的区域和没有band的区域分开再,使用魔术棒工具(工具列第八个选项)点选要分析的区域。
Step 5.当我们点选分析时,在result的对话视窗会出现分析的数据,依序点选就会出现每个band的值。
注:当我们选择分析的条带也可以是横向选取,就可以只比较相同大小的DNA 的含量,同样也可以应用在western blot或其它类似实验条带的分析上。
使用ImageJ 分析图像中的颗粒数[] 原创教程,转载请保留此行1,到本站资料下载-实用小工具栏目下载 ImageJ 并安装。
2,打开ImageJ并打开要分析的图片。
请看演示图片。
3,把图像二值话或者设定阈值。
选择Image - Adjust - Threshold...根据提示设定你需要的阈值。
imagej基本操作

imagej基本操作
ImageJ是一个强大的图像处理软件,以下是其基本操作:
1. 打开图像:选择“File”菜单中的“Open”选项,然后选择要打开的图像文件。
2. 图像显示:在“Display”菜单中选择不同的颜色通道或颜色模式来显示图像。
3. 调整图像大小:选择“Image”菜单中的“Resize”选项,然后输入新的图像大小。
4. 裁剪图像:选择“Edit”菜单中的“Crop”选项,然后选择要裁剪的区域。
5. 调整亮度/对比度:选择“Image”菜单中的“Adjust”选项,然后选择“Brightness/Contrast”进行调整。
6. 滤镜处理:选择“Process”菜单中的“Filter”选项,然后选择不同的滤镜进行处理。
7. 测量工具:选择“Analyze”菜单中的“Measure”选项,然后选择要测量的长度、角度等参数。
8. 绘制线条或标记:选择“Draw”或“Label”工具,然后在图像上绘制线条或标记。
9. 保存图像:选择“File”菜单中的“Save As”选项,然后选择要保存的文件格式。
10. 退出程序:选择“File”菜单中的“Exit”选项,然后保存所有未保存的更改。
以上仅是ImageJ的基本操作,它还有更多高级功能和工具,可以进一步探索并掌握。
免疫荧光双标操作方法及注意事项

免疫荧光双标操作方法及注意事项在同一组织细胞标本上需要同时检测两种抗原时,需进行双重荧光染色。
双重免疫荧光标记法(double immunofluorescence labeling method) 也分为直接法和间接法。
(1) 直接法双重免疫荧光标记:将标记有两种不同荧光素的抗体( 如抗 A 和抗 B) 以适当比例混合,滴加在标本上孵育,然后洗去未结合的荧光抗体,在荧光显微镜下分别选择两种相应的激发滤片观察,即可对两种抗原进行定位和定量。
直接法简便可靠,但灵敏度较低。
(2) 间接法双重免疫荧光标记:用未标记的两种特异性第一抗体孵育组织或细胞,洗去多余的第一抗体后,再用两种不同的荧光素分别标记的第二抗体孵育组织或细胞,洗去多余的第二抗体,后在荧光显微镜下分别选择两种相应的激发滤片观察,从而对两种抗原进行定位和定量。
使用此法应注意两种特异性第一抗体必须来源于不同种属,且荧光标记第二抗体的种属必须与第一抗体的种属相匹配。
免疫荧光双标技术中操作要点和注意事项一、免疫荧光技术中标本制作的基本程序近似于酶免疫组化,不同点如下:1、免疫荧光不需要使用双氧水处理,封闭和一抗孵育与其相同。
2、免疫荧光的二抗使用不同荧光标记的二抗孵育,孵育时间根据抗体的工作浓度确定。
3、二抗孵育之后充分洗片后即可贴片、封片和观察。
4、免疫荧光在封片时常使用专用封片剂或甘油: 0.01M PBS (1 :1)。
条件许可,建议购买抗淬灭的封片液,使标本可以保存更久。
5 、荧光抗体的孵育以及后续处理需要避光。
6 、荧光抗体染色假阳性可能会多,需要分别设定阳性和阴性对照。
二、注意事项1、荧光染色后一般在 1h 内完成观察,或于4℃保存 4h ,时间过长,可能会使荧光提前衰退。
2 、每次试验均需设置以下三种对照:(1) 阳性对照:阳性血清 +荧光标记物 ;(2) 阴性对照:阴性血清 +荧光标记物 ;(3) 荧光标记物对照: PBS+ 荧光标记物。
