初三化学第十单元酸和碱知识点总结(4月2日)
中考化学第十单元常见的酸和碱知识点总结

第十单元酸和碱课题一常见的酸和碱1.酸碱指示剂(简称:指示剂)能跟酸或碱的溶液起作用而显示不同的颜色。
常见的有:石蕊溶液、酚酞溶液。
2.变色规律:石蕊溶液遇酸溶液变成红色,遇碱溶液变成蓝色。
酚酞溶液遇酸溶液不变色,遇碱溶液变成红色。
3.二氧化碳通入紫色的石蕊试液中,(1).溶液由紫色变成红色。
(2).二氧化碳溶于水生成了碳酸,是碳酸改变了溶液的颜色,而不是二氧化碳使紫色石蕊溶液变色。
4.用酸碱指示剂检验溶液的酸碱性的方法:(1)取少量该溶液,滴入几滴石蕊试液,若溶液呈现红色,则说明该溶液为酸性溶液。
(2)取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;或者滴入几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液注意:1.是酸碱使指示剂变色,而不是指示剂使酸碱变色2.使石蕊溶液呈红色的是酸性溶液,酸性溶液不一定是酸,例如NaHSO4考点二、常见的酸盐酸、硫酸、硝酸在水溶液中都解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。
我们把在水溶液中能解离出唯一的阳离子(H+)的化合物叫做酸。
1、浓盐酸、浓硫酸的物理性质、特性、用途浓盐酸浓硫酸颜色、状态“纯净”:无色液体工业用盐酸:黄色(含Fe3+)无色粘稠、油状液体气味有刺激性气味无特性挥发性(挥发出氯化氢气体)(敞口置于空气中,瓶口有白雾)吸水性脱水性腐蚀性用途①金属除锈②制造药物③人体胃中含有少量盐酸,助消化①金属除锈②浓硫酸作干燥剂③生产化肥、精炼石油注意:①浓盐酸密封保存的原因:浓盐酸具有挥发性,易挥发出氯化氢气体。
浓硫酸密封保存的原因:浓硫酸具有吸水性,易吸收空气中的水蒸气。
②浓盐酸在空气里会形成白雾,这是因为从浓盐酸里挥发出来的氯化氢气体跟空气里的水蒸气接触,形成盐酸小液滴的缘故。
③浓盐酸敞口放置在空气中一段时间后,溶质、溶液质量减少,溶剂质量不变,溶质质量分数减少。
④浓硫酸敞口放置在空气中一段时间后,溶质质量不变,溶剂、溶液质量增加,溶质质量分数减少。
人教版九年级下册化学第十单元酸和碱知识点总结
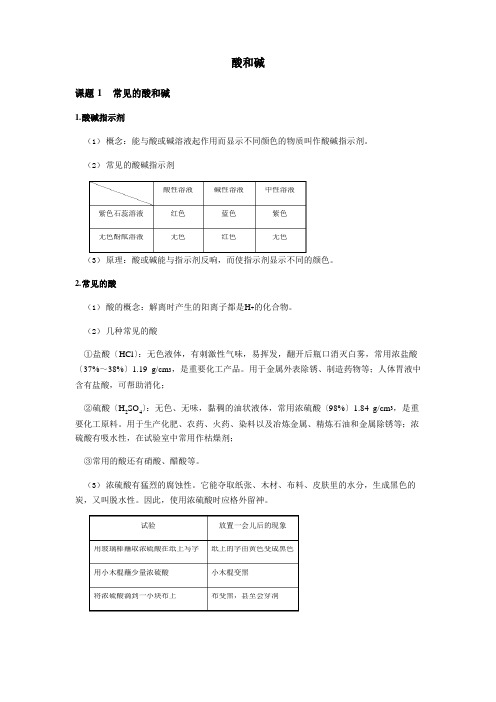
4酸性溶液碱性溶液 中性溶液 紫色石蕊溶液红色 蓝色 紫色 无色酚酞溶液 无色 红色 无色试验放置一会儿后的现象 用玻璃棒蘸取浓硫酸在纸上写字纸上的字由黄色变成黑色 用小木棍蘸少量浓硫酸小木棍变黑 将浓硫酸滴到一小块布上 布变黑,甚至会穿洞酸和碱课题 1 常见的酸和碱1. 酸碱指示剂(1) 概念:能与酸或碱溶液起作用而显示不同颜色的物质叫作酸碱指示剂。
(2) 常见的酸碱指示剂(3) 原理:酸或碱能与指示剂反响,而使指示剂显示不同的颜色。
2. 常见的酸(1) 酸的概念:解离时产生的阳离子都是H +的化合物。
(2) 几种常见的酸①盐酸〔HCl 〕:无色液体,有刺激性气味,易挥发,翻开后瓶口消灭白雾,常用浓盐酸〔37%~38%〕1.19 g/cm 3,是重要化工产品。
用于金属外表除锈、制造药物等;人体胃液中含有盐酸,可帮助消化;②硫酸〔H 2SO 〕:无色、无味,黏稠的油状液体,常用浓硫酸〔98%〕1.84 g/cm 3,是重要化工原料。
用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等;浓硫酸有吸水性,在试验室中常用作枯燥剂;③常用的酸还有硝酸、醋酸等。
(3) 浓硫酸有猛烈的腐蚀性。
它能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭,又叫脱水性。
因此,使用浓硫酸时应格外留神。
42 2 2 2 2(4) 浓硫酸的稀释:稀释浓硫酸时,确定要把浓硫酸沿器壁渐渐注入水里,并用玻璃棒 不断搅拌。
假设将水注入浓硫酸,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出的热能使水马上沸腾,使硫酸液滴向四周飞溅。
假设不慎将浓硫酸沾到皮肤或衣服上,应马上 用大量水冲洗,然后涂上 3%~5%的碳酸氢钠溶液。
3. 酸的化学性质①与酸碱指示剂作用:能使紫色石蕊溶液变红,使无色酚酞溶液不变色;②与活泼金属反响: Mg+2HCl =MgCl 2+H 2↑; Mg+H 2SO 4=MgSO 4+H 2↑; Zn+2HCl = ZnCl 2+H ↑;Zn+H SO =ZnSO +H ↑;Fe+2HCl =ZnCl +H ↑;Fe+H SO =FeSO +H ↑;③与金属氧化物反响:Fe 2O 3+6HCl =2FeCl 3+3H 2O ;Fe 2O 3+3H 2SO =Fe 2(SO 4)3+3H 2O 。
人教版九年级化学下册第十单元课题一常见的酸和碱知识点总结笔记

第十单元酸和碱课题一、常见的酸和碱一、酸、碱、盐的组成及其电离方程式:1、【酸==H++酸根离子】如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、CH3COOH(醋酸,又名乙酸)、碳酸(H2C O3) HCl = H+ + Cl-,H2SO4 = 2H+ + SO42-HNO3 = H+ + NO3-H 2C O3= 2H+ + C O32-CH3COOH = CH3COO-+ H+2、【碱==金属阳离子/ NH4++ OH-】如:KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)KOH = K++ OH-NaOH = Na++ OH-Ca(OH)2= Ca2++ 2OH-Ba(OH)2 = Ba2++ 2 OH-NH3·H2O=NH4++ OH-3、【盐==金属阳离子/ NH4++酸根离子】如:氯化钠NaCl、碳酸钠Na2CO3、硫酸铜CuSO4硝酸钡Ba(NO3)2 硫酸铵(NH4)2SO4 硫酸铁Fe2(SO4)3NaCl = Na++Cl-Na2CO3 =2Na++CO32-CuSO4 =Cu2++ SO42-Ba(NO3)2 = Ba2++2NO3-(NH4)2SO4 = 2NH4+ + SO42- Fe2(SO4)3= 2Fe3++ 3SO42-【小结:因为酸、碱、盐的水溶液都能离解成自由移动的阴、阳离子,所以它们的水溶液都能导电】二、酸碱指示剂●定义:像石蕊、酚酞溶液一样能跟酸或碱的溶液起作用而显示不同颜色的物质叫做酸碱指示剂。
●在氨分子运动、CO2与水的反应等实验探究中我们分别用过紫色石蕊溶液和无色酚酞溶液。
●某些植物的花瓣或果实(如牵牛花、月季花、紫卷心菜等)也可用作酸碱指示剂。
●紫色石蕊溶液遇酸溶液(含H+)变红,遇碱溶液(含OH-)变蓝,在中性溶液中呈紫色。
无色酚酞溶液遇酸溶液不变色,在中性溶液中不变色,遇碱溶液变红。
初三化学《酸和碱的反应》知识点总结

初三化学《酸和碱的反应》知识点总结课题1常见的酸和碱一、酸、碱、盐1、酸:阳离子只含氢离子的化合物。
生活中常见的酸有:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、碳酸(H2CO3)、醋酸(CH3COOH)等,一般说酸时写名称不写化学式。
2、碱:阴离子只含氢氧根离子的化合物。
生活中常见的碱有:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3.H2O)等。
3、盐:由金属(或铵根)离子和酸根离子构成的化合物。
如:氯化钠(食盐)[NaCl]、硫酸铜(CuSO4)、碳酸钙(CaCO3)等。
4、能够导电的物质:酸、碱、盐的水溶液,金属,石墨等。
(金属能导电是因为其中存在自由移动的电子;酸、碱、盐溶液能导电是因为有自由移动的离子。
二、酸碱指示剂1、酸碱指示剂(简称指示剂):是指与酸性或碱性溶液作用而显示不同顔色的物质。
2、常见的指示剂有紫色石蕊溶液和无色酸酞溶液;紫色石蕊遇酸变红,遇碱变蓝;无色酚酞遇碱变红,遇酸不变色。
三、生活中常见的酸1、盐酸(HCl):氯化氢气体的水溶液,人的胃液中含有盐酸。
⑴、物理性质:纯净的盐酸是无色,有刺激性气味和酸味的液体,工业盐酸因含有杂质而略带黄色。
⑵、浓盐酸有挥发性,打开浓盐酸瓶盖后瓶口有白雾是因为挥发出的氯化氢气体与空气中水蒸气结合形成的盐酸小液滴。
盛放浓盐酸的试剂敞口放臵会导致溶液质量减少,溶质质量分数变小。
⑶、盐酸是重要的化工产品,用途:①、金属表面除锈、②、制造药物、③、胃液中的盐酸可帮助消化。
2、硫酸(H2SO4):汽车的铅蓄电池中含有盐酸。
⑴、物理性质:纯净的浓盐酸是无色、粘稠、油状的液体,不易挥发,有酸味。
⑵、浓硫酸:①、有很强的吸水性,常用作某些气体的干燥剂;将盛放浓硫酸的容器敞口放臵其溶液质量会增加,溶质质量分数会减小,是因为浓硫酸吸收空气中的水蒸气使溶剂质量增加。
②、浓硫酸有很强的腐蚀性(脱水性),能夺取纸张、木材里的水分,生成黑色的炭,使用时要十分小心。
人教版九年级下册化学第十单元 酸和碱 总复习知识点总结

第十单元酸和碱课题1 常见的酸和碱1、酸、碱、盐、的定义及举例:①酸:酸由氢离子和酸根组成的如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)。
②碱:碱是由金属离子和氢氧根组成的化合物如:氢氧化钠(NaOH)、氢氧化钙Ca(OH)2 、氨水(NH3·H2O)。
③盐:由金属离子(或铵根)和酸根组成的化合物一定是盐如:氯化钠(NaCl)、碳酸钠(Na2CO3)、氯化铵(NH4Cl)。
2、酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)。
3、拓展:酸、碱、盐、的定义电离:氯化钠(NaCl)溶解在水时,产生了能够自由移动的钠离子(Na+)和氯离子(Cl-)的过程称为电离。
可用电离方程式表示:NaCl == Na+ + Cl- (也要配平)①酸是电离时生成的阳离子全部都是氢离子(H+)的化合物。
但碳酸氢钠NaHCO3不是酸,因为NaHCO3 ==Na+ + H++ CO32-电离时生成的阳离子不是全部是氢离子。
②碱是电离时生成的阴离子全部都是氢氧根离子(OH-)的化合物。
但碱式碳酸铜Cu2(OH)2CO3不是碱,因为Cu2(OH)2CO3 == 2Cu2+ + 2 OH- + CO32-电离时生成的阴离子不是全部是氢氧根离子。
③盐是电离时生成金属离子(或铵根)和酸根离子的化合物。
碳酸氢钠NaHCO3、碱式碳酸铜Cu2(OH)2CO3也是盐,因为电离时只要有金属离子和酸根离子的化合物就是盐。
4、酸碱指示剂变色规律:石蕊溶液遇酸溶液变红色,遇碱溶液变蓝色;酚酞溶液遇酸溶液不变色,遇碱溶液变红色。
中性(大多盐如NaCl)溶液遇石蕊、酚酞溶液均不变色。
5、盐酸的物理性质、用途:“纯净”的盐酸是混合物,是无色有刺激性气味的液体,打开浓盐酸瓶盖有白雾(不是白烟)产生,说明盐酸具有挥发性,这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中的水蒸气接触,形成了盐酸的小液滴。
工业盐酸因含有铁离子而呈黄色。
人教版九年级化学 第十单元 酸和碱 知识点(原创)

第十单元酸和碱知识点1:酸碱指示剂1.定义:能跟酸或碱的溶液起作用而显示不同颜色的物质,叫做酸碱指示剂(简称指示剂)。
2.常用的指示剂有紫色石蕊溶液和无色酚酞溶液等。
3.酸碱指示剂与酸碱性溶液的反应4.注意①酸碱指示剂与酸或碱溶液反应时,变色的是酸碱指示剂,不是酸或碱溶液。
如我们可以说盐酸使石蕊溶液变红,而不能说石蕊溶液使盐酸变红。
②酸碱指示剂只能判断溶液的酸碱性,不能确定溶液中的溶质一定是酸或碱。
如Na2CO3不是碱但显碱性,也能使无色酚酞溶液变红。
为了方便还可用蓝色或红色石蕊试纸来检验溶液的酸碱性。
③不溶性的酸或碱不能使指示剂变色。
如:氢氧化铜Cu(OH)2(不溶于水),就不能使酸碱指示剂变色。
④酸碱指示剂是从植物的花瓣或果实中提取的浸出液,只要在不同的酸性或碱性溶液中能显示不同的颜色,都可作酸碱指示剂。
知识点2:常见的酸一、浓盐酸、浓硫酸的物理性质、特性、用途1.盐酸和硫酸的物理性质和用途①浓盐酸能在空气中形成白雾的原因:浓盐酸有挥发性,挥发出的氯化氢气体与空气中水蒸气结合成盐酸小液滴。
浓盐酸有挥发性,应密封保存。
②实验室和化工生产中常用硝酸(HNO3)、醋酸(CH3COOH)等。
生活中常见的酸:食醋中含有醋酸;柠檬、柑橘等水果中含有柠檬酸;除锈剂中含有盐酸,汽车用铅蓄电池中含有硫酸。
2.浓硫酸的特性①吸水性(物理性质):浓硫酸具有吸水性,常用来做气体的干燥剂,干燥不和它反应的气体。
(液体干燥剂)由于浓硫酸有吸水性,能够吸收空气中的水蒸气而变稀,所以浓硫酸应密封保存。
②腐蚀性(脱水性)(化学性质):浓硫酸具有强烈的腐蚀性,它能夺取纸张、木柴、布料、皮肤里的水分,生成黑色的炭。
所以使用浓硫酸时应十分小心。
③如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
3.浓硫酸的稀释①方法:一定要将浓硫酸沿器壁慢慢注入水里,并不断搅拌。
切不可将水倒入浓硫酸。
②原因:如果将水注入浓硫酸中,浓硫酸的密度比水大,且溶于水时放出大量的热,水会浮在浓硫酸的上面,溶解时放出的热能使水立刻沸腾,使硫酸液滴向四周飞溅。
九年级化学下册“第十单元 酸和碱”必背知识点

九年级化学下册“第十单元酸和碱”必背知识点一、酸和碱的定义1. 酸:电离时生成的阳离子全部是氢离子的化合物。
例如,盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)等。
2. 碱:电离时生成的阴离子全部是氢氧根离子的化合物。
例如,氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氨水(NH3·H2O)等。
二、酸和碱的性质1. 酸碱指示剂无色酚酞:遇酸不变色,遇碱变红色。
紫色石蕊:遇酸变红色,遇碱变蓝色。
2. 酸的通性1. 与指示剂作用:使紫色石蕊变红,无色酚酞不变色。
2. 与活泼金属反应:生成盐和氢气。
例如,Zn + H2SO4 = ZnSO4 + H2↑。
3. 与金属氧化物反应:生成盐和水。
例如,Fe2O3 + 6HCl = 2FeCl3 + 3H2O。
4. 与碱反应:生成盐和水 (中和反应)。
例如,NaOH + HCl = NaCl + H2O。
5. 与某些盐反应:生成新盐和新酸(复分解反应)。
例如,AgNO3 + HCl = AgCl↓+ HNO3。
3. 碱的通性1. 与指示剂作用:使紫色石蕊变蓝,使无色酚酞变红 (仅限于可溶性碱)。
2. 与酸性氧化物反应:生成盐和水。
例如,2NaOH + CO2 = Na2CO3 + H2O。
3. 与酸反应:生成盐和水 (中和反应)。
例如,NaOH + HCl = NaCl + H2O。
4. 与某些盐反应:生成新碱和新盐(复分解反应)。
例如,2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓。
三、酸碱度的表示方法——pH1. 定义:pH是表示溶液酸碱性强弱的一种指标。
2. 测定方法:使用pH试纸。
将少量待测液滴在干燥的pH试纸上,再与标准比色卡对照,读出溶液的pH值。
3. 范围与意义:pH = 7,溶液呈中性。
pH < 7,溶液呈酸性;pH越小,酸性越强。
pH > 7,溶液呈碱性;pH越大,碱性越强。
四、酸碱反应的应用1. 中和反应:酸和碱作用生成盐和水的反应。
第十单元酸和碱知识点总结

第十单元酸和碱知识点总结【篇一:第十单元酸和碱知识点总结】初三化学第十单元酸和碱知识点汇总 1.(1) 常见的酸:常见的碱: (2)常见酸的物理性质及用途:物理性质盐酸(hcl) 浓盐酸是体,具有冒。
色、有气味的液性,在空气中用途硫酸 (h2so4)浓硫酸是、有性和时。
、液体,性,溶于水(3).如何稀释浓硫酸: 2.酸的通性:①酸能使石蕊溶液显示色使无色酚酞溶液显示②酸能与多种活泼金属反应,生成氢气;与稀盐酸反应镁\铝锌\铁与稀硫酸反应③酸能与某些金属氧化物反应,生成水。
铁锈盐酸硫酸 3. (1)常见碱的物理性质及用途:俗名氢氧化钠(naoh)氢氧化钙 (ca(oh)2) 氢氧化钙制取:(反应放出大量的热)某些物质暴漏在空气中时容易吸水,使表面潮湿并逐渐溶解,这种现象叫做。
(2)碱的通性:①碱能使石蕊溶液显示色使无色酚酞溶液显示色;②碱能与某些非金属氧化物反应,生成水。
naoh+co2==== naoh+so2==== naoh+so3==== ca(oh)2+co2 氢氧化钠的保存方法。
原因:易吸收水分潮解;能与空气中的co2 反应。
物理性质用途氧化铜【篇二:第十单元酸和碱知识点总结】初三化学第十单元酸和碱知识点总结1、石蕊试液和酚酞试液叫做,通常也简称,它们能和酸或碱的溶液起作用而显示不同的颜色。
石蕊溶液色,遇酸溶液变成色,遇碱溶液变成色;酚酞试液色,遇酸溶液 3、酸雨的主要成分是;胃酸就是;盐酸是气体溶于水的溶液。
4、打开装有浓盐酸的瓶盖,可看见,这说明盐酸有,所以如果浓盐酸敞口放置在空气中,其质量会,质量分数会 5、浓硫酸有,所以可用来做某些气体的干燥剂。
6、用玻璃棒蘸浓硫酸在纸上写字,放置一会儿会看到。
这是因为浓硫酸具有强烈的7、在稀释浓硫酸时,一定要把沿着慢慢地注入,并不断 8、如果不慎将浓硫酸沾到皮肤或衣服上,应立即,然后涂上9、稀盐酸的用途:用于金属、制造(如盐酸麻黄素、氯化锌)等;人体胃液中有,可帮助消化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
仪器名称:①U型管②干燥管③洗气瓶(“多功能瓶”)④硬质玻璃管
pH:10~11)
株洲市)一些物质在常温下的近似
12.(2013.北京市)下列物质质量置于空气中,一段时间后,质量减小的是()A.碳酸钙B.氯化钠C.浓盐酸D.氢氧化钠
13.(2013•扬州)盛有下列物质的烧杯敞口放置在空气中一段时间,总质量会减轻的是( )
A. 氢氧化钠
B. 浓盐酸
C. 浓硫酸
D. 生石灰
14.(2013.苏州市)下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而增大的是()
A.浓盐酸B.氯化钾溶液C.浓氨水D.氢氧化钠溶液
15.(2013.荆门市)某NaOH固体样品,可能含有固体KOH和不溶于酸的杂质A,取5.6g 该样品与100g一定质量分数的稀盐酸反应,两者恰好完全反应,生成m g水。
下列说法正确的是()
A.若样品不含任何杂质,则m<1.8
B.若m=1.8,则样品中一定含有杂质A,可能含有固体KOH
C.若m=1.8,则样品中至少含有杂质A或固体KOH的一种
D.若样品中不含A,则盐酸的溶质质量分数不小于7.3%
16.(2013.日照市)某些金属氢化物与水反应可生成碱和氢气,如:NaH + H2O=NaOH
+ H2 ↑。
CaH2与足量Na2CO3溶液之间发生反应的产物有()
A.Ca(OH)2 和H2B.CaCO3、NaOH和H2
C.NaOH和Ca(OH)2D.Ca(OH)2、CaCO3和H2
三:图像解析题(上点档次喔)
17.(2013.泰安市)下列图像不能正确反映对应变化关系的是()
18.(2013.苏州市)向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是()
A、在某温度下,向一定量接近饱和的硝酸钾溶液中,不断加入硝酸钾晶体
B、向NaOH溶液中滴中稀盐酸至过量
C、用相等质量的双氧水来制取氧气
D、电解水生成氢气和氧气
21.(2013.北京市)下列四个图象中,能正确反应对应变化关系的是()22.(2013.日照市)向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加
A.向一定量稀硫酸中滴入水B.向一定量纯碱和烧碱的混合溶液中滴入盐酸C.一定温度时向一定量饱和石灰水中加入氧化钙
.在氢氧化钠溶液中:
.在硫酸铵溶液中:Na
娄底市)小红对某无色溶液所含溶质的记录,合理的是(
能得到无色透明溶液的是
(4)①反应开始前通入氮气的目的是 。
,。
0 200 400 600 800 1000
12.814.65.60。
