第九章固体结构PPT课件
第九章固体结构PPT课件

AB型:NaCl型
晶格:面心立方 配位比:6:6
.
24
氯化钠的晶格扩展
.
25
(2) 氯化铯的晶体结构
AB型:CsCl型
晶格:简单立方 配位比: 8:8
.
26
(3) 硫化锌的晶体结构
AB型: ZnS型
晶格: 面心立方 配位比: 4:4
.
27
其它类型的离子晶体
AB2型:CaF2的结构
离子半径的概念在预言物质性质、判断矿物中离子相互取 代等方面十分有用,但使用时要注意选用同一套数据,不 能将来源不同的数据混用。
形成离子晶体时只有当正、负离子紧靠在一起,晶体才能 稳定。离子能否完全紧靠与正. 、负离子半径之比r+/r-有关。29
半径比(r+/r-)规则:
(4r)22(2r2r)2
+ e- + e-
e- e- e-
+ e-
e- + e-
e-
e-
+
+
+
+
e- e-
+ e- +
e- e-
e-
++金属键的电子海模型(碱金属)
.
18
二、金属晶体的结构
❖ 1.金属晶体的定义
金属原子或离子彼此靠金属键结合而成的晶体。
❖ 2.金属晶体的特点
有金属光泽,能导电、传热,富有延展性等。
❖ 3.金属晶体中粒子的排列方式
❖1.晶格能的定义
在标准状态下,按下列化学反应计量式使离子晶体 变为气态正离子和气态负离子时所吸收的能量。
M a X b ( s ) ab M g ba X g
中药化学九单元结晶PPT课件

•
也称为饱和浓度。
•
该状态的溶液称为饱和溶液。
•
• 影响物质的溶解度的因素: • 物质的化学性质 • pH值 • 温度 • 溶剂的种类 • 溶剂的组成 • 离子强度
•
•
当某一物质在特定的溶剂中溶解时,
其溶解度主要随pH值、温度而变化。
•
大多数物质的溶解度随温度的升高
而增大。
•
也有一些物质对温度不敏感。
•
ln C / C* =2Mσ/ RTρr =lnS
• 过饱和度与颗粒大小的关系:
•
过饱和度越大,颗粒直径越小。
•
若某溶液中同时存在大小不同的诸
多颗粒,则经过一段时间之后,小颗粒溶
质逐渐消失,而大颗粒溶质逐渐粗大整齐,
这就是结晶操作中的养晶过程。
• 过饱和溶液的形成
•
结晶的首要条件是溶液处于过饱和状态,
(1)晶体的自范性。
晶体具有自发地生长成为结晶多 面体的可能性,即晶体常以平面作为与周 围的分界面,这种性质称为晶体的自范性。
•
晶体为化学性质均一的固体,且 具有规则的晶型。晶体在形成过程中,其 分子、原子或离子按一定方式排列,形成 有规则的多面体外形,称为结晶多面体。
• (2)晶体的均匀性
•
晶体中每一宏观质点的物理性质和
物质的分离与纯化。
•
重结晶的关键是选择适合的溶剂。
• 杂质产生的原因主要包括:
•
某些杂质与产物的溶解度相近,产生
共结晶现象;
•
有些杂质会被结合到产品的晶格中;
•
因洗涤不完全,而使晶体上带有母液
和杂质。
• 结晶操作:
• 溶剂的选择 • 操作过程 • 结晶条件的控制
§2.1 固体的微观结构

分析:从图上可以看出,沿不 同方向所画的等长直线 AB 、 AC 、 AD 上,晶体微粒的数目不同。正 因为在不同方向上晶体微粒的排列 情况不同,才引起晶体在不同方向 上物理性质的不同。
上一页 下一页 目 录
退 出
总之,晶体外形的有规则和它的各向异性都是由于晶 体内部结构有规则的缘故。非晶体内部的物质微粒的排列 是不规则的,由于微粒的数目非常多,平均起来,各个方 向的物理性质就相同了。
石英晶体
雪花晶体
上一页
下一页
目 录
退 出
2.物理性质 晶体在不同的方向上不仅导热性能不同,机械强度和 导电性能等其他物理性质也不同。也就是说,晶体内部的 物理性质与方向有关,这种特性叫做各向异性。 3.晶体可分为单晶体和多晶体 (1)如果整个物体就是一个晶体,这样的物体就叫做 单晶体。 (2)如果整个物体是由许多杂乱无章地排列着的小晶 体(晶粒)组成的,这样的物体就叫做多晶体,它没有规 则的几何形状,具有各向同性。
上一页
下一页
目 录
退 出
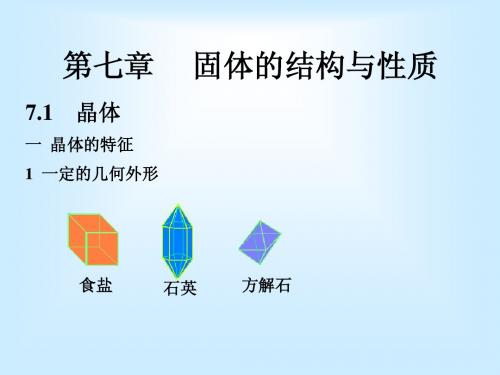
常见的固体中属于晶体的有:石英、云母、明矾、食 盐、硫酸铜等。
晶 体
非晶体
属于非晶体的有:玻璃、松香、沥青、橡胶等。
上一页 下一页 目 录
退 出
二、晶
体
1. 晶体的外形是有规则的几何形状
例如,食盐晶体的外形是呈立方体形,明矾的晶体是 八面体。
食盐结构示意图
食盐晶体
明矾晶体
上一页
下一页
目 录
退 出
石英晶体的中间是一个六面棱柱,两端是六面棱锥; 雪花晶体的形状虽然不同,但都具有六角形的规则图案。
上一页
下一页
目 录
退 出
四、晶体和非晶体存在差异的原因 主要是因为它们有不同的微观结构。
《固体物理教案》课件

《固体物理教案》PPT课件第一章:引言1.1 固体物理的重要性介绍固体物理在科学技术领域中的应用,如半导体器件、磁性材料等。
强调固体物理对于现代科技发展的关键性作用。
1.2 固体物理的基本概念定义固体物理的研究对象和方法。
介绍晶体的基本特征和分类。
1.3 教案安排简介本教案的整体结构和内容安排。
第二章:晶体结构2.1 晶体的基本概念解释晶体的定义和特点。
强调晶体结构在固体物理中的核心地位。
2.2 晶体的点阵结构介绍点阵的基本概念和分类。
讲解点阵的周期性和空间群的概念。
2.3 晶体的空间结构介绍晶体的空间结构描述方法。
讲解晶体中原子的排列方式和空间群的对称性。
第三章:晶体物理性质3.1 晶体物理性质的基本概念介绍晶体物理性质的分类和特点。
强调晶体物理性质与晶体结构的关系。
3.2 晶体介电性质讲解晶体的介电性质及其与晶体结构的关系。
介绍介电材料的制备和应用。
3.3 晶体磁性质讲解晶体的磁性质及其与晶体结构的关系。
介绍磁材料的制备和应用。
第四章:固体能带理论4.1 能带理论的基本概念介绍能带理论的起源和发展。
强调能带理论在固体物理中的重要性。
4.2 紧束缚模型讲解紧束缚模型的基本原理和应用。
介绍紧束缚模型的数学表达式和计算方法。
4.3 平面紧束缚模型讲解平面紧束缚模型的基本原理和应用。
介绍平面紧束缚模型的数学表达式和计算方法。
第五章:半导体器件5.1 半导体器件的基本概念介绍半导体器件的定义和特点。
强调半导体器件在现代电子技术中的重要性。
5.2 半导体二极管讲解半导体二极管的工作原理和特性。
介绍半导体二极管的制备和应用。
5.3 半导体晶体管讲解半导体晶体管的工作原理和特性。
介绍半导体晶体管的制备和应用。
第六章:超导物理6.1 超导现象的基本概念介绍超导现象的发现和超导材料的特点。
强调超导物理在凝聚态物理中的重要性。
6.2 超导微观理论讲解超导微观理论的基本原理,如BCS理论。
介绍超导材料的制备和应用。
2019-2020学年高二物理人教版选修3-3课件第九章 1_2固体液体

1~2 固体 液体
首页
自自主主预预习习 探究学习
随堂检测
(4)若某种液体浸润,那么它对所有固体都浸润。 ( ) 解析:同一种液体,对有些固体浸润,对有些固体不浸润,同一种固 体,可以被某些液体浸润,也可以不被另一些液体浸润。 答案:×
-12-
1~2 固体 液体
首页
自自主主预预习习 探究学习
没有确定的几何形 (1)有确定的熔点;
状
(2)物理性质上表现为各向同性
-18-
1~2 固体 液体
首页
自主预习 探究学习
随堂检测
探究一
探究二
探究三
2.晶体的微观结构与物理性质
(1)晶体结构。
①组成晶体的物质微粒有规则地在空间排列,呈现空间上的周期
性。
②晶体内部各微粒之间存在很强的相互作用力,结构不同、作用
-24-
1~2 固体 液体
首页
自主预习 探究学习
随堂检测
探究一
探究二
探究三
知识归纳 1.液体的微观结构 液体中的分子跟固体一样是聚集在一起的,液体分子的热运动主 要表现为在平衡位置附近做微小的振动,但液体分子只在很小的区 域内有规则地排列,这种区域是暂时形成的,边界和大小随时改变, 有时瓦解,有时又重新形成。液体由大量这种暂时形成的小区域构 成,这种小区域杂乱无章地分布着。
-4-
1~2 固体 液体
首页
自自主主预预习习 探究学习
随堂检测
二、晶体的微观结构 1.为什么晶体的形状和物理性质会与非晶体不同呢? 答案:因为它们具有不同的微观结构。 2.在各种晶体中,原子(或分子、离子)都是按照一定的规则排列 的,具有空间上的周期性。 3.有的物质在不同条件下可以形成不同的晶体,那是因为组成它 们的微粒能够按照不同规则在空间分布,例如石墨和金刚石。 4.同种物质也可能以晶体和非晶体两种不同的形态出现,有些非 晶体在一定条件下也可以转化为晶体,这说明物质是晶体还是非晶 体,并不是绝对的。
固体的结构与性质
二 晶体的内部结构 1 晶格 把晶体中规则排列的粒子看作几何点,叫作结点。 把晶体中规则排列的粒子看作几何点,叫作结点。将结点 按照一定方向和某种规则连接起来, 按照一定方向和某种规则连接起来,得到可以描述晶体内 部结构的空间格子,简称晶格。晶格有14种不同形状。 部结构的空间格子,简称晶格。晶格有 种不同形状。 种不同形状
晶体类型 结点上的粒子
离子晶体 正、负离 子
原子晶 体 原子 极性分 子
分子晶体 非极性分子
金属晶体 金属原子、 金属原子、金属 正离子(离子间隙 正离子 离子间隙 处有自由电子) 处有自由电子 金属键
结合力
离子键
共价键
性 质 特 征
熔、沸点 硬度 机械性能
较高 硬 脆
高 硬 不脆
分子间 力、氢 键 低 软 软
如,Na的3s1形成3s能带: Na的 形成3 能带:
(σ*3s) (σ3s)
能量较低的σ3s能带充满电子,称满带; 3s能带没 能量较低的σ3s能带充满电子,称满带;σ*3s能带没 σ3s能带充满电子 有电子,为空带,又称导带,在满带和导带之间有禁带。 有电子,为空带,又称导带,在满带和导带之间有禁带。
标准态下
Na+(g)+Cl-(g)
U=786kJ·mol-1
z1 z 2 U ∝ d
z:阴、阳离子所带电荷数 : d:核间距 :
对于晶体构型相同的离子晶体:离子所带电荷数越高、 对于晶体构型相同的离子晶体:离子所带电荷数越高、核 间距越短,晶格能越大,晶体越稳定。 间距越短,晶格能越大,晶体越稳定。 2 离子晶体的稳定性 晶格能越大,离子晶体越稳定,其熔点越高,硬度越大。 晶格能越大,离子晶体越稳定,其熔点越高,硬度越大。 思考:按熔点高低将下列物质排列: 思考:按熔点高低将下列物质排列:NaCl、MgO、CaO、KCl。 、 、 、 。 MgO > CaO >NaCl>KCl
固体结构全部优秀PPT

45°
65.1°
82.8
37
晶体的对称性
38
2.2金属的晶体结构
重点与难点:
1.三种典型金属晶体结构的晶体学特点;
2.晶体中的原子堆垛方式和间隙。
39
一、三种典型的金属晶体结构
最常见金属晶体结构
面心立方晶体结构
面心立方
A1或fcc(face-centred cubic lattice)
体心立方
20
原子是实在物体
21
晶向指数的求法及标定
第一种求法:
1) 确定坐标系
2) 过坐标原点,作直线与待求晶向平行;
3) 在该直线上任取一点,并确定该点的坐标(x,y,z)
4) 将此值化成最小整数u,v,w并加以方括号[u v w]即
是。
z
[101]
y
视频
o
x <100>晶向族
22
2.晶面指数( Miller Indices of Crystallographic Planes )
晶面指数为(233)
24
晶面指数不仅仅代表一个面,而是代表着一组相互平
行的晶面。
这两个面晶面指数相同吗?
晶面族:
晶体内凡晶面间距和晶面上原子的分布完全相同,
只是空间位向不同的晶面可以归并为同一晶面族,
以{hkl}表示。
它代表由对称性相联系的若干组等效晶面的总和。
对称性越高,所包括的晶面数越多!
固体结构全部
第二章 固体结构
气态(gas state)
物质(substance)
液态(liquid state)
晶体(crystal)
固态(solid state)
第九章 固态相变(一)

3.晶体缺陷的影响
固态相变时母相中的晶体缺陷对相变有促进作用,这是由 于缺陷处在晶格畸变,该处原子的自由能较高。形核时,原缺 陷能可用于形核,使形核功比均匀形核功降低,故新相易在母 相的晶界、位错、层错、空位等缺陷处形核。此外晶体缺陷对 组元的扩散和新相的生长也有很大影响。实验表明,母相的晶 粒越西,晶内缺陷越多,相变速度也越快。
脱溶分解、共析转变等
连续型相变:若在很大范围内原子发生轻微的重排,相变的 起始状态和最终状态之间存在一系列连续状态,不需形核, 靠连线涨落形成新相,这种相变为连续型相变。
调幅分解
按相变时是否获得符合状态图的平衡组织可将固态相变分 为平衡转变和非平衡转变;
根据相变过程中有无原子的扩散可以将固态相变分为扩散 相变、半扩散相变和非扩散型相变。
变晶核形状和共格性等降低形核阻力,使固态相变得以进行。
当新相和母相为共格界面时,界面能很低,相变阻力主要来
自应变能,为减少应变能,新相晶核应为圆盘状或针状。当
新相和母相为非共格界面时,若比热引起的应变能不大的情
况下,相变阻力主要来自界面能,为减少界面能,新相晶核
应为球形,以降低单位体积的表面积,减少界面能。
n级相变:相变过程中新旧两相自由焓的第(n-1)偏导数相等, 而其n阶偏导数不相等。
2. 按结构变化分类 按发生相变时新相与母相在晶体结构上的差异,可以将相 变分为重构型相变和位移型相变。
重构型相变——伴随化学键的破坏,新键的形成,原子重 新排列,新相和母相在晶体学上没有明确的位向关系。所 需要克服较高的能垒,相变潜热很大,相变进行缓慢。
5. 过渡相
过渡相是指成分和结构,或两者都处于新旧两相之间的 亚稳相。
这种情况通常发生在稳定相的成分与母相相差较远,转 变温度较低,原子扩散慢,稳定相的形核困难。钢中的渗碳 体其实也是铁碳平衡中的一过渡相。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
8
1. 面心立方密堆积:fcc
.
配位数 12
空间占有率 74%
9
2.六方密堆积:hcp
.
配位数 12
空间占有率 74%
10
3.体心立方堆积:bcc
.
配位数 8
空间占有率 68%
11
最密堆积层间的两类空隙 A 四面体空隙
B 八面体空隙
.
12
C 简单立方堆积所形成的空隙
.
13
四、晶体类型
金属晶体 离子晶体 分子晶体 层状晶体
六方密堆积(hcp),面心立方密堆积(fcc), 体心立方堆积(bcc)
.
19
用金属离子价层s和p轨道上的电子数目来判断金属原 子采用的堆积方式。若s,p电子数较少,容易出现体 心立方堆积, s,p电子数较多常出现面心立方堆积, 而s,p电子数居中则为六方密堆积。多晶现象。
常温下某些金属元. 素的晶体结构
.
16
一、金属键理论
金属键的定义:金属正离子在电子海中规则排 列,并靠自由电子的胶合作用构成金属晶体, 这种作用就是金属键。
金属键的特征:没有方向性。每个金属原子周 围总是有尽可能多的临近金属离子紧密地堆积 在一起,以使系统能量最低。金属晶体内原子 都以具有较高的配位数为特征。
.
17
金属键的理论模型——电子海模型
离子半径的概念在预言物质性质、判断矿物中离子相互取 代等方面十分有用,但使用时要注意选用同一套数据,不 能将来源不同的数据混用。
形成离子晶体时只有当正、负离子紧靠在一起,晶体才能 稳定。离子能否完全紧靠与正. 、负离子半径之比r+/r-有关。29
半径比(r+/r-)规则:
(4r)22(2r2r)2
z
c
a
b y
x
a, b, c, , , 晶胞参数
.
5
立方晶系(NaCl,ZnS)
a=b=c ===90°
.
6
三种典型立方晶体结构
简单立方
体心立方 面心立方
.
7
三、球的密堆积
密堆积:许多固体的微观结构可用球(代 表原子或离子)堆积描述。最简单的情况 是金属,金属单质的所有原子都相同,其 结构可看作等径圆球堆积,并且尽可能紧 密地堆积在一起形成密堆积结构。
AB2型:金红石的结构
.
28
ABX3型:钙钛矿的结构
❖ 4.离子半径与配位数
设想离子成球形,在离子晶体中正、负离子中心之间的距 离是正、负离子半径之和。离子中心之间的距离可以用X 射线衍射测出。
离子中心之间的距离与晶体构型有关。为了确定离子半径, 通常以NaCl构型的半径作为标准,对其他构型的半径再作 一定的校正。
.
14
离子晶体
晶格节 点粒子
粒子间 作用力
物理性质
熔沸点
硬度
熔融导 电性
例
离子 离子键 高
大
好 NaCl
原子晶体 原子 共价键 高
大
差
金刚 石
金属晶体
原子 离子
金属键
高 低
大 小
好
Cr, K
分子晶体 分子
分子间 力
低
小
差 干冰
.
15
第二节 金属晶体
一、金属键理论 二、金属晶体的结构 三、金属合金
20
第三节 离子晶体
一、离子键 二、离子晶体的结构 三、晶格能 四、离子极化
.
21
一、离子键
❖1.离子键的定义 正、负离子的静电作用。
❖2.离子键的特点
离子键没有方向性和饱和性。离子在晶体中常常趋 向于采取紧密堆积的方式,但不同的是各离子周围 接触的是带异号电荷的离子。一般负离子半径较大, 可把负离子看作等径圆球进行密堆积,而正离子有 序地填在四面体空隙和八面体空隙之中。
第一节 晶体结构和类型
一、晶格结构的特征 二、晶格理论 三、球的密堆积 四、晶体类型
一、晶格结构的特征
晶体:是由原子、离子或分子在空间按一 定规律周期性地重复排列构成的固体。
晶体结构的特征: ✓晶体具有规则的几何外形 ✓晶体呈现各向异性 ✓晶体具有固定的熔点
.
晶面夹角 守恒定律
2
三种晶体的熔点
金刚石
B汽 化 热r2 H ( l m ) ,3f 1 2mvap Hm(B2r,l)KBr(s)
升 华 焓
=
sub Hm
(1) 氯化钠的晶体结构
AB型:NaCl型
晶格:面心立方 配位比:6:6
.
24
氯化钠的晶格扩展
.
25
(2) 氯化铯的晶体结构
AB型:CsCl型
晶格:简单立方 配位比: 8:8
.
26
(3) 硫化锌的晶体结构
AB型: ZnS型
晶格: 面心立方 配位比: 4:4
.
27
其它类型的离子晶体
AB2型:CaF2的结构
+ e- + e-
e- e- e-
+ e-
e- + e-
e-
e-
+
+
+
+
e- e-
+ e- +
e- e-
e-
+
+
金属键的电子海模型(碱金属)
.
18
二、金属晶体的结构
❖ 1.金属晶体的定义
金属原子或离子彼此靠金属键结合而成的晶体。
❖ 2.金属晶体的特点
有金属光泽,能导电、传热,富有延展性等。
❖ 3.金属晶体中粒子的排列方式
食盐
.
干冰
3
二、晶格理论
晶格:是用点和线反映晶体结构的周期性, 是从实际晶体结构中抽象出来以表示晶体 周期性结构的规律。
晶胞:包括晶格点上的微粒在内的平行六面 体。它是晶体的最小重复单元,通过晶胞在 空间平移并无隙地堆砌而成晶体。
.
4
如果将三维空间以周期性的方式全部占满, 则仅有14种六面体是允许的,称之为14个布 拉维晶格。这14种六面体都是平行六面体, 按对称性划分,可分为7类,称为7个晶系。
r/r 0.414
配位比为6:6 NaCl晶体
.
30
离子半径比与配位数的关系
r / r 0.225→0.414 0.414→0.732 0.732→1.00
1.00
配位数 4 6 8
12
构型 ZnS 型 NaCl 型 CsCl 型 最密堆积
r/r 0.414最理想的稳定结构(NaCl)
.
31
三、晶格能(U)
.
22
二、离子晶体的结构
❖ 1.离子晶体的定义
靠正、负离子相互作用形成的离子键而组成的晶体。
❖ 2.离子晶体的特点
硬度大,熔点高,熔融后都能导电。❖Fra bibliotek3.离子晶体类型
AB型(NaCl、CsCl和ZnS),AB2型(萤石CaF2 和金红石TiO2),ABX3型(钙钛矿CaTiO3)。
.
23
三种典型的离子晶体
❖1.晶格能的定义
在标准状态下,按下列化学反应计量式使离子晶体 变为气态正离子和气态负离子时所吸收的能量。
M a X b ( s ) ab M g ba X g
❖2.晶格能的计算
.
32
(1)利用Born-Haber循环,计算晶格能
K(s) +
H m,1
1 2 1
H (KBrs,)
