2018年中考化学复习资料第07讲酸的性质(含解析)
2018初中化学方程式之酸的化学性质

2018初中化学方程式之酸的化学性质各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢新一轮中考复习备考周期正式开始,中考网为各位初三考生整理了中考五大必考学科的知识点,主要是对初中三年各学科知识点的梳理和细化,帮助各位考生理清知识脉络,熟悉答题思路,希望各位考生可以在考试中取得优异成绩!下面是《2018初中化学方程式之酸的化学性质》,仅供参考!酸+ 金属-------- 盐+ 氢气酸+ 金属氧化物-------- 盐+ 水氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe23 + 3H2O氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O氧化铜和稀硫酸反应:CuO +H2SO4 == CuSO4 + H2O酸+ 碱-------- 盐+ 水盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O盐酸和氢氧化钙反应:2HCl + Ca2 == CaCl2 + 2H2O氢氧化铝药物治疗胃酸过多:3HCl + Al3 == AlCl3 + 3H2O硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O酸+ 盐-------- 另一种酸+ 另一种盐大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢。
中考化学专项复习-酸和碱的化学性质(中考复习)-课件

其中,猜想__四____一定是错的,
请你解释原因__C_a_(_O_H_)_2_和___H_C_l_要__继__续__反__应__
【设计实验】请完成实验报告。
实验步骤
实验现象
取少量滤液于试管中,滴加 适量的碳酸钠溶液。
取少量滤液于试管中, 滴加 _稀__盐__酸__(填名称)。
盐碱 水
盐 盐酸
OH-碱
盐
非金属 盐 氧化物 水
酸
盐 水
盐酸
CNa(aOOHH)2
HCl
NaCl Cu Fe2O3
入口 ④ Cu NaCl CuSO4 Fe2O3 出口
⑤ Cu NaCl NaOH Fe2O3
碱的化学性质:
1、碱 + 指示剂
碱能使石蕊溶液变( 蓝 ) 无色酚酞溶液(变红 )
2、碱 +非金属氧化物
→(盐) +(水 ) CO2+2NaOH= Na2CO3+H2O
2、
Na2CO3+H2O
变红
CO2+2NaOH= 密封
酸
3.
酸 紫色石蕊溶液 Fe2O3 铁
H2SO4 + Cu(OH)2 == CuSO4 + 2H2O
4、 B
5、为探究盐酸的化学性质,某化学小组做了如下实验:
(1)A试管中的实验现象为___变__红_________,C试管中所发
生反应的化学方程式为__F_e_2_O_3_+_6_H_C__l=_2_F__e_C_l_3+_3_H__2_O。
→(盐) + (水)
Fe2O3+6HCl=
2FeCl3+3H2O
2018年中考化学第7章 应用广泛的酸、碱、盐 (2)
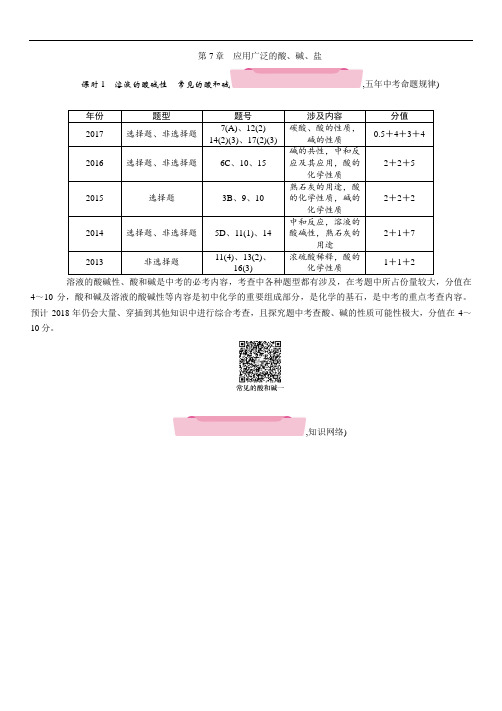
第7章应用广泛的酸、碱、盐课时1溶液的酸碱性常见的酸和碱,五年中考命题规律) 年份题型题号涉及内容分值2017 选择题、非选择题7(A)、12(2)14(2)(3)、17(2)(3)碳酸、酸的性质,碱的性质0.5+4+3+42016 选择题、非选择题6C、10、15 碱的共性,中和反应及其应用,酸的化学性质2+2+52015 选择题3B、9、10 熟石灰的用途,酸的化学性质,碱的化学性质2+2+22014 选择题、非选择题5D、11(1)、14 中和反应,溶液的酸碱性,熟石灰的用途2+1+72013 非选择题11(4)、13(2)、16(3) 浓硫酸稀释,酸的化学性质1+1+2溶液的酸碱性、酸和碱是中考的必考内容,考查中各种题型都有涉及,在考题中所占份量较大,分值在4~10分,酸和碱及溶液的酸碱性等内容是初中化学的重要组成部分,是化学的基石,是中考的重点考查内容。
预计2018年仍会大量、穿插到其他知识中进行综合考查,且探究题中考查酸、碱的性质可能性极大,分值在4~10分。
,知识网络),考点梳理)溶液的酸碱性1.酸碱指示剂(1)概念:能检验溶液__酸碱性__的试剂。
(2)酸碱指示剂在溶液中的颜色变化酸碱性指示剂酸性中性碱性石蕊溶液①__红色__②__紫色__③__蓝色__酚酞溶液④__无色__⑤__无色__⑥__红色__2.溶液的酸碱性强弱(1)溶液pH大小与酸碱的关系标准比色卡01234567891011121314――→酸性增强中性――→碱性增强(2)测定溶液的pH①测定方法:将玻璃棒蘸取的试样溶液滴在__pH试纸__上,(pH试纸不能预先__用水润湿__),把试纸呈现的颜色与__标准比色卡__对照,就可以确定__溶液的酸碱度__。
②注意事项:不能润湿;不能伸入待测液;不能测得小数值,若要测得小数值,可用pH计。
【温馨提示】测定溶液pH时,若先将pH试纸润湿,会测得碱性溶液pH偏小,酸性溶液pH偏大。
[中考必杀技]酸的化学性质中考点击
![[中考必杀技]酸的化学性质中考点击](https://img.taocdn.com/s3/m/1277b7dc6529647d272852d7.png)
[中考必杀技]酸的化学性质中考点击【知识点的认识】酸的化学性质主要有如下五个:1.酸溶液能跟酸碱指示剂起反应。
紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色。
变色情况可以简记为:“石红酚无”。
2.酸能跟多种活泼金属起反应,通常生成盐和氢气。
只有位于金属活动性顺序表中氢前面的金属才能与稀盐酸(或稀硫酸)反应,产生氢气,而位于氢后的金属却不能。
例如,常见的镁、铝、锌、铁、铜五种金属分别与稀盐酸、稀硫酸反应,具体的现象、结论(用化学方程式表示)如下表所示。
3.酸能跟金属氧化物(即碱性氧化物)反应生成盐和水。
例如,铁锈(主要成分是氧化铁)分别与盐酸、硫酸反应,具体现象、结论(用化学方程式表示)如下表所示。
4.酸能跟碱起中和反应生成盐和水。
例如,NaOH+HCl=NaCl+H2O、2NaOH+H2SO4=Na2SO4+2H2O、Ca(OH)2+2HCl=CaCl2+2H2O、Ca(OH)2+H2SO4=CaSO4+2H2O、H2SO4+Ba(OH)2=BaSO4↓(白色沉淀,不溶于硝酸)+2H2O。
5.酸能跟某些盐反应生成新酸和新盐。
例如,H2SO4+BaCl2=BaSO4↓+2HCl、HCl+AgNO3=AgCl↓(白色沉淀,不溶于硝酸)+HNO3。
有时生成的新酸不稳定,会继续分解;例如,CaCO3+2HCl=CaCl2+CO2↑+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O。
另外,碳酸不稳定,容易分解成二氧化碳和水。
【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对酸的化学性质的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力。
并且,经常将其与酸碱指示剂及其性质、金属的化学性质、酸的用途、中和反应、二氧化碳和氢气的实验室制取原理、碳酸钠和碳酸氢钠的化学性质、灭火器的反应原理、物质的推断和鉴别、碳酸根离子的检验、复分解反应的条件与实质、化学方程式的书写、有关实验操作(或现象、结论)等相关知识联系起来,进行综合考查。
《酸的化学性质》PPT课件

酸与金属的反应及原理
01
02
03
反应原理
酸中的氢离子与金属发生 置换反应,生成金属盐和 氢气。
反应条件
金属必须是活泼金属(金 属活动性顺序表中排在氢 前面的金属),酸通常是 稀硫酸或稀盐酸。
例如
铁与稀硫酸反应生成硫酸 亚铁和氢气。
03 酸与其他物质的反应
酸与金属氧化物的反应
反应原理
酸与金属氧化物反应生成盐和水 。
变为无色。
酸能与碳酸钠溶液反应,生成可 溶性的钠盐、水和二氧化碳气体
,有气泡产生。
实验结果及分析
实验分析
实验结果符合酸的通性及其与指示剂、金属氧化物、金 属、碱和盐的反应原理。
通过实验可以验证酸的化学性质及其与不同物质的反应 规律。
通过实验可以加深对酸的性质的理解和应用能力。
THANKS FOR WATCHING
应用领域
用于制造肥料、炸药、颜料等;也用于石油精炼、金属冶炼等工业 过程。
硝酸的性质及应用
物理性质
01
无色透明液体,有刺激性气味,易挥发。
化学性质
02
具有强氧化性和强酸性,能与多种物质发生反应,如与金属反
应生成硝酸盐、氮氧化物和水。
应用领域
03
用于制造氮肥、染料、炸药等;也用于金属表面处理、制药等
3. 观察并记录实验现象。
实验操作
在试管中加入少量稀盐酸或稀硫酸,滴入几滴紫 色石蕊试液或无色酚酞试液,观察颜色变化。
实验步骤及操作
01
02
03
04
在试管中加入生锈的铁钉,加 入稀盐酸或稀硫酸,观察现象
。
在试管中加入镁条,加入稀盐 酸或稀硫酸,观察现象。
在试管中加入氢氧化钠溶液, 滴入几滴酚酞试液,再加入稀 盐酸或稀硫酸,观察颜色变化
《7.1酸及其性质-酸的化学性质》优秀课件

(3)酸与金属氧化物的反应 3H2SO4 +Fe2O3==== Fe2(SO4)3 + 3H2O H2SO4 +CuO ==== CuSO4 + H2O
酸+金属氧化物→ 盐 + 水
(4)酸与某些盐的反应
CaCO3 + 2HCl ==== CaCl2 + CO2↑+ H2O Na2CO3 + 2HCl ==== 2NaCl + H2O + CO2↑ BaCl2 + H2SO4 ====BaSO4↓+ 2HCl H2CO3
复习提问
1.人的胃液里含有什么酸?胃液里含盐酸(HCl); 2.食醋里含有什么酸?食醋里含醋酸(CH3COOH;
我们生活中常会接触一些有酸味的物质,如食醋、西 红柿、柠檬汁
第七单元 常见的酸和碱
第二节 酸的化学性质
1.酸的化学性质
实验探究
实验内容
取少量稀盐酸于2支试管中分 别加入紫色石蕊和无色酚酞 将镁、铁、铜分别放入3支试 管中并分别加入稀硫酸
5.写出下列反应的化学方程式:
(1)Fe2O3+ 3 H2SO4====___F_e_2_(_S_O_4_)_3_+__3_H_2_O________; (2)CuO+H2SO4====___C_u_S_O_4__+__H_2_O______; (3)2 HCl+Na2CO3====___2_N_a_C_l__+__H_2_O__+__C_O_2_↑_________。
6.除去稀盐酸中的少量稀硫酸可用——氯——化—钡——溶—液—。 除去氯化钠溶液中的少量碳酸钠可用——稀——盐—酸——。
初中化学_酸的性质PPT课件
D
A、不能用铁制容器盛放稀盐酸和稀硫酸 B、用稀盐酸可以除去热水瓶中的水垢 主要成分是 CaCO3和 Mg(OH)2
C、用含Al(OH)3的药物胃舒平可治疗胃酸过多
D、铁制零件在电镀前,放在盐酸池中浸泡时间越 长越好
两瓶浓硫酸和浓盐酸敞口放置在桌面上,一 段时间后质量各有什么变化,溶质质量分数 各有什么变化?
Mg + 2HCl = MgCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑
2.酸能与某些金属氧化物反应生成盐和水
Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 3H2SO4 =Fe2(SO4)3+ 3H2O
3.酸能与某些盐反应生成新盐和新酸
CaCO3 + 2 HCl
通过这一节课 的学习,你有哪些 收获?
课后作业: 1、复习本节内容熟练书写有关酸的化学性质的化 学方程式,试找出反应物与生成物的组成上有什
么联系?
2、查阅资料或上网,了解盐酸、硫酸的用途。
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达· 芬奇 4、与肝胆人共事,无字句处读书。——周恩来 5、一个人即使已登上顶峰,也仍要自强不息。——罗素· 贝克 6、一切节省,归根到底都归结为时间的节省。——马克思 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿 11、有勇气承担命运这才是英雄好汉。——黑塞 12、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼· 罗兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔· F· 斯特利 16、业余生活要有意义,不要越轨。——华盛顿 17、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、我这个人走得很慢,但是我从不后退。——亚伯拉罕· 林肯 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃 21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈 23、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 24、知之者不如好之者,好之者不如乐之者。——孔子 25、学习是劳动,是充满思想的劳动。——乌申斯基 26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭 27、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 28、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚 29、越是没有本领的就越加自命不凡。——邓拓 30、阅读使人充实,会谈使人敏捷,写作使人精确。——培根
2018年中考酸碱盐知识点总结
2018年中考酸碱盐知识点总结一、酸的化学性质:1、酸的溶液可使紫色石蕊溶液变红,不能使无色酚酞变色2、酸+活泼金属——盐+H2↑2HCl+Mg=MgCl2+H2↑H2SO4+Mg=MgSO4+H2↑2HCl+Zn=ZnCl2+H2↑H2SO4+Zn=ZnSO4+H2↑2HCL+Fe=FeCl2+H2↑(金属溶解,有气体放出)H2SO4+ Fe=FeSO4+H2↑3 、酸+金属氧化物——盐+H2O6HCl+Fe2O3=2FeCl3+3H2O(溶液变成红褐色,红色固体溶解)3H2SO4+Fe2O3=2FeCl3+H2O2HCl+CuO=CuCl2+H2O(溶液变成蓝色,黑色固体溶解)H2SO4+CuO=CuSO4+H2O4、酸+碱——盐+H2OHCl+NaOH=NaCl+H2O2HCl+Ca(OH)2=CaCl2+H2OH2SO4+NaOH=Na2SO4+2H2OH2SO4+Cu(OH)2=2H2O+CuSO4(蓝色固体溶解,溶液变蓝)5、酸+某些盐——新酸+新盐HCl+AgNO3=AgCl↓+HNO3(生成白色沉淀,沉淀不溶于稀硝酸)H2SO4+BaCl2=BaSO4↓+H2SO4(生成白色沉淀,沉淀不溶于稀硝酸)2HCl+CaCO3=H2O+CO2↑+CaCl2 (生成气体)2HCl+Na2CO3=2NaCl+H2O+CO2↑(生成气体)二、碱的化学性质:1、碱溶液可使紫色石蕊试液变蓝,可是无色酚酞变红2 、碱+非金属氧化物——盐+H2O2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(OH)2+CO2=CaCO3↓+H2O (生成白色沉淀)3 、碱+酸——盐+H2OHCl+NaOH=NaCl+H2O2H2SO4+Ca(OH)2=Ca SO4+H2OH2SO4+2NaOH=Na2SO+2H2O2HCl+Cu(OH)2=2HCl+CuCl2 (蓝色沉淀溶解,溶液变蓝)H2SO4+Ca(OH)2=CaSO4+2H2O4 、碱+某些盐——新盐+新碱3NaOH+FeCl3=Fe(OH)3↓+3NaCl (生成红褐色沉淀)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 (生成蓝色沉淀)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (生成白色沉淀)Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O (有刺激性气体生成)5、不溶性碱遇热分解Cu(OH)2△CuO+H2O (蓝色沉淀变黑)2Fe(OH)3=Fe2O3+H2O三、盐的化学性质:1、酸+某些盐——新酸+新盐HCl+AgNO3=AgCl↓+HNO3(生成白色沉淀,沉淀不溶于稀硝酸)H2SO4+BaCl2=BaSO4↓+H2SO4(生成白色沉淀,沉淀不溶于稀硝酸)2HCl+CaCO3=H2O+CO2↑+CaCl2 (生成气体)2HCl+Na2CO3=2NaCl+H2O+CO2↑(生成气体)2 、碱+某些盐——新盐+新碱3NaOH+FeCl3=Fe(OH)3+3NaCl (生成红褐色沉淀)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 (生成蓝色沉淀)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (生成白色沉淀)Ca(OH)2+ 2NH4Cl=CaCl2+2NH3↑+2H2O (有刺激性气味)3 、金属+某些金属盐=新金属+金属盐CuSO4+Fe=FeSO4+Cu (蓝色溶液变绿,铁片变红)Cu+AgNO3=CuNO3+Ag (无色溶液变蓝,红色铁片变银白色)4 、盐+盐=新盐+新盐FeCl2+2AgNO3=Fe(NO3)2+2AgCl2↓(生成不溶于稀硝酸的白色沉淀)Na2SO4+BaCl2=BaSO4+2NaClCaCl2+2AgNO3=Ca(NO3)2+2AgCl↓(生成不溶于稀硝酸的白色沉淀)。
初中化学酸的化学性质及常见的酸
考前冲刺知识梳理酸的化学性质及常见的酸重点一. 酸的化学性质(重要性①能使紫色石蕊溶液变色易错点:变色的是石蕊,而不是酸②能与活泼金属发生反应规律:活泼金属+酸=对应的盐+氢气2Al+6HCl=2AlCl₃+3H₂↑【例】Mg+2HCl=MgCl₂+H₂↑Fe+2HCl=FeCl₂+H₂↑Zn+2HCl=ZnCl₂+H₂↑易错点:酸是盐酸或者稀硫酸、但不能是硝酸、浓硫酸@简单初中生考察方向:描述金属与酸反应的实验现象、金属活动性比较、实验室制取氢气方向1:描述实验现象,包含三方面:固体溶解、溶液颜色变化、气体产生【例】向铁粉中加入稀盐酸,描述反应现象。
正确:铁粉逐渐溶解,有气泡产生,溶液由无色变成浅绿色错误:铁粉逐渐溶解,有氢气产生,溶液由无色变成浅绿色(描述现象,千万不能点名道姓)方向2:金属活动性比较规律:一看反应与否,二看气泡快慢,能反应的金属比不反应的金属活泼性强,产生气泡快的金属比产生气泡慢的金属强@简单初中生方向3:实验室制取氢气原料:锌粒、稀硫酸原理:Zn+H₂SO₄=ZnSO₄+H₂↑常见问题:(1) 为什么不用盐酸制取氢气?答:不使用稀盐酸,因为:盐酸易挥发,使制得的氢气中含有HCl气体(2) 为什么不用镁或铁制取氢气?答:不用镁是因为反应速度太快,不用铁是因为反应速度太慢(3) 氢气点燃前需要做什么?答:验纯③能和金属氧化物反应(复分解反应)规律:金属氧化物+酸=对应的盐+水(金属元素的化合价不变)Fe₂O₃+6HCl=2FeCl₃+3H₂O(反应前后,铁元素都是+3价,化合价未发生改变)【例】FeO+2HCl=FeCl₂+H₂O((反应前后,铁元素都是+2价,化合价未发生改变) CuO+2HCl=CuCl₂+H₂O考察方向:金属氧化物与酸的反应现象、流程题中除杂方向1:金属氧化物与酸的反应现象,与金属单质类似,要点:固体溶解,溶液颜色变化【例】向氧化铜粉末中加入稀硫酸@简单初中生答:黑色粉末逐渐溶解,溶液由无色变成蓝色方向2:流程题中除杂常见问题:流程题中,原料往往含有某些金属氧化物杂质,除去的方法一般是添加酸(盐酸或者硫酸)【2019白云一模(节选)】下图是以黄铜矿(主要成分为CuFeS₂)为原料制取胆矾晶体(CuSO₄⋅5H₂O)的流程:已知:高温焙烧时的主要反应有:2CuFeS2+O2高温Cu2S+2FeS+SO22Cu₂S+5O₂高温2CuO+2CuSO₄, 2FeS+3O₂高温=2FeO+2SO₂;(1)最适合的试剂X是 (填化学式)溶液。
初中化学《酸的性质》共7页word资料
第三节酸和碱的性质第一课时酸的性质【学习要求】1、了解浓盐酸和浓硫酸的性质。
2、认识酸的化学性质,理解酸的化学性质实质是氢离子的性质。
3、体会分类选取代表物,宏观与微观结合等科学认识物质的方法。
4、通过对酸性质的开放性探究活动,引领学生进一步发展科学探究能力。
【重点】1、酸的化学性质2、对酸的化学性质反应原理的微观认识【学案设计】知识回顾:什么是酸?你知道哪些酸?如何证明一瓶失去标签的无色溶液是酸?一、酸的性质1、认识浓盐酸和浓硫酸【探究活动一】浓盐酸和浓硫酸的性质(1)阅读浓盐酸和浓硫酸的标签并完成填空(2)用木条蘸取浓硫酸在滤纸上写字(3)稀释浓硫酸【形成知识】1、浓硫酸的特性,,。
2、稀释浓硫酸时,一定要把慢慢倒入,并不断用搅拌。
3、如果不慎将浓硫酸沾到皮肤上,应立即用冲洗,再涂上,以防灼伤皮肤。
2、酸的化学性质【问题组】1、稀盐酸能与哪些物质反应?你还想探究有关它们的什么知识呢?2、我们准备的实验用品,有镁条、生锈铁钉(铁锈主要成分是氧化铁)、碳酸钠、氯化铜溶液等,分析判断它们各是哪类物质的代表?为什么要选取这些物质?3、铁锈和盐酸的反应,在铁锈完全溶解后,铁钉表面有什么现象,为什么?【探究活动二】稀盐酸的化学性质完成实验并填写实验报告。
友情提示:1、分工合作,边做边记录实验现象2、酸有一定的腐蚀性,注意安全3、先固后液,药液加入4—5滴4、碳酸钠用药匙小头取绿豆粒大小5、注意滴管不要碰触井穴板实验:稀盐酸与镁条、锈铁钉、碳酸钠、氯化铜溶液的反应【形成知识】知识拓展:[动画展示]稀盐酸与镁条、碳酸钠反应的微观实质【探究活动三】稀硫酸的化学性质完成实验并填写实验报告。
实验:稀硫酸与镁条、锈铁钉、碳酸钠、氯化铜溶液的反应【形成知识】知识拓展:[动画展示]稀硫酸与镁条、碳酸钠、氯化铜反应的微观实质【问题组】1、为什么稀盐酸和稀硫酸会有相似的化学性质?2、酸具有哪些化学性质?【形成知识】酸的化学性质:酸与_________________________反应;酸与_________________________反应;酸与_________________________反应;酸与_________________________反应;酸与_________________________反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的酸 知识精讲
一.酸的定义 酸是在水溶液中电离时,电离出的阳离子都是氢离子( H )的化合物。
二.酸碱指示剂
跟酸或碱(碱是在水中电离出的阴离子全是 OH 的化合物)的溶液起作用而显示不同颜 色的物质叫酸碱指示剂,简称指示剂。常用的指示剂有紫色石蕊溶液和无色酚酞溶液。石蕊 溶液遇酸溶液变红,遇碱溶液变蓝。酚酞溶液遇酸溶液不变色,遇碱溶液变红色。
比 2:1 脱去,这种作用叫做脱水作用。如果不慎将浓硫酸沾到皮肤上或者衣物上,应用大量 水冲洗,然后涂上 3% ~ 5% 的碳酸氢钠溶液。
4.浓硫酸的稀释:在稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水里,并不断 搅拌;且不可将水直接倒在浓硫酸里。
五.硝酸 1.硝酸也是一种含氧酸,对应的酸酐是 N2O5 。 2.物理性质: (1)纯净的硝酸是无色的液体,具有刺激性气味、易挥发,打开浓硝酸的瓶盖在瓶口
三点剖析
一.考点: 1.酸、碱的介绍. (1)酸、碱的概念 (2)酸碱指示剂的应用 2.常见的酸 (1)常见酸的物理、化学性质 (2)常见酸的应用
二.重难点:
1.常见酸的的性质 (1)常见酸的物理性质 (2)常见酸的化学性质 (3)常见酸的应用
2.酸碱指示剂
三.易错点: 1.酸碱溶液与指示剂反应使指示剂变色,而不是酸碱变色。因此可以说紫色石蕊溶液
B. 将熟石灰撒在泄漏出的浓硫酸上
C. 将氯化钡撒在泄漏出的浓硫酸上
D. 用土将泄漏的浓硫酸掩埋
题模四:硝酸
例 1.4.1 对于硝酸的物理性质,下列叙述中,不正确的是( ) A. 可以与水以任意比互溶 B. 不易挥发 C. 有刺激性气味 D. 质量分数在 95%以上的硝酸为发烟硝酸
例 1.4.2 长期放置的浓硝酸常显黄色。消除其中的黄色最好的方法是( )
随练 1.2 下列实验方案不能达到实验目的是( ) A. 用带火星的木条检验 O2 B. 用点燃的方法除去 CO2 中的 CO C. 用酚酞溶液鉴别食盐水和烧碱溶液 D. 用 Na2CO3 溶液和 Ca(OH)2 溶液制备少量的 NaOH 溶液
随练 1.3 向一定质量的稀盐酸中加入镁粉至过量,若右图中横坐标表示镁粉的质量,则纵 坐标不能是( )
酸,可帮助消化。
四.硫酸 1.硫酸的物理性质:浓硫酸是无色粘稠、油状液体,有吸水性,溶于水时放热。 2.稀硫酸的化学性质: (1)能使石蕊试液变红,不能使酚酞溶液变色; (2)和活泼金属反应,生成盐和氢气,如 Fe H2SO4 FeSO4 H2 ; (3)与金属氧化物反应,生成盐和水,如 CuO H2SO4 CuSO4 H2O ; (4)有很强的腐蚀性。 3.浓硫酸的脱水性:浓硫酸能将木材、布料、皮肤等物质中的氢、氧元素按水的组成
题模二:盐酸
例 1.2.1 下列物质① FeCl3 ② ZnCl2 ③ CuCl2 ④ AlCl3 中,能用金属和盐酸直接反应制得的 物质是( )
A. ①②
②④
C. ③④
例 1.2.2 下列实验现象描述错误的是( ) A. 红磷燃烧产生大量的白烟 B. 硫磺在空气中燃烧发出淡蓝色的火焰 C. 铁丝在氧气中燃烧生成红色的固体 D. 打开盛放浓盐酸的试剂瓶盖,瓶口会出现白雾 题模三:硫酸
遇盐酸变红,或盐酸能使紫色石蕊溶液变红,但不能说紫色石蕊溶液能使盐酸变红。 2.锌能与稀硫酸发生置换反应生成氢气,但是稀硫酸的组成中只有氢元素,没有氢气.因
此不能说锌能置换出稀硫酸里的氢气。 3.浓硫酸能直接把水分吸收到浓硫酸分子中,并与之结合形成硫酸的水合物,放出大
量的热,同时使质量增加,这表现了浓硫酸的吸水性,利用此性质,浓硫酸可以作为某种气 体的干燥剂。而脱水性则是浓硫酸将纸张、木材、布料、皮肤中氢、氧元素的原子按水分子 的组成比脱去,同时使物质碳化的性质。浓硫酸使纸张炭化变黑,是利用了浓硫酸的脱水性。
D. ①③
例 1.3.1 某同学用玻璃棒蘸取少量溶液涂在紫色石蕊试纸上,试纸先变红,后碳化,则蘸
取的溶液是( )
A. 稀硫酸
B. 浓硫酸
C. 氢氧化钠
D. 浓盐酸
例 1.3.2 据报载,一辆满载浓硫酸的槽罐车在路上因车祸翻倒,为了不污染旁边的水源,
下列采取的措施适宜的是( )
A. 用水冲洗泄漏的浓硫酸
紫色石蕊
遇酸变红 遇碱变蓝
无色酚酞
遇酸不变 遇碱变红
三.盐酸 1.盐酸的物理性质:浓盐酸是无色、有刺激性气味的液体,易挥发,在空气中易产生
白雾,有酸味。 2.盐酸的化学性质: (1)能使石蕊试液变红,不能使酚酞溶液变色; (2)和活泼金属反应,生成盐和氢气,如 2Al 6HCl 2AlCl3 3H2 ; (3)与金属氧化物反应,生成盐和水,如 Fe2O3 6HCl 2FeCl3 3H2O 。 3.盐酸的用途:重要化工产品,用于金属表面除锈,制药等;人体胃液中含有少量盐
题模精讲
题模一:酸碱指示剂
例 1.1.1 下列溶液中,能使紫色石蕊试液变红的是( )
A. 稀硫酸
B. 澄清石灰水 C. 烧碱溶液
D. 碳酸钠溶液
例 1.1.2 下列区分物质的试剂或方法不正确的是____
A. 用水区分氯化钙和碳酸钙
B. 用酚酞试液区分盐酸和食盐水
C. 用肥皂水区别硬水和软水
D. 用闻气味的方法区分白醋和白酒
会产生白色酸雾。 (2)浓硝酸通常带有黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,
光照或者受热时分解产生红棕色的 NO2 气体, NO2 又溶解于硝酸溶液中而呈黄色。 (3)实验室保存硝酸要用棕色(避光)玻璃试剂瓶,贮放在低温黑暗的地方。硝酸具
有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
A. 在光亮处放置
B. 通入适量的空气
C. 加入足量水
D. 加入漂白粉
随堂练习
随练 1.1 下列分析判断正确的是( ) A. 酸能够使紫色石蕊溶液变红,二氧化碳能使紫色石蕊溶液变红色,所以二氧化碳是酸 B. 铁、铜都是金属单质,都能够置换出盐酸、稀硫酸中的氢 C. 氧化物中含有氧元素,但是含有氧元素的化合物不一定是氧化物 D. 点燃的木条伸入某无色气体中会熄灭,证明该无色气体一定是二氧化碳
