高考化学一轮大题冲关滚动练【3】电化学原理综合应用题ppt课件
合集下载
第六章 课时 4 电化学原理的综合应用 课件 2021届高三一轮复习化学(共51张PPT)

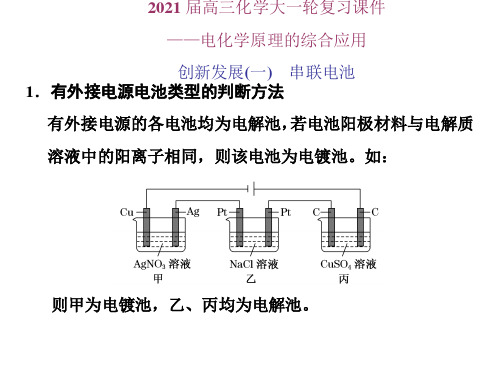
(3)根据电极反应现象判断 在某些装置中根据电极反应或反应现象可判断电极,并由此 判断电池类型。如图所示:若 C 极溶解,D 极上析出 Cu, B 极附近溶液变红,A 极上放出黄绿色气体,则可知乙是原 电池,D 是正极,C 是负极;甲是电解池,A 是阳极,B 是 阴极。B、D 极发生还原反应,A、C 极发生氧化反应。
科学家近期利用三维多孔海绵状 Zn(3D-Zn)可以高效沉积
ZnO 的特点,设计了采用强碱性电解质的 3D-Zn—NiOOH 二
次电池,结构如下图所示。电池反应为 Zn(s)+2NiOOH(s)+
H2O(l)
放电 充电
ZnO(s)+2Ni(OH)2(s)。
下列说法错误的是
()
A.三维多孔海绵状 Zn 具有较高的表面积,所沉积的 ZnO 分
散度高
B.充电时阳极反应为 Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s) +H2O(l)
C.放电时负极反应为 Zn(s)+2OH-(aq)-2e-===ZnO(s)+
H2O(l) D.放电过程中 OH-通过隔膜从负极区移向正极区
[解析] A 正确,三维多孔海绵状 Zn 为多孔结构,具有 较高的表面积,所沉积的 ZnO 分散度高;B 正确,二次电池 充电时遵循电解池原理,阳极发生氧化反应,元素化合价升高, 原 子 失 去 电 子 , 阳 极 反 应 为 Ni(OH)2(s) + OH - (aq) - e - ===NiOOH(s)+H2O(l);C 正确,二次电池放电时遵循原电池 原理,负极发生氧化反应,元素化合价升高,原子失去电子, 由 电 池 总 反 应 可 知 , 负 极 反 应 为 Zn(s) + 2OH - (aq) - 2e - ===ZnO(s)+H2O(l);D 错误,二次电池放电时,阴离子从正 极区向负极区移动。
最新化学高考冲刺-复习方案课件:专题10-电化学原理(共56张ppt)幻灯片

专题十 │ 要点热点探究
铜锌原电池工作时,下列叙述正确的是( )
图 10-2 A.实验过程中取出盐桥,原电池仍继续工作 B.将锌片浸入 CuSO4 溶液中发生的化学反应与该原电池反应相同 C.在外电路中,电子从正极流向负极 D.盐桥中的 K+移向 ZnSO4 溶液
专题十 │ 主干知识整合
(1)以酸性溶液为电解质溶液构成的氢氧燃料电池反应原理为: 2H2+O2===2H2O。
负极:2H2-4e-===4H+, 正极:O2+4H++4e-===2H2O。 (2)以碱性溶液为电解质溶液构成的甲烷燃料电池反应原理为: CH4+2O2+2OH-===CO32-+3H2O。 负极:CH4+10OH--8e-===CO32-+7H2O, 正极:2O2+4H2O+8e-===8OH-。
专题十 │ 主干知识整合
3.金属的防护 (1)改变金属的内部结构,例如把 Ni、Cr 等加入普通钢中制成 不锈钢。 (2)覆盖保护层:①涂油脂、油漆、搪瓷、塑料等;②电镀耐腐 蚀的金属(Zn、Sn、Ni、Cr 等)。 (3)电化学保护法:多采用牺牲阳极保护法。如在船只的螺旋桨 附近的船体上镶嵌活泼金属锌块。另外,也可采用与电源负极相连 接的保护方式,即外加电流的阴极保护法。
2013年化学高考冲刺-复 习方案课件:专题10-电 化学原理(共56张PPT)
专题十 │ 主干知识整合
主干知识整合 一、原电池和电解池
专题十 │ 主干知识整合
专题十 │ 主干知识整合
(1)放电反应 负极:Pb+SO24--2e-===PbSO4 正极:PbO2+4H++SO24-+2e-===PbSO4+2H2O (2)充电反应 阴极:PbSO4+2e-===Pb+SO24- 阳极:PbSO4+2H2O-2e-===PbO2+4H++SO42- 3.燃料电池 燃料电池以还原剂(氢气、烃类、甲醇等)为负极反应物,以氧化 剂(氧气、空气等)为正极反应物。
2024届高考化学一轮复习专题电化学原理的综合应用课件

OH-。下列说法错误的是( B )
A.电极a连接电4溶液
可避免有害气体的产生 D.Ⅱ口排出的是淡水
5.普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜(阴离子交换
膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是( D )
的电能进行粗铜的精炼。下列说法不正确的是( )
C
A.B 极为负极,发生氧化反应 B.当电路中有 0.2 mol 电子通过时,
Y 极质量可能减少 3.2 g
C.A 极的电极反应式:
+e-===
+Cl-
D.反应一段时间后,经甲装置中排出污水的 pH 减小
3.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的 电键时,观察到电流表的指针发生了偏转。
A.电极a为粗铜,电极b为纯铜 B.甲膜为过滤膜,可阻止阳极泥及
漂浮物杂质进入阴极区 C.乙膜为阴离子交换膜,可阻止杂
质阳离子进入阴极区 D.当电路中通过1 mol电子时,可
生成32 g纯铜
6.四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c为阴、阳离子交 换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子
题组一 “隔膜”在新型电池中的应用
1.二甲醚(CH3OCH3)燃料电池的工作原理如图,下列有关叙述正确的是( C )
A.该装置能实现化学能100%转化为电能 B.电子移动方向:a极→b极→质子交换膜
→a极 C.a 电 极 的 电 极 反 应 式 为 : CH3OCH3 +
3H2O-12e-===2CO2+12H+ D.当b电极消耗22.4 L O2时,质子交换膜
透过。下列叙述正确的是( D )
A.b、c 分别依次为阳离子交换膜、阴离子交 换膜
A.电极a连接电4溶液
可避免有害气体的产生 D.Ⅱ口排出的是淡水
5.普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜(阴离子交换
膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是( D )
的电能进行粗铜的精炼。下列说法不正确的是( )
C
A.B 极为负极,发生氧化反应 B.当电路中有 0.2 mol 电子通过时,
Y 极质量可能减少 3.2 g
C.A 极的电极反应式:
+e-===
+Cl-
D.反应一段时间后,经甲装置中排出污水的 pH 减小
3.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的 电键时,观察到电流表的指针发生了偏转。
A.电极a为粗铜,电极b为纯铜 B.甲膜为过滤膜,可阻止阳极泥及
漂浮物杂质进入阴极区 C.乙膜为阴离子交换膜,可阻止杂
质阳离子进入阴极区 D.当电路中通过1 mol电子时,可
生成32 g纯铜
6.四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c为阴、阳离子交 换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子
题组一 “隔膜”在新型电池中的应用
1.二甲醚(CH3OCH3)燃料电池的工作原理如图,下列有关叙述正确的是( C )
A.该装置能实现化学能100%转化为电能 B.电子移动方向:a极→b极→质子交换膜
→a极 C.a 电 极 的 电 极 反 应 式 为 : CH3OCH3 +
3H2O-12e-===2CO2+12H+ D.当b电极消耗22.4 L O2时,质子交换膜
透过。下列叙述正确的是( D )
A.b、c 分别依次为阳离子交换膜、阴离子交 换膜
高考化学一轮复习 模块二 第六章 热点专题(三)电化学组合装置问题的分析课件

ppt精选
6
上图中,装置甲是原电池,装置乙是电解池,若电路中有 0.2 mol 电子转移,则 Zn 极溶解 6.5 g,Cu 极上析出 H2 2.24 L(标准状况), Pt 极上析出 Cl2 0.1 mol,C 极上析出 Cu 6.4 g。甲池中 H+被还 原,产生 H2,负极 Zn 氧化生成 ZnSO4 溶液,pH 变大;乙池中 是电解 CuCl2 溶液,由于 Cu2+浓度的减小使溶液 pH 微弱增大, 电解后再加入适量 CuCl2 固体可使溶液复原。
ppt精选
12
2.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放 100 g 5.00%的 NaOH 溶液、足量的 CuSO4 溶液和 100 g 10.00% 的 K2SO4 溶液,电极均为石墨电极。
池”),通入 CH3OH 电极的电极反应为 _C__H_3_O_H__-__6_e_-_+__8_O_H__-_=_=_=_C__O_32_-_+__6_ห้องสมุดไป่ตู้_2_O___。
ppt精选
8
(2)乙池中 A(石墨)电极的名称为__阳__极__(填“正极”“负 极”“阴极”或“阳极”),总反应式为
电解 _4_A_g_N__O_3_+__2_H__2O__=_=_=_=_=_4_A__g_+__O_2_↑__+__4_H__N_O__3 _。 (2)乙池中为用惰性电极电解 AgNO3 溶液,其中 A 作阳极,B 作
ppt精选
5
第二步:利用相关概念进行分析判断 在确定了原电池和电解池后,利用有关概念作分析和判断,
如电极的判断、电极反应方程式的书写、实验现象的描述、溶液 中离子的移动方向、pH的变化及电解质溶液的恢复等。只要按 照各自的规律分析即可。 第三步:串联装置中的数据处理
2021届高三化学大一轮复习课件——电化学原理的综合应用(共35张PPT)
气体 22.4 L(标准状况下),假定电解后溶液体积仍为 500 mL,
下列说法正确的是
()
A.原混合溶液中 c(Na+)=6 mol·L-1 B.电解后溶液中 c(H+)=4 mol·L-1
C.上述电解过程中共转移 8 mol 电子
D.电解后得到的 Cu 的物质的量为 2 mol
解析:石墨作电极电解此溶液,当通电一段时间后,两极
用于串联电路中阴阳两极产物、正负两极产物、相同电量等 类型的计算,其依据是电路中转移的电子数相等。
如图所示:图中装置甲是_原__电__池__,乙是_电__解__池__,若电路中 有 0.2 mol 电子转移,则 Zn 极溶解 6.5 g,Cu 极上析出 H2_2_.2_4__ L(标准状况),Pt 极上析出 Cl2 0.1 mol,C 极上析 出 Cu 6.4 g。甲池中 H+被还原,生成 ZnSO4,溶液 pH 变 大;乙池是电解 CuCl2,由于 Cu2+浓度的减小使溶液 pH 微 弱增大,电解后再加入适量 CuCl2 固体可使溶液复原。
反应物质)及相应的还原产物和氧化产物。
(2)根据相关信息,找准一个电极上原子或离子得失电子数
(注意化学式中粒子的个数)。
(3)根据串联电路中各电极转移电子相等列出等式。
[过关训练]
1.500 mL NaNO3 和 Cu(NO3)2 的混合溶液中 c(NO- 3 )=6 mol·L-1,用 石墨作电极电解此溶液,当通电一段时间后,两极均收集到
硝酸溶液,发生的反应为2H++2e-===H2↑,虽然消耗了H+,但 同时有等量的H+从阳极区迁移过来,故溶液的pH不变,B项正
确;c电极为阳极,发生氧化反应:N2O4-2e-+2HNO3===
2N2O5+2H+,C项错误;依据电子转移数相同可知,甲装置的左
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 2 3 4 5 6
解析 + 2e
-
其反应原理为阳极:Fe-2e-===Fe2+、阴极:2H+
+ 2- 2+ 3+ 3+ ===H2↑, Cr2O7 + 6Fe + 14H ===2Cr + 6Fe
+ 7H2O , Cr3 + + 3OH - ===Cr(OH)3↓ , Fe3 + + 3OH - ===Fe(OH)3↓。 16.8 g 1 (1) -1·=0.05 mol。 56 g· mol 6 (2)图 1 中,Cr 作负极,Cu 作正极,Cr 比铜活泼。图 2
- 3+ 3+ Cr2O 2 发生反应,生成的 Fe 和 Cr 在阴极区与 7
OH-结合生成 Fe(OH)3 和 Cr(OH)3 沉淀除去。 (1) 若阳极铁质量减少 16.8 g ,则理论上被还原的
2- Cr2O7 的物质的量为________mol。
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6Fra bibliotek(2)在下图装置中,观察到图 1 装置铜电极上产生大量的 无色气泡,而在图 2 装置中当开关 K 断开时,铬电极无 现象,K 闭合时,铬电极上产生大量无色气体,并变成 红棕色气体。根据上述现象试推测金属铬的两个重要化 学性质_________________、__________________。
大题冲关滚动练之三——电化学原理综合应用题
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
(2)芒硝化学式为 Na2SO4· 10H2O,无色晶体,易溶于水, 是一种分布很广泛的硫酸盐矿物。该小组同学设想,如 果模拟工业上离子交换膜法制烧碱的方法,用上图 2 所 示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧 化钠,无论从节省能源还是从提高原料的利用率而言都 更加符合绿色化学理念。 ①该电解槽的阳极反应式为__________________。此时 通过阴离子交换膜的离子数 __________( 填“大于”、 “小于”或“等于”)通过阳离子交换膜的离子数。
③Na2FeO4 之所以能消毒净水,是因为 Na2FeO4 具有强 氧化性,其还原产物 Fe3+能水解生成 Fe(OH)3 胶体。
答案 (2)①a 4H2O ③BC (1)O2+4e-+2H2O===4OH- 氧化反应
-
Fe2O3· xH2O
-
2Fe3++Fe===3Fe2+ ②Fe - 6e + 8OH
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”), 该 电池工作一段时间后必须充电,充电时生成 NiO2 的反应类型是 __________。 ②写出在用电解法制取高铁酸钠时, 阳极的电极反应式________。 ③你认为高铁酸钠作为一种新型净水剂的理由可能是________。 A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性 B.高铁酸钠具有强氧化性,能消毒杀菌 C.高铁酸钠在消毒杀菌时被还原生成 Fe3+,水解产生氢氧化铁 胶体能吸附悬浮杂质
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
放电 (2)爱迪生蓄电池的反应式为 Fe+NiO2+2H2O 充电 Fe(OH)2+ Ni(OH)2;高铁酸钠 (Na2FeO4)是一种新型 净水剂。用如图装置可以制取少量高铁酸钠。
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
解析
(1)正极发生还原反应,在潮湿的空气中钢铁锈蚀正
极反应式为 O2+2H2O+4e-===4OH-,铁锈的主要成分为 Fe2O3 的水合物,可表示为 Fe2O3· xH2O。由于在生锈的钢 铁中,Fe 过量,当 Fe2O3+6H ===2Fe +3H2O 反应后又 发生 2Fe3++Fe===3Fe2+反应,所以检测不到 Fe3+。 (2)①在该电解池中,Fe 一定做阳极,所以 a 为负极,b
化学
苏教浙江
专题6
化学反应与能量变化
大题冲关滚动练之三 ——电化学原理综合应用题
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
1.铁和铁的化合物在工业生产和日常生活中都有广 泛的用途。请回答下列问题: (1)钢铁锈蚀是目前难以解决的现实问题,电化学 腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发 生还原反应的电极反应式:_____________。 铁锈的主要成分是____________(填写化学式), 将 生锈的铁屑放入 H2SO4 溶液中充分溶解后,在溶 液中并未检测出 Fe3+,用离子方程式说明原因: ___________________________。
2- ===FeO 4 +
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
2.+6 价铬易被人体吸收,可致癌;+3 价铬不易被人 体吸收,毒性小。工业含铬废水的处理方法之一是将 含+6 价铬的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 后进行电解:阳极区生成的 Fe2 + 和
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
3.(1)某课外活动小组同学用下图 1 装置进行实验,试回 答下列问题: ①若开始时开关 K 与 a 连接,则铁发生电化学腐蚀中 的________腐蚀。 ②若开始时开关 K 与 b 连接,则总反应的离子方程式 为_____。
图1
图2
中,Cr 在稀硝酸中无明显现象,说明 Cr 在稀硝酸中钝 化,而 Cu 不钝化,Cu 失电子通过导线到达 Cr 电极,然 后 NO3 在 Cr 电极上得到电子,生成 NO。
-
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
答案
(1)0.05 铬在稀硝酸中可以发生钝化
(2)铬比铜活泼
为正极,当充电时,Ni(OH)2 生成 NiO2,化合价升高, 发生氧化反应。
- - ②在 FeO2 中 Fe 的化合价为+ 6 价, 所以 Fe 应失去 6e , 4 - 电极反应式为 Fe-6e-+8OH-===FeO2 4 +4H2O。
+
3+
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
解析 + 2e
-
其反应原理为阳极:Fe-2e-===Fe2+、阴极:2H+
+ 2- 2+ 3+ 3+ ===H2↑, Cr2O7 + 6Fe + 14H ===2Cr + 6Fe
+ 7H2O , Cr3 + + 3OH - ===Cr(OH)3↓ , Fe3 + + 3OH - ===Fe(OH)3↓。 16.8 g 1 (1) -1·=0.05 mol。 56 g· mol 6 (2)图 1 中,Cr 作负极,Cu 作正极,Cr 比铜活泼。图 2
- 3+ 3+ Cr2O 2 发生反应,生成的 Fe 和 Cr 在阴极区与 7
OH-结合生成 Fe(OH)3 和 Cr(OH)3 沉淀除去。 (1) 若阳极铁质量减少 16.8 g ,则理论上被还原的
2- Cr2O7 的物质的量为________mol。
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6Fra bibliotek(2)在下图装置中,观察到图 1 装置铜电极上产生大量的 无色气泡,而在图 2 装置中当开关 K 断开时,铬电极无 现象,K 闭合时,铬电极上产生大量无色气体,并变成 红棕色气体。根据上述现象试推测金属铬的两个重要化 学性质_________________、__________________。
大题冲关滚动练之三——电化学原理综合应用题
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
(2)芒硝化学式为 Na2SO4· 10H2O,无色晶体,易溶于水, 是一种分布很广泛的硫酸盐矿物。该小组同学设想,如 果模拟工业上离子交换膜法制烧碱的方法,用上图 2 所 示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧 化钠,无论从节省能源还是从提高原料的利用率而言都 更加符合绿色化学理念。 ①该电解槽的阳极反应式为__________________。此时 通过阴离子交换膜的离子数 __________( 填“大于”、 “小于”或“等于”)通过阳离子交换膜的离子数。
③Na2FeO4 之所以能消毒净水,是因为 Na2FeO4 具有强 氧化性,其还原产物 Fe3+能水解生成 Fe(OH)3 胶体。
答案 (2)①a 4H2O ③BC (1)O2+4e-+2H2O===4OH- 氧化反应
-
Fe2O3· xH2O
-
2Fe3++Fe===3Fe2+ ②Fe - 6e + 8OH
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”), 该 电池工作一段时间后必须充电,充电时生成 NiO2 的反应类型是 __________。 ②写出在用电解法制取高铁酸钠时, 阳极的电极反应式________。 ③你认为高铁酸钠作为一种新型净水剂的理由可能是________。 A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性 B.高铁酸钠具有强氧化性,能消毒杀菌 C.高铁酸钠在消毒杀菌时被还原生成 Fe3+,水解产生氢氧化铁 胶体能吸附悬浮杂质
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
放电 (2)爱迪生蓄电池的反应式为 Fe+NiO2+2H2O 充电 Fe(OH)2+ Ni(OH)2;高铁酸钠 (Na2FeO4)是一种新型 净水剂。用如图装置可以制取少量高铁酸钠。
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
解析
(1)正极发生还原反应,在潮湿的空气中钢铁锈蚀正
极反应式为 O2+2H2O+4e-===4OH-,铁锈的主要成分为 Fe2O3 的水合物,可表示为 Fe2O3· xH2O。由于在生锈的钢 铁中,Fe 过量,当 Fe2O3+6H ===2Fe +3H2O 反应后又 发生 2Fe3++Fe===3Fe2+反应,所以检测不到 Fe3+。 (2)①在该电解池中,Fe 一定做阳极,所以 a 为负极,b
化学
苏教浙江
专题6
化学反应与能量变化
大题冲关滚动练之三 ——电化学原理综合应用题
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
1.铁和铁的化合物在工业生产和日常生活中都有广 泛的用途。请回答下列问题: (1)钢铁锈蚀是目前难以解决的现实问题,电化学 腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发 生还原反应的电极反应式:_____________。 铁锈的主要成分是____________(填写化学式), 将 生锈的铁屑放入 H2SO4 溶液中充分溶解后,在溶 液中并未检测出 Fe3+,用离子方程式说明原因: ___________________________。
2- ===FeO 4 +
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
2.+6 价铬易被人体吸收,可致癌;+3 价铬不易被人 体吸收,毒性小。工业含铬废水的处理方法之一是将 含+6 价铬的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 后进行电解:阳极区生成的 Fe2 + 和
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
3.(1)某课外活动小组同学用下图 1 装置进行实验,试回 答下列问题: ①若开始时开关 K 与 a 连接,则铁发生电化学腐蚀中 的________腐蚀。 ②若开始时开关 K 与 b 连接,则总反应的离子方程式 为_____。
图1
图2
中,Cr 在稀硝酸中无明显现象,说明 Cr 在稀硝酸中钝 化,而 Cu 不钝化,Cu 失电子通过导线到达 Cr 电极,然 后 NO3 在 Cr 电极上得到电子,生成 NO。
-
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
答案
(1)0.05 铬在稀硝酸中可以发生钝化
(2)铬比铜活泼
为正极,当充电时,Ni(OH)2 生成 NiO2,化合价升高, 发生氧化反应。
- - ②在 FeO2 中 Fe 的化合价为+ 6 价, 所以 Fe 应失去 6e , 4 - 电极反应式为 Fe-6e-+8OH-===FeO2 4 +4H2O。
+
3+
大题冲关滚动练之三——电化学原理综合应用题
1 2 3 4 5 6
