各国医疗器械标准目录(中英文对照)
国内国际医疗标准目录对照表
人工心肺机 热交换水箱
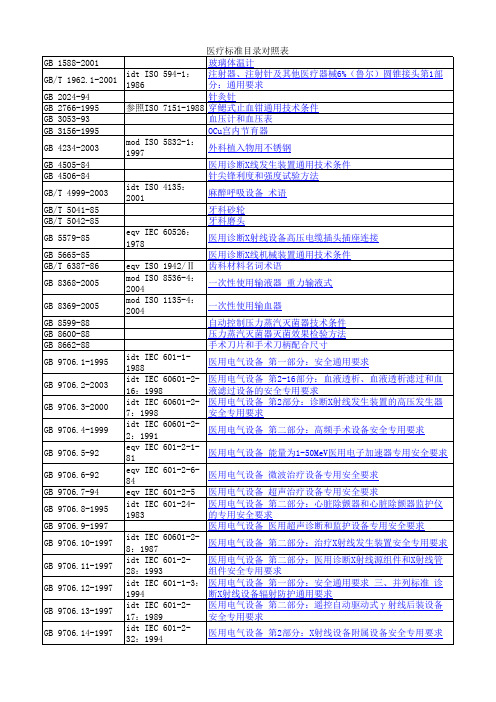
GB 12279-90
参照ISO 5840-84 人工心脏瓣膜通用技术条件
GB 12417-90
参照ISO 采用ISO
5832,等效 6018-87
外科金属植入物通用技术条件
GB 13074-91
血液净化术语 血液透析和血液滤过
GB/T 13797-92 参照IEC 102导则 医用X射线管空白详细规范(可供认证用)
mod ISO 2000
10936.1:
手术显微镜
第1部分:
要求和试验方法
idt IEC 60601-219:1990
医用电气设备 第2部分:婴儿培养箱安全专用要求
neq ISO 8600: 1997
医用内窥镜及附件通用要求
B型超声诊断设备
参照ISO 7151-83 医用钳锁合力、脱开力测定方法
参照ISO 7151-83 医用钳夹持拉力测定方法
eqv ISO 1942/Ⅱ 齿科材料名词术语
mod ISO 8536-4: 2004
一次性使用输液器 重力输液式
mod ISO 1135-4: 2004
一次性使用输血器
自动控制压力蒸汽灭菌器技术条件
压力蒸汽灭菌器灭菌效果检验方法
手术刀片和手术刀柄配合尺寸
idt IEC 601-11988
医用电气设备 第一部分:安全通用要求
GB 11244-2005
neq ISO 8600: 1997
医用内窥镜及附件通用要求
GB 12260-2005
人工心肺机 滚压式血泵
GB 12261-90
参照ISO/DP 7199.3 人工心肺机 鼓泡式氧合器
GB 12262-90
美国FDA_医疗器械体系法规QSR820中英文版

美国FDA 医疗器械体系法规QSR820中文版之巴公井开创作Part 820——质量体系法规——目录Subpart A- 总则820.1 范围820.3 定义 820.5 质量体系Subpart B –质量体系要求820.20 管理职责820.22 质量审核 820.25 人员Subpart C- 设计控制 820.30 设计控制Subpart D- 文件控制 820.40 文件控制Subpart E- 推销控制 820.50 推销控制Subpart F- 标识与可追溯性820.60 标识 820.65 可追溯性Subpart G - 生产和过程控制820.70 生产和过程控制820.72 检验、丈量和试验设备 820.75 过程确认Subpart H - 验收活动: 820.80 进货、过程和成品器械检验 820.86 检验状态Subpart I –分歧格品 820.90 分歧格品Subpart J - 纠正和预防措施 820.100 纠正和预防措施Subpart K –标识和包装控制820.120 设备标签 820.130 设备包装Subpart L –搬运/储存/分销和装置820.140 搬运820.150 贮存820.160 分销 820.170 装置Subpart L –记录820.180 记录的通用要求820.181 设备主要记录820.184 设备历史记录820.186 质量体系记录 820.198 投诉文件Subpart M –服务 820.200 服务Subpart N –统计技术820.250 统计技术Subpart A——总则Subpart A--General Provisions Sec.820.1 范围Sec. 820.1 Scope. (a)适用性Applicability。
(1)实质量体系法规说明了当前良好制造法规Current good manufacturing practice(CGMP)的要求。
美国FDA_医疗器械体系法规QSR820中英文版

美国FDA 医疗器械体系法规QSR820中文版Part 820——质量体系法规——目录Subpart A- 总则820.1 范围820.3 定义820.5 质量体系Subpart B –质量体系要求820.20 管理职责820.22 质量审核820.25 人员Subpart C- 设计控制820.30 设计控制Subpart D- 文件控制820.40 文件控制Subpart E- 采购控制820.50 采购控制Subpart F- 标识与可追溯性820.60 标识820.65 可追溯性Subpart G - 生产和过程控制820.70 生产和过程控制820.72 检验、测量和试验设备820.75 过程确认Subpart H - 验收活动:820.80 进货、过程和成品器械检验820.86 检验状态Subpart I –不合格品820.90 不合格品Subpart J - 纠正和预防措施820.100 纠正和预防措施Subpart K –标识和包装控制820.120 设备标签820.130 设备包装Subpart L –搬运/储存/分销和安装820.140 搬运820.150 贮存820.160 分销820.170 安装Subpart L –记录820.180 记录的通用要求820.181 设备主要记录820.184 设备历史记录820.186 质量体系记录820.198 投诉文件Subpart M –服务820.200 服务Subpart N –统计技术820.250 统计技术Subpart A——总则Subpart A--General ProvisionsSec.820.1 范围Sec. 820.1 Scope.(a)适用性Applicability。
(1)本质量体系法规阐明了当前良好制造法规Current good manufacturing practice (CGMP)的要求。
本标准适用于所有预期用于人类的成品器械的设计、制造、包装、标识、储存、安装和服务中所使用的管理方法、设施和控制。
医疗器械常用词汇中英文对照

69
Ⅰ类
70
Ⅰ类
71
Ⅱ类
72
Ⅰ类
73
Ⅱ类
74
Ⅰ类
75
681005 681006 681007.1 681007.2 681008.1 681008.2
Ⅰ类
矫形(骨科)外科用钩、针 orthopedic surgical hook & needle 矫形(骨科)外科用刮 orthopedic surgical scrape 矫形(骨科)外科用有源器械 orthopedic surgical instruments with power 矫形(骨科)外科用有源器械 orthopedic surgical instruments with power 矫形(骨科)外科用其它器械 other orthopedic surgical instruments 矫形(骨科)外科用其它器械 other orthopedic surgical instruments 妇产科用手术器械 obstetric and gynecologic surgical operation instruments 妇产科用刀 obstetric and gynecologic knife 妇产科用剪 obsteric and gynecologic scissors 妇产科用钳 obsteric and gynecologic forceps 妇产科用镊、夹 obsteric and gynecologic tweezer & clip 妇产科用钩、针 obsteric and gynecologic hook & needle 妇产科用其他器械 other obsteric and gynecologic instruments
一次性医疗器械英文标准清单

EN 980:2003 expiry date : 2010-05-31 to be replaced by EN
980:2008
EN 1041:1998 to be replaced by EN 1041:2008
EN ISO 14971:2000+A1:2003 expiry date : 2010-03-31 to be replaced
| EN 980:2003 | ISO 10993-4:2002/A1:2006| immunization) |
| | | EN ISO 7886-4:2006 ( |
| EN 1041:1998 | EN ISO 10993-5:1999 | Syringes with re-use |
| | | prevention feature) |
EN ISO 7886-3:2005 Sterile hypodermic syringes for single use - Part 3:
Auto-disable syringes for fixed-dose immunization (ISO 7886-3:2005);
German version EN ISO 7886-3:2005(自毁式皮下注射)
| ISO 11607:2003EN | EN ISO 10993-7:2008 | |
| 868-1:1997 | | |
| | EN ISO 10993-10:2002EN | |
| | ISO | EN ISO 8536-4:2007 |
| | 10993-10:2002/A1:2006 | (infusion set) |
by EN ISO 14971:2007
美国FDA_医疗器械体系法规QSR820中英文版之欧阳体创编

美国FDA 医疗器械体系法规QSR820中文版Part 820——质量体系法规——目录Subpart A- 总则820.1 范围820.3 定义 820.5 质量体系Subpart B –质量体系要求820.20 管理职责820.22 质量审核 820.25 人员Subpart C- 设计控制 820.30 设计控制Subpart D- 文件控制 820.40 文件控制Subpart E- 采购控制 820.50 采购控制Subpart F- 标识与可追溯性820.60 标识 820.65 可追溯性Subpart G - 生产和过程控制820.70 生产和过程控制820.72 检验、测量和试验设备 820.75 过程确认Subpart H - 验收活动: 820.80 进货、过程和成品器械检验 820.86 检验状态Subpart I –不合格品 820.90 不合格品Subpart J - 纠正和预防措施 820.100 纠正和预防措施Subpart K –标识和包装控制820.120 设备标签 820.130 设备包装Subpart L –搬运/储存/分销和安装820.140 搬运820.150 贮存820.160 分销 820.170 安装Subpart L –记录820.180 记录的通用要求820.181 设备主要记录820.184 设备历史记录820.186 质量体系记录 820.198 投诉文件Subpart M –服务 820.200 服务Subpart N –统计技术820.250 统计技术Subpart A——总则Subpart A--General Provisions Sec.820.1 范围Sec. 820.1 Scope. (a)适用性Applicability。
(1)本质量体系法规阐明了当前良好制造法规Current good manufacturing practice(CGMP)的要求。
医疗器械国家、行业标准目录
YY
14
1990
1991.4.1
生化分析仪
YY
15
1990
1991.4.1
功量机
YY
16
1993
1993.10.1
低频电子脉冲治疗仪
YY0016-1990
YY
17
2002
2003.4.1
骨接合植入物,金属接骨板
WS2-52-73、YY0017-1990、YY0121-1993
YY
127.5
1999
1999.10.1
口腔材料生物学评价第2单元:口腔材料生物试验方法吸入毒性试验
YY/T
127.6
1999
1999.10.1
口腔材料生物学评价第2单元:口腔材料生物试验方法显性致死试验
YY/T
127.7
2001
2001.8.1
口腔材料生物学评价第二单元:口腔材料生物试验方法—牙髓牙本质应用试验
YY
128
1993
1993.10.1
医用X射线防护装置及用具
ZBC3017-3022-89
YY/T
129
1993
1993.10.1
医用诊断X射线可变限束器技术要求及试验方法
YY/T
130
1993
1993.10.1
医用X射线设备及用具标准体系表
YY
131
93
1993.12.1
口服液瓶撕拉铝盖
YY
132
YY
87
1992
1992.10.1
电泳仪
ZBC44001-85
YY
88
1992
1992.10.1
EN 1041-2008 医疗器械厂商提供的信息(中英文版)
Information suppliedby the manufacturer ofmedical devices医疗器械厂商提供的信息I C S 01.110; 11.040.01; 11.120.01B R I T I S H S T A N D A R D B S E N1041:2008N O COPYING W I T H O U T BSI PERMISSION EXCEPT AS PERMITTED BY COPYRIGHT L A WB S E N 1041:2008National foreword国家前言This British Standard is the U K implementation of E N 1041:2008. Itsupersedes BS E N1041:1998, which will be withdrawn on 3 August 2011.此英国标准是英国执行的EN1041:2008,取代了英国标准EN 1041:1998,将于2011年8月3日被孤立。
The U K participation in its preparation was entrusted to TechnicalCommittee CH/210/3, General terminology and symbols.A list of organizations represented on this committee can be obtained on requestto its secretary.This publication does not purport to include all the necessary provisions ofa contract. Users are responsible for its correct application.Compliance with a British Standard cannot confer immunity fromlegal obligations.英国参与此制定是委托了技术委员会CH/210/3,常规术语和符号。
EN 1041-2008 医疗器械厂商提供的信息(中英文版)
Information suppliedby the manufacturer ofmedical devices医疗器械厂商提供的信息I C S 01.110; 11.040.01; 11.120.01B R I T I S H S T A N D A R D B S E N1041:2008N O COPYING W I T H O U T BSI PERMISSION EXCEPT AS PERMITTED BY COPYRIGHT L A WB S E N 1041:2008National foreword国家前言This British Standard is the U K implementation of E N 1041:2008. Itsupersedes BS E N1041:1998, which will be withdrawn on 3 August 2011.此英国标准是英国执行的EN1041:2008,取代了英国标准EN 1041:1998,将于2011年8月3日被孤立。
The U K participation in its preparation was entrusted to TechnicalCommittee CH/210/3, General terminology and symbols.A list of organizations represented on this committee can be obtained on requestto its secretary.This publication does not purport to include all the necessary provisions ofa contract. Users are responsible for its correct application.Compliance with a British Standard cannot confer immunity fromlegal obligations.英国参与此制定是委托了技术委员会CH/210/3,常规术语和符号。
欧盟mdcg医疗器械法规中英文对照
欧盟mdcg医疗器械法规中英文对照全文共3篇示例,供读者参考篇1The European Union Medical Device Regulation (MDR) provides a comprehensive regulatory framework to ensure the safety and effectiveness of medical devices marketed in the EU. The MDR replaces the existing Medical Device Directive (MDD) and introduces several new requirements to enhance the oversight of medical devices throughout their lifecycle.In this article, we will provide a side-by-side comparison of key provisions in the MDR in both English and Chinese to help stakeholders understand the changes and implications of the new regulation.Title/标题欧盟医疗器械法规/ European Medical Device RegulationScope/范围The MDR applies to medical devices and in vitro diagnostic medical devices intended for use by humans for the purpose of diagnosis, prevention, monitoring, treatment or alleviation ofdisease./ 欧盟医疗器械法规适用于用于诊断、预防、监测、治疗或减轻疾病目的的医疗器械和体外诊断医疗器械。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NF S90-410-1988
NF S90-411-1988
NF S90-414-1988
NF S90-420-1986
NF S90-426-1988
外科医疗器械.外科植入物.不锈钢粗糙面骨干板.尺寸和表面特性
NF S90-பைடு நூலகம்27-1990
外科医疗器械.脊椎用接骨器材.不锈钢制或钴基合金制脊椎板.A系 统.尺寸与几何形状 外科医疗器械.矫形外科设备.传动连接.第2部分:十字形和一字形旋 具 外科医疗器械.外科植入物.嵌入胯骨中的人造大腿部件.嵌合物顶端 部分和阳部分的规范 外科医疗器械.外科植入物.局部和全部髋关节修复术.第2部分: 由 金属和塑料材料制成的关节面 外科医疗器械.骨科关节假体.基本规范 外科医疗器械.膝关节全体和部分假肢.第1部分:分类、定义和尺寸 名称 外科医疗器械.髋关节全部和部分假体.第1部分:分类和,尺寸的标识 和要求 外科医疗器械.止血钳.尺寸和试验 外科医疗器械.钳、穿线管和持针器.尺寸和试验 外科医疗器械.一般用途.手术刀、解剖镊、重复使用的手术刀、导 管 医用外科设备.外科医疗器械.剪刀.尺寸和试验 外科医疗器械.外科植入物.心血管植入物、心脏瓣膜 外科医疗器械.矫形和假肢组件.肩轴和颈轴 外科医疗器械.矫形和假肢组件.带凸耳的凸圆头开槽全螺纹螺钉 外科医疗器械.矫形和假肢组件.带凸耳的平圆头开槽合螺纹螺钉
NF C52-558-2-15-2001
NF C71-025-1995 NF C74-0102-1993 NF C74-012-1993
NF C74-0131-1996
NF C74-014-1994
NF C74-043-2003
NF C74-114-1992
NF C74-118-1993
NF C74-122-1996 NF C74-122/A11-2000 NF C74-134-1994 NF C74-135-1994 NF C74-136-1994
NF S90-529-1973
编号
中文名称 测量、控制和试验室用电气设备的安全要求.第723部分:医疗材料处 理及实验室加工用蒸压器的特殊要求
NF C42-723-1996
NF C42-724-1997
测量、控制和实验室用电气设备的安全要求.第2-042部分:使用毒气 的实验室处理和医疗材料处理用高压釜和消毒
NF C42-726-1997
NF C74-152-1997
NF C74-153-1997
NF C74-201-1999
NF C74-205-2002 NF C74-208/A1-2001
医疗电气设备.在放射治疗中使用的带电离室的剂量计 医疗电气设备.医疗电子加速器.功能特性 医疗电气设备.第2部分:远程控制的自动驱动γ射线后装设备安全的 特殊要求 医疗电气设备.放射性核素调整器.描述性能的特殊方法 医疗电气设备.电光X射线图象增强器的特性.第1部分:入口尺寸的测 定 医疗电气设备.电光X射线图象增强器的特性.第2部分:变换系数的测 定 医疗电气设备. 电光X射线图象增强器的特性.第3部分:亮度分配和 亮度不均匀的测定(欧州标准61 262-3) 医疗电气设备.电光X-射线图象增强器的特性.第4部分:图象失真的 测定 医疗电气设备.电光X射线图象增强器的特性.第6部分:对比率和杂光 指数的测定 X射线医疗诊断保护装置.第1部分:材料衰减特性的测定 X射线医疗诊断保护装置.第2部分:防护玻璃板 医疗电器设备.第2部分:具有内部功率源的外部心脏起搏器的特殊安 全要求 医疗电器设备.第2部分:内诊镜检查设备安全性的特殊要求 医疗电气设备.第2-41部分:外科和诊断照明设备的特殊安全要求 医疗电气设备.第2部分:诊断和治疗用激光设备安全性特殊要求 医用电气设备.微波医疗仪器.特殊安全规则 可植入的有源医疗器件.第1部分:由制造商提供的安全性,标识和信 息的一般要求
NF C74-210-1996
NF C74-214-1995
NF C74-221-1994
NF C74-222-1994
NF C74-223-1994
NF C74-224-1994
NF C74-226-1994
NF C74-228-1-2002 NF C74-228-2-2002
NF C74-308-1995
NF S90-433-1986
NF S90-443-1989
NF S90-444-1987
NF S90-445-1985
NF S90-446-1985
NF S90-449-1985
NF S90-460-1982 NF S90-461-1982
NF S90-462-1982
NF S90-463-1982 NF S90-480-1987 NF S90-510-1973 NF S90-511-1973 NF S90-512-1973
NF C74-318-1997 NF C74-325-2003 NF C74-341-1996 NF C74-372-1985
NF C74-502-1-1998
NF C91-011/A1-1999
工业、科学和医疗用射频设备的无线电干扰特性测量方法与限值
NF C91-011/A2-2003
工业、科学和医疗(ISM)用射频设备.无线电干扰特性.极限值和测量 方法 医疗诊断超声波设备的声输出申报的要求
NF S90-525-1973
NF S90-526-1973 NF S90-527-1973
NF S90-528-1973
外科医疗器械.矫形和假肢组件.带HOFFA销钉、无滚珠轴承、带套膝 的连接件 外科医疗器械.矫形和假肢组件.无销钉、无滚珠轴承、带套臀部连 接件 外科医疗器械.矫形和假肢组件.HOFFA销钉带单臀部连接件 外科医疗器械.矫形和假肢组件.常HOFFA销钉、无滚珠轴承:带套臀 部连接件 外科医疗器械.矫形和假肢组件.无销钉带滚珠有套臀部连接件 外科医疗器械.矫形和假肢组件.带套的HOFFA销钉、无滚珠轴承有套 臀部连接件 外科医疗器械.矫形和假肢组件.单肘的连接件 外科医疗器械.外部乳房假体 牙科学.牙科用医疗装置.牙科植入物 牙科学.牙科用医疗装置.仪器 牙科学.牙科用医疗装置.材料 牙科工艺.用于牙科的医疗装置的生物配伍性预诊评估.牙科材料的 试验方法 牙科学.牙科用医疗装置.设备 活体外医疗装置.生物起源的样品数量测量.参考测量过程展示(欧洲 标准EN 12286)
NF C97-904-1994
NF C97-907-1995
超声领域.0.5MHz至15MHz范围内的液体中医疗超声设备超声功率的 测量和特点指南
NF S64-021/A1-2003 NF S90-010-1987 NF S90-014-1981
医疗车辆及其设备.道路救护车 外科医疗器械.可重复使用的全玻璃或金属和玻璃医疗注射器.第1部 分:尺寸 外科医疗器械.可多次使用胰岛素玻璃注射器
NF S90-033-1986 NF S90-045-1985 NF S90-133-1989 NF S90-191-1986 NF S90-201-1990 NF S90-202-1990 NF S90-203-1986 NF S90-221-1986 NF S90-222-1986
外科医疗器械.多次用橡胶避孕套 外科医疗器械.制药或配药用铝帽.验收检验 外科医疗器械.外科手术用的辐射热保温箱.规范 外科医疗器械.输液用玻璃瓶.几何特性及标记 外科医疗器械.输血必需 外科医疗器械.输液必需 外科医疗器械.输血和输液传送、加长和其它附属装置 外科医疗器械.输血器械.500ml玻璃瓶 外科医疗器械.输血器械.250ml玻璃瓶 外科医疗器械.输血器械.血及其制品用软塑料简式囊的尺寸和物理 性能 外科医疗器械.医用输血器械.血及其制品用软塑料简式囊的尺寸和 物理特性 外科医疗器械.生物抽样用一次性器皿.真空器皿 外科医疗器械.推力注射器.功能特性 外科医疗器材.血液透析仪器.功能的特性 外科医疗器械.活膜渗析分布监测器.功能特性 外科医疗器械.细胞和血浆离心分离器(监视器和一次性用品).工作 性能 外科医疗器械.医院用病床 外科医疗器械.手术台 外科医疗器械.蒸气消毒用包、套、软片和卷筒尺寸 外科医疗器械.蒸汽消毒器具 医疗保健设施.清洁室和相关受控环境.空气中污物的控制要求
NF S90-361-1990 NF S90-408-1981
外科医疗器械.钉子.股骨最高端用的不锈钢片 外科医疗器械.外科植入物.氧化铝陶瓷制品 外科医疗器械.外科植入物.接骨板.不对称螺纹和可变底座(球形) 板 外科医疗器械.外科植入物.不对称螺纹和球形底座的接骨用金属螺 钉.尺寸 外科医疗器械.外科植入物.不对称螺纹和球形底座接骨用不锈钢螺 丝.机械性能和试验 外科医疗器械.外科植入物.骨髓腔内插钉术系统.第1部分:首蓿叶式 或V型剖面的骨髓腔内钉
NF S90-513-1973
外科医疗器械.矫形和假肢组件.带安装边的凸圆头半螺纹连接螺钉
NF S90-514-1973 NF S90-520-1973 NF S90-521-1973 NF S90-522-1973 NF S90-523-1973 NF S90-524-1973
外科医疗器械.矫形和假肢组件.凸耳凸圆头铆钉 外科医疗器械.矫形和假肢组件.带连接挂钩的可拆卸踝骨的连接 外科医疗器械.矫形和假肢组件.连接钩 外科医疗器械.矫形和假体组件.不可拆卸的单踝骨连接 外科医疗器械.矫形和假肢组件.不可拆卸的有套踝骨连接 外科医疗器械.矫形和假肢组件.无销单膝的连接 外科医疗器械.矫形和假肢组件.无销、无滚珠轴承、有套膝骨的连 接 外科医疗器械.矫形和假肢组件.带滚珠轴承、无销有套膝骨的连接 外科医疗器械.矫形和假肢组件.带HOFFA销钉单膝连接件
NF S90-230-1978
NF S90-231-1978
NF S90-240-1990 NF S90-251-1986 NF S90-304-1989 NF S90-305-1986 NF S90-307-1990 NF S90-312-1984 NF S90-316-1987 NF S90-321-1986 NF S90-325-1989 NF S90-351-2003
