仪器分析原子吸收PPT
合集下载
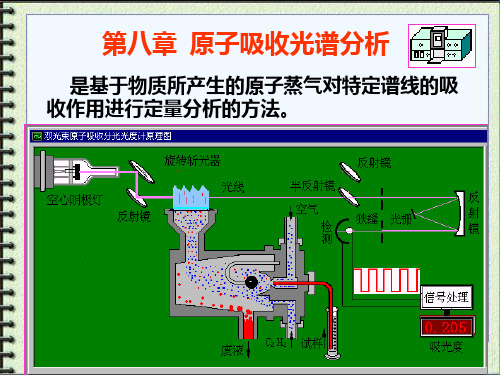
仪器分析原子吸收光谱分析

∫ I =
e 0
I0e-KLd
∫ A = lg
e 0
I0
d
∫e 0
I0e-KLd
第14页,本讲稿共55页
对锐线光源,可以认为Kν= b×K0 为常数:
A
=
lg 1 e-bK0L
=
lg
eK0Lb
=
0.4343K0Lb
Under normal operation condition for AAS, line profile is mainly determined by Doppler broadening, hence,
这以公式表明:积分吸收值与单位原子蒸汽中吸收辐 射的基态原子数呈简单的线性关系,这是原子吸收光谱分析
法的重要理论依据。
第10页,本讲稿共55页
前面公式中: e为电子电荷;m为电子质量;c为光速;N0
为单位体积内基态原子数;f 振子强度,即能
被入射辐射激发的每个原子的平均电子数,它正 比于原子对特定波长辐射的吸收几率。
若能测定积分吸收,则可求出原子浓度。 但是,测定谱线宽度仅为10-3nm的积分吸收, 需要分辨率非常高的色散仪器,技术上很难实现。 所以,1955年瓦尔西提出采用锐线光源来解决 求积分吸收值的难题。参见下图:
第11页,本讲稿共55页
第12页,本讲稿共55页
由图可见,在使用锐线光源时,光源发射线半宽度 很小,并且发射线与吸收线的中心频率一致。这时发射 线的轮廓可看作一个很窄的矩形,即峰值吸收系数K 在
一、原子吸收线和原子发射线
A
B
A 产生吸收光谱
B 产生发射光谱
E3
E0 基态能级
E1、E2、E3、激发态能级
E2
原子吸收光谱仪实验课ppt课件

22
2.2.7 样品分析
23
2.2.8 关机
24
2.3 原子吸收的干扰及抑制
1. 物 理 干 扰(基体效应) 如:通过标准加入法来抑制 3. 光 谱 干 扰 如:通过氘灯进行校正 2. 化 学 干 扰 如:石墨炉法测铅加入加入磷酸二氢铵 (NH4H2PO4)
25
化学干扰
产生:待测元素与共存组分发生了化学反应,生成了难挥发或难 解离的化合物,使基态原子数目减少所产生的干扰。
24小时,并清洗干净
• 矩管及与发生器的连接管使用前保持清洁
、干燥
• 测砷时使用到碘化钾,因此应及时用酸清
洗整个系统4小时以上,再用蒸馏水清洗, 以免碘化钾吸收汞蒸气影响汞的测定。
44
思考题
• 原子吸收光谱仪为何要做维护保养? • 测试时如何选择定量分析方法? • 原子吸收光谱用于定量分析的理论依据是
什么?
45
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
46
气 液 分 离 器
蠕动泵管
42
3.7 氢化物发生器使用注意事项
当仪器调试好后,确认光路是最优化状态 时,测定发现无信号,相对偏差太大,应 考虑以下几点:
蠕动泵管是否正常运作 矩管及与发生器的连接管是否清洁、干燥 气液分离器是否干净无污
43
3.7.1 氢化物发生器的维护保养
• 蠕动泵管用后及时清洗,防止堵塞 • 气液分离器污染后,必要时拆下用硝酸泡
特点:原子吸收分析的主要干扰来源,具有选择性。 如:石墨炉法加入加入磷酸二氢铵(NH4H2PO4)
26
3 仪器的维护与保养
• 仪器缺乏保养可能出现的问题 • 仪器的维护保养内容 • 仪器的使用注意事项与保养
2.2.7 样品分析
23
2.2.8 关机
24
2.3 原子吸收的干扰及抑制
1. 物 理 干 扰(基体效应) 如:通过标准加入法来抑制 3. 光 谱 干 扰 如:通过氘灯进行校正 2. 化 学 干 扰 如:石墨炉法测铅加入加入磷酸二氢铵 (NH4H2PO4)
25
化学干扰
产生:待测元素与共存组分发生了化学反应,生成了难挥发或难 解离的化合物,使基态原子数目减少所产生的干扰。
24小时,并清洗干净
• 矩管及与发生器的连接管使用前保持清洁
、干燥
• 测砷时使用到碘化钾,因此应及时用酸清
洗整个系统4小时以上,再用蒸馏水清洗, 以免碘化钾吸收汞蒸气影响汞的测定。
44
思考题
• 原子吸收光谱仪为何要做维护保养? • 测试时如何选择定量分析方法? • 原子吸收光谱用于定量分析的理论依据是
什么?
45
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
46
气 液 分 离 器
蠕动泵管
42
3.7 氢化物发生器使用注意事项
当仪器调试好后,确认光路是最优化状态 时,测定发现无信号,相对偏差太大,应 考虑以下几点:
蠕动泵管是否正常运作 矩管及与发生器的连接管是否清洁、干燥 气液分离器是否干净无污
43
3.7.1 氢化物发生器的维护保养
• 蠕动泵管用后及时清洗,防止堵塞 • 气液分离器污染后,必要时拆下用硝酸泡
特点:原子吸收分析的主要干扰来源,具有选择性。 如:石墨炉法加入加入磷酸二氢铵(NH4H2PO4)
26
3 仪器的维护与保养
• 仪器缺乏保养可能出现的问题 • 仪器的维护保养内容 • 仪器的使用注意事项与保养
PPT原子吸收光谱法分析原理和方法PPT课件PPT54页

AAS 分析时,待测物浓度很低,该变宽可勿略。
❖ 外界压力增加——谱线中心频率0位移、形状和宽度发生变化—— 发射线与吸收线产生错位——影响测定灵敏度;
❖ 温度在1500-30000C之间,压力为1.01310-5Pa ——热变宽和压变宽 有相同的变宽程度;
❖ 火焰原子化器——压变宽为主要;石墨炉原子化器——热变宽为主 要。
第6页,共54页。
根据吸收定律的表达式,以 I~ 和 K- 分别作图得吸收强度与频 率的关系及谱线轮廓。可见谱线是有宽度的。
K0
K0/2 I0
I K
0
I~ (吸收强度与频率的关系)
0
K~ (谱线轮廓)
图中:
K—吸收系数;K0—最大吸收系数; 0,0—中心频率或波长(由原子能级决定); ,—谱线轮廓半宽度(K0/2处的宽度);
电流越大,光强越大,但过大则谱线变宽且强度不稳定;充入低压惰性气 体可防止与元素反应并减小碰撞变宽。 问题:为什么HCL会产生低背景的锐线光源? 答:低压-原子密度低,Lorentz Broadening小;小电流-温度低Doppler Broadening 小,故产生锐线光源!惰性气体难于激发且谱线相对简单——低背景。
K0
1
D
ln 2 e2 mc
N0 f
1
D
ln 2 e2 (c) f mc
A KcL
上式表明,当用锐线光源作原子吸收测定时,所得A与原子蒸气中待测元素的基态 原子数成正比。
第15页,共54页。
3. 锐线光源 根据Walsh的两点假设,发射线必须是“锐线”(半宽度很小的谱线)。
发射线
吸收线
I
形式,其高度和角度可调(让光通过火焰适宜的部位并有最
❖ 外界压力增加——谱线中心频率0位移、形状和宽度发生变化—— 发射线与吸收线产生错位——影响测定灵敏度;
❖ 温度在1500-30000C之间,压力为1.01310-5Pa ——热变宽和压变宽 有相同的变宽程度;
❖ 火焰原子化器——压变宽为主要;石墨炉原子化器——热变宽为主 要。
第6页,共54页。
根据吸收定律的表达式,以 I~ 和 K- 分别作图得吸收强度与频 率的关系及谱线轮廓。可见谱线是有宽度的。
K0
K0/2 I0
I K
0
I~ (吸收强度与频率的关系)
0
K~ (谱线轮廓)
图中:
K—吸收系数;K0—最大吸收系数; 0,0—中心频率或波长(由原子能级决定); ,—谱线轮廓半宽度(K0/2处的宽度);
电流越大,光强越大,但过大则谱线变宽且强度不稳定;充入低压惰性气 体可防止与元素反应并减小碰撞变宽。 问题:为什么HCL会产生低背景的锐线光源? 答:低压-原子密度低,Lorentz Broadening小;小电流-温度低Doppler Broadening 小,故产生锐线光源!惰性气体难于激发且谱线相对简单——低背景。
K0
1
D
ln 2 e2 mc
N0 f
1
D
ln 2 e2 (c) f mc
A KcL
上式表明,当用锐线光源作原子吸收测定时,所得A与原子蒸气中待测元素的基态 原子数成正比。
第15页,共54页。
3. 锐线光源 根据Walsh的两点假设,发射线必须是“锐线”(半宽度很小的谱线)。
发射线
吸收线
I
形式,其高度和角度可调(让光通过火焰适宜的部位并有最
环境仪器分析PPT课件

-
10
第四章 荧光及磷光光谱法
4.1 原理 4.2 荧光光谱仪 4.3 荧光分析方法 4.4 荧光光谱法在环境监测中的应用 4.5 磷光分析法
-
11
第五章 化学发光监测技术
5.1 原理 5.2 化学发光反应的类型 5.3 化学发光监测仪器
-
12
第六章 色谱分析法理论基础6.1 色谱法理论础➢定量校正因子
➢
定量方法
-
14
第八章 高效液相色谱分析法
8.1 高效液相色谱仪
➢ 高压输液系统 ➢ 进样系统 ➢ 色谱柱 ➢ 检测系统 ➢ 附属系统
-
15
第二章 原子吸收分光光度法 2.1 原子吸收分光光度法基本原理
原子吸收分光光度法是基于空心阴极灯发射出 的待测元素的特征谱线,通过试样蒸气,被蒸 气中待测元素的基态原子所吸收,由特征谱线 被吸收的程度,来测定试样中待测元素含量的
※选择监测项目应遵循如下原则:
① 对污染物的自然性、化学活性、毒性、扩散性、持久
性、生物可分解性和积累性等全面分析,从中选出影响 面广、持续时间长,不易或不能被微生物所分解而且能 使动植物发生病变的物质作为日常例行的监测项目。对 某些有特殊目的或特殊情况的监测工作,则要根据具体
情况和需要选择要监测的项目。
完善监测网络、实现监测信- 息网络化管理。
Back 8
第二章 原子吸收分光光度法
2.1 基本原理 2.2 原子吸收分光光度计 2.3 测定条件的选择 2.4 定量分析方法 2.5 灵敏度及检出极限 2.6 原子吸收光谱法在环境监测中的应用
-
9
第三章 原子荧光光谱法
3.1 概述 3.2 原理 3.3 原子荧光光谱仪 3.4 定量分析方法及应用
大学仪器分析教学课件原子吸收光谱仪主要部件.ppt

device of atomization
四、单色器
monochromators
五、检测器
detector
15:25:11
原子吸收仪器(1)
15:25:11
原子吸收仪器(2)
15:25:11
原子吸收仪器(3)
15:25:11
一、流程
特点
1.采用待测元素的 锐线光源 2.单色器在火焰与 检测器之间 3.原子化系统
(1)雾化器
结构如图所示
主要缺点:雾化效率低。
15:25:11
(动画)
(2)燃烧器
它的作用是产生火焰,使进入火焰的试样 气溶胶蒸发和原子化。燃烧器是用不锈钢材料制 成,耐腐蚀、耐高温。燃烧器所用的喷灯有“孔 型”和“长缝型”两种。预混合型燃烧器中,一
般 采用吸收光程较长的长缝型喷灯。喷灯的缝长和 缝宽随火焰而不同, 空气-乙炔焰: 0.5mm×100mm; 氧化亚氮-乙炔焰:0.5mm×50mm;
(动画)
原子化过程分为干燥、灰化(去除基体)、原子化、净化( 去除残渣) 四个阶段,待测元素在高温下生成基态原子。
15:25:11
(3)优缺点
优点:原子化程度高,试样用量少(1-100μL),可测固 体及粘稠试样,灵敏度高,检测极限10-12 g/L。
缺点:重现性差,测定速度慢,操作不够简便,装置复 杂。
15:25:11
5.其他原子化方法
(1)低温原子化方法 主要是氢化物原子化方法,原子化温度700~900 ゜C ; 主要应用于:As、Sb、Bi、Sn、Ge、Se、Pb、Ti等元素 原理: 在酸性介质中,与强还原剂硼氢化钠反应生成气
态氢化物。例
AsCl3 +4NaBH4 + HCl +8H2O = AsH3 ↑+4NaCl +4HBO2+13H2 将待测试样在专门的氢化物生成器中产生氢化物,送入原
四、单色器
monochromators
五、检测器
detector
15:25:11
原子吸收仪器(1)
15:25:11
原子吸收仪器(2)
15:25:11
原子吸收仪器(3)
15:25:11
一、流程
特点
1.采用待测元素的 锐线光源 2.单色器在火焰与 检测器之间 3.原子化系统
(1)雾化器
结构如图所示
主要缺点:雾化效率低。
15:25:11
(动画)
(2)燃烧器
它的作用是产生火焰,使进入火焰的试样 气溶胶蒸发和原子化。燃烧器是用不锈钢材料制 成,耐腐蚀、耐高温。燃烧器所用的喷灯有“孔 型”和“长缝型”两种。预混合型燃烧器中,一
般 采用吸收光程较长的长缝型喷灯。喷灯的缝长和 缝宽随火焰而不同, 空气-乙炔焰: 0.5mm×100mm; 氧化亚氮-乙炔焰:0.5mm×50mm;
(动画)
原子化过程分为干燥、灰化(去除基体)、原子化、净化( 去除残渣) 四个阶段,待测元素在高温下生成基态原子。
15:25:11
(3)优缺点
优点:原子化程度高,试样用量少(1-100μL),可测固 体及粘稠试样,灵敏度高,检测极限10-12 g/L。
缺点:重现性差,测定速度慢,操作不够简便,装置复 杂。
15:25:11
5.其他原子化方法
(1)低温原子化方法 主要是氢化物原子化方法,原子化温度700~900 ゜C ; 主要应用于:As、Sb、Bi、Sn、Ge、Se、Pb、Ti等元素 原理: 在酸性介质中,与强还原剂硼氢化钠反应生成气
态氢化物。例
AsCl3 +4NaBH4 + HCl +8H2O = AsH3 ↑+4NaCl +4HBO2+13H2 将待测试样在专门的氢化物生成器中产生氢化物,送入原
原子吸收光谱分析PPT课件
N0激发态原子数,N基态原子数,c 待测元素浓度
即: A = lg(I0/I) = K' c
16
8.3 原子吸收光谱仪 1. 构成
(1) 特点
➢采用锐线光源;
➢单色器在火焰与检
测器之间;
➢采用调制方式区分
光源和原子化系统
的辐射
17
原子吸收中的原子发射现象
在原子化过程中,原子受到辐射跃迁到激发态后,处于 不稳定状态,将再跃迁至基态,故既存在原子吸收,也有原 子发射。尽管返回释放出的能量可能有多种形式,产生的辐 射也不在一个方向上,但对测量仍将产生一定干扰。
2.放大器 将光电倍增管输出的信号放大。 3.对数变换器 光强度与吸光度之间的转换。 4.显示、记录 原子吸收计算机工作站。
33
8.4 定量分析方法
1. 标准曲线法
配制一系列不同浓度的标准试样,由低到高依次分析,将 获得的吸光度A数据对应于浓度c作标准曲线。在相同条件下 测定试样的吸光度A数据,在标准曲线上查出对应的浓度值 。
第八章 原子吸收光谱分析
是基于物质所产生的原子蒸气对特定谱线的吸 收作用进行定量分析的方法。
1
8.1 原子吸收光谱分析概述
原子吸收光谱与发射光谱
➢ 基态第一激发态
吸收一定频率的辐射能量
产生共振吸收
吸收光谱
激发态基态
发射出一定频率的辐射
产生共振线
发射光谱
➢ 原子吸收线比发射线数目少,谱线重叠概率小,光谱干
4
能级跃迁
分子中电子能级 间跃迁的同时,总 伴随有振动和转动 能级间的跃迁。即 电子光谱中总包含 有振动能级和转动 能级间跃迁产生的 若干谱线而呈现宽 谱带。
5
2. 光吸收定律 ➢朗伯-比耳定律
即: A = lg(I0/I) = K' c
16
8.3 原子吸收光谱仪 1. 构成
(1) 特点
➢采用锐线光源;
➢单色器在火焰与检
测器之间;
➢采用调制方式区分
光源和原子化系统
的辐射
17
原子吸收中的原子发射现象
在原子化过程中,原子受到辐射跃迁到激发态后,处于 不稳定状态,将再跃迁至基态,故既存在原子吸收,也有原 子发射。尽管返回释放出的能量可能有多种形式,产生的辐 射也不在一个方向上,但对测量仍将产生一定干扰。
2.放大器 将光电倍增管输出的信号放大。 3.对数变换器 光强度与吸光度之间的转换。 4.显示、记录 原子吸收计算机工作站。
33
8.4 定量分析方法
1. 标准曲线法
配制一系列不同浓度的标准试样,由低到高依次分析,将 获得的吸光度A数据对应于浓度c作标准曲线。在相同条件下 测定试样的吸光度A数据,在标准曲线上查出对应的浓度值 。
第八章 原子吸收光谱分析
是基于物质所产生的原子蒸气对特定谱线的吸 收作用进行定量分析的方法。
1
8.1 原子吸收光谱分析概述
原子吸收光谱与发射光谱
➢ 基态第一激发态
吸收一定频率的辐射能量
产生共振吸收
吸收光谱
激发态基态
发射出一定频率的辐射
产生共振线
发射光谱
➢ 原子吸收线比发射线数目少,谱线重叠概率小,光谱干
4
能级跃迁
分子中电子能级 间跃迁的同时,总 伴随有振动和转动 能级间的跃迁。即 电子光谱中总包含 有振动能级和转动 能级间跃迁产生的 若干谱线而呈现宽 谱带。
5
2. 光吸收定律 ➢朗伯-比耳定律
仪器分析张新荣原子吸收光谱ppt

在生物体内的分布、代谢和作用。
03
临床诊断与疾病预防
通过原子吸收光谱法对生物体液和排泄物中的元素进行定量分析,为
临床诊断和疾病预防提供依据和支持。
原子吸收光谱法的应用前景及挑战
样品前处理
原子吸收光谱法的样品前处理方法需要进一步优化和完 善,以提高待测元素的回收率和纯度,降低干扰物质的 影响。
仪器性能与技术参数
仪器分析张新荣原子吸收光谱
xx年xx月xx日
Байду номын сангаас
目 录
• 原子吸收光谱法简介 • 原子吸收光谱仪基本结构与原理 • 原子吸收光谱仪的实验技术 • 原子吸收光谱法与其他仪器分析方法比较 • 原子吸收光谱法在环境样品中的应用 • 原子吸收光谱法的展望
01
原子吸收光谱法简介
原子吸收光谱法的基本原理
原子吸收光谱法是一种基于原子能级跃迁的定量分析方法,样品中的基态原子在 吸收特定波长的光源后,吸收能量跃迁到激发态,再回到基态时发射出与光源波 长相同的光,通过测量光源通过样品后的吸光度来定量分析样品中的元素含量。
结果分析
对测定结果进行分析,判断土壤中重金属元素含量的高低,了解 土壤污染状况。
原子吸收光谱法测定大气颗粒物中的重金属元素
样品前处理
采集大气颗粒物样品,将颗粒物 进行分离、洗涤、干燥等处理, 以备后续分析。
仪器分析
利用原子吸收光谱法测定大气颗 粒物中重金属元素的含量,如Pb 、Cd、Cr等。
结果分析
原子发射光谱法
是一种基于原子能级跃迁的分析方法,通过测定样品在加热或电激发下发射 的光谱线来确定元素浓度。该方法具有较高的多元素分析能力和较低的检出 限,但干扰因素较多且分析时间较长。
05
仪器分析第6章 原子吸收光谱

火焰类型正确。根据燃气与助燃气比例可将火焰 分为:化学计量火焰,富燃火焰,贫燃火焰。
化学计量火焰 由于燃气与助燃气之比与化学计量 反应关系相近,又称为中性火焰,这类火焰,温 度高、稳定、干扰小背景低,适合于许多元素的 测定。
富燃火焰 指燃气大于化学元素计量的火焰。其特 点是燃烧不完全,温度略低于化学火焰,具有还 原性,适合于易形成难解离氧化物的元素测定; 干扰较多,背景高。
(3)原子吸收法的选择性高,干扰较少且易于克服
(4)原子吸收条件下,原子蒸气中基态原子比激发 态原子数目多得多,所以测定的是大部分原子,这 就使得原子吸收法具有较高的灵敏度
原子吸收光谱的特点:
优点: (1) 检出限低,10-10~10-14g; (2) 准确度高,RSD约1%~5%; (3) 选择性高,一般情况下共存元素不干扰; (4) 应用广,可测定70多个元素(各种样品中) 局限性:难熔元素、非金属元素测定困难;不能同 时多元素测定
澳大利亚物理学家瓦尔西发表了著名论文:《原 子吸收光谱法在分析化学中的应用》奠定了原子吸收 光谱法的基础,之后原子吸收光谱法迅速发展。
原子吸收光谱与原子发射光谱的比较:
(1)原子吸收光谱分析利用的是原子吸收现象,而 发射光谱分析则基于原子发射现象
(2)原子吸收线比发射线的数目少的多,这样谱线 的重叠概率小
✓ 单道双光束型:利用参比光束补偿 光源引起的基线漂移。
1. 光源
作用:辐射待测元素的特征光谱(共振线和其它 非吸收谱线),以供测量之用。
要求: A. 能辐射锐线光源 B. 辐射的光强度必须足够、稳定且背景小 C. 灯供电稳定,以确保光强度稳定 空心阴极灯、蒸气放电灯、无极放电灯
空心阴极灯结构
♫ 干燥:试液随升温脱水干燥,由液体转化为固 体。一般情况下,90~120℃,15 ~ 30 s。
化学计量火焰 由于燃气与助燃气之比与化学计量 反应关系相近,又称为中性火焰,这类火焰,温 度高、稳定、干扰小背景低,适合于许多元素的 测定。
富燃火焰 指燃气大于化学元素计量的火焰。其特 点是燃烧不完全,温度略低于化学火焰,具有还 原性,适合于易形成难解离氧化物的元素测定; 干扰较多,背景高。
(3)原子吸收法的选择性高,干扰较少且易于克服
(4)原子吸收条件下,原子蒸气中基态原子比激发 态原子数目多得多,所以测定的是大部分原子,这 就使得原子吸收法具有较高的灵敏度
原子吸收光谱的特点:
优点: (1) 检出限低,10-10~10-14g; (2) 准确度高,RSD约1%~5%; (3) 选择性高,一般情况下共存元素不干扰; (4) 应用广,可测定70多个元素(各种样品中) 局限性:难熔元素、非金属元素测定困难;不能同 时多元素测定
澳大利亚物理学家瓦尔西发表了著名论文:《原 子吸收光谱法在分析化学中的应用》奠定了原子吸收 光谱法的基础,之后原子吸收光谱法迅速发展。
原子吸收光谱与原子发射光谱的比较:
(1)原子吸收光谱分析利用的是原子吸收现象,而 发射光谱分析则基于原子发射现象
(2)原子吸收线比发射线的数目少的多,这样谱线 的重叠概率小
✓ 单道双光束型:利用参比光束补偿 光源引起的基线漂移。
1. 光源
作用:辐射待测元素的特征光谱(共振线和其它 非吸收谱线),以供测量之用。
要求: A. 能辐射锐线光源 B. 辐射的光强度必须足够、稳定且背景小 C. 灯供电稳定,以确保光强度稳定 空心阴极灯、蒸气放电灯、无极放电灯
空心阴极灯结构
♫ 干燥:试液随升温脱水干燥,由液体转化为固 体。一般情况下,90~120℃,15 ~ 30 s。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分别用S,P,D,F ······,表示 例:碳原子,基态的电子层结构(1s)2(2s)2(2p)2, 两个外层2p电子: l 1=l2 =1; L=2,1,0;
总自旋量子数S :
S =∑ s ;外层价电子自旋量子数的矢量和 S =0 , 1, 2,······, S 正整数(价电子为偶数) 或 = 0 , 1/2,3/2 ,······, S 半整数(奇数) 例:碳原子,基态的电子层结构(1s)2(2s) 2(2p) 2 , 两个外层2p电子: S =1 L与S之间存在相互作用;可裂分产生(2 S +1)个能级; 这就是原子光谱产生光谱多重线的原因,称为谱线的多 重性;
分子光谱:
原子光谱为线状光谱, 分子光谱为带状光谱; 为什么分子光谱为带状光谱?
原子光谱图
分子光谱图
1.分子中的能量
E=Ee+ Ev + Er + En + Et + Ei 分子中原子的核能: En 分子的平移能:Et 电子运动能: Ee 原子间相对振动能: Ev 分子转动能: Er 基团间的内旋能: Ei
内量子数J取决于总角量子数L与总自旋量子数S的矢量和 J = (L + S), (L + S - 1),······,|L - S| 若 L ≥ S ; 其数值共(2 S +1)个; 若 L < S ; 其数值共(2 L +1)个;
例:L=2,S=1,则 J 有三个值,J = 3,2,1; L=0,S=1/2;则 J 仅有一个值 1/2;
1.光谱项符号
原子外层有一个电子时,其可由四个量子数决定 :
主量子数 n;角量子数 l;磁量子数 m;自旋量 子数 s;
原子外层有多个电子时,其运动状态用主量子数 n;总角量子数L;总自旋量子数S;内量子数J 描述 ;
总角量子数L
L=∑ l 外层价电子角量子数的矢量和,两个价电子时
L=| l 1+ l2 | , | l 1+ l2 -1|,······,| l 1 - l2 | L=0,1,2,3,······,
例 钠原子的双重D线 Na 5889.96AO ; 32S1/ 2 — 32P3/ 2; Na 5895.93 AO ; 32S1/ 2 — 32P1/ 2;
电子能级跃迁的选择定则
根据量子力学原理,电子的跃迁不能在任意两个能级之 间进行;必须遵循一定的“选择定则”: (1)主量子数的变化 Δn为正整数,包括零; (2)总角量子数的变化ΔL = ±1;S-P,P-S,P-D,D-F等 (3)内量子数的变化ΔJ =0, ±1;但是当J =0时, ΔJ =0的 跃迁被禁阻; (4)总自旋量子数的变化ΔS =0 ,即不同多重性状态之间的 跃迁被禁阻;
分子的荧光光谱是在紫外或可见光照射下,电子跃迁至 单重激发态,并以无辐射弛豫方式回到第一单重激发态的最 低振动能级,再跃回基态或基态中的其他振动能级所发出的 光谱;
分子的磷光是指处于第一最低单重激发态的分子以无辐 射弛豫方式回到第一最低三重激发态,再跃迁回到基态所发 出的光谱。
第四章 原子吸收光谱法
2. 能级图
元素原子可能存在的光谱 项及能级跃迁常用能级图来 表示。最上面的是光谱项符 号;最下面的横线表示基态 ;上面的表示激发态; 可以产生的跃迁用线连接;
线系:由各种高能级跃迁 到同一低能级时发射的一系 列光谱线;
3. 共振线
元素由基态到第一激发 态的跃迁最易发生,需要的 能量最低,产生的谱线也最 强,该谱线称为共振线 ,也 称为该元素的特征谱线;
J 值不同的光谱项称光谱支项: n2S+1LJ
如:钠原子的光谱支项符号 32S1/2; 表示钠原子的电子处于n=3,2S+1 =2(S = 1/2)
,L =0,J = 1/2 的能级状态(基态能级);
例:写出镁原子基p63s2
l 1=0, l 2=0 L=0 S=1/2-1/2=0 2S+1=1
单重态分子具有抗磁性; 三重态分子具有顺磁性; 跃迁至单重激发态的几率 大,寿命长;
3.跃迁类型与分子光谱
分子光谱复杂,电子跃迁时伴有振动和转动能级跃迁;
分子的紫外-可见吸收光谱是由电子跃迁引起的,故又 称电子光谱,谱带比较宽;
分子的红外吸收光谱是由于分子中基团的振动和转动能 级跃迁引起的,故也称振转光谱;
在一般化学反应中, En不变; Et 、 Ei较小; E=Ee+ Ev + Er
分子产生跃迁所吸收能量的辐射频率:
ν=ΔEe / h + ΔEv / h + ΔEr / h
2.双原子分子能级图
分子中价电子位于自旋成 对 的 单 重 基 态 S0 分 子 轨 道 上 ,当电子被激发到高能级上 时,若激发态与基态中的电 子自旋方向相反,称为单重 激发态,以S1 、 S2 、······表 示;反之,称为三重激发态 ,以T1 、 T2 、······表示;
第一节 引言
原子吸收光谱法(Atomic Absorption Spectrometry,AAS) 也称原子吸收分光光度法。它是根据物质的基态原子蒸气对 特征辐射的吸收作用来进行元素的定量分析的方法。
该方法具有灵敏度高、抗干扰能力强、精密度高、选择 性好、仪器简单、操作方便等特点,在20世纪60年代后,得 到迅速发展,并趋于成熟,它是微量或痕量元素的灵敏而可 靠的分析方法。现在能够测定的元素达70多种,已成为一种 常规的分析测试手段 。
例:钠原子,一个外层电子,1s22s22p63s1 S =1/2;因此: M =2( S ) +1 = 2;双重线;
碱土金属:两个外层电子, 自旋方向相同时, S =1/2 + 1/2 =1, M = 3;三重线; 自旋方向相反时, S =1/2 - 1/2 =0, M = 1;单重线;
内量子数J :
J=0
所以n2s+1LJ为 31S0
• 第一激发态: 1s22s22p63s13p1
l 1=0, l 2=1 L=1
S=0 ,1
2S+1=1, 3
(1)S=0,J=1; (2)S=1,J=2,1,0;
所以n2s+1LJ为 31P1 , 33P2 , 33P1 , 33P0
电子能级跃迁的选择定则
一条谱线是原子的外层电子在两个能级之间的跃迁产生 的,可用两个光谱项符号表示这种跃迁或跃迁谱线:
总自旋量子数S :
S =∑ s ;外层价电子自旋量子数的矢量和 S =0 , 1, 2,······, S 正整数(价电子为偶数) 或 = 0 , 1/2,3/2 ,······, S 半整数(奇数) 例:碳原子,基态的电子层结构(1s)2(2s) 2(2p) 2 , 两个外层2p电子: S =1 L与S之间存在相互作用;可裂分产生(2 S +1)个能级; 这就是原子光谱产生光谱多重线的原因,称为谱线的多 重性;
分子光谱:
原子光谱为线状光谱, 分子光谱为带状光谱; 为什么分子光谱为带状光谱?
原子光谱图
分子光谱图
1.分子中的能量
E=Ee+ Ev + Er + En + Et + Ei 分子中原子的核能: En 分子的平移能:Et 电子运动能: Ee 原子间相对振动能: Ev 分子转动能: Er 基团间的内旋能: Ei
内量子数J取决于总角量子数L与总自旋量子数S的矢量和 J = (L + S), (L + S - 1),······,|L - S| 若 L ≥ S ; 其数值共(2 S +1)个; 若 L < S ; 其数值共(2 L +1)个;
例:L=2,S=1,则 J 有三个值,J = 3,2,1; L=0,S=1/2;则 J 仅有一个值 1/2;
1.光谱项符号
原子外层有一个电子时,其可由四个量子数决定 :
主量子数 n;角量子数 l;磁量子数 m;自旋量 子数 s;
原子外层有多个电子时,其运动状态用主量子数 n;总角量子数L;总自旋量子数S;内量子数J 描述 ;
总角量子数L
L=∑ l 外层价电子角量子数的矢量和,两个价电子时
L=| l 1+ l2 | , | l 1+ l2 -1|,······,| l 1 - l2 | L=0,1,2,3,······,
例 钠原子的双重D线 Na 5889.96AO ; 32S1/ 2 — 32P3/ 2; Na 5895.93 AO ; 32S1/ 2 — 32P1/ 2;
电子能级跃迁的选择定则
根据量子力学原理,电子的跃迁不能在任意两个能级之 间进行;必须遵循一定的“选择定则”: (1)主量子数的变化 Δn为正整数,包括零; (2)总角量子数的变化ΔL = ±1;S-P,P-S,P-D,D-F等 (3)内量子数的变化ΔJ =0, ±1;但是当J =0时, ΔJ =0的 跃迁被禁阻; (4)总自旋量子数的变化ΔS =0 ,即不同多重性状态之间的 跃迁被禁阻;
分子的荧光光谱是在紫外或可见光照射下,电子跃迁至 单重激发态,并以无辐射弛豫方式回到第一单重激发态的最 低振动能级,再跃回基态或基态中的其他振动能级所发出的 光谱;
分子的磷光是指处于第一最低单重激发态的分子以无辐 射弛豫方式回到第一最低三重激发态,再跃迁回到基态所发 出的光谱。
第四章 原子吸收光谱法
2. 能级图
元素原子可能存在的光谱 项及能级跃迁常用能级图来 表示。最上面的是光谱项符 号;最下面的横线表示基态 ;上面的表示激发态; 可以产生的跃迁用线连接;
线系:由各种高能级跃迁 到同一低能级时发射的一系 列光谱线;
3. 共振线
元素由基态到第一激发 态的跃迁最易发生,需要的 能量最低,产生的谱线也最 强,该谱线称为共振线 ,也 称为该元素的特征谱线;
J 值不同的光谱项称光谱支项: n2S+1LJ
如:钠原子的光谱支项符号 32S1/2; 表示钠原子的电子处于n=3,2S+1 =2(S = 1/2)
,L =0,J = 1/2 的能级状态(基态能级);
例:写出镁原子基p63s2
l 1=0, l 2=0 L=0 S=1/2-1/2=0 2S+1=1
单重态分子具有抗磁性; 三重态分子具有顺磁性; 跃迁至单重激发态的几率 大,寿命长;
3.跃迁类型与分子光谱
分子光谱复杂,电子跃迁时伴有振动和转动能级跃迁;
分子的紫外-可见吸收光谱是由电子跃迁引起的,故又 称电子光谱,谱带比较宽;
分子的红外吸收光谱是由于分子中基团的振动和转动能 级跃迁引起的,故也称振转光谱;
在一般化学反应中, En不变; Et 、 Ei较小; E=Ee+ Ev + Er
分子产生跃迁所吸收能量的辐射频率:
ν=ΔEe / h + ΔEv / h + ΔEr / h
2.双原子分子能级图
分子中价电子位于自旋成 对 的 单 重 基 态 S0 分 子 轨 道 上 ,当电子被激发到高能级上 时,若激发态与基态中的电 子自旋方向相反,称为单重 激发态,以S1 、 S2 、······表 示;反之,称为三重激发态 ,以T1 、 T2 、······表示;
第一节 引言
原子吸收光谱法(Atomic Absorption Spectrometry,AAS) 也称原子吸收分光光度法。它是根据物质的基态原子蒸气对 特征辐射的吸收作用来进行元素的定量分析的方法。
该方法具有灵敏度高、抗干扰能力强、精密度高、选择 性好、仪器简单、操作方便等特点,在20世纪60年代后,得 到迅速发展,并趋于成熟,它是微量或痕量元素的灵敏而可 靠的分析方法。现在能够测定的元素达70多种,已成为一种 常规的分析测试手段 。
例:钠原子,一个外层电子,1s22s22p63s1 S =1/2;因此: M =2( S ) +1 = 2;双重线;
碱土金属:两个外层电子, 自旋方向相同时, S =1/2 + 1/2 =1, M = 3;三重线; 自旋方向相反时, S =1/2 - 1/2 =0, M = 1;单重线;
内量子数J :
J=0
所以n2s+1LJ为 31S0
• 第一激发态: 1s22s22p63s13p1
l 1=0, l 2=1 L=1
S=0 ,1
2S+1=1, 3
(1)S=0,J=1; (2)S=1,J=2,1,0;
所以n2s+1LJ为 31P1 , 33P2 , 33P1 , 33P0
电子能级跃迁的选择定则
一条谱线是原子的外层电子在两个能级之间的跃迁产生 的,可用两个光谱项符号表示这种跃迁或跃迁谱线:
