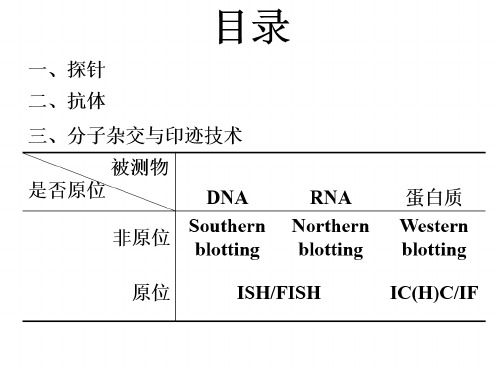
DNA印迹与杂交技术课件PPT
合集下载
8.印迹杂交技术

基因突变位点周围的碱基序列是已知的 合成15~20nt的两种探针: 正常探针:与正常基因序列互补 突变探针:与突变基因序列互补 两者区别是与突变位点对应的碱基不同,称 为等位基因特异性寡核苷酸(ASO)探针。
55
用ASO探针分别与待测DNA进行杂交
只与正常探针杂交-正常纯合子 结果 与正常及突变探针均杂交-杂合子
地高辛标记
18
生物素-11-dUTP
19
异硫氰酸荧光素
罗丹明
荧光素
20
四、探针标记的方法
1.切口平移标记法
2.随机引物标记法 3.PCR标记法
4.末端标记法
21
(一)缺口平移标记法
22
(二)随机引物标记法
23
(三)PCR标记法
以四种dNTP(其中一种为标记dNTP)
为底物,扩增产物即为标记DNA,可作 探针使用,其灵敏度和特异性很高。
上,转移后各待测核酸片段在固相膜 上的相对位置和在凝胶中的相对位置
一样。此过程最重要的是要保持核酸
片段的相对位置不变。
31
固相膜:硝酸纤维素膜、尼龙膜 活化滤纸
印迹方法 毛细管虹吸转移法(毛细转移)
真空转移法 电转移法(电泳转移)
32
(1) 毛细管虹吸转移法
33
(2)真空转移法
34
(3) 电转移法
片段的大小和含量
40
41
第四节 核酸分子杂交的分类
根据杂交核酸分子的种类:
DNA与DNA杂交
DNA与RNA杂交 RNA与RNA杂交
42
根据杂交探针标记的不同: 同位素杂交
非同位素杂交
43
根据杂交介质的不同: 液相杂交 点杂交/狭缝杂交
55
用ASO探针分别与待测DNA进行杂交
只与正常探针杂交-正常纯合子 结果 与正常及突变探针均杂交-杂合子
地高辛标记
18
生物素-11-dUTP
19
异硫氰酸荧光素
罗丹明
荧光素
20
四、探针标记的方法
1.切口平移标记法
2.随机引物标记法 3.PCR标记法
4.末端标记法
21
(一)缺口平移标记法
22
(二)随机引物标记法
23
(三)PCR标记法
以四种dNTP(其中一种为标记dNTP)
为底物,扩增产物即为标记DNA,可作 探针使用,其灵敏度和特异性很高。
上,转移后各待测核酸片段在固相膜 上的相对位置和在凝胶中的相对位置
一样。此过程最重要的是要保持核酸
片段的相对位置不变。
31
固相膜:硝酸纤维素膜、尼龙膜 活化滤纸
印迹方法 毛细管虹吸转移法(毛细转移)
真空转移法 电转移法(电泳转移)
32
(1) 毛细管虹吸转移法
33
(2)真空转移法
34
(3) 电转移法
片段的大小和含量
40
41
第四节 核酸分子杂交的分类
根据杂交核酸分子的种类:
DNA与DNA杂交
DNA与RNA杂交 RNA与RNA杂交
42
根据杂交探针标记的不同: 同位素杂交
非同位素杂交
43
根据杂交介质的不同: 液相杂交 点杂交/狭缝杂交
基因组学课件 第8章 分子杂交与印迹技术
➢ 操作步骤:
✓ 蛋白样品的制备 ✓ 蛋白样品的分离-(SDS-PAGE) ✓ 转膜 ✓ 封闭 ✓ 一抗杂交 ✓ 二抗杂交 ✓ 底物显色
50
3、Western 印迹杂交
➢ 酶联显色:
HRP:底物为DAB AP:底物为BCIP/NBT
51
3、Western 印迹杂交
52
3、Western 印迹杂交
转印方法:毛细管虹吸法
➢ 利用毛细管的虹吸作用由转移缓冲液带动核酸分子转移至滤膜上。 ➢ DNA片段由液体携带而从凝胶转移并聚集于薄膜表面。液体通过毛
细管作用抽吸通过凝胶,借助于一叠干的吸水纸巾产生并维持毛细 管作用。转移的速度取决于DNA片段的大小和凝胶中琼脂糖的浓度, 小片段DNA(<1kb)1h内就能够从0.7%琼脂糖上几乎定量地转移, 而较大片段的DNA转移较慢且效率较低。
3)荧光原位杂交
64
2)组织/细胞原位杂交
➢ 特点:
能在成分复杂的组织中进行单一 细胞的研究
不需从组织或细胞中提取核酸, 对含量极低的靶序列灵敏度高
能准确反映组织细胞的相互关系 及功能状态
65
4、原位杂交(in situ hybridization)
1)菌落原位杂交 2)组织/细胞原位杂交 3)荧光原位杂交
5、斑点杂交(dot blot)
59
4、原位杂交(in situ hybridization)
➢ 核酸原位杂交特点:
(1)不受组织成分的影响; (2)灵敏度高; (3)可完整保持细胞或组织形态,准确反映组织细胞的相互关系
及功能; (4)可检测多个探针。
60
4、原位杂交(in situ hybridization)
7
2、分子印迹(blot、bloting)
✓ 蛋白样品的制备 ✓ 蛋白样品的分离-(SDS-PAGE) ✓ 转膜 ✓ 封闭 ✓ 一抗杂交 ✓ 二抗杂交 ✓ 底物显色
50
3、Western 印迹杂交
➢ 酶联显色:
HRP:底物为DAB AP:底物为BCIP/NBT
51
3、Western 印迹杂交
52
3、Western 印迹杂交
转印方法:毛细管虹吸法
➢ 利用毛细管的虹吸作用由转移缓冲液带动核酸分子转移至滤膜上。 ➢ DNA片段由液体携带而从凝胶转移并聚集于薄膜表面。液体通过毛
细管作用抽吸通过凝胶,借助于一叠干的吸水纸巾产生并维持毛细 管作用。转移的速度取决于DNA片段的大小和凝胶中琼脂糖的浓度, 小片段DNA(<1kb)1h内就能够从0.7%琼脂糖上几乎定量地转移, 而较大片段的DNA转移较慢且效率较低。
3)荧光原位杂交
64
2)组织/细胞原位杂交
➢ 特点:
能在成分复杂的组织中进行单一 细胞的研究
不需从组织或细胞中提取核酸, 对含量极低的靶序列灵敏度高
能准确反映组织细胞的相互关系 及功能状态
65
4、原位杂交(in situ hybridization)
1)菌落原位杂交 2)组织/细胞原位杂交 3)荧光原位杂交
5、斑点杂交(dot blot)
59
4、原位杂交(in situ hybridization)
➢ 核酸原位杂交特点:
(1)不受组织成分的影响; (2)灵敏度高; (3)可完整保持细胞或组织形态,准确反映组织细胞的相互关系
及功能; (4)可检测多个探针。
60
4、原位杂交(in situ hybridization)
7
2、分子印迹(blot、bloting)
核酸分子杂交技术核酸分子杂交的基本原理PPT课件
第43页/共46页
(4)杂交 • 杂交液体积小:10~20μl • cDNA和RNA探针杂交温度约为50℃ • 杂交时间:DNA探针杂交为2~4h.RNA探针杂交过夜 • 杂交前一般将组织切片置95 ℃ 5~15分钟使DNA变 性 • 冲洗温度一般 不超过50 ℃
第44页/共46页
(5)杂交结果检测 • 所用探针为核素标记,放射自显影检测 • 所用探针为非核素标记,比色或化学发光检测
第40页/共46页
2、杂交过程: (1)组织或细胞的固定
理想固定液应具备: • 保持组织细胞的形态 • 对核酸无抽提,修饰与降解作用 • 不改变核酸在组织细胞内的定位 • 不阻碍核酸与探针的杂交过程 • 对杂交信号无遮蔽作用 • 理化性质稳定
第41页/共46页
(2)组织细胞杂交前的预处理 • 去垢剂(如Triton x-100和SDS)和蛋白酶
K去除核酸表面的蛋白质 • 组织细胞内的核酸与蛋白质结合成核酸蛋白复合体 • 控制消化时间,避免细胞结构破坏和核酸从载玻
片上脱落
第42页/共46页
(3)探针的选择与标记 • 以获得最好杂交效果为依据选择探针 • 探针的长度一般为50~300bp ,有时达1.5kb • 放射性核素标记探针敏感性高,操作简便稳定 检测结果分辨率高,但信号检测时间长 • 非核素标记探针安全、稳定性好、显色快,易 于观察
第19页/共46页
四、探针的纯化
1、乙醇沉淀法:无水乙醇可以沉淀DNA片段,可 去除dNTP和蛋白质
2、凝胶过滤柱层析法:利用凝胶的分子筛作用,将 大分子DNA和小分子dNTP、磷酸根离子及寡核苷 酸(<80bp)等物质分离,常用凝胶基质是 Sephadex G-50
3、微柱离心法:其原理与上述凝胶过滤柱层析法相 同,不同的是上述采用洗脱的方式纯化探针,而此 法则是利用离心的方式来纯化探针
(4)杂交 • 杂交液体积小:10~20μl • cDNA和RNA探针杂交温度约为50℃ • 杂交时间:DNA探针杂交为2~4h.RNA探针杂交过夜 • 杂交前一般将组织切片置95 ℃ 5~15分钟使DNA变 性 • 冲洗温度一般 不超过50 ℃
第44页/共46页
(5)杂交结果检测 • 所用探针为核素标记,放射自显影检测 • 所用探针为非核素标记,比色或化学发光检测
第40页/共46页
2、杂交过程: (1)组织或细胞的固定
理想固定液应具备: • 保持组织细胞的形态 • 对核酸无抽提,修饰与降解作用 • 不改变核酸在组织细胞内的定位 • 不阻碍核酸与探针的杂交过程 • 对杂交信号无遮蔽作用 • 理化性质稳定
第41页/共46页
(2)组织细胞杂交前的预处理 • 去垢剂(如Triton x-100和SDS)和蛋白酶
K去除核酸表面的蛋白质 • 组织细胞内的核酸与蛋白质结合成核酸蛋白复合体 • 控制消化时间,避免细胞结构破坏和核酸从载玻
片上脱落
第42页/共46页
(3)探针的选择与标记 • 以获得最好杂交效果为依据选择探针 • 探针的长度一般为50~300bp ,有时达1.5kb • 放射性核素标记探针敏感性高,操作简便稳定 检测结果分辨率高,但信号检测时间长 • 非核素标记探针安全、稳定性好、显色快,易 于观察
第19页/共46页
四、探针的纯化
1、乙醇沉淀法:无水乙醇可以沉淀DNA片段,可 去除dNTP和蛋白质
2、凝胶过滤柱层析法:利用凝胶的分子筛作用,将 大分子DNA和小分子dNTP、磷酸根离子及寡核苷 酸(<80bp)等物质分离,常用凝胶基质是 Sephadex G-50
3、微柱离心法:其原理与上述凝胶过滤柱层析法相 同,不同的是上述采用洗脱的方式纯化探针,而此 法则是利用离心的方式来纯化探针
DNA印迹与杂交技术PPT课件

23
4.3 Southern印迹的常用方法 (1)毛细管虹吸印迹法
利用浓盐转移缓冲液的推动作用,将凝胶中的 DNA转移到固相支持物上。 其基本原理是:容器 中的转移缓冲液含有高浓度的NaCl和柠檬酸钠, 上层吸水纸的虹吸作用使缓冲液通过滤纸桥、滤 纸、凝胶、硝酸纤维素滤膜向上运动,同时带动 凝胶中的DNA片段垂直向上运动,凝胶中的DNA 片段移出凝胶而滞留在膜上。
47
3、离子强度: (1)低盐浓度时杂交率较低,随着盐浓度增加,杂
交率增加 (2)高浓度的盐使碱基错配的杂交体更稳定,当进
行序列不完全同源的核酸分子杂交时,必须维持杂交 反应液中较高的盐浓度和洗膜溶液的盐浓度
48
4、甲酰胺: (1)甲酰胺能降低核酸杂交的Tm值,能降低杂交
液的温度,低温时探针与待测核酸杂交更稳定,当待 测核酸与探针同源性不高时,加50%甲酰胺溶液在 35~42 ℃杂交
的非特异性吸附 (2)常用的封闭物有两类:即非特异性DNA和高分
子化合物。如鲑精DNA或小牛胸腺DNA,Denharts 溶液或脱脂奶粉。
51
五、 其它分子杂交方法
Southern 印迹法 Northern 印迹法 斑点印迹杂交 原位杂交 Western 印迹法 液相杂交
固相杂交
52
(一)Northern印迹杂交
30
5、Southern杂交
1、预杂交:封闭膜上能与DNA结合的位点 预杂交液为不含DNA探针的杂交液
2、杂交:液相中的DNA探针与膜上的待测DNA杂交 双链DNA探针需加热变性为单链,再杂交
3、洗膜:去除游离的放射性探针或非特异结合的 DNA
31
6. 杂交结果的检测
化学显色或放射自显影
32
4.3 Southern印迹的常用方法 (1)毛细管虹吸印迹法
利用浓盐转移缓冲液的推动作用,将凝胶中的 DNA转移到固相支持物上。 其基本原理是:容器 中的转移缓冲液含有高浓度的NaCl和柠檬酸钠, 上层吸水纸的虹吸作用使缓冲液通过滤纸桥、滤 纸、凝胶、硝酸纤维素滤膜向上运动,同时带动 凝胶中的DNA片段垂直向上运动,凝胶中的DNA 片段移出凝胶而滞留在膜上。
47
3、离子强度: (1)低盐浓度时杂交率较低,随着盐浓度增加,杂
交率增加 (2)高浓度的盐使碱基错配的杂交体更稳定,当进
行序列不完全同源的核酸分子杂交时,必须维持杂交 反应液中较高的盐浓度和洗膜溶液的盐浓度
48
4、甲酰胺: (1)甲酰胺能降低核酸杂交的Tm值,能降低杂交
液的温度,低温时探针与待测核酸杂交更稳定,当待 测核酸与探针同源性不高时,加50%甲酰胺溶液在 35~42 ℃杂交
的非特异性吸附 (2)常用的封闭物有两类:即非特异性DNA和高分
子化合物。如鲑精DNA或小牛胸腺DNA,Denharts 溶液或脱脂奶粉。
51
五、 其它分子杂交方法
Southern 印迹法 Northern 印迹法 斑点印迹杂交 原位杂交 Western 印迹法 液相杂交
固相杂交
52
(一)Northern印迹杂交
30
5、Southern杂交
1、预杂交:封闭膜上能与DNA结合的位点 预杂交液为不含DNA探针的杂交液
2、杂交:液相中的DNA探针与膜上的待测DNA杂交 双链DNA探针需加热变性为单链,再杂交
3、洗膜:去除游离的放射性探针或非特异结合的 DNA
31
6. 杂交结果的检测
化学显色或放射自显影
32
医学分子生物学第九章印迹杂交技术

cDNA; 分别用cy3(绿色)和cy5红色两种荧光燃料标记两种
cDNA。 将标记后的cDNA与点好的芯片进行杂交。 激光扫描芯片杂交结果,计算机处理。 分析杂交数据。
基因芯片
芯片杂交操作流程:
基因芯片
经大规模PCR扩增获得独立cDNA插入片段
人工制作芯片
商业化芯片
分别用cy3(绿色)和cy5红色两种荧光燃料标记两 种cDNA
23 ICK
4 IL-3
22 MIP-3 alpha
25 MMP-8
原始值
model
normal
30386
12625 14732 14606 11547.5 9262.5 20601 16912 16590.5 22787 28232.5
12482.5
7836.5 8059.5 8564.5 6742.5
辣根过氧化物酶源自底物产物, 并发出光辣根过氧化物酶:HRPO 底片曝光
③ Blotting过程
1)牛血清白蛋白封闭硝酸纤维素膜 2)先用一抗(待测蛋白的单克隆抗体)与
膜上的蛋白结合。 3)洗去未结合的一抗。 4)用二抗与一抗结合(二抗上带有HRPO)。 5)清洗掉未结合的二抗。 6)显影,检测
④结果 单抗blotting 结果
在蛋白质凝胶电泳以后,用转膜和免疫的方法检测 胶上的蛋白质泳带。
(1)SDS聚丙烯酰胺凝胶电泳 (SDS-PAGE):
是蛋白质的变性剂,使煮沸变性的蛋白质维持线 性状态,并与蛋白质结合,使蛋白质带上负电荷。
② 聚丙烯酰胺凝胶电泳(PAGE) (Polyacrylamide gel electrophoresis)
(一)核酸的变性与复性
复性
RNA
DNA
cDNA。 将标记后的cDNA与点好的芯片进行杂交。 激光扫描芯片杂交结果,计算机处理。 分析杂交数据。
基因芯片
芯片杂交操作流程:
基因芯片
经大规模PCR扩增获得独立cDNA插入片段
人工制作芯片
商业化芯片
分别用cy3(绿色)和cy5红色两种荧光燃料标记两 种cDNA
23 ICK
4 IL-3
22 MIP-3 alpha
25 MMP-8
原始值
model
normal
30386
12625 14732 14606 11547.5 9262.5 20601 16912 16590.5 22787 28232.5
12482.5
7836.5 8059.5 8564.5 6742.5
辣根过氧化物酶源自底物产物, 并发出光辣根过氧化物酶:HRPO 底片曝光
③ Blotting过程
1)牛血清白蛋白封闭硝酸纤维素膜 2)先用一抗(待测蛋白的单克隆抗体)与
膜上的蛋白结合。 3)洗去未结合的一抗。 4)用二抗与一抗结合(二抗上带有HRPO)。 5)清洗掉未结合的二抗。 6)显影,检测
④结果 单抗blotting 结果
在蛋白质凝胶电泳以后,用转膜和免疫的方法检测 胶上的蛋白质泳带。
(1)SDS聚丙烯酰胺凝胶电泳 (SDS-PAGE):
是蛋白质的变性剂,使煮沸变性的蛋白质维持线 性状态,并与蛋白质结合,使蛋白质带上负电荷。
② 聚丙烯酰胺凝胶电泳(PAGE) (Polyacrylamide gel electrophoresis)
(一)核酸的变性与复性
复性
RNA
DNA
斑点印迹杂交(共7张PPT)

预杂交:将膜封入15ml离心管中,做好剪角标记。 封闭杂交膜上多余的非特异性DNA结合位点
预杂交的:将探膜封针入15〕ml离,心管中放,做射好剪自角标显记。 影,判断是否有杂交或其杂交强度,主 要用于基因缺失或拷贝数改变的检测。根据点样磨具不同, 点样形状呈圆形称为斑点杂交,呈狭缝形那么称为狭缝杂交。
斑点杂交:是指将待测的DNA变形后点加在硝酸纤维素膜〔或 5 洗膜:倒掉杂交液,洗液1(每次5ml〕洗膜三次〔洗液1预热到42℃〕,每次5min;
预杂交:将膜封入15ml离心管中,做好剪角标记。
再将洗液2 (每次5ml〕洗膜两次〔预热到42℃〕,每次15min。
尼龙膜〕上,用已标记的探针进行杂交,洗膜〔除去未结合 封闭杂交膜上非特异性的蛋白结合位点
立即置于冰中5min〔使DNA变性〕,参加 根据点样磨具不同,点样l 20×SSC混匀。 封闭杂交膜上多余的非特异性DNA结合位点
置42℃恒温摇床上,轻轻振摇30min。
点样:将上述变性后的样品180ul点在尼龙膜的 预杂交:将膜封入15ml离心管中,做好剪角标记。
第3页,共7页。
斑点印迹杂交不需要电泳和转移,杂交过程包括点 样,变性,中和,枯燥固定,预杂交,杂交,封闭, 检测杂交结果等步骤,相对southern印迹杂交和 Northern印记杂交来说快,适合于同时分析多个样 品。
第4页,共7页。
实验步骤:
变性:按8:1将80ul ddH2O参加至10ul待测 DNA样品中,稀释样品。100℃加热10min后,
中120℃烘烤15min。使变性的DNA与膜结合 杂交的双方是待测核酸及探针。
杂交的双方是待测核酸及探针。
牢固 点样:将上述变性后的样品180ul点在尼龙膜的毛面上,真空抽滤,室温下风干后,于烤箱中120℃烘烤15min。
预杂交的:将探膜封针入15〕ml离,心管中放,做射好剪自角标显记。 影,判断是否有杂交或其杂交强度,主 要用于基因缺失或拷贝数改变的检测。根据点样磨具不同, 点样形状呈圆形称为斑点杂交,呈狭缝形那么称为狭缝杂交。
斑点杂交:是指将待测的DNA变形后点加在硝酸纤维素膜〔或 5 洗膜:倒掉杂交液,洗液1(每次5ml〕洗膜三次〔洗液1预热到42℃〕,每次5min;
预杂交:将膜封入15ml离心管中,做好剪角标记。
再将洗液2 (每次5ml〕洗膜两次〔预热到42℃〕,每次15min。
尼龙膜〕上,用已标记的探针进行杂交,洗膜〔除去未结合 封闭杂交膜上非特异性的蛋白结合位点
立即置于冰中5min〔使DNA变性〕,参加 根据点样磨具不同,点样l 20×SSC混匀。 封闭杂交膜上多余的非特异性DNA结合位点
置42℃恒温摇床上,轻轻振摇30min。
点样:将上述变性后的样品180ul点在尼龙膜的 预杂交:将膜封入15ml离心管中,做好剪角标记。
第3页,共7页。
斑点印迹杂交不需要电泳和转移,杂交过程包括点 样,变性,中和,枯燥固定,预杂交,杂交,封闭, 检测杂交结果等步骤,相对southern印迹杂交和 Northern印记杂交来说快,适合于同时分析多个样 品。
第4页,共7页。
实验步骤:
变性:按8:1将80ul ddH2O参加至10ul待测 DNA样品中,稀释样品。100℃加热10min后,
中120℃烘烤15min。使变性的DNA与膜结合 杂交的双方是待测核酸及探针。
杂交的双方是待测核酸及探针。
牢固 点样:将上述变性后的样品180ul点在尼龙膜的毛面上,真空抽滤,室温下风干后,于烤箱中120℃烘烤15min。
第十二章 印迹杂交技术

二、RNA印迹法(Northern blot)
操作:与Southern印迹极为相似,但不需要酶切可直 接变性转移; RNA经变性后再电泳(可用甲酰胺、甲醛等 使RNA变性,不能用碱,易使RNA降解); 电泳时不能加EB,影响RNA与膜结合; 严防RNase污染。 用途:检测RNA(定性或定量分析细胞内总RNA或 某一特定RNA,特别是分析mRNA的大小和含 量)——研究基因插入缺失等突变、基因表达(金 标准)。
一、核酸探针
——带有标记物且序列已知的核酸片段, 能与待测核酸中的特定序列特异杂交。
• 核酸探针是否合适是决定核酸杂交分析 能否成功的关键。
核酸杂交与分子探针
核酸探针应具有的条件
① 特异性高:只与待测核酸样品中的 互补序列杂交。 ② 带有标记物:标记物灵敏度高而稳 定,检测方便。
核酸探针的种类
常用核酸杂交分类
杂交方法
Southern印迹 Northern印迹 斑点杂交 菌落杂交和噬斑杂交
适用范围
检测经凝胶电泳分开的DNA 分子,需转印到膜上 检测经凝胶电泳分开的RNA 分子,需转移到膜上 检测未经分离的,固定在膜上的 DNA或RNA分子 检测固定在膜上的,经裂解后从 细菌和噬菌体中释放的 DNA分子 检测细胞或组织中的DNA或 RNA分子
2.非放射性标记物
优点:无环境污染,可长时间贮存。 • 生物素:
一种小分子水溶性维生素,连接在碱基上 和抗生物素蛋白(avidin)特异结合 抗生物素蛋白上连接有显色物质(酶、荧光素等) 。 • 酶促显色:
碱性磷酸酶(ALP或AKP):催化底物(5-溴-4-氯-4吲哚 磷酸,BCIP)和硝基蓝四氮唑(NBT),生成不溶性紫色 化合物二甲臜; 辣根过氧化物酶(HRP):催化底物二氨基联苯胺(DAB) 生成红棕色沉淀物;或催化底物四氨基联苯胺(TMB)生 成蓝色沉淀物。
医学分子生物学原理-分子杂交和印迹技术

最适切口平移的片段一般为50-500个核苷酸。
2020年3月4日1时8分
15
DNA切口平移标记法示意图
DNA 酶 Ⅰ : 在 双 链DNA上随机打开 若干个单链缺口, 产生3’-OH端。
大 肠 杆 菌 DNA 聚 合 酶 Ⅰ : 5’→3’ DNA聚合酶活性; 5’→3’ 外 切 核 酸 酶活性。
➢ 将这些菌落归并到一个琼脂主平板,第二个琼 脂平板表面铺一张硝酸纤维素滤膜。经培养一 段时间后,对菌落进行原位裂解。
2020年3月4日1时8分
6
核酸分子杂交应用
(1)特定基因序列的定性和定量分析 (2)基因克隆的筛选 (3)酶切图谱的制作 (4)基因突变分析 (5)疾病的诊断
2020年3月4日1时8分
7
二、探针的种类和制备
探针(probe)的概念: 用来检测某一特定核苷酸序列或基因序列
的DNA或RNA的互补标记片段:
5′ 3′ 5′
3′
53′′ 5′
3′
2020年3月4日1时8分
3′ 5′ 限制性内切酶
3′ 5′
Klenow DNA聚合酶
完整双链DNA
5 ′末端突出 的DNA
[α-32P]-dNTP 其他3 种dNTP
变性
35 ′′
3 ′末端标记的 DNA
3 ′ 32P-末端标记的
5′
单链DNA探针
21
标记探针的纯化
Luminol化学发光原理
1.曝光:用滤纸吸去杂交膜上多余底物,作好标记, 保鲜膜包裹,放在暗夹里,放上X光片,曝光1-5 分钟;
2.显影:取出X光片,按使用说明书显影和定影。
思考题:
2020年3月4日1时8分
29
2020年3月4日1时8分
15
DNA切口平移标记法示意图
DNA 酶 Ⅰ : 在 双 链DNA上随机打开 若干个单链缺口, 产生3’-OH端。
大 肠 杆 菌 DNA 聚 合 酶 Ⅰ : 5’→3’ DNA聚合酶活性; 5’→3’ 外 切 核 酸 酶活性。
➢ 将这些菌落归并到一个琼脂主平板,第二个琼 脂平板表面铺一张硝酸纤维素滤膜。经培养一 段时间后,对菌落进行原位裂解。
2020年3月4日1时8分
6
核酸分子杂交应用
(1)特定基因序列的定性和定量分析 (2)基因克隆的筛选 (3)酶切图谱的制作 (4)基因突变分析 (5)疾病的诊断
2020年3月4日1时8分
7
二、探针的种类和制备
探针(probe)的概念: 用来检测某一特定核苷酸序列或基因序列
的DNA或RNA的互补标记片段:
5′ 3′ 5′
3′
53′′ 5′
3′
2020年3月4日1时8分
3′ 5′ 限制性内切酶
3′ 5′
Klenow DNA聚合酶
完整双链DNA
5 ′末端突出 的DNA
[α-32P]-dNTP 其他3 种dNTP
变性
35 ′′
3 ′末端标记的 DNA
3 ′ 32P-末端标记的
5′
单链DNA探针
21
标记探针的纯化
Luminol化学发光原理
1.曝光:用滤纸吸去杂交膜上多余底物,作好标记, 保鲜膜包裹,放在暗夹里,放上X光片,曝光1-5 分钟;
2.显影:取出X光片,按使用说明书显影和定影。
思考题:
2020年3月4日1时8分
29
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
24
25
(2)电转法 利用电场的电泳作用将凝胶中的DNA转移到
固相支持物上。
26
(3)真空转移法 此法原理与毛细管虹吸法相同,只是以滤膜
在下,凝胶在上的方式将其放置在一个真空室上, 利用真空作用将转膜缓冲液从上层容器中通过凝 胶和滤膜抽到下层真空室中,同时带动核酸片段 转移到凝胶下面的尼龙膜或硝酸纤维素膜上。
第二 是将具有核酸印迹的滤膜与带有放射性或其它标记的DNA或 RNA探针进行杂交
12
杂交模式图
-
DNA印迹转移
探针杂交
放射自显影
+
13
Southern bloting的主要步骤
1.待测DNA样品的制备、酶切 2.待测DNA 样品的电泳分离:琼脂糖凝胶电泳 3.凝胶中DNA的变性:碱变性 4.Southern转膜(印迹):
分离、转印到固相支持物上,用探针进行检 测的方法。 应用:基因组DNA的定性和定量分析
基因诊断、分子克隆、法医学等
11
在大多数核酸杂交反应中,经过凝胶电泳分离的DNA或 RNA分子,都必须通过毛细管或电导作用被转移到滤膜上,而 且是按其在凝胶中的位置原封不动地“吸印”上去的,因此, 核酸杂交也被称为“DNA印迹杂交”。 材料:尼龙滤膜、硝酸纤维素滤膜、二乙氨基乙基纤维素滤膜(DEAE) 步骤: 第一 将分离的核酸样品转移到固体支持物滤膜上-核酸印迹转移 电泳凝胶核酸印迹法、 斑点和狭线印迹法、 菌落和噬菌斑印迹法
9
核酸的分子杂交
将带有互补的特定核 苷酸序列的单链DNA或 RNA混合在一起,其相应 的同源区段就会退火形成 双链结构。如果退火的核 酸来自不同的生物有机体, 所形成的双链分子就被称 为杂种核酸分子。
10
三、Southern blotting DNA印迹与杂交
1975年,英国Edwen Southern创建 定义:检测DNA杂交方法,即将DNA电泳
5
2、变性的方法: (1)热变性:温度升高到90~100℃时,双链核酸
分子链间的氢键完全断裂。 (2)酸碱变性:pH值低于3或高于10时,双链核
酸分子链 间的氢键断裂。 (3)化学试剂变性:如尿素、甲酰胺、甲醛等使
双链核酸分子链间的氢键断裂。
6
3、变性后的理化性质变化: 粘度降低 密度增加 紫外吸收值增加
22
4.2 常用的固相支持物 ①硝酸纤维素膜:优点是吸附能力强,杂交信号本 底低。缺点是DNA分子结合不牢固 ②尼龙膜:优点是结合单链,双链DNA的能力比硝酸 纤维素膜强;缺点:杂交信号本底高 ③化学活化膜:优点:DNA与膜共价结合;对不同 大小的DNA片段有同等结合能力;缺点:结合能 力较上述两种膜低
毛细管虹吸印迹法、电转印法、真空转移法 5.Southern杂交(预杂交、杂交、洗膜) 6.杂交结果的检测
14
(a)
Southern 凝 (b) 胶转移杂交
技术
基因组DNA
DNA限制片段
(c)
(d) 硝酸纤维素滤膜
(e)
同探针同源杂交的 基因DNA片段
X光底片
15
步骤解析
1. 待测DNA样品的制备、酶切
第三节 核酸分子杂交技术
DNA印迹与杂交技术 RNA印迹与杂交技术
1
一、 分子杂交的基本方法
Southern 印迹法 Northern 印迹法 斑点印迹杂交 原位杂交 Western 印迹法 液相杂交
固相杂交
2
二、核酸分子杂交的基本原理
• 具有互补序列两条单链核酸分子在一定 条件下 按碱基互补配对原则退火形成双链 的过程。 • 杂交的双方是待测核酸和已知核酸序列, 已知核酸序列称探针。
凝胶置于NaOH溶液中使DNA变性断裂为 较短的单链 DNA,中性缓冲液中和凝胶中的 缓冲液。
20
4. Southern转膜(印迹)
待测定核酸分子通过一定的方法转移并结 合到一定的固相支持物(如纤维素膜)上, 即印迹。
21
4.1 固相支持物的选择 (1)理想的固相支持物应具备的特性
①具有较强结合核酸分子的能力 ②不影响与探针的杂交反应 ③与核酸分子结合稳定牢固 ④具有良好的机械性能 非特异吸附少
3
Hybridization of Nucleic Acids
DNA1
DNA2
DNA RNA
探针
probe
Northern
Southern
hybridization
hybridization
4
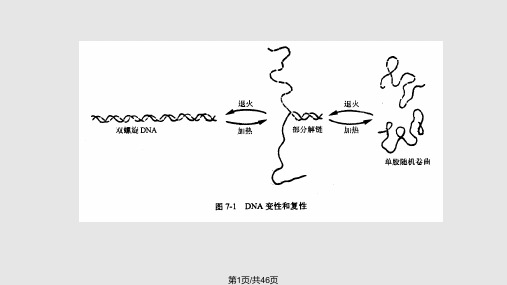
(一)DNA变性与复性
DNA变性 1、定义:某些理化因素导致两条DNA链间的
氢链断裂变为单链的过程,称DNA变性。
DNA的提取原理:裂解细胞,使DNA释 放,交替使用酚、氯仿两种蛋白质变性 剂,有效去除蛋白质
标准程序:酚——酚-氯仿——氯仿。
16
17
2. 待测DNA 样品的电泳分离: 琼脂糖凝胶电泳
18
A
B
ห้องสมุดไป่ตู้
C
M 琼脂糖凝胶电泳
bp
—1534
— 994 — 695
— 515
— 377 — 237
19
3. 凝胶中DNA的变性:碱变性
7
复性 1、定义:变性的单链核酸分子在一定
条件下按碱基互补原则重新结合为双链核酸 的过程,称复性或杂交。 具有互补序列的两条单链核酸都可互补形成 双链:DNA/DNA、RNA/DNA、RNA/RNA、 寡核苷酸/DNA和寡核苷酸/RNA。
8
2、复性过程 (1)单链分子间碰撞形成局部双链 (2)局部双链周围的碱基如不配对时,双链重新解离 (3)局部双链周围的碱基如配对,则形成中心序列 (4)形成完整的双链分子
23
4.3 Southern印迹的常用方法 (1)毛细管虹吸印迹法
利用浓盐转移缓冲液的推动作用,将凝胶中的 DNA转移到固相支持物上。 其基本原理是:容器 中的转移缓冲液含有高浓度的NaCl和柠檬酸钠, 上层吸水纸的虹吸作用使缓冲液通过滤纸桥、滤 纸、凝胶、硝酸纤维素滤膜向上运动,同时带动 凝胶中的DNA片段垂直向上运动,凝胶中的DNA 片段移出凝胶而滞留在膜上。
27
28
各种转移方法的比较 i) 毛细管虹吸法:操作简便,不需要特殊转 移仪器,但转移效率低,(扩散法为70%, 毛细管法80%)耗时多。 ii) 电转移法:效率高,耗时少,需特殊转 移仪,对转移条件要求较严。 iii) 真空转移法:效率高,耗时最少,需特 殊真空转移仪。
29
转移的最佳条件
i) 固定基质的选择 ii) 转移前预处理:DNA和RNA分子变性,蛋白质 则需除去凝胶中的SDS。 iii)大分子的转移 对于分子量较大的DNA片段,必须进行原位断裂 后再进行转移,断裂DNA分子最佳长度为1-2kb。 其步骤是: 0.25M HCl处理凝胶两次(每次15分钟) →水洗→0.5M NaOH/1M NaCl两次,每次15分钟→ 转移。
25
(2)电转法 利用电场的电泳作用将凝胶中的DNA转移到
固相支持物上。
26
(3)真空转移法 此法原理与毛细管虹吸法相同,只是以滤膜
在下,凝胶在上的方式将其放置在一个真空室上, 利用真空作用将转膜缓冲液从上层容器中通过凝 胶和滤膜抽到下层真空室中,同时带动核酸片段 转移到凝胶下面的尼龙膜或硝酸纤维素膜上。
第二 是将具有核酸印迹的滤膜与带有放射性或其它标记的DNA或 RNA探针进行杂交
12
杂交模式图
-
DNA印迹转移
探针杂交
放射自显影
+
13
Southern bloting的主要步骤
1.待测DNA样品的制备、酶切 2.待测DNA 样品的电泳分离:琼脂糖凝胶电泳 3.凝胶中DNA的变性:碱变性 4.Southern转膜(印迹):
分离、转印到固相支持物上,用探针进行检 测的方法。 应用:基因组DNA的定性和定量分析
基因诊断、分子克隆、法医学等
11
在大多数核酸杂交反应中,经过凝胶电泳分离的DNA或 RNA分子,都必须通过毛细管或电导作用被转移到滤膜上,而 且是按其在凝胶中的位置原封不动地“吸印”上去的,因此, 核酸杂交也被称为“DNA印迹杂交”。 材料:尼龙滤膜、硝酸纤维素滤膜、二乙氨基乙基纤维素滤膜(DEAE) 步骤: 第一 将分离的核酸样品转移到固体支持物滤膜上-核酸印迹转移 电泳凝胶核酸印迹法、 斑点和狭线印迹法、 菌落和噬菌斑印迹法
9
核酸的分子杂交
将带有互补的特定核 苷酸序列的单链DNA或 RNA混合在一起,其相应 的同源区段就会退火形成 双链结构。如果退火的核 酸来自不同的生物有机体, 所形成的双链分子就被称 为杂种核酸分子。
10
三、Southern blotting DNA印迹与杂交
1975年,英国Edwen Southern创建 定义:检测DNA杂交方法,即将DNA电泳
5
2、变性的方法: (1)热变性:温度升高到90~100℃时,双链核酸
分子链间的氢键完全断裂。 (2)酸碱变性:pH值低于3或高于10时,双链核
酸分子链 间的氢键断裂。 (3)化学试剂变性:如尿素、甲酰胺、甲醛等使
双链核酸分子链间的氢键断裂。
6
3、变性后的理化性质变化: 粘度降低 密度增加 紫外吸收值增加
22
4.2 常用的固相支持物 ①硝酸纤维素膜:优点是吸附能力强,杂交信号本 底低。缺点是DNA分子结合不牢固 ②尼龙膜:优点是结合单链,双链DNA的能力比硝酸 纤维素膜强;缺点:杂交信号本底高 ③化学活化膜:优点:DNA与膜共价结合;对不同 大小的DNA片段有同等结合能力;缺点:结合能 力较上述两种膜低
毛细管虹吸印迹法、电转印法、真空转移法 5.Southern杂交(预杂交、杂交、洗膜) 6.杂交结果的检测
14
(a)
Southern 凝 (b) 胶转移杂交
技术
基因组DNA
DNA限制片段
(c)
(d) 硝酸纤维素滤膜
(e)
同探针同源杂交的 基因DNA片段
X光底片
15
步骤解析
1. 待测DNA样品的制备、酶切
第三节 核酸分子杂交技术
DNA印迹与杂交技术 RNA印迹与杂交技术
1
一、 分子杂交的基本方法
Southern 印迹法 Northern 印迹法 斑点印迹杂交 原位杂交 Western 印迹法 液相杂交
固相杂交
2
二、核酸分子杂交的基本原理
• 具有互补序列两条单链核酸分子在一定 条件下 按碱基互补配对原则退火形成双链 的过程。 • 杂交的双方是待测核酸和已知核酸序列, 已知核酸序列称探针。
凝胶置于NaOH溶液中使DNA变性断裂为 较短的单链 DNA,中性缓冲液中和凝胶中的 缓冲液。
20
4. Southern转膜(印迹)
待测定核酸分子通过一定的方法转移并结 合到一定的固相支持物(如纤维素膜)上, 即印迹。
21
4.1 固相支持物的选择 (1)理想的固相支持物应具备的特性
①具有较强结合核酸分子的能力 ②不影响与探针的杂交反应 ③与核酸分子结合稳定牢固 ④具有良好的机械性能 非特异吸附少
3
Hybridization of Nucleic Acids
DNA1
DNA2
DNA RNA
探针
probe
Northern
Southern
hybridization
hybridization
4
(一)DNA变性与复性
DNA变性 1、定义:某些理化因素导致两条DNA链间的
氢链断裂变为单链的过程,称DNA变性。
DNA的提取原理:裂解细胞,使DNA释 放,交替使用酚、氯仿两种蛋白质变性 剂,有效去除蛋白质
标准程序:酚——酚-氯仿——氯仿。
16
17
2. 待测DNA 样品的电泳分离: 琼脂糖凝胶电泳
18
A
B
ห้องสมุดไป่ตู้
C
M 琼脂糖凝胶电泳
bp
—1534
— 994 — 695
— 515
— 377 — 237
19
3. 凝胶中DNA的变性:碱变性
7
复性 1、定义:变性的单链核酸分子在一定
条件下按碱基互补原则重新结合为双链核酸 的过程,称复性或杂交。 具有互补序列的两条单链核酸都可互补形成 双链:DNA/DNA、RNA/DNA、RNA/RNA、 寡核苷酸/DNA和寡核苷酸/RNA。
8
2、复性过程 (1)单链分子间碰撞形成局部双链 (2)局部双链周围的碱基如不配对时,双链重新解离 (3)局部双链周围的碱基如配对,则形成中心序列 (4)形成完整的双链分子
23
4.3 Southern印迹的常用方法 (1)毛细管虹吸印迹法
利用浓盐转移缓冲液的推动作用,将凝胶中的 DNA转移到固相支持物上。 其基本原理是:容器 中的转移缓冲液含有高浓度的NaCl和柠檬酸钠, 上层吸水纸的虹吸作用使缓冲液通过滤纸桥、滤 纸、凝胶、硝酸纤维素滤膜向上运动,同时带动 凝胶中的DNA片段垂直向上运动,凝胶中的DNA 片段移出凝胶而滞留在膜上。
27
28
各种转移方法的比较 i) 毛细管虹吸法:操作简便,不需要特殊转 移仪器,但转移效率低,(扩散法为70%, 毛细管法80%)耗时多。 ii) 电转移法:效率高,耗时少,需特殊转 移仪,对转移条件要求较严。 iii) 真空转移法:效率高,耗时最少,需特 殊真空转移仪。
29
转移的最佳条件
i) 固定基质的选择 ii) 转移前预处理:DNA和RNA分子变性,蛋白质 则需除去凝胶中的SDS。 iii)大分子的转移 对于分子量较大的DNA片段,必须进行原位断裂 后再进行转移,断裂DNA分子最佳长度为1-2kb。 其步骤是: 0.25M HCl处理凝胶两次(每次15分钟) →水洗→0.5M NaOH/1M NaCl两次,每次15分钟→ 转移。
