各种转染试剂中文说明
fugene 4k 转染试剂 中文说明书

2022版 CTM694原英文技术手册TM694中 文 说 明 书适用产品目录号:E5911和E5912FuGENE ®4K TransfectionReagent普洛麦格(北京)生物技术有限公司Promega (Beijing) Biotech Co., Ltd 地址:北京市东城区北三环东路36号环球贸易中心B座907-909电话:************网址:技术支持电话:400 810 8133技术支持邮箱:*************************CTM 6942022制作1所有技术文献的英文原版均可在/ protocols 获得。
请访问该网址以确定您使用的说明书是否为最新版本。
如果您在使用该试剂盒时有任何问题,请与Promega 北京技术服务部联系。
电子邮箱:*************************1. 描述 (2)2. 产品组分和储存条件 (2)3. 一般注意事项 (2)3. A. 转染试剂与DNA的比例 (3)3. B. DNA (3)3. C. 时间 (3)3. D. 血清 (3)3. E. 细胞培养条件 (3)3. F. 稳定转染 (3)4. 推荐操作步骤 (4)4. A. 细胞铺板 (5)4. B. FuGENE® 4K Transfection Reagent准备 (5)4. C. 一般转染操作步骤 (6)4. D. 稳定转染操作步骤 (8)4. E. 转染优化 (9)4. F. 报告基因活性和细胞健康的多重检测方案 (11)5. 疑难解答 (12)FuGENE® 4K Transfection Reagent普洛麦格(北京)生物技术有限公司Promega (Beijing) Biotech Co., Ltd 地址:北京市东城区北三环东路36号环球贸易中心B座907-909电话:************网址:技术支持电话:400 810 8133技术支持邮箱:*************************CTM 6942022制作21. 描述FuGENE® 4K Transfection Reagent是一个多组分,非脂质体试剂,用于将DNA高效、低毒地转染至多种哺乳动物细胞系中,无需在加入试剂-DNA复合物后更换培养基。
RNAi-Mate转染试剂操作手册说明书

目录号 C-01
产品说明 RNAi-Mate 转染试剂
规格 0.1mL
价格 ¥160
交货期限 2 个工作日
操作方法
一、体外转染方法 1. 细胞培养
可广泛应用于多种细胞系的DNA和siRNA转染。已成功地应用于多种代表各种来源的细胞类 型,包括 Hela(人宫颈癌细胞), MCF-7(人乳腺癌细胞), Hep3B(人肝细胞癌细胞), COS-7(猴肾细胞), Neuro-2a(鼠神经 母细胞瘤细胞),NIKS(人角质化细胞),C6(鼠神经胶质瘤细胞), DLD-1(人结肠癌细胞), NIH/3T3(鼠胚胎成纤维细 胞), HT-29(人结肠腺癌细胞), A549(人肺癌细胞), CHO-k1(仓鼠卵巢细胞)和293(腺病毒5 DNA转化的人胚胎 肾细胞), SVRbag4细胞。
3. 细胞出现明显死亡
问题 与细胞生存相关的关键基因被关闭
细胞状态欠佳
siRNA/RNAi-Mate(或DNA/RNAiMate) 复合物浓度过高
重新设计实验
建议
使用传代次数较低的细胞;细胞接种后在24小时内达 到70-90%,并在24小时内完成转染
siRNA/RNAi-Mate(或 DNA/RNAi-Mate)浓度过高 时,有时也会产生毒性
4.悬浮细胞转染程序 本程序适用于使用24孔板悬浮细胞的转染。选用生理状态良好的细胞对提高转染效率很重要。 siRNA(DNA)和DNA的用量和两者的比例可在推荐范围内适当调整。 4.1 转染的当天,收集细胞离心,重悬。 4.2 在50μl的DMEM(或Opti-MEM, 或其他无血清培养基)无血清培养基加入20pmol siRNA(或 0.8μg DNA), 柔和混匀。 4.3 混匀RNAi-Mate试剂,用50μl无血清的DMEM或Opti-MEM,或其他无血清培养基)稀释 1μl RNAi-Mate试剂(DNA转染时,则加入2μl RNAi-Mate试剂),轻轻混匀,室温放置5分钟。 4.4 将稀释好的siRNA和RNAi-Mate试剂混合;轻柔混匀,室温放置20分钟,以便形成siRNA/RNAiMate(或DNA/RNAi-Mate)复合物。 4.5 将100μl siRNA/RNAi-Mate(或DNA/RNAi-Mate)复合物加到含有细胞和培养基的培养板的孔 中,来回轻柔摇晃细胞培养板。 4.6 再加入400μL细胞悬浮液(细胞数量决定于细胞类型和转染后分析测试的时间)。 4.7 细胞在37℃温育24h-48h后进行转染后的其它步骤。如果细胞株比较敏感,孵育4-6小时后,除去 复合物,更换培养基。
各种转染试剂的中文转染方法

各种转染试剂的中文转染方法FuGENE6(Roche)转染步骤:转染前一天将细胞分至培养板,转染当天细胞应50-80%融合。
将细胞以1-3×105/2 ml接种于6孔板后孵育过夜将达到如此密度。
将FuGENE6 Reagent在室温孵育10-15分钟。
使用之前将FuGENE6颠倒混匀一下。
1. 在PCR管中加入不含血清和双抗的营养液以稀释FuGENE6,直至总体积到100 ul。
2. 将3-6 ul FuGENE6 Reagent直接加入营养液,轻弹管壁混合。
3. 加入1-2 ug的DNA溶液(0.02-2.0 ug/ul),轻弹管壁混合。
4. 室温孵育20分钟。
5. 将6孔板中的旧营养液吸出,加入约1 ml不含血清和双抗的营养液洗涤一次,再加入2 ml不含血清和双抗的营养液。
6. 将转染复合物加入细胞,混匀使之均匀分布。
7. 3-8小时后,加入血清或换成含血清的营养液。
Lipofectamine 2000(Invitrogen)转染试剂转染步骤(6孔板):1. 转染前一天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90-95%。
细胞铺板在2 ml含血清,不含抗生素的正常生长的培养基中。
2. 对于每孔细胞,使用250 ul无血清培养基(如OPTI-MEM I培养基)稀释4.0 ugDNA,轻轻混匀。
3. 使用前将Lipofectamine 2000转染试剂轻轻混匀,用250 ul无血清培养基(如OPTI-MEM I培养基)稀释10 ul Lipofectamine 2000转染试剂,轻轻混匀。
Lipofectamine 2000稀释后,在5分钟内同稀释的DNA混合(<30分钟)。
NOTE:若使用DMEM培养基,则需在5分钟内同稀释的DNA混合。
4. 混合稀释的DNA(第二步)和稀释的Lipofectamine 2000(第三步)。
室温放置20分钟。
5. (optional)将6孔板中的旧营养液吸出,用无血清培养基清洗两次。
转染试剂使用说明书

210102
1ml
1. 2. 3. 4. 5. 6.
适用范围及特点: 适应于众多原代培养细胞和转化细胞株的基因转染 适用于瞬时转染和稳定转染 适应于贴壁细胞和悬浮细胞转染 转染效率高且稳定,在有无血清存在的细胞培养基中均能获得高效率转染 细胞毒性低 转染程序简单,转染实验可以在半小时内完成
产品储存: GenFectinTM (1.0mg/ml) 在室温下运输,试剂到时请即存放于 4℃,在 4℃可存放
2. 3).
配制转染工作液: ( 6 孔板或 35 mm 平皿, 2 ml 培养液) 取 5~8μ g DNA (起始用量 5μ g) ,加入稀释液中至总体积为 100μ l,轻轻混匀,室 温放置。
4).
先将 GenFectin TM 涡旋振荡混匀。取 GenFectinTM 1~4μ0μl,轻轻混匀,室温放置 5 分钟。
8).
稳定转染时,于转染后 24~48 小时消化细胞分至 3~5 个培养皿中,加适当浓度的 相应抗生素(如 G418)筛选。
建议的起始转染条件 : 培养容器
96 孔板 24 孔板 6 孔板 35mm 培养皿 60mm 培养皿
转染前一天 接种细胞数
1-1.510 个 0.5-1 10 个 2-4 10 个 2-4 10 个 4-6 105 个
3.
GenFectinTM 在转染中不受血清影响,所以 GenFectinTM / DNA 复合物能直接加到 含血清的培养基中,但稀释 GenFectinTM 和 DNA 的缓冲液不能混有血清,因为 GenFectinTM 在制备 GenFectinTM / DNA 复合物之前可能会与血清中的蛋白质反 应,影响转染效率。
-5-
Xfect转染试剂操作中文手册(clontech)

Xfect 质粒DNA 转染试剂• 操作简便且兼容血清 • 转染效率高 • 细胞毒性极低 • 细胞类型广泛操作流程图:Xfect 质粒DNA 转染试剂操作步骤(6-孔板):1. 转染前的准备贴壁细胞: 在转染的前1d ,接种1ml 合适密度的细胞于6-孔板的单孔中,使转染当天细胞融合度能够达到50–80%。
悬浮细胞: 在混匀Xfect Polymer 前,将细胞以5 x10e5–1.25 x10e6/1ml 接种于6-孔板中培养。
2. 漩涡混匀Xfect Polymer 。
3. 对于单孔转染,分别在2个离心管中混匀以下试剂: Tube 1 (质粒DNA)---μl (5 μg) 质粒DNA---μl Xfect 反应缓冲液 100 μl 总体积T ube 2 (Polymer) 1.5 μl Xfect Polymer (100μg /μl ) 98.5 μl Xfect 反应缓冲液 100 μl 总体积注意:• 上述为6-孔板单孔转染所需的量。
• 每1μg 质粒DNA 加0.3 μl Xfect Polymer 。
• 对于大多细胞来说,5 μg 的质粒DNA 是最佳使用量。
若您是首次使用Xfect 转染细胞,需要按照2.5 μg ,5 μg 和7.5 μg 的质粒DNA 的量进行梯度实验,确定质粒DNA 的最优使用量。
实验证明,质粒DNA 的量不能少于2.5 μg ,不然会造成转染效率低(经转染Hela 细胞实验验证)。
• Xfect Polymer 预混液室温放置不要超过30min 。
4. 漩涡混匀每管混合物。
5. 将Xfect Polymer 预混液和DNA 预混液混合,再将混合液以适中的速度漩涡10sec 。
6. 室温孵育10 min ,形成Xfect/DNA 复合物。
7. 将200μl 纳米复合物逐滴加入细胞培养基中,轻柔地前后摇晃混匀。
注意:无需去除培养基中的血清,当纳米复合物加入培养基后,培养基的颜色会有些改变,这是正常的。
英格恩entranster转染试剂说明书

英格恩entranster转染试剂说明书一、产品概述英格恩 Entanster 转染试剂是一种用于转染外源 DNA/RNA 到细胞内的试剂。
它是经过优化的化学试剂组合,可以将外源 DNA/RNA 高效地传递到各种细胞中,并促进其定向表达。
本试剂适用于体外转染实验和基因工程研究,具有高转染效率、低细胞毒性、简单易用等优点。
二、试剂成分英格恩 Entanster 转染试剂主要成分包括转染缓冲液和转染增强剂。
转染缓冲液中包含有机溶剂、非离子表面活性剂等,用于稳定 DNA/RNA与转染剂的结合。
转染增强剂含有具有阴离子表面活性剂、脂质、蛋白质等物质,可以提高细胞膜通透性和转染效率。
三、使用说明1.储存和稀释:试剂应储存于-20℃的冰箱中,保持干燥和避光。
使用前需要将试剂溶解在适当体积的转染缓冲液中,最佳稀释比例为1:9、溶液需充分混匀,离心并去除任何沉淀物。
2.样品准备:在转染前,将目标DNA/RNA溶解在适当的缓冲液中,浓度通常在0.1-1μg/μL最佳。
确保样品充分溶解并无明显沉淀。
3.转染操作:对于已经培养至适当倍数的细胞,将细胞用预先暖和的转染缓冲液洗涤一次,并去除缓冲液。
将转染缓冲液和溶解好的目标DNA/RNA混合,稍微搅拌均匀。
与此同时,将适量的转染增强剂加入到混合物中,充分混合。
然后将混合物直接滴加到细胞上,并轻轻摇晃培养板以确保混合物均匀分布。
4.培养和检测:将含有转染混合物的培养板放回恒温培养箱中,保持恒定的温度和CO2浓度。
培养时间和温度根据需要进行调整,通常在24-48小时后可以进行下一步实验或观察。
四、注意事项1.试剂需保存在干燥、阴凉、避光的环境中,避免结冰或暴露在高温环境中。
2.操作中需佩戴手套并遵循生物安全实验操作规范。
3.使用前需充分摇匀试剂瓶,确保所有试剂成分充分混合均匀。
4.转染缓冲液中的有机溶剂可能对一些细胞有毒性,因此在选择试剂时应参考相关文献或尝试不同的浓度和时间,以确定最佳条件。
jetPRIME 转染siRNA说明书
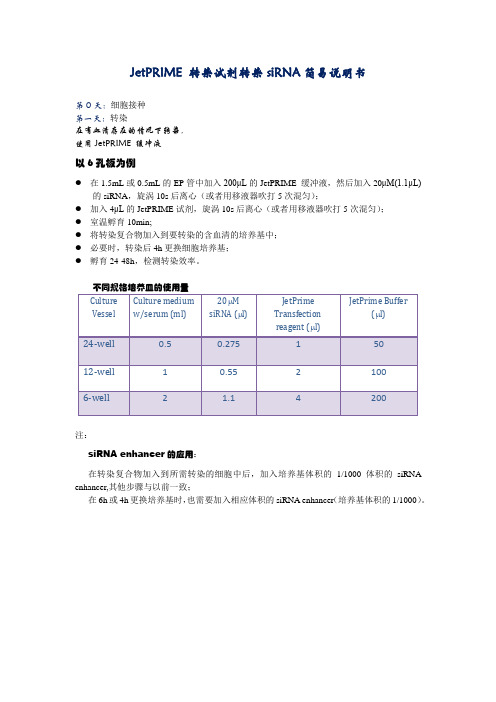
JetPRIME 转染试剂转染siRNA简易说明书
第0天:细胞接种
第一天:转染
在有血清存在的情况下转染,
使用JetPRIME缓冲液
以6孔板为例
●在1.5mL或0.5mL的EP管中加入200μL的JetPRIME 缓冲液,然后加入20μM(1.1μL)
的siRNA,旋涡10s后离心(或者用移液器吹打5次混匀);
●加入4μL的JetPRIME试剂,旋涡10s后离心(或者用移液器吹打5次混匀);
●室温孵育10min;
●将转染复合物加入到要转染的含血清的培养基中;
●必要时,转染后4h更换细胞培养基;
●孵育24-48h,检测转染效率。
不同规格培养皿的使用量
注:
siRNA enhancer的应用:
在转染复合物加入到所需转染的细胞中后,加入培养基体积的1/1000体积的siRNA enhancer,其他步骤与以前一致;
在6h或4h更换培养基时,也需要加入相应体积的siRNA enhancer(培养基体积的1/1000)。
lipo293转染试剂说明书

Lipo293转染试剂是一种高效的转染试剂,特别适用于贴壁生长的HEK293、HEK293T、HEK293A、293FT等293系列细胞的转染。
以下是Lipo293转染试剂的使用说明书:适用范围:Lipo293转染试剂适用于贴壁生长的HEK293、HEK293T、HEK293A、293FT等293系列细胞的转染。
转染步骤:(1)准备转染试剂和DNA:按照推荐的DNA用量,将DNA溶解在无菌水中,然后与Lipo293转染试剂按照1:1的比例混合。
(2)细胞处理:将细胞按照推荐的培养条件在细胞培养箱中培养至适宜的密度。
(3)转染:将DNA-Lipo293复合物与细胞混合,并轻轻摇晃,使复合物均匀分布。
(4)培养:将转染后的细胞继续培养,期间注意观察细胞的生长状态。
注意事项:(1)使用高质量的DNA:为了获得最佳的转染效果,建议使用高质量的DNA。
(2)细胞密度和状态:转染前,细胞需要处于良好的生长状态,密度适宜。
(3)保存条件:Lipo293转染试剂应保存在4℃或-20℃的条件下,避免反复冻融。
(4)过敏反应:对于过敏体质的用户,建议在使用前进行皮肤过敏试验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
FuGENE6(Roche)转染步骤:转染前一天将细胞分至培养板,转染当天细胞应50-80%融合。
将细胞以1-3×105/2ml接种于6孔板后孵育过夜将达到如此密度。
将FuGENE6 Reagent在室温孵育10-15分钟。
使用之前将FuGENE6颠倒混匀一下。
1.在PCR管中加入不含血清和双抗的营养液以稀释FuGENE6,直至总体积到100ul。
2.将3-6ul FuGENE6 Reagent直接加入营养液,轻弹管壁混合。
3.加入1-2ug的DNA溶液(0.02-2.0ug/ul),轻弹管壁混合。
4.室温孵育20分钟。
5.将6孔板中的旧营养液吸出,加入约1ml不含血清和双抗的营养液洗涤一次,再加入2ml不含血清和双抗的营养液。
6.将转染复合物加入细胞,混匀使之均匀分布。
7.3-8小时后,加入血清或换成含血清的营养液。
Lipofectamine 2000(Invitrogen)转染试剂转染步骤(6孔板):1.转染前一天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90-95%。
细胞铺板在2ml含血清,不含抗生素的正常生长的培养基中。
2.对于每孔细胞,使用250ul无血清培养基(如OPTI-MEM I培养基)稀释4.0ugDNA,轻轻混匀。
3.使用前将Lipofectamine 2000转染试剂轻轻混匀,用250ul无血清培养基(如OPTI-MEM I培养基)稀释10ul Lipofectamine 2000转染试剂,轻轻混匀。
Lipofectamine 2000稀释后,在5分钟内同稀释的DNA混合(<30分钟)。
NOTE:若使用DMEM培养基,则需在5分钟内同稀释的DNA混合。
4.混合稀释的DNA(第二步)和稀释的Lipofectamine 2000(第三步)。
室温放置20分钟。
5.(optional)将6孔板中的旧营养液吸出,用无血清培养基清洗两次。
加入2ml无血清配养基。
6.直接将复合物加入到每孔中,摇动培养板,轻轻混匀。
7.在37℃,5%CO中保温24-48小时。
无需去掉复合物或更换培养基。
2或者在4-5小时后更换培养生长基也不会降低转染活性。
8.在细胞中加入复合物24-72小时后,分析细胞抽提物或进行原位细胞染色,检测报告基因活性。
这依赖于细胞类型和启动子活性。
对稳定表达,在开始转染一天后将细胞传代至新鲜培养基中,两天后加入筛选抗生素。
进行稳定表达需要数天或数周。
贴壁细胞的稳定转染:转染后24小时,将细胞以≥1:10的比例传代至新鲜培养基中,次日加入选择性培养基。
Lipofectamine 2000转染试剂转染步骤(24孔板):1.转染前一天,胰酶消化细胞并计数(0.5-2×105),细胞铺板,使其在转染日密度为90-95%。
细胞铺板在0.5ml含血清,不含抗生素的正常生长的培养基中。
2.对于每孔细胞,使用50ul无血清培养基(如OPTI-MEM I培养基)稀释0.8-1.0ugDNA,轻轻混匀。
3.使用前将Lipofectamine 2000转染试剂轻轻混匀,用50ul无血清培养基(如OPTI-MEM I培养基)稀释1-3ul Lipofectamine 2000转染试剂,轻轻混匀。
Lipofectamine 2000稀释后,在5分钟内同稀释的DNA混合(<30分钟)。
NOTE:若使用DMEM培养基,则需在5分钟内同稀释的DNA混合。
4.混合稀释的DNA(第二步)和稀释的Lipofectamine 2000(第三步)。
室温放置20分钟。
5.(optional)将24孔板中的旧营养液吸出,用无血清培养基清洗两次。
加入0.5ml无血清配养基。
6.直接将复合物加入到每孔中,摇动培养板,轻轻混匀。
中保温24-48小时。
无需去掉复合物或更换培养基。
7.在37℃,5%CO2或者在4-5小时后更换培养生长基也不会降低转染活性。
8.在细胞中加入复合物24-72小时后,分析细胞抽提物或进行原位细胞染色,检测报告基因活性。
这依赖于细胞类型和启动子活性。
对稳定表达,在开始转染一天后将细胞传代至新鲜培养基中,两天后加入筛选抗生素。
进行稳定表达需要数天或数周。
贴壁细胞的稳定转染:转染后24小时,将细胞以≥1:10的比例传代至新鲜培养基中,次日加入选择性培养基。
Effectene Transfection Reagent(Qiagen) 转染步骤:以下步骤适用于在6孔培养板中转染贴壁细胞。
开始时,每6孔培养板使用0.4ug DNA。
尽管DNA的量看起来很少,但已足够用于转染。
如果想获得最高的转染效率,对每种细胞系的转染条件都要进行优化。
1.转染前一天,用5ml含血清和抗生素的培养基分装使每6孔培养板含2-8×105的细胞(根据细胞类型而定)。
2.在细胞的正常培养条件下培养(通常37℃和5%CO2)。
转染当天细胞应40-80%融合。
3.转染时,用DNA浓缩缓冲液(EC Buffer)稀释1ug DNA至100ul总体积(DNA用pH 7-8的TE Buffer溶解,DNA最低浓度:0.1ug/ul)。
加入3.2ul Enhancer,涡旋1s以混合溶液。
重要:请保持DNA与Enhancer比例恒定。
注意:质粒DNA的质量会显著影响几个转染参数如转染效率、细胞增殖和细胞毒性、以及对于结果的解释。
因此,只应该使用最高纯度的DNA。
使用HiSpeed,QIAfilter和QIAGEN Plasmid Kits抽提纯化的质粒适合于大多数细胞系的转染。
要获得最好的重复性和最好的结果,我们推荐使用Endofree Plasmid Kit,该试剂盒可以快速有效地在质粒纯化过程中去除细菌内毒素,从而获得最佳的转染结果。
4.室温(15-25℃)孵育2-5分钟,离心(spin down)几秒钟以从管顶去除液5滴。
5.向DNA-Enhance混合液中加入10ul Effectene Transfection Reagent,反复吸取5次或涡旋10秒钟以混合。
注意:没必要一直把Effectene Reagent置于冰上。
在室温中放置10-15分钟不会改变它的稳定性。
6.室温下(15-25℃)孵育5-10分钟以形成转染复合物。
7.孵育过程中,从培养板上轻柔地吸出培养液,用4ml PBS洗涤一次细胞。
加入1.6ml新鲜培养液(可以包含血清和抗生素)到细胞中。
8.加入0.6ml培养液(可以包含血清和抗生素)至包含转染转染复合物的EP管中。
吸取两次以混合,立即将转染复合物drop-wise加入6孔培养板的细胞中。
轻摇培养板使转染复合物分布均匀。
9.将细胞与转染复合物在它们的正常培养条件下孵育适当的时间直至转染基因表达。
孵育时间和由所采用的实验和所使用的基因决定。
Optional:大多数情况下,不需去除转染复合物。
然而,如果观察到细胞毒性,则需在转染后6-18小时移除Effectene-DNA混合物,用PBS洗涤一次细胞,然后加入5ml新鲜细胞培养液。
10.瞬时转染时,进一步试验分析转染基因的表达。
转染β-gal 或cat 报告基因的重组子常在转染后孵育24-48小时以使转染基因的表达最大化。
稳定转染时,在转染后24-48小时,将细胞以1:5~1:10传代至合适的选择性培养基中。
保持细胞在选择性培养基中直至克隆出现。
注意:我们推荐对每一细胞系和使用的抗生素建立一个致死曲线(剂量-反应曲线)。
但是一定要记住致死曲线受细胞密度的影响。
以下步骤有时是必须的:将转染的细胞置于它们正常的培养液(如:不含选择性抗生素的培养液),然后孵育1-2天,然后再加入选择性培养液。
Superfect Transfection Reagent(Qiagen) 转染步骤:以下步骤适用于在6孔培养板中转染贴壁细胞。
如果想获得最高的转染效率,对每种细胞系的转染条件都要进行优化。
1.转染前一天,用含血清和抗生素的培养基分装使每6孔培养板含2-8×105的细胞(根据细胞类型而定)。
2.在细胞的正常培养条件下培养(通常37℃和5%CO2)。
转染当天细胞应40-80%融合。
3.转染时,用无血清培养基稀释2ug DNA至100ul总体积(DNA用pH 7-8的TEBuffer溶解,DNA最低浓度:0.1ug/ul)。
混合,离心几秒钟以从管顶去除液滴。
注意:质粒DNA的质量会显著影响几个转染参数如转染效率、细胞增殖和细胞毒性、以及对于结果的解释。
因此,只应该使用最高纯度的DNA。
使用HiSpeed,QIAfilter和QIAGEN Plasmid Kits抽提纯化的质粒适合于大多数细胞系的转染。
要获得最好的重复性和最好的结果,我们推荐使用Endofree Plasmid Kit,该试剂盒可以快速有效地在质粒纯化过程中去除细菌内毒素,从而获得最佳的转染结果。
4.向DNA稀释液中加入10ul Superfect Transfection Reagent,反复吸取5次或涡旋10秒钟以混合。
注意:没必要一直把Superfect Reagent置于冰上。
在室温中放置10-15分钟不会改变它的稳定性。
5.室温下(15-25℃)孵育5-10分钟以形成转染复合物。
6.孵育过程中,从培养板上轻柔地吸出培养液,用2ml PBS洗涤一次细胞。
7.加入600ul培养液(包含血清和抗生素)至包含转染转染复合物的EP管中。
吹打两次以混合,立即将转染复合物加入6孔培养板的细胞中。
轻摇培养板使转染复合物分布均匀。
8.将细胞与转染复合物在它们的正常培养条件下孵育2-3小时。
9.小心移除Superfect-DNA混合物,用2mlPBS洗涤3-4次细胞10.加入新鲜的正常培养基,孵育24-48小时。
11.瞬时转染时,进一步试验分析转染基因的表达。
转染β-gal 或cat 报告基因的重组子常在转染后孵育24-48小时以使转染5基因的表达最大化。
稳定转染时,在转染后24-48小时,将细胞以1:10~1:15传代至合适的选择性培养基中。
保持细胞在选择性培养基中直至克隆出现。
注意:我们推荐对每一细胞系和使用的抗生素建立一个致死曲线(剂量-反应曲线)。
但是一定要记住致死曲线受细胞密度的影响。
以下步骤有时是必须的:将转染的细胞置于它们正常的培养液(如:不含选择性抗生素的培养液),然后孵育1-2天,然后再加入选择性培养液。
