17-第十七章杂环化合物
有机化学---第17章 杂环化合物

、 内酯、环状酸酐等。
环为平面型共轭体系,环内π电子数符合4n+2规 则,具有一定芳香性的杂环化合物。
2
2、杂环化合物的分类
五元杂环, 如 单杂环 六元杂环, 如 杂环化合物 稠杂环 两个以上单杂环稠并
N N N H
O N
N H
S
苯环与单杂环稠并, 如 N H
N
N
3
3、杂环化合物的命名 (1)音译法 ——在同音汉字左边 + 口字旁
N ..
H2SO4,HgSO4 220℃
N
N
NO2
β-硝基吡啶
SO3H
β-吡啶磺酸
34
当吡啶环上连有供电子基团时,将有利于亲电取
代反应的发生;反之,就更难以进行亲电取代反应。
NO2
HNO3,H2SO4
H3 C N CH3
100℃
H3 C
N
CH3
吡啶环也象硝基苯一样,不能发生F―C烷基化和 酰基化反应。
吲哚具有芳香性,亲电取代反应发生在吡咯环上; 吲哚亲电取代反应的活性比苯高,但比吡咯低。 亲电取代反应的位置:
5 4 3 7
E+
1
苯 环
6
N H
2
吡咯环
26
进攻 C2 N H + E
+
进攻 C3
只有一个带有完 E N 2 H 整苯环的共振杂化体。 H 3 E 3 E H H + + N N H H
OH
6
S1
苯并呋喃
1
苯并吡咯 喹啉
N
9 7 8
苯并噻唑
N N
3
5 4
HO
N H
OH
第17章杂环化合物

HOOC CH3 CH 3 S N C O CH NH C R O
命名3:根据相应的碳环来命名。把杂环看作相应碳环 中的碳原子被杂原子取代而形成的化合物,命名时在 相应的碳环名称前加上杂原子的名称:
• 在没有误会的情况下,“杂”字可以省去。
杂环化合物(heterocyclic compounds):
构成环的原子除碳原子外还有其它原子 的一类环状化合物 , 常见的杂原子是O,N,S。
0.1361 0.1370 0.1382 0.1341
0.1430 0.1423 0.1417 0.1455
C C
C C
键长/nm 0.154 0.134
17.2 五元杂环化合物
17.2.1 五元杂环化合物的化学性质
X
X = NH,O,S
杂原子的+C 效应,增加了杂环的亲电 取代反应的活性。亲电取代反应活性顺序:
加成反应
呋喃的芳香性比较弱, 除进行亲电取代反应外;还 容易进行亲电加成和Diels-Alder环加成反应。
O O +
O S + O
OO
O O
O
30oC
O H O H 90%
100 C 1500MPa
o
SO O H H
H CH3OH Br CH
O
47%
+ Br2
O
CH3COOK CH3OH
H Br
有机化学-第十七章 杂环化合物
Br
Br
N H
Br2
N H
乙 醇
Br
Br
噻吩对氧化剂稳定,可用一般的硝化剂和磺化剂
H2SO4 , 25℃
S
SO3H S
α-噻吩磺酸
呋喃和吡咯对及氧化剂都比较敏感,应使用特殊的试
剂乙酰硝酸酯进行硝化,使用吡啶三氧化硫进行磺化。
+
N
SO3
-
SO3H O
O CH3 C ONO2 (CH3CO)2O,-10 ℃
O
α-呋喃磺酸
N H
N H
α-硝基吡咯
NO2
吡啶比苯难发生亲电取代反应,反应条件要求和硝基
苯差不多;在发生反应时取代基主要进入β-位。
HNO3 , H2SO4
NO2 N
β(3)-硝基吡啶
N
300 ℃
吡啶的氯代要用AlCl3催化且要加热; 吡啶的磺化要用发烟H2SO4并要加热;
(2) 氧化反应 吡啶环对氧化剂稳定,比苯环难氧化。
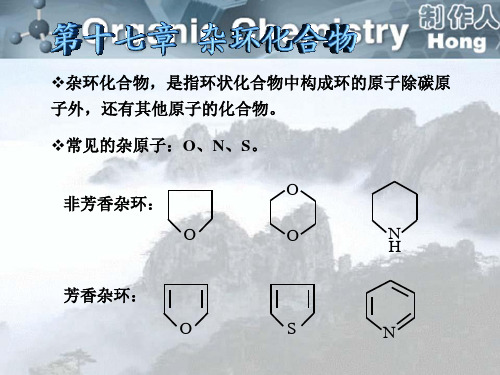
杂环化合物,是指环状化合物中构成环的原子除碳原
子外,还有其他原子的化合物。
常见的杂原子:O、N、S。 非芳香杂环:
O O O N H
芳香杂环:
O
S
N
17-1 分类和命名
一、杂环化合物的分类
单杂环:
{
五元杂环 六元杂环
O
呋喃
N H
吡咯
S
噻吩
N S
噻唑
N N H
咪唑
N
N
吡啶
N
嘧啶
稠杂环:
{
N
1 6 5
N N
3 4
N7
8
N2
2
N9 H
第17章杂环化合物

第十七章杂环化合物一、本章知识结构及知识要点本章知识结构知识要点1、杂环化合物命名和结构1命名杂环母核音译法按照IUPAC推荐的普通名称用23个汉字音译使用带口字旁的同音汉字。
如呋喃、吡啶等。
系统命名法根据相应的碳环命名。
如O氧杂-24-环戊二烯原子的编号杂环化合物分类、命名和结构分类和命名结构和芳香性五元杂环化合物化学性质常见的五元杂环化合物呋喃和糠醛噻吩吡咯和吲哚咪唑和噻唑六元杂环化合物吡啶和嘧啶喹啉和异喹啉嘌呤编号从杂原子开始。
含有两种以上杂原子时①让杂原子的位号尽可能小②当两个杂原子不相同时价数小的在前大的在后③价数相等时原子序数小的在前大的在后。
有些稠杂环化合物的原子编号是固定的。
2结构和芳香性呋喃、吡咯、噻吩的结构sp2杂化结构特点杂原子共轭效应是供电子的诱导效应是吸电子的。
杂原子是sp2杂化未成键电子对在2p轨道上参与共轭。
由于6个π电子分布于5个原子上整个环的π电子几率密度比苯大是富电子芳环因而比苯环活泼亲电取代反应比苯快得多。
芳香性由大到小苯噻吩吡咯呋喃吡啶的结构sp2杂化结构特点杂原子的共轭效应和诱导效应都是吸电子的。
未成键电子对在sp2杂化轨道上不参与共轭。
形成∏66共轭体系具有芳香性。
由于N原子的吸电子作用使环的电子云密度降低亲电反应活性比苯低类似硝基苯。
2、五元杂环化合物1吡咯、呋喃和噻吩的化学性质容易发生亲电取代反应主要发生在α-位反应的活性为吡咯呋喃噻吩苯。
由于这些五元杂环容易被破坏稳定性差因而对试剂及反应条件应有所控制。
硝化硝化应在较低的温度下使用温和的硝化剂乙酰硝酸酯。
NHNHNO2CH3COONO210CH3CO2O ℃SSNO2CH3COONO210CH3CO2O ℃呋喃比较特殊先生成稳定的或不稳定的25加成产物然后加热或用吡啶除去乙酸得到硝化产物。
OCH3COONO230 5 ℃ONO2HONO2HHCH3COO吡啶ONO2 磺化吡咯、呋喃不太稳定所以须用温和的磺化试剂磺化。
第十七章杂环化合物

-NO2 S
5%
③ 磺化反应 吡咯、呋喃不能直接用硫酸磺化,因为它们在浓硫酸中 不稳定,会发生聚合,通常用一种温和的磺化剂—— 吡啶 三氧化硫进行磺化。
+ SO3
+
吡啶
N
N 吡啶三氧化硫 SO3
100 ℃
+ N H
HCl
N SO3 -SO3H +
90%
+
N H 90% Cl
-SO3 ·
-
N+ H
4 - 甲基 - 5 - ( 2' -羟乙基 ) 噻唑
N O 苯并呋喃 S 苯并噻唑
3) 根据相应碳环母核命名
把杂环当作是相应的碳环中碳原子被杂原子置换而形 成的,命名时在碳环母体名称前加“某杂” (杂原子的名 称)两字,以表示其中的杂原子。 N 氮(杂)茂 N
苯(碳环母核)
茂(碳环母核)
O 氧(杂)茂
150 ℃~160 ℃
N N H H 2-乙酰基吡咯 呋喃与酸酐或酰氯在催化剂作用下发生酰基化反应。 + (CH3CO)2O
BF3
-COCH3 60%
-COCH3 75%~92%
O
(或CH3COCl)
H2PO4
或SnCl4
O 2-乙酰基呋喃
噻吩酰化反应要用磷酸或氯化锡作催化剂。
S
+ (CH3CO)2O
① 卤代反应 像苯酚和苯胺一样,吡咯、呋喃、噻吩很容易发生卤代 反应。 氯代、溴代不但不需催化剂,而且为避免多取代物,往 往采用温和条件,如用溶剂稀释和采用低温。 吡咯反应活性最大,在低温下进行,一般得多卤产物。 Br-Br C2H5OH + Br2 Br-Br 0℃ N N
第17章 杂环--2

-吡啶甲酸 3-吡啶甲酸
§17-1 概 述
二、杂环化合物的结构
1、五员杂环化合物的结构
如吡咯。在吡咯中,成环的五个原子(1个N,4 个C)均为sp2杂化,形成三个键,2p轨道以侧面交 盖形成大键,其环上的电子数符合4n+2,因而具 有芳香性。 • •
H H
C C
•
H N H
吡咯分子中的键
§17-3 杂环化合物的性质
Br2 0℃
Br– Br–
N H
–Br –Br
2,3,4,5-四溴吡咯
CH3COONO2
–NO2 N 2-硝基吡咯 H –SO3H N 2-吡咯磺酸 H –COCH3 N 2-乙酰基吡咯 H
N H
SO3 N·
不能用混酸、 H2SO4直接 (CH3CO)2O 硝化、磺化
§17-3 杂环化合物的性质
E
EE E E AA A A E A
E E
中间体有三个主要共振式 中间体有三个主要共振式 中间体有三个主要共振式 中间体有三个主要共振式 中间体有三个主要共振式 较稳定 较稳定 较稳定 较稳定 较稳定 满足八隅体 贡献大
E E H H
E - H+ A
E+ E+
A A
A
E
A A
中间体有三个主要共振式 较稳定 A A
§17-3 杂环化合物的性质
2、六元杂环化合物
0.95 ① 亲电取代: 0.85 N有吸电子的诱导效应,使杂环上的电子 N 云密度降低,因而比苯难发生亲电取代反应。 吡啶的一元取代总是发生在间位。
+ Br2
N
0.82
浮石催化 300℃
FeBr3 50℃ H2SO4 300℃ H2SO4 50-60℃
第十七章杂环化合物

2004年8月13日
(三) 六元杂环化合物
N N 吡啶 N 嘧啶 H2N N 磺胺嘧啶(SD) SO2 NH N
(1) 碱性与亲核性
由于氮上孤对电子与苯环共面,不参与环体系的共轭 由于氮上孤对电子与苯环共面,不参与环体系的共轭, 所以吡啶有碱性和亲核性,且碱性大于苯胺: 所以吡啶有碱性和亲核性,且碱性大于苯胺:
(
。) b.p81 C
(苯层)
浓 H2SO4 室温 分液 蒸馏
无噻吩苯
S 。 ( b.p84 C) .
S
SO3H (酸层)
2004年8月13日
付氏酰基化: 付氏酰基化:
N H
+(CH3CO)2O
150-200 C 60%
。 N H COCH3
2004年8月13日
(2) 加成
O N H
+ H2 + H2
2004年8月13日
例:
N N N
+ Br2
。 300 C
以上
Br N
β溴代吡啶
+ H2SO4 + 混酸
350 C
。 。 N
SO3H NO2 N
β吡啶磺酸
300 C 24h
β硝基吡啶 (产率很低, 6%) 约
2004年8月13日
(3) 亲核取代
N N
+ NaNH2 + KOH
N NH2 N OH
能与强酸成盐
不能与强酸成盐, 不能与强酸成盐,遇酸分解
2004年8月13日
另一方面,吡咯有弱酸性: 另一方面,吡咯有弱酸性:
N H
+
KOH(S)
H2O
N+ K
第十七章 杂环化合物

NH
N
N
HN
例如:叶绿素(1818年,由植物叶中分离出)
(3)噻唑的重要衍生物
一些重要的天然产物及合成药物含有噻唑结构, 如青霉素、维生素B1等。
噻唑环
维生素B1(VB1)
NH3Cl N CH3 N Cl CH3 S CH2CH2OH
CH2 N
噻唑环
5. 杂环化合物的检验方法
呋喃: 盐酸浸渍的松木片 → 绿色 吡咯: 盐酸浸渍的松木片 → 红色 噻吩: 浓硫酸-靛红 → 蓝色 糠醛: 乙酸-苯胺→红色 吲哚: 盐酸浸渍的松木片 → 红色
O
1 4
N1 H
4 3 5 6 7 3
N
1 4
5 6 7
5 6 7
3
O
1
2
S
1
2
N1 H
2
例如:
O CHO O2N O CHO
2-呋喃甲醛(糠醛)
CH3
5-硝基-2-呋喃甲醛
CH2COOH
N
COOH
N H
4-甲基-2-吡啶甲酸
3-吲哚乙酸
(2)含有两个或两个以上相同杂原子
从连有氢或取代基的杂原子开始编号,并且使 杂原子位次之和最小。
(CH3)3C N
CH2CH3 KMnO4 (CH3)3C N
COOH
CH3 N
? N
NH2
还原反应
吡啶因环上电子云密度较低,比苯易还原, 用钠加乙醇、催化加氢等均使吡啶还原。
H2,Pt
N
CH 3COOH
N H
六氢吡啶(哌啶)
六氢吡啶(哌啶),沸点106℃,能溶于水、 乙醇、乙醚等溶剂,它的性质与一般仲胺相似。 是常用的有机碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N
N
N
Kekule’s structure
Aromaticity ? 电子云的分布
0 .8 7
1.01
1.01
0.84
0.84
N
1 .4 3
E.S. 变难 N.S. 变易 Oxidation 难 Reduction 易 Basicity
Six-membered Heterocyclic compounds
试给出下列反应的产物结构、名称及OONa +
C H 2O H
O
O
CH3COCH3,稀 OH-
BO
C H =C H C O C H 3
CHO O
KCN
C
O CH C
(CH3CO)2O D
O OH
O
CH3COOH
C H =C H C O O H
O
(2) 叶绿素和血红素
N C H 3
• 杂环作取代基:
O2N
CHO
O
O C-N(C2H5)2
O H3C N
CH3 N
N
ON N
CH3
5-硝基-2-呋喃甲醛 N,N-二乙基-3-吡啶甲酰胺 1,3,7-三甲基嘌呤 -2,6-二酮
• “指示氢” 和稠合边的表示 (N O S)
O
1
cS
2
5
1a bc
2
b
-O
HN a 3
4
O
3 4
4H-吡喃
2H-吡喃
噻吩并吡咯
萘并呋喃
噻吩并[3,2-b]吡咯 萘并[1,2-b]呋喃
二. 五元杂环化合物
1. 含一个杂原子的五元杂环化合物 1) 呋喃、吡咯、噻吩的结构
sp2
碳原子p轨道中有一个电子,
杂原子p轨道中有两个电子,
Z Z= O S NH
形成环状离域大键.
Z: +C > -I 效应; 电子数:6
三. 六元杂环化合物
N
N 吡啶
N 嘧啶
O 吡喃
NH
N上的孤电子对在 P轨道上,参与 环内共轭,为富 电子芳环。
N
N
N上的孤电子对在 sp2 轨道上,在环外 未参与环内共轭。
C_ sp2
N_ sp2
6
Π6
体系
成环原子
共平面
Six-membered Heterocyclic compounds
or
or
(2) 亲电取代反应
试推断呋喃、吡咯、噻吩发生亲电取代反应,比苯容易 还是难?
杂原子具有+C效应,活化杂环。
亲电取代反应活性顺序: 吡咯 > 呋喃 > 噻吩 > 苯。
亲电取代发生在位还是位?
位比位活泼。亲电取代主要发生在位。
Cl
C+ l
ClC 2 l
Br2, 0℃
O
O
-4 0 ℃O O O稀释
Br (86%) O
应用:苯与噻吩的分离和鉴别
(二者沸点接近,噻吩84℃,苯80℃, 但噻吩比苯易磺化,加入H2SO4后噻吩因反 应而溶于浓H2SO4)
(3) 加成反应
H2
S
MoS2
S
R C OS
OO
C R兰 尼 N i O H 2
R C (C H 2)4C R+N iS
O
O
O+
O
OO
O
O
3) 呋喃、吡咯、噻吩的衍生物 (1) 糠醛
2. Physical properties
(1) (偶极矩) Dipole moment
= 7.4110-38 c.m
3.90 10-38 c.m
I
方向一致
C
(2) Solubility: 吡啶可以与水以任意比例互溶
Six-membered Heterocyclic compounds
3. Chemical reactions a. Basicity of Pyridine
有芳香性。
O
离域能 KJmol 67
N H 88
S 117
(
)
150
2) 呋喃、噻吩、吡咯的性质 (1) 吡咯的酸碱性
吡咯没有碱性, 具有一定程度的酸性(pka=17.5)
K O H
- +H 2 O
N
N
H
K +
C H 3 M g I N 乙 醚 H
+ C H 4 N
M g I
为什么吡咯具有弱酸性?
.HCl ..
Pyr.SO3 磺化试剂
甲基化试剂
PhCOCl N
N Cl COPh
酰化试剂
Six-membered Heterocyclic compounds
b. Electrophilic Substitution:
N的-I
钝化环 反应条件剧烈
取代反应 发生在3-位()
0 .8 7
1.01
1.01
0.84
p K a
4 .6
5 .1 9
9 .2 5
R C H 2 N H 2 -1 0 .0
Basicity
脂 肪 胺 > >
>
>
Six-membered Heterocyclic compounds
..
+ HCl
SO3
N
CH2Cl2
N SO3-
CH3I
N I-
N
CH3
Cl- or H
O SO3- N H
S+ N
ClCH2CH2Cl
r. t.
Ba(OH)2
SO3
Ba2+
S
SO3- 2
+ N H
100 oC
N S O 3
N S O 3- N H
H
H C l
N S O 3H H
说明:
吡咯、呋喃、噻吩的亲电取代反应,对试剂及反应条 件必须有所选择和控制。
卤代反应 不需要催化剂,要在较低温度和进行。 硝化反应 不能用混酸硝化,一般是用乙酰基硝酸 酯(CH3COONO2)作硝化试剂,在低温下进行。 磺化反应 呋喃、吡咯不能用浓硫酸磺化,要用特 殊的磺化试剂——吡啶三氧化硫的络合物,噻吩可直接 用浓硫酸磺化。
CH3CONO2 + CH3COOH
AcONO2 O oC
S
Ac2O/AcOH
AcONO2 O oC
N
Ac2O/AcOH
H
NO2 + S 60 %
NO2 + N H
NO2
S 10 % NO2
N H
51 %
13 %
+ O
N SO3
ClCH2CH2Cl
r. t. 3 days
O SO3- N H
N -O3S H
Br2 AcOH
Br (78%) S
S
I2, HgO C6H6, 0℃
I 碘不活泼,要用催化剂才能发生一元取代
S
BrBr
Br N
BrB E r 2 ,0 ℃ tON HS O C E lt 2 2 ( O 1 ,m 0 ℃ o l)
H
H
Cl(8 0% ) N H
OO
O
CH3COCCH3 + HNO3
H O O C C H 2C H 2
C H 2C O O H
N H
N H
灵菌红素
(C H 2)4C H 3
N C H 2N H 2 H
卟吩胆色素原
NH N
N HN
卟吩 (P ro p h in e)
卟吩由四个吡咯和四个次甲基(=CH) 交替相连组成的共轭体系。
卟吩呈平面结构, 环中间空隙里四个氮 原子可分别以共价键、配价键与不同的 金属离子结合。叶绿素(镁), 血红素(铁)。
