常见酶切位点与保护碱基
NEB保护碱基-各种酶切位点保护碱基
切割率%
2 hr
20 hr
0
0
0
0
0
0
0
0
>90
>90
>90
>90
>90
>90
>90
>90
>90
>90
50
>90
>90
>90
>90
>90
10
25
>90
>90
>90
>90
0
0
75
>90
25
>90
0
0
0
0
50
>90
0
10
0
0
25
50
25
>90
0
0
0
0
>90
>90
50
50
>90
>90
>90
>90
>90
>90
0
0
>90
>90
75
>90
75
>90
Xho I
CCTCGAGG CCCTCGAGGG CCGCTCGAGCGG
0
0
10
25
10
75
欢迎阅读
Xma I
CCCCGGGG CCCCCGGGGG CCCCCCGGGGGG TCCCCCCGGGGGGA
0
0
25
75
50
>90
>90
>90
注释:
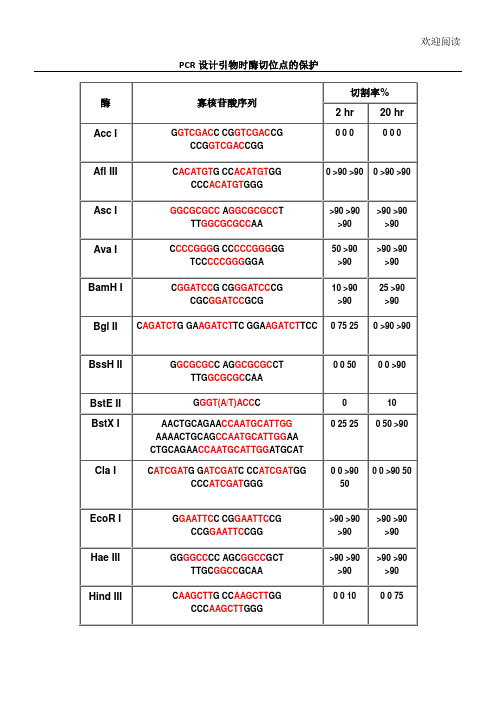
PCR设计引物时酶切位点的保护碱基

PCR设计引物时酶切位点的保护碱基引物设计是PCR实验的关键步骤之一,引物的好坏会直接影响到PCR反应的成功与否。
而在引物设计过程中,酶切位点的保护碱基是需要考虑的重要因素之一在PCR实验中,引物的作用是指定PCR反应的放大区域,并提供启动位点供聚合酶结合。
一般情况下,引物至少需要包含一段特定的DNA序列,以便与目标序列互补配对。
在引物设计过程中,选择合适的酶切位点是十分必要的。
酶切位点是指位于特定DNA序列上的限制酶可以识别并切割的区域。
酶切位点的选择通常需要考虑如下几个方面:1.切割效果:选择切割效果好的酶切位点可以提高PCR反应的特异性和灵敏度。
经典的选择是选择一种具有4-6个碱基的酶切位点,并且该位点在引物中间的位置。
这可以有效防止酶切位点的保护碱基对PCR反应的影响。
2.特异性:引物需要选择适合的酶切位点,以确保只有目标序列被放大,而不包括其他与之相关的非特异性序列。
因此,在选择酶切位点时应尽量避免与其他非特异性序列存在相似性。
3.引物长度:引物长度的选择也与酶切位点相关。
如果引物长度过短,可能会导致酶切位点过于靠近PCR反应产物的端点,从而使切割效果不佳。
因此,在引物设计时,应选择适当的引物长度,以保证酶切位点的保护碱基不会对PCR反应产物的生成产生不利影响。
酶切位点的保护碱基是指在特定的DNA序列上,通过选择相应的碱基来避免受到酶切的影响。
常见的保护碱基有甲基化碱基、磷酸化碱基以及接上阻断扩增的非互补碱基等。
1.甲基化碱基:将酶切位点中的一些碱基进行甲基化处理,可以有效地阻止特定酶的切割作用。
甲基化碱基可以通过DNA甲基转移酶进行甲基化修饰。
2.磷酸化碱基:磷酸化碱基是在引物设计过程中添加磷酸基团的方法,通过给酶切位点添加一个磷酸基团来阻断酶的切割作用。
3.非互补碱基:为了阻断酶切位点的切割作用,可以在酶切位点的周围引入一个与其不互补的碱基序列。
这样可以阻断酶的结合和切割。
总的来说,选择合适的酶切位点和保护碱基对PCR实验的成功至关重要。
常用酶切位点表(含保护碱基)课件.doc
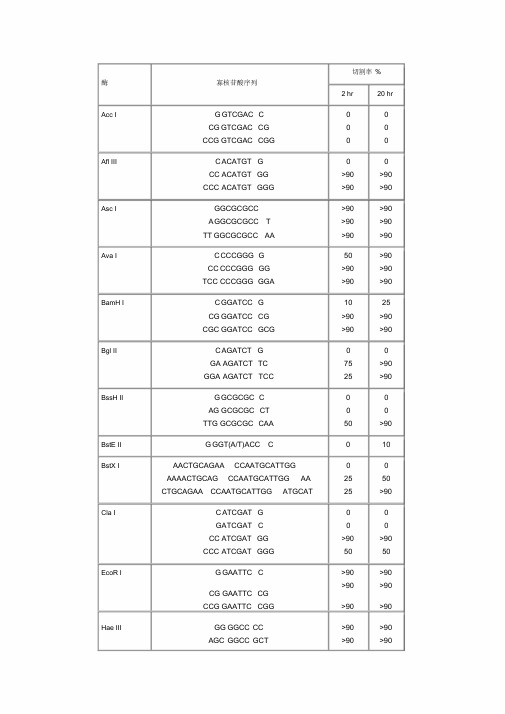
切割率%酶寡核苷酸序列2 hr 20 hrAcc I G GTCGAC C 0 0CG GTCGAC CG 0 0CCG GTCGAC CGG 0 0Afl III C ACATGT G 0 0CC ACATGT GG >90 >90CCC ACATGT GGG >90 >90Asc I GGCGCGCC >90 >90A GGCGCGCC T >90 >90TT GGCGCGCC AA >90 >90Ava I C CCCGGG G 50 >90CC CCCGGG GG >90 >90TCC CCCGGG GGA >90 >90BamH I C GGATCC G 10 25CG GGATCC CG >90 >90CGC GGATCC GCG >90 >90Bgl II C AGATCT G 0 0GA AGATCT TC 75 >90GGA AGATCT TCC 25 >90BssH II G GCGCGC C 0 0AG GCGCGC CT 0 0TTG GCGCGC CAA 50 >90BstE II G GGT(A/T)ACC C 0 10BstX I AACTGCAGAA CCAATGCATTGG 0 0 AAAACTGCAG CCAATGCATTGG AA 25 50CTGCAGAA CCAATGCATTGG ATGCAT 25 >90Cla I C ATCGAT G 0 0GATCGAT C 0 0CC ATCGAT GG >90 >90CCC ATCGAT GGG 50 50EcoR I G GAATTC C >90 >90>90 >90CG GAATTC CGCCG GAATTC CGG >90 >90Hae III GG GGCC CC >90 >90AGC GGCC GCT >90 >90TTGC GGCC GCAA >90 >90Hind III C AAGCTT G 0 0CC AAGCTT GG 0 0CCC AAGCTT GGG 10 75Kpn I G GGTACC C 0 0GG GGTACC CC >90 >90CGG GGTACC CCG >90 >90Mlu I G ACGCGT C 0 0CG ACGCGT CG 25 50Nco I C CCATGG G 0 0CATG CCATGG CATG 50 75Nde I C CATATG G 0 0CC CATATG GG 0 0CGC CATATG GCG 0 0GGGTTT CATATG AAACCC 0 0GGAATTC CATATG GAATTCC 75 >90GGGAATTC CATATG GAATTCCC 75 >90Nhe I G GCTAGC C 0 0CG GCTAGC CG 10 25CTA GCTAGC TAG 10 50切割率%酶寡核苷酸序列2 hr 20 hrNot I TT GCGGCCGC AA 0 0ATTT GCGGCCGC TTTA 10 10AAATAT GCGGCCGC TATAAA 10 10 ATAAGAAT GCGGCCGC TAAACTAT 25 90 AAGGAAAAAA GCGGCCGC AAAAGGAAAA 25 >90Nsi I TGC ATGCAT GCA 10 >90 CCA ATGCAT TGGTTCTGCAGTT >90 >90Pac I TTAATTAA 0 0G TTAATTAA C 0 25CC TTAATTAA GG 0 >90Pme I GTTTAAAC 0 0G GTTTAAAC C 0 25GG GTTTAAAC CC 0 50AGCTTT GTTTAAAC GGCGCGCCGG 75 >90Pst I G CTGCAG C 0 0TGCA CTGCAG TGCA 10 10 AA CTGCAG AACCAATGCATTGG >90 >90AAAA CTGCAG CCAATGCATTGGAA >90 >90CTGCAG AACCAATGCATTGGATGCAT 0 0Pvu I C CGATCG G 0 0AT CGATCG AT 10 25TCG CGATCG CGA 0 10 Sac I C GAGCTC G 10 10Sac II GCCGCGG C 0 0TCC CCGCGG GGA 50 >90Sal I GTCGAC GTCAAAAGGCCATAGCGGCCGC 0 0 GC GTCGAC GTCTTGGCCATAGCGGCCGCG 10 50G 10 75ACGC GTCGAC GTCGGCCATAGCGGCCGCGGAASca I GAGTACT C 10 25AAA AGTACT TTT 75 75Sma I CCCGGG 0 10CCCCGGG G 0 10CC CCCGGG GG 10 50TCC CCCGGG GGA >90 >90Spe I GACTAGT C 10 >90GG ACTAGT CC 10 >90CGG ACTAGT CCG 0 50CTAG ACTAGT CTAG 0 50Sph I G GCATGC C 0 0CAT GCATGC ATG 0 25ACAT GCATGC ATGT 10 50Stu I AAGGCCT T >90 >90GA AGGCCT TC >90 >90AAA AGGCCT TTT >90 >90Xba I CTCTAGA G 0 0GC TCTAGA GC >90 >90TGC TCTAGA GCA 75 >90CTAG TCTAGA CTAG 75 >90Xho I C CTCGAG G 0 0CC CTCGAG GG 10 25CCG CTCGAG CGG 10 75Xma I CCCCGGG G 0 0CC CCCGGG GG 25 75CCC CCCGGG GGG 50 >90TCCC CCCGGG GGGA >90 >90。
NEB保护碱基各种酶切位点保护碱基

>90
>90
>90
>90
>90
>90
Xba I Xho I Xma I
CTCTAGAG GCTCTAGAGC TGCTCTAGAGCA CTAGTCTAGACTAG
CCTCGAGG CCCTCGAGGG CCGCTCGAGCGG
CCCCGGGG CCCCCGGGGG CCCCCCGGGGGG TCCCCCCGGGGGGA
>90
>90
>90
0
0
0
25
0
>90
Pme I
GTTTAAAC GGTTTAAACC GGGTTTAAACCC AGCTTTGTTTAAACGGCGCGCCGG
0
0
0
25
0
50
75
>90
Pst I
GCTGCAGC TGCACTGCAGTGCA AACTGCAGAACCAATGCATTGG AAAACTGCAGCCAATGCATTGGAA CTGCAGAACCAATGCATTGGATGCAT
0
0
>90
>90
75
>90
75
>90
0
0
10
25
10
75
0
0
25
75
50
>90
>90
>90
注释:
1.如果要加在序列的 5’端,就在酶切位点识别碱基序列(红色)的 5’端加
上相应的碱基(黑色),相同如果要在 3’端加保护碱基,就在酶切位点识
别碱基序列(红色)的 3’端加上相应的碱基(黑色)。
各种酶切位点的保护碱基引物设计必看)

各种酶切位点的保护碱基酶不同,所需要的酶切位点的保护碱基的数量也不同。
一般情况下,在酶切位点以外多出3个碱基即可满足几乎所有限制酶的酶切要求。
在资料上查不到的,我们一般都随便加3个碱基做保护。
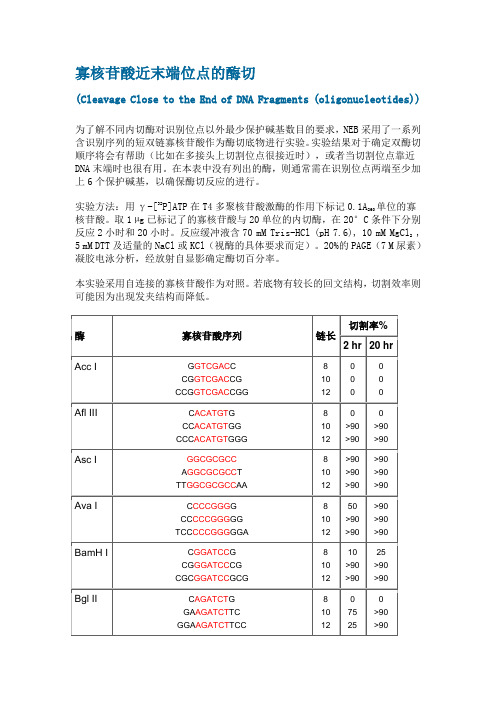
寡核苷酸近末端位点的酶切(Cleavage Close to the End of DNA Fragments(oligonucleotides)为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。
实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。
在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。
实验方法:用γ-[32P]ATP在T4多聚核苷酸激酶的作用下标记0.1A260单位的寡核苷酸。
取1 μg 已标记了的寡核苷酸与20单位的内切酶,在20°C条件下分别反应2小时和20小时。
反应缓冲液含70 mM Tris-HCl (pH 7.6), 10 mM MgCl2 , 5 mM DTT及适量的NaCl或KCl(视酶的具体要求而定)。
20%的PAGE(7 M尿素)凝胶电泳分析,经放射自显影确定酶切百分率。
本实验采用自连接的寡核苷酸作为对照。
若底物有较长的回文结构,切割效率则可能因为出现发夹结构而降低。
2.双酶切的问题参看目录,选择共同的buffer。
其实,双酶切选哪种buffer是实验的结果,takara公司从1979年开始生产限制酶以来,做了大量的基础实验,也积累了很多经验,目录中所推荐的双酶切buffer完全是依据具体实验结果得到的。
有共同buffer的,通常按照常规的酶切体系,在37℃进行同步酶切。
但BamH I在37℃下有时表现出star活性,常用30℃单切。
两个酶切位点相邻或没有共同buffer的,通常单切,即先做一种酶切,乙醇沉淀,再做另一种酶切。
酶切位点所加保护碱基
28
30
32
0
10
10
0
50
75
Sca I
GAGTACTC
AAAAGTACTTTT
8
12
10
75
25
75
Sma I
CCCGGG
CCCCGGGG
CCCCCGGGGG
TCCCCCGGGGGA
6
8
10
12
0
0
10
>90
10
10
50
>90
Spe I
CCGATCGG
ATCGATCGAT
TCGCGATCGCGA
8
10
12
0
10
0
0
25
10
Sac I
CGAGCTCG
8
10
10
Sac II
GCCGCGGC
TCCCCGCGGGGA
8
12
0
50
0
>90
Sal I
GTCGACGTCAAAAGGCCATAGCGGCCGC
GCGTCGACGTCTTGGCCATAGCGGCCGCGG
CCATATGG
CCCATATGGG
CGCCATATGGCG
GGGTTTCATATGAAACCC
GGAATTCCATATGGAATTCC
GGGAATTCCATATGGAATTCCC
8
10
12
18
20
22
0
0
0
0
75
75
0
0
0
0
psha1酶切位点的保护碱基序列

在分子生物学研究中,酶切位点起着至关重要的作用,它们是DNA分子上特定的核苷酸序列,是酶切作用的靶点。
psha1酶切位点是在DNA序列中非常常见的一种酶切位点,因此对于这种酶切位点的保护碱基序列的研究具有重要的意义。
在本文中,我们将探讨psha1酶切位点的保护碱基序列的相关知识,并详细介绍其在分子生物学领域中的应用和意义。
1. psha1酶切位点的特点psha1酶切位点的保护碱基序列是指在进行DNA消化酶切实验时,为了避免psha1酶切位点被psha1酶识别和切割而采取的措施。
psha1酶切位点的特点是其识别特定的6个碱基序列,并在该序列的附近切割DNA链。
在进行相关实验时,为了防止DNA在这种位点被切割,需要对其进行保护。
2. psha1酶切位点的保护方法在实验室中,为了保护psha1酶切位点,常常采取在其周围序列引入methyl化的方法。
通过在psha1酶切位点的附近引入methyl化的碱基,可以有效地避免psha1酶对该位点的切割作用。
这种保护方法在分子生物学的基因工程实验中得到了广泛应用,为研究人员提供了便利。
psha1酶切位点的保护碱基序列不仅在基因工程领域有重要意义,还在DNA技术、分子诊断和分子标记等方面有着广泛的应用。
通过对psha1酶切位点的保护和相关研究,可以更好地理解DNA序列的特点,为相关领域的研究与应用提供更多可能性。
4. 个人观点和总结psha1酶切位点的保护碱基序列是分子生物学研究中不可或缺的重要部分。
通过对其相关知识的学习和实践操作,研究人员可以更好地进行DNA分子的操作和研究,为生命科学的发展做出更大的贡献。
在进行相关实验时,应充分重视psha1酶切位点的保护,以确保实验的准确性和可靠性。
以上是对psha1酶切位点的保护碱基序列的相关介绍和探讨,希望对您有所帮助。
在未来的研究中,我们也将继续深入探讨该领域的相关知识,为分子生物学研究的进步贡献力量。
psha1酶切位点的保护碱基序列在分子生物学研究中扮演着至关重要的角色。
酶切位点保护碱基表

酶切位点保护碱基表:PRC引物保护碱基的设计首先要明确什么是保护碱基限制性内切酶识别特定的DNA序列,除此之外,酶蛋白还要占据识别位点两边的若干个碱基,这些碱基对内切酶稳定的结合到DNA双链并发挥切割DNA作用是有很大影响的,被称为保护碱基。
添加保护碱基的目的在分子克隆实验中,有时我们会在待扩增的目的基因片段两端加上特定的酶切位点,用于后续的酶切和连接反应。
但实验证明,大多数限制酶对裸露的酶切位点不能切断。
必须在酶切位点旁边加上一个至几个保护碱基,才能使所定的限制酶对其识别位点进行有效切断。
因此在设计PCR引物时,为保护5` 端外加的内切酶识别位点,人为地在酶切位点序列的5‘端外侧添加额外的碱基序列,即保护碱基,用来提高酶切时的活性,使酶切完全。
其次,在分子克隆实验中选择载体的酶切位点时,相临的两个酶切位点往往不能同时使用,因为一个位点切割后留下的碱基过少以至于影响旁边的酶切位点切割。
添加保护碱基的原则添加保护碱基,需要考虑两个因素:一是碱基数目,一是碱基种类。
添加保护碱基时,最关心的应该是保护碱基的数目,而不是种类。
什么样的酶切位点,添加几个保护碱基,是有数据可以参考的。
一般情况下,普通的内切酶只加入两个保护碱基,其内切反应就可以正常进行;而有一类,仅仅只加入两个保护碱基,其内切反应就不能正常进行,这是因为内切酶不能正常结合DNA段上。
如NdeI就属这类,需要加入至少6个保护碱基,常用的HindIII也要三个。
添加什么保护碱基,如果严格点,是根据两条引物的Tm值和各引物的碱基分布及GC含量。
如果某条引物Tm值偏小,GC%较低,添加时多加G或C,反之亦反。
为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。
实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。
在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0
CGC CATATG GCG
0
0
GGGTTT CATATG AAACCC
0
0
GGAATTC CAT ATG GAATTCC
75
>90
GGGAATTC CATATG GAATTCCC
75
>90
Nhel
GGCTAGC C
0
0
CG GCTAGC CG
10
25
CTA GCTAGC TAG
10
50
切割率%
CGC GGATCC GCG
>90
>90
Bglll
CAGATCT G
0
0
GAAGATCT TC
75
>90
GGA AGATCT TCC
25
>90
BssHII
GGCGCGC C
0
0
AG GCGCGC CT
0
0
TTG GCGCGC CAA
50
>90
1BstEII
GGGT(A/T)ACC C
0
10
BstXI
10
25
TCG CGATCG CGA
0
10
SacI
CGAGCTC G
10
10
Sacll
GCCGCGG C
0
0
TCC CCGCGG GGA
50
>90
Sall
GTCGAC GTCAAAAGGCCATAGCGGCCGC
0
0
GCGTCGAC GTCTTGGCCATAGCGGCCGCG
10
50
G
10
75
ACGC GTCGAC GTCGGCCATAGCGGCCGCG
GAA
Seal
GAGTACT C
10
25
AAA AGTACT TTT
75
75
Smal
CCCGGG
0
10
CCCCGGG G
0
10
CCCCCGGG GG
10
50
TCC CCCGGG GGA
>90
>90
Sp el
GACTAGT C
10
>90
GG ACTAGT CC
10
>90
CGG ACTAGT CCG
0
50
Hale Waihona Puke 1075KpnlGGGTACC C
0
0
GG GGTACC CC
>90
>90
CGG GGTACC CCG
>90
>90
Mlul
GACGCGT C
0
0
CG ACGCGT CG
25
50
Ncol
CCCATGG G
0
0
CATG CCATGG CATG
50
75
Ndel
CCATATG G
0
0
CC CATATG GG
CTAG ACTAGT CTAG
0
50
Sp hl
GGCATGC C
0
0
CAT GCATGC ATG
0
25
ACAT GCATGC ATGT
10
50
Stul
AAGGCCT T
>90
>90
GA AGGCCT TC
>90
>90
AAA AGGCCT TTT
>90
>90
Xbal
CTCTAGA G
0
0
GC TCTAGA GC
AACTGCAGAA CCAATGCATTGG
0
0
AAAACTGCAG CCAATGCATTGG AA
25
50
CTGCAGAA CCAATGCATTGG ATGCAT
25
>90
Clal
CATCGAT G
0
0
GATCGAT C
0
0
CCATCGAT GG
>90
>90
CCC ATCGAT GGG
50
50
EcoRI
75
>90
PstI
GCTGCAG C
0
0
TGCA CTGCAG TGCA
10
10
AACTGCAG AACCAATGCATTGG
>90
>90
AAAA CTGCAG CCAATGCATTGGAA
>90
>90
CTGCAG AACCAATGCATTGGATGCAT
0
0
P vul
CCGATCG G
0
0
ATCGATCG AT
>90
>90
TGC TCTAGA GCA
75
>90
CTAG TCTAGA CTAG
75
>90
Xhol
CCTCGAG G
0
0
CC CTCGAG GG
10
25
CCG CTCGAG CGG
10
75
Xmal
CCCCGGG G
0
0
CCCCCGGG GG
25
75
CCC CCCGGG GGG
50
>90
TCCC CCCGGG GGGA
不同内切酶对识别位点以外最少保护碱基数目的要求
不同内切酶对识别位点以外最少保护碱基数目的要求
酶
切割率%
寡核甘酸序列
2hr
20hr
AccI
GGTCGAC C
0
0
CG GTCGAC CG
0
0
CCG GTCGAC CGG
0
0
Afllll
CACATGT G
0
0
CCACATGT GG
>90
>90
CCC ACATGT GGG
酶
寡核甘酸序列
2hr
20hr
Notl
TTGCGGCCGC AA
0
0
ATTTGCGGCCGC TTTA
10
10
AAATAT GCGGCCGC TATAAA
10
10
ATAAGAAT GCGGCCGC TAAACTAT
25
90
AAGGAAAAAA GCGGCCGC AAAAGGAAAA
25
>90
Nsil
TGC ATGCAT GCA
GGAATTC C
>90
>90
CG GAATTC CG
>90
>90
CCG GAATTC CGG
>90
>90
Haelll
GG GGCC CC
>90
>90
AGC GGCC GCT
>90
>90
TTGC GGCC GCAA
>90
>90
Hi ndlll
CAAGCTT G
0
0
CCAAGCTT GG
0
0
CCC AAGCTT GGG
>90
>90
10
>90
CCA ATGCAT TGGTTCTGCAGTT
>90
>90
P acl
TTAATTAA
0
0
GTTAATTAA C
0
25
CC TTAATTAA GG
0
>90
Pmel
GTTTAAAC
0
0
GGTTTAAAC C
0
25
GGGTTTAAAC CC
0
50
AGCTTT GTTTAAAC GGCGCGCCGG
>90
>90
AscI
GGCGCGCC
>90
>90
AGGCGCGCC T
>90
>90
TT GGCGCGCC AA
>90
>90
Aval
CCCCGGG G
50
>90
CCCCCGGG GG
>90
>90
TCC CCCGGG GGA
>90
>90
BamHI
CGGATCC G
10
25
CG GGATCC CG
>90
>90
