高一化学必修一物质的量
高中化学必修一1.2物质的量-知识点
小初高个性化辅导,助你提升学习力! 1 高中化学必修一1.2物质的量-知识点
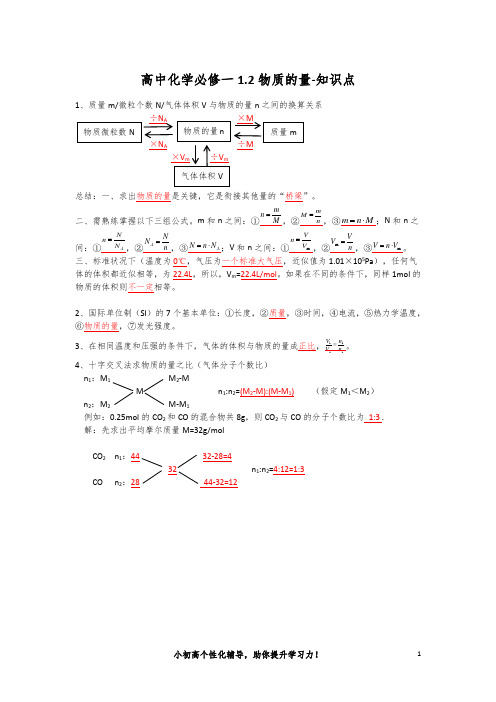
1、质量m/微粒个数N/气体体积V 与物质的量n 之间的换算关系
×N A ÷M
总结:一、求出物质的量是关键,它是衔接其他量的“桥梁”。
二、需熟练掌握以下三组公式。
m 和n 之间:①
M m n =,②n m M =,③M n m ⋅=;N 和n 之间:①A N N n =,②n N N A =,③A N n N ⋅=;V 和n 之间:①m V V n =,②n V V =m ,③m V n V ⋅=。
三、标准状况下(温度为0℃,气压为一个标准大气压,近似值为1.01×105Pa ),任何气体的体积都近似相等,为22.4L ,所以,V m =22.4L/mol 。
如果在不同的条件下,同样1mol 的物质的体积则不一定相等。
2、国际单位制(SI )的7个基本单位:①长度,②质量,③时间,④电流,⑤热力学温度,⑥物质的量,⑦发光强度。
3、在相同温度和压强的条件下,气体的体积与物质的量成正比,21
21n n V V =。
4、十字交叉法求物质的量之比(气体分子个数比)
n 1:M 1 M 2-M
M n 1:n 2=(M 2-M):(M-M 1) (假定M 1<M 2)
n 2:M 2 M-M 1
例如:0.25mol 的CO 2和CO 的混合物共8g ,则CO 2与CO 的分子个数比为 1:3 .
解:先求出平均摩尔质量M=32g/mol
CO 2 n 1 32-28=4
n 1:n 2=4:12=1:3
CO n 2:28 44-32=12。
(完整word版)高中化学必修一物质的量

高中化学物质的量难点解析一、物质的量(n)1.定义: 它是一个描述宏观物质中所含有的微粒数目的多少的一个物理量。
2、单位:摩尔, 简称摩, 符号是mol。
3、阿伏伽德罗常数(NA): 0.012kg 12C所含的碳原子数目叫做阿伏伽德罗常数。
1mol任何微粒所含的微粒数均为N A个。
N A =6.02×1023 mol-14.公式: n = N :微粒数。
二、摩尔质量(M)1.定义: 单位物质的量的物质所具有的质量叫做摩尔质量。
1mol的任何物质的质量, 以g为单位时, 它在数值上等于该物质的相对原子质量或相对分子质量。
2.单位: g· mol-1(g/mol)或kg· mol-1(kg/mol)。
3、公式: n =三、摩尔体积(V m)1.定义: 一定温度和压强下, 单位物质的量的气体所占的体积叫做气体的摩尔体积。
2.单位: L· mol-1(L/mol)或m3· mol-1(m3/mol)3、标准状况下, 气体摩尔体积约为22.4 L· mol-1。
标准状况:指温度为0℃、压强为101kPa的状况, 简称STP。
4、公式: n =5.书写规律:①在相同条件下, 1mol气体所占的体积比1mol固体或液体所占的体积大得多。
②在相同条件下, 1mol固体或液体的体积不同, 而1mol气体的体积却几乎完全相同。
③在相同条件下, 决定物质的体积的微观因素:气体体积大小 1.粒子数目固、液体体积大小的主要因素 2.粒子(半径)大小的主要因素3.粒子间的平均距离阿伏伽德罗定律:在同温同压下, 相同体积的任何气体都含有相同数目的分子。
p V=n RT四、物质的量浓度(c B)1.定义: 单位体积溶液中所含溶质的物质的量。
2.单位: mol· L-1(mol/L)或mol· m-3(mol/m-3)。
3.公式: n B=c B×V4.一定物质的量浓度溶液的配置:(1)主要仪器: 容量瓶、烧杯、胶头滴管、玻璃棒、托盘天平(砝码)、药匙、量筒。
人教版高一化学必修一第一章知识点:化学计量在实验中的应用

人教版高一化学必修一第一章知识点:化学计量在实验中的应用一、物质的量1、物质的量①含义:物质的量是表示构成物质的微观粒子多少的物理量。
它表示含有一定数目粒子的集合体。
②符号:n③单位:摩尔(mol)说明① “物质的量”是不可拆分的,也不能增减字,绝对不能读作“物质量”②物质的量是以微观粒子为计量的对象,而这里的“粒子”是指构成物质的“基本单元”、这个基本单元可以是分子、原子、离子、中子、质子等单一粒子,也可以是这些粒子的特定组合。
使用范围:微观粒子(包括原子、分子、离子、原子团、电子、质子、中子及它们的特定组合)。
假如用来衡量宏观物体,则很不合适,就失去意义。
③由于微观粒子(包括原子、分子、离子、原子团、电子、质子、中子及它们的特定组合),所以在描述物质的物质的量时一定要指明是那种粒子。
例如,我们可以说“1摩尔氧气分子”,也可以说“1摩尔氧原子”,两者的含义截然不同。
但是,绝不能说“1摩尔氧”,让人无法知道粒子是氧气分子还是氧原子。
④物质的量就是一个特定的单位,物质的量实际上表示含有一定数目粒子的集体。
不能当做衡量物质数量或质量的物理量。
2、摩尔摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒。
摩尔简称“摩”,符号为“mol”。
3、阿伏加德罗常数科学规定:1摩尔物质中的微粒数目与0.012kg (12g)12C中所含的碳原子相同,约为6.02×1023个。
为了纪念伟大的科学家阿伏加德罗,将这个常数称为阿伏加德罗常数。
这个粒子的集合体作为计量单位,它就是“摩尔”。
4、物质的量和微粒个数的关系:物质的量、微粒个数和阿伏加德罗常数三者之间的关系为:n=N / NA (N为粒子数)推论:①物质的物质的量相同,粒子数就相同。
②物质的物质的量之比,等于粒子数之比。
最后,希望精品小编整理的人教版高一化学必修一第一章知识点对您有所帮助,祝同学们学习进步。
苏教版高一化学丰富多彩的化学物质知识点(上册)苏教版高一化学人类对原子结构的认识知识点(上册)。
物质的量高中化学必修一

物质的量高中化学必修一1. 物质的量是什么?说到物质的量,大家可能会觉得这名字听起来有点高大上,但其实它跟我们的日常生活是紧密相连的。
你知道吗?物质的量就像是一个大大的“数量词”,用来描述我们在化学反应中各种物质的“量”。
想象一下,咱们在厨房里做菜,盐、糖、油的量要把握得恰到好处,不然做出来的菜可就要大打折扣。
这就和化学反应中的物质的量一样,得精确才能让反应顺利进行。
1.1 物质的量的单位在化学世界里,物质的量的单位是摩尔(mol),听起来是不是有点拗口?别担心,这个词一旦学会,就像喝水一样简单。
一个摩尔的物质,简单来说,就是包含了阿伏伽德罗常数(大约 (6.02 times 10^{23))个微小粒子,哇,真是个庞大的数字啊!想象一下,如果我们有一摩尔的巧克力豆,那简直可以开一个巧克力豆派对,让所有的小伙伴都来共享美味,哈哈!1.2 物质的量与质量的关系接下来,让我们聊聊物质的量和质量的关系。
大家肯定听过“量”和“重”这两个词,没错,物质的量可以通过质量来计算!我们常用的公式是:物质的量(mol)= 质量(g)/ 摩尔质量(g/mol)。
这就像是你买东西时要看价格,知道一公斤苹果多少钱,才能算出你能买多少个。
其实,化学也是一种购物,买的是各种各样的分子和原子,得算清楚才能不会“超支”哦!2. 为什么物质的量这么重要?物质的量在化学反应中起着至关重要的作用。
想象一下,如果你在做化学实验,量错了材料,搞不好就会发生“爆炸”哦,不是真的爆炸,但反应不会如你所愿。
就像是你做蛋糕的时候,面粉少了,蛋糕肯定发不起来,结果只能做成“平底锅蛋糕”,真是哭笑不得。
2.1 化学反应中的“定量”在化学反应中,我们讲究的是“定量”,也就是说,要精确到位,才能实现“物尽其用”。
如果一个反应需要2摩尔的A和3摩尔的B,但你只放了1摩尔的A,那这个反应就可能不完全,剩下的B就像被放在角落里的“孤独者”,干等着没用。
所以说,学会如何计算物质的量,真的是化学学习的“敲门砖”。
高一必修一化学知识点笔记

高一必修一化学知识点笔记一、物质的量与摩尔质量1.物质的量(化学单位:摩尔)- 定义:物质的量是物质的基本属性之一,用单位摩尔(mol)表示,记作n。
- 摩尔质量:每摩尔物质的质量,单位为g/mol。
- 摩尔质量的计算:将化学式中各元素的相对原子质量相加即可。
- 摩尔质量与质量的关系:n = m/M,其中m为物质的质量,M为物质的摩尔质量。
二、化学式与化合价1.化学公式- 定义:化学公式是用化学符号表示化合物中各种元素的种类和绝对数目的式子。
- 化合物的种类:- 二元化合物:由两种不同元素组成。
- 多元化合物:由两种以上的元素组成。
- 离子化合物:由阳离子(金属元素)和阴离子(非金属元素)组成。
- 分子化合物:由非金属元素组成。
2.化合价- 定义:元素的化合价是元素在化合物中的原子价值。
- 化合价的确定:- 金属元素的化合价通常为元素的电子数目。
- 非金属元素的化合价根据化合物的电荷平衡及最低共价数原则确定。
三、化学方程式与化学反应1.化学方程式- 定义:用化学符号表示化学反应的式子。
- 反应物与生成物:反应物位于方程式的左侧,生成物位于方程式的右侧。
- 反应条件:一些特殊条件下的反应条件可以用符号在方程式的上方标记。
- 平衡符号:用“→”表示反应方向,用“↑”、“↓”表示气体、液体的状态。
2.化学反应类型- 酸碱中和反应:酸与碱反应生成盐和水。
- 氧化还原反应:涉及电子的转移,发生氧化和还原过程。
- 沉淀反应:两种溶液混合后生成沉淀。
- 双替换反应:两种溶液交换离子形成新的化合物。
四、化学键与物质属性1.化学键- 定义:原子与原子之间通过共用或转让电子而形成的化学连接。
- 电负性:元素吸引电子的能力。
- 离子键:电子转移形成的化学键。
- 共价键:电子共享形成的化学键。
2.物质属性- 化学性质:物质在化学变化中表现出来的性质。
- 物理性质:物质在物理变化中表现出来的性质。
- 结构性质:物质在分子或晶体结构中的特征性质。
高一化学必修一物质的量知识点总结

高一化学必修一物质的量知识点总结高一化学必修一物质的量知识点总结高一的学生在学习必修一的化学课本时,会碰见很多理论性的知识概念,你知道物质的量是什么吗?关于物质的量这个内容我们需要掌握哪些知识点呢?下面是店铺为大家整理的高一化学必修一知识点,希望对大家有用!高一化学必修一物质的量知识点总结1一、物质的量的单位——摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量 ( n = m/M )二、气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol三、物质的量在化学实验中的应用1.物质的量浓度.(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V2.一定物质的量浓度的配制(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.(2)主要操作a.检验是否漏水.b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.(3)注意事项A 选用与欲配制溶液体积相同的容量瓶.B 使用前必须检查是否漏水.C 不能在容量瓶内直接溶解.D 溶解完的溶液等冷却至室温时再转移.E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)高一化学必修一物质的量知识点总结2胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
高一化学必修一物质的量笔记

高一化学必修一物质的量笔记
高一化学必修一物质的量笔记
物质的量是高一化学必修一中的重要概念、重要内容,物质量的计算主要针对物质的质量和物质的体积,是测定物质的数量的重要方法。
从物质的体积计算物质量,可以根據比表計算密度來計算物质量,它是物质在某種溫度、壓力及特定液體中每立方厘米的質量。
通過量測物质体積及計算密度就可以求出物質質量,即D= m/V。
也可以用質量定律m=M×V,其中M為物質的摩爾質量而V為体積。
另一種量度物质的方法是以質量為基礎,即針對質量進行測量。
質量量測的類型有衡量天平、電子秤等多種,只要得到物質的質量,求出質量後再除以体積,即可得到物質的摩爾質量,即M= m/V,除以時間后可得到該物質的摩爾質量流速,即n=m/V×t。
物質的量是一個重要的概念,物質的量可以將質量、体積、濃度等參數結合起來計算出來。
它的量的幾種計算方式也是高一化学必修一所研究的重要內容,對于學生來說,弄清楚這些概念有助于以后的學習。
化学高一年级必修一知识点

化学高一年级必修一知识点1.化学高一年级必修一知识点篇一物质的量的单位摩尔1、物质的量(n)是表示含有一定数目粒子的集体的物理量。
2、摩尔(mol):把含有6、02×1023个粒子的任何粒子集体计量为1摩尔。
3、阿伏加德罗常数:把6、02X1023mol—1叫作阿伏加德罗常数。
4、物质的量=物质所含微粒数目/阿伏加德罗常数n=N/NA5、摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量。
(2)单位:g/mol或g、、mol—1(3)数值:等于该粒子的相对原子质量或相对分子质量。
6、物质的量=物质的质量/摩尔质量(n=m/M)2.化学高一年级必修一知识点篇二物质的分类1、常见的物质分类法是树状分类法和交叉分类法。
2、混合物按分散系大小分为溶液、胶体和浊液三种,中间大小分散质直径大小为1nm—100nm之间,这种分散系处于介稳状态,胶粒带电荷是该分散系较稳定的主要原因。
3、浊液用静置观察法先鉴别出来,溶液和胶体用丁达尔现象鉴别。
当光束通过胶体时,垂直方向可以看到一条光亮的通路,这是由于胶体粒子对光线散射形成的。
4、胶体粒子能通过滤纸,不能通过半透膜,所以用半透膜可以分离提纯出胶体,这种方法叫做渗析。
5、在25ml沸水中滴加5—6滴FeCl3饱和溶液,煮沸至红褐色,即制得Fe(OH)3胶体溶液。
该胶体粒子带正电荷,在电场力作用下向阴极移动,从而该极颜色变深,另一极颜色变浅,这种现象叫做电泳。
3.化学高一年级必修一知识点篇三氧化还原反应(1)氧化还原反应的本质和特征氧化还原反应是有电子转移(电子得失或共用电子对偏移)的化学反应,它的基本特征是反应前后某些元素的化合价发生变化。
(2)氧化剂和还原剂反应中,得到电子(或电子对偏向),所含元素化合价降低的反应物是氧化剂;失去电子(或电子对偏离),所含元素化合价升高的反应物是还原剂。
在氧化还原反应中,氧化剂发生还原反应,生成还原产物;还原剂发生氧化反应,生成氧化产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单位名称 米 千克 秒 安培
开尔文
摩尔
坎德拉
单位符号 m kg s A K
mol
cad
一、物质的量及其单位——摩尔 1.物质的量
①是国际单位制七个基本物理量之一,符号为n 。
②是表示含有一定数目微观粒子的集合体。
③单位:摩尔
分子、原子、离子、电 子、质子、中子或这些 粒子的特定组合。
简称:摩 符号:mol
物质的量(n) 2mol 1mol
2mol
微观(粒子 数N)
2个 1个
2个
物质的量关系:2mol炭和1mol氧气完全反应可以生成2mol一氧化碳
巩固提高
1.1molCO2分子中有 1 molC, 2 molO,共有 3 mol 原子.
2. 0.3 mol H2SO4含有1.806×1023个硫酸分子,1.2 molO, 0.3 molS 0.6 molH
摩尔是物质的量的单位 。 2、摩尔是物质的质量单位 3、摩尔是物质的数量单位
摩尔是物质的量的单位
概念辨析
1、1mol氯含有6.02×1023个微粒 2、阿伏加德罗常数数值约等于6.02×1023 3、钠的摩尔质量等于它的相对原子质量 4、H2O的摩尔质量是18g •5、1molC的质量是C的摩尔质量 •6、摩尔质量的单位必须是“ g/mol” •7、CO2的摩尔质量是44 •8、1molH2SO4的质量是98g/mol
48g
。
1molH2O的摩尔质量为 18g·mol-1 ,2molH2O的 摩尔质量为 18g·mol。-1 1molO含有 6.02 ×1023 个 O,
质量为 16g ,O原子的摩尔质量为 16g·mol-1。
【例题】 求0.3molH2O的质量?其中所含O原子个数?
m(H2O)= n(H2O)× M(H2O) = 0.3mol × 18g·mol-1 = 5.4g
(2)1.806×1024个水分子的物质的量为3mol, 则阿伏加德罗常数NA为多少?
1个水分子中有2个氢原子和1个氧原子,有如
下关系:
H2O——2H—— O
12
1
即H2O——2H——O 1mol 2mol 1mol
NA 2NA NA
分子中原子的物质的量之比==分子中原子个数之比
点燃
2C+O2====2CO
(1)1mol氧
错误。没有指明微粒的种类。改成1molO,1molO2都是 正确的。因此使用摩尔作单位时,所指微粒必须十分明确, 且微粒的种类一般用化学符号表示。
(2)2molCO2 正确。
(3)1mol小麦 不能,因为物质的量及其单位的使用对象只能是微 观粒子,不能用来描述宏观物质.
国际规定
1mol任何微粒所含的微粒数与0.012kg12C 中所含的碳原子数相同
三、物质的量与微粒个数的关系
N=n·NA
温固而知新
一、物质的量
定义:表示一定数目微观粒子的集体 符号:n 单位:摩尔,简称:摩(mol)
1.定义值:0.012kg 12C 所含的C原子数
二、阿常数: 2.近似值:约为6.02×1023
3.单位:mol-1
4.含义:1mol 任何粒子所含的粒子数均为阿
伏加德罗常数(NA)个,约为6.02×1023
CO2: 44 g·mol-1 C: 12 g·mol-1 S: 32 g·mol-1 O2 32 g·mol-1 Cl2 71 g·mol-1
44 相对分子质量 12 相对原子质量 32 相对原子质量 32 相对分子质量 71 相对分子质量
(1)1mol任何原子的质量(以克为单位)在数值 上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数 值上等于这种分子的相对分子质量。
结论
1mol任何微粒的质量以克为单位时,在数值上等于 该微粒的相对原子质量或相对分子质量。
3、摩尔质量
(1)定义:单位物质的量的物质所具有的质量。 (2)单位:g/mol
m
(3)公式: M= n
(4)数值:等于相对原子(分子)质量。
教 学 重 点:物质的量及其单位
教4×1024 )氢原子
氧原子( 6.02×1023)微粒数
6.02×1023个水分子
物质的量(2mol)H
1molH2O
O(1mol)物质的量
课前放松两分钟: 下列叙述是否正确
1、摩尔是七个基本物理量之一 物质的量是七个基本物理量之一 ,
摩尔质量只与物质的种类有关,与物质的物质 的量、质量无关.
概念辨析
1molO2的质量是 ,O2 的相对分子
质量为
,O2的摩尔质量为
。
【小试牛刀 】
1molCa2+的质量为 40g
,Ca2+的摩尔
质量为 40g·mol-1。Na2O2的摩尔质量为 78g·mol-。1
0.5molSO42-的质量为
N(O) = n(O)× NA = 0.3mol × 6.02 ×1023mol-1 = 1.806 ×1023
公式套用
求28gFe的物质的量?Fe原子的个数?
n(Fe) =
m(Fe) = 28g
= 0.5 mol
M(Fe)
56g·mol-1
N(Fe) = n(Fe) × NA
=
28g NA
56g/mol
1、生活中,大米为什么通常用千克作
思 为单位,而不用米粒来计量? 考 2、化学中描述 C + O2 = CO2
宏观上 12克 32克 44克
质量可以通过天平称量,当我们在分子原子 水平上研究时,12gC中有多少个碳原子你又 将如何知道呢?
约17万亿亿个!
“一滴水中有多少个分子啊?”
宏观物质 质量
3.1mol CO2与
molO2所含原子数相等。
微粒个数
归纳整合
n=
N NA
物质的量
阿伏加德罗常数
1mol任何物质都约含有6.02X1023 个粒子,那么这1mol物质的质量到底 有多大?
以水为例:
CO2: C: S: O2 Cl2
44 g·mol-1 12 g·mol-1 32 g·mol-1 32 g·mol-1 71 g·mol-1
=0.5NA
问: 53gNa2CO3中含有Na+和CO32的物质的量的是多少?
n (Na2CO3) =
m (Na2CO3) M(Na2CO3)
n (Na+)= 2 n (Na2CO3) n (CO32-)= 1 n (Na2CO3)
N,n,m之间的相互转化
N ÷NA n ×M m
×NA
÷M
联系微观和宏观物质的桥梁
已知:一个碳原子的质量为 1.993 × 10-23g
求: 0.012kg 碳-12 中所含的碳原数?
解:
0.012kg
碳原子数 =
≈ 6.02×1023
1.993 × 10-26kg
2.阿伏加徳罗常数
① 符号:NA
② NA 近似等于6.02 ×1023mol-1
例如:
1摩尔O含有6.02×1023个O
摩尔质量 单位物质的量的物质所具有的质量。
作业: 练习册----第10-11页
教 学 目 标:
(一)知识目标 1、使学生了解物质的量及其单位——摩尔,了解物质的量与微 观粒子之间的关系。 2、使学生了解物质的量、阿伏加德罗常数、微粒个数之间的关 系。 (二)能力目标 初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识 进行计算能力。 (三)情感目标 通过对概念的透彻理解,培养学生严谨、认真的学习态度,使 学生掌握科学的学习方法。
? 微观粒子 个数
1971年,在第十四届国际计量大会上决定用长
资 料
度、质量、时间、电流、热力学温度、物质的量和 发光强度作为基本物理量,其他物理量则按其定义
由基本物理量导出。
国际单位制(SI)的7个基本单位:
物理量 长度(l) 质量(m) 时间(t) 电流(I)
热力学温度(T)
物质的量(n)
发光强度(Iv)
是(
)
√A、98g
√ B、49g C、1mol D、0.5mol
通过本节课的学习,你能计算 出18g水中含有多少个水分子 了吧!
物质的量 表示含有一定数目粒子集合体的物理量
摩尔 物质的量的单位,符号为mol
阿伏加德罗 常数
0.012 千克12c 所含的碳原子数. 6.02 × 1023mol-1
①“物质的量”是一个统一、不可分割的整体, 这四个字缺一不可,不能把它理解为“物质的 质量”或“物质的数量”
②摩尔作为物质的量的单位,这一单位只适用于 微观粒子,不适用于宏观物质。
③使用摩尔作为单位表示物质的量时,必须指明 微粒的种类,如原子、分子、离子等为:
1mol Na+
学以致用
判断下列说法是否正确,并说明理由。
Nm n
NA M
练习题:
1.下列说法是否正确: A、 6.02 ×1023个12C原子的质量为1g B、 H的摩尔质量为1g C、 H2SO4的摩尔质量等于6.02 ×1023个
H2SO4 分子的质量
√D、 NaOH的摩尔质量为40g·mol-1
练习题
与98gH3PO4所含有的O原子数目相等的H2SO4
1摩尔H2O含有6.02×1023个H2O 1摩尔含Cl-有6.02×1023个Cl-
③单位: mol-1 (每摩尔)
④物质的量(n)、阿伏加德罗常数( NA )、
n= N 微粒数(N)之间的关系式 NA
例题
9.03×1023个氧分子的物质的量是多少?
小试牛刀
(1)0.5mol铁原子的个数是多少?
