常用缓冲溶液配制
常用缓冲溶液的配制
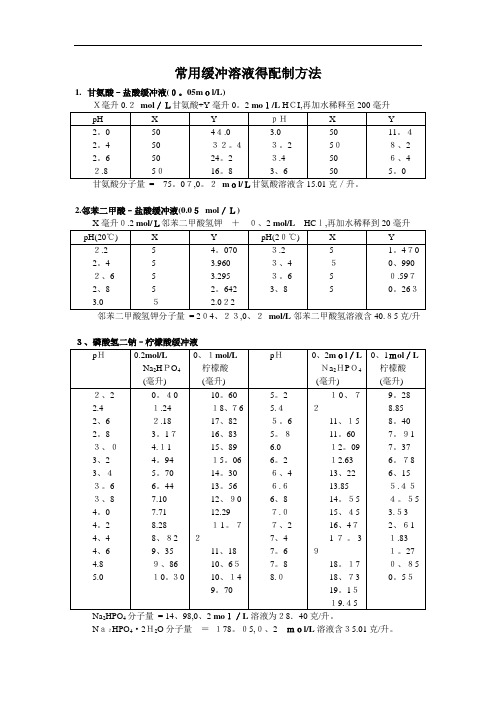
常用缓冲溶液得配制方法1.甘氨酸–盐酸缓冲液(0。
05mol/L)X毫升0.2mol/L甘氨酸+Y毫升0。
2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05mol/L)邻苯二甲酸氢钾分子量= 204、23,0、2mol/L邻苯二甲酸氢溶液含40.85克/升3、磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14、98,0、2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量=178。
05,0、2mol/L溶液含35.01克/升。
C4H 2O 7·H 2O 分子量 = 210。
14,0。
1 m ol/L 溶液为21.01克/升。
① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存、5.柠檬酸–柠檬酸钠缓冲液(0.1 mo l/L)柠檬酸C 6H 8O7·H 2O:分子量210。
14,0.1 mol /L溶液为21.01克/升。
柠檬酸钠Na 3 C 6H5O 7·2H2O:分子量294、12,0.1 mol/L 溶液为29。
41克/毫升、Na2Ac·3H2O分子量= 136、09,0、2 mol/L溶液为27.22克/升。
7、磷酸盐缓冲液242Na2HPO4·12H2O分子量= 358。
22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量=156。
03,0.2mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量= 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升、8.磷酸二氢钾–氢氧化钠缓冲液(0。
05M)X毫升0.2MK2PO10.Tris–盐酸缓冲液(0.05M,25℃)50毫升0。
1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100毫三羟甲基氨基甲烷(Tris)HOCH2CH2OHCHOCH2NH2分子量=121、14;0.1M溶液为12.114克/升、Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
常用缓冲溶液配制方法

常用缓冲溶液配制方法一、酸碱配制法:该方法通过酸和碱两种溶液的混合反应来控制溶液的pH值。
常用的酸碱配制法有以下几种:1.酸和碱的摩尔比例法:前提是需要知道所配制溶液的酸碱消耗量。
首先分别测量酸和碱的摩尔消耗量,然后按照摩尔比例混合酸和碱的溶液。
例如,如果酸的摩尔消耗量为1mol,碱的摩尔消耗量为1.5mol,则将1mol酸和1.5mol碱混合配制成缓冲溶液。
2.浓度法:通过将已知浓度的酸和碱溶液混合配制成缓冲溶液。
首先确定所需缓冲溶液的pH值和酸碱消耗量,然后调整酸和碱溶液的浓度,最后按照一定的体积比例混合两种溶液。
二、配制法控制pH值:该方法根据所需缓冲溶液的pH值,通过使用酸和碱的不同混合配比来控制溶液的pH值。
常用的方法有以下几种:1.酸碱体积法:根据Henderson-Hasselbalch方程,通过将酸和碱的体积按照一定比例混合配制成缓冲溶液。
对于酸性缓冲溶液,通常用酸体积除以碱体积;对于碱性缓冲溶液,通常用碱体积除以酸体积。
2.四倍溶液法:如果需要配制缓冲溶液的pH值为pHx,可以制备pH(x-1)和pH(x+1)的四倍浓度溶液,在适当比例下混合这两种溶液,可以得到所需pH值的缓冲溶液。
三、缓冲剂配制法:缓冲剂是一种特殊的溶液,能够在酸和碱之间进行迅速的反应,稳定溶液的pH值。
常见的缓冲剂有磷酸盐缓冲剂、醋酸缓冲剂、碳酸氢盐缓冲剂等。
1.磷酸盐缓冲剂的配制方法:磷酸盐缓冲剂的配制,通常选择以二氢磷酸盐(H2PO4-)和氢磷酸盐(HPO42-)为主要组分。
根据所需pH值和缓冲溶液的酸碱消耗量,可以计算出所需H2PO4-/HPO42-的比例,然后按照一定的体积和浓度配制出满足比例的溶液。
2.醋酸缓冲剂的配制方法:醋酸缓冲剂的配制通常选择乙酸(CH3COOH)和乙酸钠(CH3COONa)为主要组分。
根据所需缓冲溶液的pH值和酸碱消耗量,可以计算出所需CH3COOH/CH3COONa的比例,然后按照一定的体积和浓度配制出满足比例的溶液。
常用缓冲溶液的配制方法
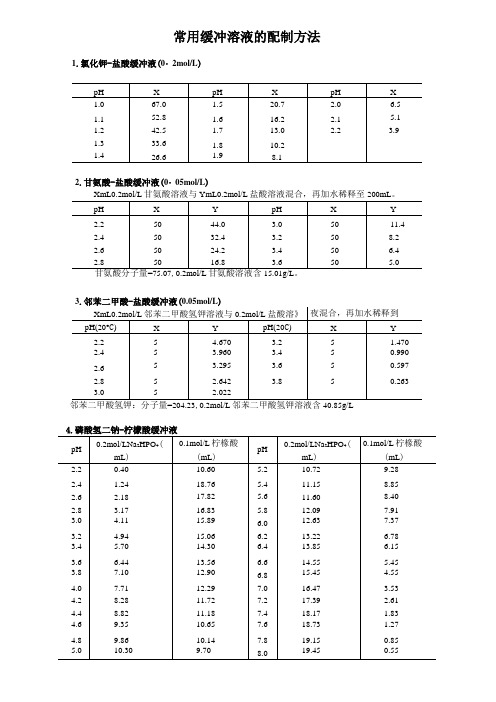
常用缓冲溶液的配制方法1.氯化钾-盐酸缓冲液(0・2mol/L)邻苯二甲酸氢钾:分子量=204.23,0.2mol/L邻苯二甲酸氢钾溶液含40.85g/L 4.磷酸氢二钠-柠檬酸缓冲液pH 0.2mol/LNa2HPO4(mL)0.1mol/L柠椽酸(mL)pH0.2mol/LNa2HPO4(mL)0.1mol/L柠椽酸(mL)2.2 0.40 10.60 5.2 10.72 9.28 2.4 1.24 18.76 5.4 11.15 8.85 2.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.78 3.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.53 4.2 8.28 11.72 7.2 17.39 2.61 4.4 8.82 11.18 7.4 18.17 1.83 4.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.85Na2HPO4分子量=141.98,0.2mol/L溶液为28.40g/L。
Na2HPO4・2H2O分子量=178.05,0.2mol/L溶液含35.61g/L。
C6H8O7•H2O分子量=210.14,0.1mol/L溶液为21.01g/L。
5.使用时可以向每升混合液中加入1g酚,若最后p H值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
6•柠檬酸-柠檬酸钠缓冲液(0・1mol/L)柠檬酸C6H8O7・H2O:分子量210.14,0.1mol/L溶液为21.01g/L。
常见缓冲液配制大全

常见缓冲液配制大全缓冲液乙醇-醋酸铵缓冲液(pH3.7) 取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml,即得。
三羟甲基氨基甲烷缓冲液(pH8.0) 取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0,即得。
三羟甲基氨基甲烷缓冲液(pH8.1) 取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml,即得。
三羟甲基氨基甲烷缓冲液(pH9.0) 取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g、氯化钠5.8g、乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0,即得。
乌洛托品缓冲液 取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml,即得。
巴比妥缓冲液(pH7.4) 取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过,即得。
巴比妥缓冲液(pH8.6) 取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml,即得。
巴比妥-氯化钠缓冲液(pH7.8) 取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
然后用0.2mol/L 盐酸溶液调节pH值至7.8,再用水稀释至500ml,即得。
甲酸钠缓冲液(pH3.3) 取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L 氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30,即得。
邻苯二甲酸盐缓冲液(pH5.6) 取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀,即得。
常见缓冲溶液配制方法

常见缓冲溶液配制方法1.醋酸钠/醋酸酸性缓冲液醋酸钠/醋酸酸性缓冲液适用于pH范围为4.0-6.0的实验。
配制方法如下:- 准备质量浓度为0.1mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液。
-根据所需pH值,按照相应的比例混合醋酸钠溶液和醋酸溶液即可。
2.磷酸/盐酸性缓冲液磷酸/盐酸性缓冲液适用于pH范围为1.0-3.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L和0.1mol/L的磷酸溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和磷酸溶液即可。
3.磷酸/氢磷酸二盐酸性缓冲液磷酸/氢磷酸二盐酸性缓冲液适用于pH范围为2.0-7.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L、0.1mol/L和0.05mol/L的氢磷酸二盐溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和氢磷酸二盐溶液即可。
4.磷酸盐缓冲液磷酸盐缓冲液适用于pH范围为5.0-8.0的实验。
配制方法如下:- 准备分别为0.2mol/L的梯度磷酸盐溶液。
-根据所需pH值,按照相应的比例混合相应浓度的磷酸盐溶液即可。
5.三氯乙酸/三氯乙酸钠酸性缓冲液三氯乙酸/三氯乙酸钠酸性缓冲液适用于pH范围为3.0-4.6的实验。
配制方法如下:- 准备质量浓度为0.2mol/L的三氯乙酸钠溶液和0.2mol/L的三氯乙酸溶液。
-根据所需pH值,按照相应的比例混合三氯乙酸钠溶液和三氯乙酸溶液即可。
以上是一些常见的缓冲溶液配制方法,具体的配制过程可能会因实验需求和具体试剂而略有不同。
在配制缓冲溶液时,一定要注意使用高纯度的试剂,并按照配制方法进行准确的实验操作。
常见缓冲溶液配制方法

常见缓冲溶液配制方法缓冲溶液是一种能够维持溶液酸碱性质相对稳定的溶液。
常见的缓冲溶液配制方法主要包括四种:酸碱对配制、酸碱配制、水解配制和氧化还原配制。
下面将详细介绍这四种配制方法以及常用的缓冲体系。
一、酸碱对配制酸碱对配制是以两种酸碱的共存为基础实现的。
常用的酸碱对包括:醋酸与醋酸钠对、琼脂酸与琼脂酸钠对、乙酸与乙酸-乙酸钠对等。
以醋酸和醋酸钠为例:1.根据所需的pH值,计算所需的酸碱物质的摩尔量比例,使用化学计算方法可以得到这个比例。
2.首先,在一定体积(如100mL)的蒸馏水中加入醋酸的量,根据计算结果。
3.然后,在同样的蒸馏水中加入醋酸钠的量,根据计算结果。
在加入醋酸钠之前,需要校对酸碱物质的总体积是否是所需的目标体积,如果不是,可以再加入适量的蒸馏水进行调整。
4.经过充分搅拌混合后,缓冲溶液就制备好了。
最后,根据需求进行PH值校准。
二、酸碱配制酸碱配制是指利用单一酸或碱的酸碱性质与反应物种数之间的关系,通过精确配比计算得出所需的缓冲体系,使溶液能够保持所需的酸碱性质稳定。
常见的酸碱配制方法有:乙酸钠-盐酸、蒸馏水盐酸-碳酸钠等。
以乙酸钠-盐酸为例:1. 根据所需的pH值,计算所需的酸碱物质的摩尔量比例。
根据缓冲溶液配制公式 pKa=pH-log([A-]/[HA]),可以反推得到[HA]/[A-]的比例,其中[A-]代表酸根离子的浓度,[HA]代表不电离酸的浓度。
2.根据计算结果和所需体积,将乙酸钠溶液添加到蒸馏水中,同时滴加适量的盐酸溶液以调整pH值。
3.增加或减少乙酸钠和盐酸的量,直到所需的pH值达到要求。
三、水解配制水解是指酸碱反应中一种物质在水中发生分解产生酸和碱的反应。
通过精确配比计算得出所需的缓冲体系,既可以保持所需的酸碱性质稳定,又可以实现水解反应的产物稳定。
常见的水解配制方法有:磷酸盐缓冲液、硼酸缓冲液、胸腺嘧啶缓冲液等。
以硼酸缓冲液为例:1.将一定体积(如100mL)的蒸馏水倒入容器中。
常见缓冲液的配制

常见缓冲液的配制附溶液配制方法:pH7.2 0.01mol/L PBSKH2PO40.38gNa2HPO4 1.02g(或Na2HPO4·12H2O2.58g) NaCl8.0g蒸馏水加至1000mLpH7.4 PBS/TNaCl8.0gKH2PO40.2gNa2HPO4·12H2O(或Na2HPO4·7H2O) 2.89g(或2.16g)KCl0.2g吐温200.5mL蒸馏水加至1000mLpH9.6碳酸盐缓冲液Na2CO3 1.59gNaHCO3 2.93g蒸馏水加至1000mL0.075mol/L氯化钾低渗液氯化钾0.559g,蒸馏水100ml甲醇冰醋酸(3:1)固定液甲醇3份冰醋(乙)酸1份姬姆萨染液Giemsa原液1ml1/15mol/L磷酸缓冲液(pH6.8或7.4)10ml2.3% 柠檬酸钠溶液柠檬酸钠(Na C H O ·2H O)2.3g蒸馏水100ml明胶显影液明胶粉0.2g三蒸水10ml甲酸0.1ml1% 醋酸冰醋(乙)酸1ml蒸馏水99mlH"o"33342-若丹明123染液H"o"33342(Hoechst 33342)0.25μg 若丹明123(Rhodamine 123)1.0μg PBS 1mlDPH贮备液DPH(1.6-Dipnenyl-1,3, 5hexatriene, 4.65mg)四氢呋喃10mlDPH工作液(2×10-6mol/L)DPH贮备液0.1mlPBS 100mlFDA贮备液二醋酸脂荧光素(Fluorescein diacetate,FDA) 5.0mg丙酮1mlFDA工作液FDA贮备液0.1mlPBS 100mlM-缓冲液(pH7.2)咪唑50mmol/L 3.404g氯化钾50mmol/L 3.7g氯化镁(MgCl ·6H O)0.5mol/L 101.65mgEGTA(乙二醇双(a-氨基乙基)醚四乙酸) 1mmol/L 380.35mg EDTA(乙二胺四乙酸) 0.1mmol/L 29.22mg疏基乙醇1mmol 0.07ml4mol/L甘油292ml蒸馏水加至1000ml1% TritonX-100液Triton X-100(聚乙二醇辛基苯基醚)1mlM-缓冲液99ml3% 戊二醛液戊二醛25% 3mlPBS 液(pH7.2)97ml0.2% 考马斯亮蓝R250染液考马斯亮蓝R250(Coomassie brilliant blue R250)0.2g 甲醇46.5ml冰醋(乙)酸7ml蒸馏水46.5ml生理盐水(0.85%氯化钠)氯化钠8.5g三蒸水1000ml0.25mol/L蔗糖水溶液(含0.003mol/L氯华钙)蔗糖85.5g无水氯华钙0.33g蒸馏水1000ml0.17mol/L氯化铵液氯化铵4.574g蒸馏水500ml0.17mol/L硝酸钠液硝酸钠7.224g 蒸馏水500ml0.12mol/L硫酸钠液硫酸钠(Na SO ·H O)19.333g蒸馏水500ml0.12mol/L草酸铵液草酸铵((NH )C o ·H O)8.527g蒸馏水500ml0.17mol/L醋酸铵液醋酸铵6.552g蒸馏水500ml0.32mol/L葡萄糖液葡萄糖28.83g蒸馏水500ml0.32mol/L甘油液甘油(C H (OH) ·1.26g/ml) 11.7ml蒸馏水500ml0.32mol/L乙醇液无水乙醇9.33ml蒸馏水500ml0.32mol/L丙醇液正丙醇(比重0.803)11.976ml蒸馏水500ml化学名:2-[4-(2-Hydroxyethyl)-1-piperazinyl]ethanesulfonic acid 中文名:羟乙基哌嗪乙硫磺酸分子式:C8H18N2O4SHEPES是一种非离子两性缓冲液,其在pH 7.2 - 7.4 范围内具有较好的缓冲能力。
缓冲溶液及其配制方法

缓冲溶液及其配制方法
以下是一些常见的缓冲溶液及其配制方法:
1.甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25mL,加酚酞
指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75mL,用水稀释至200mL,调节pH值至
3.25~3.30即可。
2.邻苯二甲酸盐缓冲液(pH5.6):取邻苯二甲酸氢钾10g,加
水900mL,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000mL,混匀即可。
3.氨-氯化铵缓冲液(pH8.0):取氯化铵1.07g,加水使溶解成
100mL,再加稀氨溶液(1→30)调节pH值至8.0即可。
4.氨-氯化铵缓冲液(pH10.0):取氯化铵
5.4g,加水20mL溶
解后,加浓氯溶液35mL,再加水稀释至100mL即可。
5.硼砂-碳酸钠缓冲液(pH10.8~11.2):取无水碳酸钠5.30g,
加水使溶解成1000mL;另取硼砂 1.91g,加水使溶解成100mL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、选择合适的缓冲对:原则是所选缓冲对弱酸的pKa尽量接近于所需pH,并尽量在缓冲对的
缓冲范围内(pH= pKa±1)。
二是所选缓冲对不能与溶液中主物质发生作用。
2、缓冲溶液的总浓度要适当,一般0.1-0.5 mol·L-1之间
3、计算所需缓冲对的量,为方便计算和配制,常用相同浓度的共轭酸、碱溶液,分别取不同体
积混合即可
4、校正,实际pH值与计算pH值常有出入,用pH计或精密pH纸校正。
表1. 常用pH缓冲溶液的配制和pH值
Preparation and pH Values of Common pH Buffer Solutions
表2. pH标准缓冲溶液Standard pH Buffer Solutions
表3. 标准缓冲液pH值与温度对照表
表4。
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)
24
Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
溶液或浓盐酸调节,冰箱保存。
6872柠檬酸钠Na 3 C 6H 5O
7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
22
7.磷酸盐缓冲液
242
Na2HPO4·2H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。
242
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M)
X毫升0.2M K2PO4 + Y毫升0.2N NaOH加水稀释至29毫升
10.Tris–盐酸缓冲液(0.05M,25℃)
50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100
C
HOCH2 NH2
分子量=121.14;1M溶液为12.114克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
2472硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
2472硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂 易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )
13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)
247
2
14.碳酸钠-碳酸氢钠缓冲液(0.1M ) 2+2+
222
N2HCO3分子量=84.0;0.1M溶液为8.40克/升。
表5。
实验室中常用酸碱的比重和浓度
表6。
常用缓冲溶液的配制
(一)甘氨酸-盐酸缓冲液(0.05 mol/L)
X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCl,再加水稀释至200毫升。
甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)
X毫升0.2 mol/L邻苯二甲酸氢钾+Y毫升0.2 mol/L HCl,再加水稀释至20毫升。
邻苯二甲酸氢钾分子量=204.23。
0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
(三)磷酸氢二钠-柠檬酸缓冲液
Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。
(四)柠檬酸-氢氧化钠-盐酸缓冲液
①使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
-柠檬酸钠缓冲液(0.1 mol/L)
(五)柠檬酸
柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
(六)醋酸-醋酸钠缓冲液(0.2 mol/L)
NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。
冰乙酸11.8 mL稀释至1 L(需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)
X 毫升0.2 mol/L KH2PO4+Y毫升0.2 mol/L NaOH 加水稀释至20毫升。
(八)磷酸盐缓冲液
磷酸氢二钠-磷酸二氢钠缓冲液(0.2 mol/L)
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。
NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。
(九)巴比妥纳-盐酸缓冲液
巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。
(十)Tris-HCl缓冲液(0.05 mol/L)
50毫升0.1mol/L三羟甲基氨基甲烷(Tris)溶液与X毫升0.1mol/L盐酸混匀并稀释至100毫升。
Tris分子量=121.14 ;0.1 mol/L溶液为12.114 g/L。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
(十一)、硼酸-硼砂缓冲液 (0.2 mol/L硼酸根)
硼砂:Na2B4O7·10H2O分子量=381.43;0.05 mol/L溶液(等于0.2 mol/L硼酸根)含19.07 g/L。
硼酸:H3BO3分子量=61.84;0.2 mol/L的溶液为12.37 g/L。
硼砂易失去结晶水,必须在带塞的瓶中保存。
(十二)甘氨酸-氢氧化钠缓冲液(0.05 mol/L)
X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L NaOH加水稀释至200毫升。
甘氨酸分子量=75.07;0.2 mol/L 溶液含15.01 g/L
(十三)硼砂-氢氧化纳缓冲液(0.05 mol/L 硼酸根)
X 毫升0.05 mol/L 硼砂+Y 毫升0.2 mol/L NaOH 加水稀释至200毫升。
硼砂Na 2B 4O 7·10H 2O 分子量=381.43;0.05 mol/L 硼砂溶液(等于
0.2 mol/L 硼酸根)为19.07 g/L 。
(十四)碳酸钠-碳酸氢钠缓冲液(0.1 mol/L )(此缓冲液在Ca 2+
、Mg 2+
存在时不得使用).
Na2CO3·10H2O分子量=286.2;0.1 mol/L溶液为28.62 g/L。
NaHCO3分子量=84.0;0.1 mol/L溶液为8.40 g/L。
表7。
一些常用弱酸的电离常数。
