非吸收性外科缝线产品技术要求派尔特
非吸收外科缝线(带针不带针)产品技术要求瑞朗
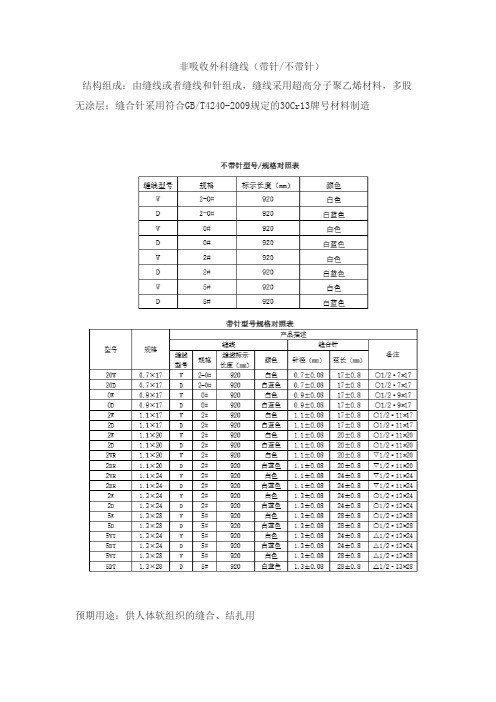
非吸收外科缝线(带针/不带针)结构组成:由缝线或者缝线和针组成,缝线采用超高分子聚乙烯材料,多股无涂层;缝合针采用符合GB/T4240-2009规定的30Cr13牌号材料制造预期用途:供人体软组织的缝合、结扎用2.1 缝线2.1.1 外观缝线表面应光滑,色泽一致,条干均匀,无污渍,无结头;2.1.2抗张强度应符合YY0167-2005表3中Ι类缝线对应的抗张强度要求;2.1.3线径缝线的线径应符YY0167-2005表2中相应型号缝线的规定;2.1.4长度缝线长度为920mm,尺寸误差应为±10mm;2.1.5褪色染色缝线的褪色试验应合格。
2.1.6缝线材质缝线红外光谱的主要吸收峰应与标准对照谱图(超高分子量聚乙烯)的特征吸收峰相吻合。
2.2 缝合针2.2.1外观2.2.1.1针体:缝合针表面应光洁、色泽均匀,针尖无弯钩,针孔和针槽应光洁居中,不得有毛刺或明显歪斜现象。
缝合针与缝合线衔接后,针尾应光洁,不得有毛刺;2.2.1.2三角刃口:三角刃口不得有卷刃、白刃或锯齿状;2.2.1.3表面粗糙度:表面粗糙度Ra之数值应不大于0.8µm。
2.2.2物理性能;2.2.2.1硬度:缝合针硬度不低于490HV0.22.2.2.2缝合针针体应有良好的弹性;2.2.2.3缝合针针体应有良好的韧性;2.2.2.4针尖强度:缝合针针尖应无虚尖,针尖经规定的加力速度加载顶压后不得有弯钩。
2.2.3使用性能2.2.3.1刺穿力:应符合YY/T0043-2016中4.3.1表2的规定;2.2.3.2切割力:应符合YY/T0043-2016中4.3.2表3的规定;2.2.3.3针线连接强度:应符合YY0167-2005中4.4表4的规定。
2.2.4材料针的材料符合GB/T4240-2009规定的30Cr13牌号材料。
2.2.5耐腐蚀性能针应有良好的耐腐蚀性能,其表面状态应不低于YY/T0149-2006中b级的要求。
非吸收外科缝线(带针 不带针)产品技术要求北京瑞朗泰科
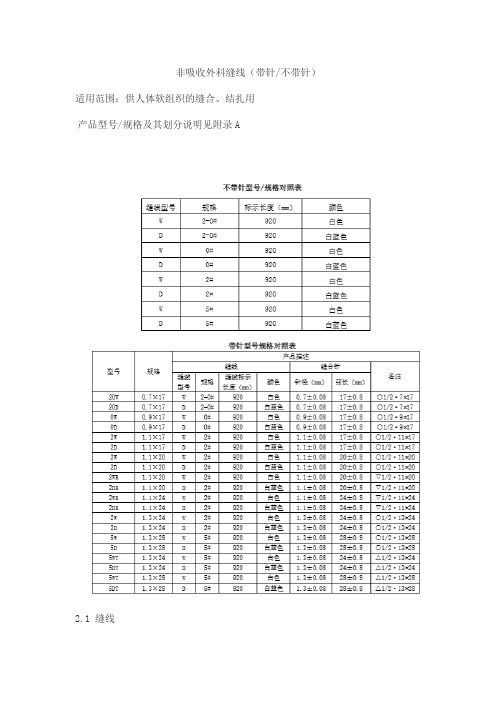
非吸收外科缝线(带针/不带针)适用范围:供人体软组织的缝合、结扎用产品型号/规格及其划分说明见附录A2.1 缝线2.1.1 外观缝线表面应光滑,色泽一致,条干均匀,无污渍,无结头;2.1.2抗张强度应符合YY0167-2005表3中Ι类缝线对应的抗张强度要求;2.1.3线径缝线的线径应符YY0167-2005表2中相应型号缝线的规定;2.1.4长度缝线长度为920mm,尺寸误差应为±10mm;2.1.5褪色染色缝线的褪色试验应合格。
2.1.6缝线材质缝线红外光谱的主要吸收峰应与标准对照谱图(超高分子量聚乙烯)的特征吸收峰相吻合。
2.2 缝合针2.2.1外观2.2.1.1针体:缝合针表面应光洁、色泽均匀,针尖无弯钩,针孔和针槽应光洁居中,不得有毛刺或明显歪斜现象。
缝合针与缝合线衔接后,针尾应光洁,不得有毛刺;2.2.1.2三角刃口:三角刃口不得有卷刃、白刃或锯齿状;2.2.1.3表面粗糙度:表面粗糙度Ra之数值应不大于0.8µm。
2.2.2物理性能2.2.2.1硬度:缝合针硬度不低于490HV;0.22.2.2.2缝合针针体应有良好的弹性;2.2.2.3缝合针针体应有良好的韧性;2.2.2.4针尖强度:缝合针针尖应无虚尖,针尖经规定的加力速度加载顶压后不得有弯钩。
2.2.3使用性能2.2.3.1刺穿力:应符合YY/T0043-2016中4.3.1表2的规定;2.2.3.2切割力:应符合YY/T0043-2016中4.3.2表3的规定;2.2.3.3针线连接强度:应符合YY0167-2005中4.4表4的规定。
2.2.4材料针的材料符合GB/T4240-2009规定的30Cr13牌号材料。
2.2.5耐腐蚀性能针应有良好的耐腐蚀性能,其表面状态应不低于YY/T0149-2006中b级的要求。
2.2.6尺寸针的尺寸应符合附录A的要求。
2.3环氧乙烷残留量采用环氧乙烷灭菌的产品,环氧乙烷残留量应≤10μg/g。
2 非吸收性外科缝线注册技术审查指导原则(征求意见稿)

非吸收性外科缝线注册技术审查指导原则(征求意见稿)本指导原则旨在为申请人进行非吸收性外科缝线的注册申报提供技术指导,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的。
因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则适用于第二类非吸收性外科缝线。
根据《总局关于发布医疗器械分类目录的公告(2017年第104号)》规定,非吸收性外科缝线管理类别为Ⅱ类,子目录为02无源手术器械,一级产品类别为13手术器械-吻(缝)合器械及材料,二级产品类别为07不可吸收缝合线。
本指导原则不适用于可吸收缝线、预期用于骨结合及其他有特殊要求的缝线(如主要用于肌腱和韧带缝合的超高分子量聚乙烯缝线、免打结式缝线、具有抗菌作用缝线等)。
二、注册申报资料要求(一)产品名称的要求产品名称应以产品的预期用途和适用范围为依据,一般应为不可吸收缝合线或非吸收性外科缝线。
产品名称中可体现缝线的材料(例如非吸收性聚丙烯外科缝线)。
(二)产品的结构组成非吸收性外科缝线通常是由天然材料或聚合材料制成的表面可有涂层的不可降解吸收的缝合线。
分为带针和不带针两种。
产品结构分为多股和单股。
根据产品材料、结构和有无涂层可以分为以下三类:表1 缝线的分类非吸收性外科缝线常见材质有蚕丝、聚酰胺、聚酯、聚丙烯、不锈钢等。
(三)产品工作原理非吸收性外科缝线在外科手术当中,或者是外伤处置当中,用于软组织、器官和/或皮肤的缝合。
(四)注册单元划分的原则和实例按照《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)第七十四条要求,“医疗器械注册或者备案单元原则上以产品技术原理、结构组成、性能指标和适用范围为划分依据”。
医疗器械包类产品技术要求

医疗器械产品技术要求编号:粤食药监械械(准)字20 第号一次性使用产包1。
产品型号/规格及其划分说明通用型具体配置见附录A。
2。
性能指标2。
1规格、数量及基本尺寸2。
2外观与结构2。
2配件性能2。
2。
1医用缝合针线2。
2。
1.1 医用缝合针应符合YY 0043-2005的规定.2.2.1.2 非吸收性外科缝线应符合YY 0167-2005的规定.2。
2.2镊子2.2.2。
1 镊子夹持物品时,不应有松脱现象。
2.2。
2.2 在镊子中部施加5N的捏合力反复捏合20次,其不应有断裂和永久变形现象.2.2.3棉球、消毒棉球2。
2。
3。
1 棉球中医用脱脂棉应符合YY 0330的规定。
2。
2。
3。
2 消毒棉球中碘伏应符合GB 27954—2011《黏膜消毒剂通用要求》中4.2的规定。
2.2.4外科纱布敷料应符合YY 0594的规定。
2.2.5非织造布单、洞巾、治疗巾应符合YY/T 0506。
2—2009中表2 产品非关键区域标准性能的要求。
2。
2.6橡胶检查手套应符合GB 10213的规定。
2.2.7托盘应能将除包布以外的所有器械盛在一起。
2.3环氧乙烷残留量缝合包若采用环氧乙烷灭菌,出厂时环氧乙烷残留量应不大于10μg/g. 2.4无菌应一经确认的灭菌过程使缝合包无菌.……3. 检验方法3。
1规格、数量及基本尺寸试验3。
2外观与结构试验以目力观察、嗅觉及手感检查进行,结果应符合2。
2的规定。
3。
3配件性能试验3。
3。
1 医用缝合针线试验3。
3.1.1 医用缝合针试验按YY 0043—2005中的规定进行试验,结果应符合2.3.1。
1的规定。
3。
3。
1。
2 非吸收性外科缝线试验按YY 0167-2005中5。
1~5。
6的规定进行试验,结果应符合2.2.1。
2的规定.3.3。
2镊子试验3.3。
2.1 用镊子分别夹持棉球、纱布块各5次,结果应符合4。
4。
2.1的规定。
3。
3。
2.2 将镊子的一片固定,然后在另一片中点处施加5N的捏合力至二片头端接触,持续5s,反复试验20次,结果应符合4。
非吸收性外科缝线产品技术要求派尔特0

非吸收性外科缝线适用范围:供人体组织的缝合、结扎用。
1.1产品型号、规格及其划分说明1.1.1根据缝合线的粗细分为9/0、8/0、7/0、6/0、5/0、4/0、3/0、2/0、0九种规格。
1.1.2根据缝合线的长度分为15cm、18cm、45cm、60cm、75cm、80cm、90cm、100cm、120cm和150cm十种规格。
1.1.3根据缝合线的颜色分为蓝色和白色。
1.1.4根据缝合针的针型不同分为圆针、圆体角针和角针,如图1、图2、图3。
图1 圆针图2 圆体角针图3 角针1.1.5根据缝线与缝针连接型式分为单针和双针,双针连接型式为缝线两端各有一枚缝合针。
1.1.6型号划分说明如下:1.1.7具体规格型号及尺寸见附录A。
1.2结构组成及材料本产品由缝合线和缝合针组成,其中缝合线是由聚丙烯材料制成的单股缝线,表面涂覆有硅氧烷涂层,经酞氰-铜(Phthalocyanine-copper)染色,分为蓝色和白色(无染色)。
缝合针材质为30Cr13不锈钢。
按YY0167-2005中的分类规定属于Ⅱ类单股合成纤维缝线。
2.1缝线2.1.1外观2.1.1.1缝线表面应光滑,条干均匀,无污渍,无结头。
2.1.1.2针线连接处应光滑、无毛刺。
2.1.2 线径缝线的线径应符合YY0167-2005中的规定,见表1。
表1缝线的规格与线径范围2.1.3 抗张强度缝线的抗张强度应符合YY0167-2005中的规定,见表2。
表2缝线的抗张强度2.1.4 长度缝线长度应不小于标识长度的95%,单根缝线的长度应不大于3.5m。
2.1.5褪色试验若缝合线染色,褪色试验应合格。
2.2缝合针2.2.1 使用性能2.2.1.1刺穿力缝合针针尖应尖锐、无弯钩,其刺穿力应符合YY0043-2005中的要求,见表3。
表3刺穿力2.2.1.2切割力三角针刃口应锋利,其切割力应符合YY0043-2005中的要求,见表4。
表4切割力2.2.2 物理性能应符合YY0043-2005中第4.2条的要求。
无源产品技术要求模板

附件3医疗器械产品技术要求编号:粤食药监械械(准)字20 第号一次性使用产包1. 产品型号/规格及其划分说明通用型具体配置见附录A。
2. 性能指标2.1规格、数量及基本尺寸2.2外观与结构2.2配件性能2.2.1医用缝合针线2.2.1.1 医用缝合针应符合YY 0043-2005的规定。
2.2.1.2 非吸收性外科缝线应符合YY 0167-2005的规定。
2.2.2镊子2.2.2.1 镊子夹持物品时,不应有松脱现象。
2.2.2.2 在镊子中部施加5N的捏合力反复捏合20次,其不应有断裂和永久变形现象。
2.2.3棉球、消毒棉球2.2.3.1 棉球中医用脱脂棉应符合YY 0330的规定。
2.2.3.2 消毒棉球中碘伏应符合GB 27954-2011《黏膜消毒剂通用要求》中4.2的规定。
2.2.4外科纱布敷料应符合YY 0594的规定。
2.2.5非织造布单、洞巾、治疗巾应符合YY/T 0506.2-2009中表2 产品非关键区域标准性能的要求。
2.2.6橡胶检查手套应符合GB 10213的规定。
2.2.7托盘应能将除包布以外的所有器械盛在一起。
2.3环氧乙烷残留量缝合包若采用环氧乙烷灭菌,出厂时环氧乙烷残留量应不大于10μg/g。
2.4无菌应一经确认的灭菌过程使缝合包无菌。
……3. 检验方法3.1规格、数量及基本尺寸试验3.2外观与结构试验以目力观察、嗅觉及手感检查进行,结果应符合2.2的规定。
3.3配件性能试验3.3.1 医用缝合针线试验3.3.1.1 医用缝合针试验按YY 0043-2005中的规定进行试验,结果应符合2.3.1.1的规定。
3.3.1.2 非吸收性外科缝线试验按YY 0167-2005中5.1~5.6的规定进行试验,结果应符合2.2.1.2的规定。
3.3.2镊子试验3.3.2.1 用镊子分别夹持棉球、纱布块各5次,结果应符合4.4.2.1的规定。
3.3.2.2 将镊子的一片固定,然后在另一片中点处施加5N的捏合力至二片头端接触,持续5s,反复试验20次,结果应符合4.4.2.2的规定。
非吸收性外科缝线

非吸收性外科缝线1 范围本标准规定了非吸收性外科缝线的分类、要求、试验方法、型式检验、标签、说明书、包装、运输、贮存和有效期。
本标准适用于人体组织缝合、结扎的非吸收性外科缝线(以下简称缝线)。
本标准不适用于特殊设计的非吸收性外科缝线。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191 包装储运图示标志GB 4234 外科植入物用不锈钢GB/T 8170数值修约规则与极限数值的表示和判定GB/T 9737-2008化学试剂易碳化物质测定通则GB/T 9969工业产品使用说明书总则GB/T 14233.1-2008 医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T 16886(所有部分)医疗器械生物学评价YY/T 0466.1 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求YY/T 0816-2010 外科植入物缝合及其他外科用柔性金属丝中华人民共和国药典(2015年版)3 缝线的分类3.1 形式缝线有带缝合针与不带缝合针两种形式,均以无菌形式提供。
3.2 结构缝线的结构有单股和多股(捻股和编织)之分。
3.3 材料缝线的制造材料涉及天然纤维、合成纤维和金属材料(符合YY/T 0816-2010的第3章或GB 4234)。
注:天然纤维,如蚕丝。
合成纤维,如聚对苯二甲酸乙二酯、聚亚乙烯基二氟化物、聚酰胺6、聚酰胺6/6及聚丙烯。
金属材料,如不锈钢丝。
3.4 类别1缝线按制造材料、结构、染色和涂层影响分为三类(见表1),其中:A类缝线,由蚕丝或合成纤维制成,涂层不影响线径;B类缝线,由天然纤维或合成纤维制成,涂层影响线径;C类缝线,由金属制成。
表1 缝线的分类4 要求4.1 外观4.1.1 缝线应光滑,条干均匀,无污渍,无结头。
多股缝线表面应有涂层。
国家药品监督管理总局关于发布《可吸收性外科缝线》等2项行业标准的通知

国家药品监督管理总局关于发布《可吸收性外科缝
线》等2项行业标准的通知
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2002.01.08
•【文号】国药监械[2002]6号
•【施行日期】2002.05.01
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】标准化
正文
国家药品监督管理局关于发布
《可吸收性外科缝线》等2项行业标准的通知
(国药监械〔2002〕6号)
各省、自治区、直辖市药品监督管理局,各医疗器械标准化技术归口单位:《可吸收性外科缝线》等2项医疗器械强制性行业标准,已由全国外科器械标准化技术委员会审定通过,现予以发布。
行业标准的编号、名称及实施日期如下:1.YY1116-2002《可吸收性外科缝线》
(代替YY91116-1999)
2.YY0166-2002《带线缝合针》
(代替YY0044-91、YY0166-94)
以上标准自2002年5月1日起实施。
国家药品监督管理局
二00二年一月八日
c31231--020306ckj。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
非吸收性外科缝线
适用范围:供人体组织的缝合、结扎用。
1.1产品型号、规格及其划分说明
1.1.1根据缝合线的粗细分为0、2/0、3/0、4/0、5/0、6/0六种规格。
1.1.2根据缝合线的长度分为60cm、75cm、80cm、90cm、100cm、120cm和160cm 七种规格。
1.1.3根据缝合线的颜色分为白色和绿色。
1.1.4根据缝合针的针型不同分为圆针和圆体角针,见图1、图2。
图1 圆
针
图2 圆体角针
1.1.5型号划分说明如下:
1.1.6具体规格型号及尺寸见附录A。
1.2结构组成及材料
本产品由缝合线和缝合针组成,其中缝合线是由聚对苯二甲酸乙二醇酯制成的多股缝线,表面涂覆有聚硅醚涂层,经(D&C绿色6号C161565)染色剂染色,分为绿色和白色(无染色)两种。
缝合针材质为30Cr13不锈钢。
按YY0167-2005中的分类规定属于Ⅱ类多股合成纤维缝线。
2.1缝线
2.1.1外观
2.1.1.1缝线表面应光滑,条干均匀,无污渍,无结头。
2.1.1.2针线连接处应光滑、无毛刺。
2.1.1.3 颜色应符合附表的要求。
2.1.2 线径
缝线的线径应符合YY0167-2005中的规定,见表1。
表1 缝线的规格与线径范围
2.1.3 抗张强度
缝线的抗张强度应符合YY0167-2005中的规定,见表2。
表2 缝线的抗张强度
2.1.4 褪色
若缝线经过染色,则缝线的褪色试验应合格。
2.1.5 长度
缝线长度应不小于标识长度的95%,单根缝线的长度应不大于3.5m。
2.2缝合针
2.2.1 使用性能
2.2.1.1刺穿力
缝合针针尖应尖锐、无弯钩,其刺穿力应符合YY0043-2005中的要求,见表3。
表3 刺穿力
2.2.1.2切割力
三角针刃口应锋利,其切割力应符合YY0043-2005中的要求,见表4。
表4 切割力
2.2.2 物理性能
应符合YY0043-2005中第4.2条的要求。
2.2.3 外观
应符合YY0043-2005中第4.3条(除4.3.4弹机孔嵌线)的要求。
2.3 针线连接强度
缝合线的针线连接强度应符合YY0167-2005中的要求,见表5。
表5 针线连接强度
2.4 环氧乙烷残留量
若缝线采用环氧乙烷灭菌时,环氧乙烷的残留量应不大于250μg/g。
2.5 垫片
应为白色,不易脱落。
2.6 无菌
缝合线和缝合针应无菌。
2.7细菌内毒素
细菌内毒素限量应小于20EU/套。
