1《中国药典》2010年版有关内容概述
2010版中国药典知识
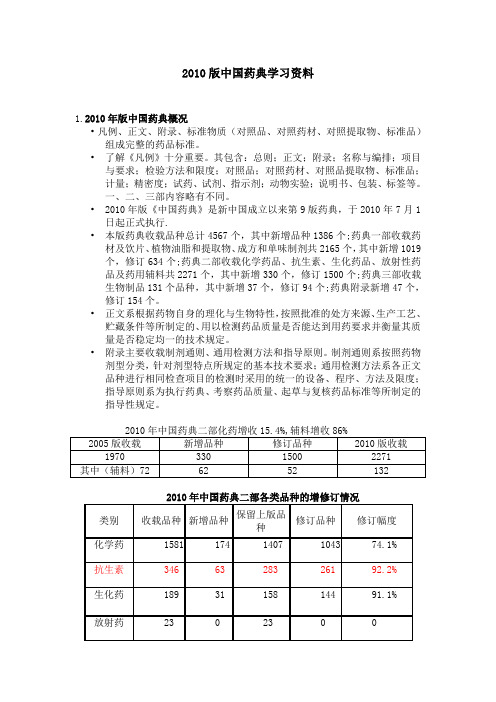
2010版中国药典学习资料1.2010年版中国药典概况•凡例、正文、附录、标准物质(对照品、对照药材、对照提取物、标准品)组成完整的药品标准。
•了解《凡例》十分重要。
其包含:总则;正文;附录;名称与编排;项目与要求;检验方法和限度;对照品;对照药材、对照品提取物、标准品;计量;精密度;试药、试剂、指示剂;动物实验;说明书、包装、标签等。
一、二、三部内容略有不同。
•2010年版《中国药典》是新中国成立以来第9版药典,于2010年7月1日起正式执行.•本版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。
•正文系根据药物自身的理化与生物特性,按照批准的处方来源、生产工艺、贮藏条件等所制定的、用以检测药品质量是否能达到用药要求并衡量其质量是否稳定均一的技术规定。
•附录主要收载制剂通则、通用检测方法和指导原则。
制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时采用的统一的设备、程序、方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。
凡例的增修订情况•新版药典凡例进行了重大修订:•1)、首次在凡例中设置总则一节。
增加了“总则”一节,将中国药典中最重要、最原则、最通用、最基础的内容集中阐明,并且做到一、二、三部之凡例的体例、结构的一致性。
内容在保留特点的基础上也基本一致。
•2)、首次明确药典制定颁布依据。
新版药典凡例总则之一明确“《中华人民共和国药典》简称《中国药典》。
《中国药典》依据《中国人民共和国药品管理法》组织制定和颁布实施”。
中国药典2010版第一部

中国药典2010版第一部摘要:一、引言二、中国药典2010版第一部的概述三、中国药典2010版第一部的主要内容1.药物的分类2.药物的命名规则3.药物的性状、鉴别与检查4.药物的炮制5.药物的制剂四、中国药典2010版第一部的应用与价值五、结论正文:一、引言中国药典是中医药行业的一部权威性法典,对药品的研究、生产、经营、使用、监督管理等方面具有重要的指导作用。
本文将重点介绍中国药典2010版第一部的相关内容。
二、中国药典2010版第一部的概述中国药典2010版第一部,简称2010版药典一部,是按照我国药品监督管理部门的要求,由中国药典委员会组织编纂的。
该书于2010年正式出版,是我国药品标准体系的重要组成部分。
三、中国药典2010版第一部的主要内容1.药物的分类2010版药典一部对药物进行了详细的分类,包括中药材、中药提取物、中药成方制剂、化学药品、生化药品、抗生素、放射性药品等。
2.药物的命名规则药典规定了药物的命名原则,包括通用名、化学名、商品名等,并对药物的命名进行了规范和统一。
3.药物的性状、鉴别与检查药典对药物的性状、鉴别与检查进行了详细的规定,包括外观性状、理化性质、鉴别方法、检查方法等,为药品的真伪鉴别提供了依据。
4.药物的炮制药典对药物的炮制进行了规范,包括炮制方法、炮制程度等,以确保药物的疗效和安全性。
5.药物的制剂药典对药物的制剂进行了详细的规定,包括制剂工艺、处方、质量要求等,以确保药品的质量和疗效。
四、中国药典2010版第一部的应用与价值2010版药典一部的出版,为药品的生产、经营、使用、监督管理等方面提供了重要的依据和指导,对提高我国药品质量、保障人民用药安全有效具有重要意义。
五、结论中国药典2010版第一部是中医药行业的一部权威性法典,对药品的研究、生产、经营、使用、监督管理等方面具有重要的指导作用。
《中国药典2010年版(二部) 概况

凡例的增修订情况
正 文
• 八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、 生产工艺、贮藏条件等所制定的、用以检测药品质量是否达到用药要求 并衡量其质量是否稳定均一的技术规定。
附 录
• 十、附录主要收载制剂通则、通用检测方法和指导原则。制剂通则系按 照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法 系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、 方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品 标准等所制定的指导性规定。
应在后续的生产环节予以有效去除。除正文已明确列
有“残留溶剂”检查的品种必须依法进行该项检查外,
其他未在“残留溶剂”项下明确列出的有机溶剂与未 在正文中列有此项检查的品种,如生产过程中引入或 产品中残留有机溶剂,均应按本版药典附录“残留溶 剂测定法”检查并应符合相应溶剂的限度规定。
药典标准—体现高质量药品
合国家有关的管理规定。 (3)来源于动物组织提取的药品,其所用动物种属要明确,所用脏 器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病地区
的健康牛群;来源于人尿提取的药品,均应取自健康人群。上述药品均
应有明确的病毒灭活工艺要求以及质量管理要求。
凡例的增修订情况
项目与要求
• 十七、(第二段)对于生产过程中引入的有机溶剂,
各论的增修订情况(1):名称与性状
药品通用名称 (制剂)
规范并真正反映药品的组成和剂型特点,明确了剂型的亚类,与制剂 通则一致。 将胶丸统一修改为软胶囊 硫糖铝片改硫糖铝咀嚼片。 替硝唑注射液(均为大容量规格)改名为替硝唑氯化钠注射液 把甲硝唑注射液中大容量规格改名为甲硝唑氯化钠注射液
中国药典2010年版中药

原子 TLC-S 滴定 吸收
38 33 1 2 38 53
2010年版 1265
(三)增订剂型品种
新增 露剂品种:金银花露 涂膜剂品种:疏痛安涂膜剂
增修订内容与特点
(一)收载品种数量大幅度增加
2005版收载中成药564种 2010版收载中成药1063种
(一)收载品种数量大幅度增加
2010版药典标准起草技术要求及编写细则 《中国药典》中药质量标准研究技术要求 《中国药典》中药质量标准复核技术要求 《中国药典》中药质量标准起草说明编写 细则 《中国药典》中药质量标准起草与复核工 作规范 《中国药典》中药质量标准正文各论编写 细则
药典编排格式
凡例 正文 附录
2010版药典标准正文内容—药材和饮片
(一)增修订品种
中药材及饮片
种类
药材 饮片
2005版 530 746
2010版 592 809
增幅(%) 12 8
收载标准数量
2005版 530 70 2010版 592 809
种类
药材
增幅(%) 12 1056
饮片
中成药增修订品种
2010年版收载总数: 1063
2010年版新增品种数:499
(三)专项研究课题 (1)含朱砂、雄黄中成药中游离砷、 汞检测方法研究; (2)农药多残留检测方法研究; (3)黄曲霉毒素检测研究; (4)重金属及有害元素研究; (5)生物活性测定法研究。
2010年版药典一部立项情况
不上的原则: (1)品种增加的越多越好,但不降低要求、不破 规矩,质量标准达不到要求的品种不上; (2)含保护动、植物的不上; (3)含龙骨的不上; (4)含人中白、紫河车、五灵脂的不上; (5)含鲜活动物的不上。 (6)处方药材基源不清楚或基础工作薄弱的品种 原则上不收载。
2010版中国药典

1019
634
2165
1146
《中国药典》发展与展望
2010版药药典二部化药增收15.4%,辅料增收86%
2005版收载 1970
新增品种 修订品种 2010版收载
330
1500
2271
其中(辅料) 72
62
52
132
《中国药典》发展与展望
2010版药药典三部(生物制品)增收29.7%
类别
收载总数
140
新增 14 15 18
修订
2010版 收载
47
112
69
152
39
149
《中国药典》发展与展望
中国药典2010版概况
管理创新 强化系统性、规范性、基础性工作
标准验证和复核;一般检查项目的增补和完善;中药材拉丁名词序 变更;规范功能与主治等。
注重体现中药 特色,表达中药特点
重视中药材与中药材饮片标准,注重质量控制的专属性,一测多 评技术,多指标成分定量;特征和指纹图谱技术的应用。
2010版中国药典概述来自010版中国药典一、 《中国药典》发展与展望 二、 《中国药典》2010年版通用检测方法和指导原则 三、 2010年版中国药典凡例附录简介 四、 《中国药典》 2010年版一部增修订情况简介 五、 《中国药典》2010年版药用辅料概述 六、 《中国药典》2010年版无菌检查和微生物限度检查部分增修订内容
新增品种
修订品种
未收载 2010版收载
3217
1386(43%) 2237(70%) 36
4567
《中国药典》发展与展望
2010版药药典品种收载情况
内容
新增
修订 2010年版 2005年版
中国药典2010版第一部

中国药典2010版第一部
摘要:
1.介绍《中国药典2010 版第一部》
2.该版本的主要内容和更新
3.《中国药典》的历史和作用
4.《中国药典》对中医药发展的影响
正文:
《中国药典2010 版第一部》是我国国家级的药品标准规范,对药品的研发、生产、质量控制以及药品的流通和使用等方面具有重要的指导意义。
《中国药典》是我国药品标准的核心,它的每一次更新都受到广泛的关注。
2010 版第一部的《中国药典》是对前一版的修订和完善,主要包括了中药、化学药品、生物制品等各类药品的标准。
此次修订,对药品的收载数量、质量标准、检验方法等方面都进行了大幅度的提升和改进,以适应我国药品研发和生产的新需求。
《中国药典》的历史可以追溯到1953 年,其初衷是为了规范药品的生产和使用,保障人民的用药安全。
从那时起,《中国药典》已经经历了多次修订,每一次修订都反映出我国药品标准的进步,以及药品研发和生产技术的提升。
《中国药典》对我国中医药的发展起到了重要的推动作用。
一方面,它规范了中医药的生产和使用,保障了人民的用药安全。
另一方面,它推动了中医药的现代化进程,促进了中医药与国际接轨。
2010药典四部 -回复

2010药典四部-回复什么是2010药典四部?2010药典四部是指2010年版中国药典中的四个不同部分,分别是《一般药品》、《中药制剂》、《药用辅料》和《中药材》。
这些部分包含了药品的标准、质量要求、检测方法等内容,是中国医药行业的重要参考依据。
一般药品部分主要规定了化学药品、生物制品以及一些特殊药品的质量要求和检测方法。
这部分内容包括了药品的纯度、杂质限度、溶解度、稳定性等指标,旨在确保药品的质量安全。
中药制剂部分主要规定了中药的制剂方法和质量要求。
中药制剂是指将中药材加工制成的制剂,如丸剂、颗粒剂、口服液等。
这部分内容包括了中药的生产工艺、制剂的质量标准、有效成分的含量等,以保证中药制剂的疗效和安全性。
药用辅料部分主要规定了药品中所使用的辅助材料的质量要求。
药用辅料是指用于制剂生产过程中的辅助材料,如溶剂、稳定剂、乳化剂等。
这部分内容包括了药用辅料的纯度、杂质限度、溶解度等指标,以确保药用辅料不会对药品的质量产生负面影响。
中药材部分主要规定了中药材的质量要求和检测方法。
中药材是指未加工的中药原材料,如草药、动植物的部分或全部。
这部分内容包括了中药材的鉴别方法、理化指标、微生物限度等,以保证中药材的质量和安全。
对于药品生产企业和医药行业从业人员来说,2010药典四部是一份重要的参考资料。
它们提供了药品质量评价的标准和方法,帮助企业确保产品的质量安全,并且为监管部门提供了一个参考依据,用于对药品进行质量监督检查和审核。
此外,2010药典四部还对药品的生产、储存、运输和使用等环节提出了相关要求,促进了全行业的规范发展。
它们对于保障患者用药安全、提高药品质量和促进行业创新有着重要的意义。
总之,2010药典四部是中国医药行业的重要标准,对于药品质量和安全具有重要意义。
它们为药品生产企业提供了明确的质量要求和检测方法,保障了药品的质量安全,并且对于监管部门提供了一个参考依据,用于监督和审核药品质量。
同时,它们也推动了行业的规范发展,保障了患者的用药安全和药品的质量。
《中华人民共和国药典》2010版简介

《中华人民共和国药典》2010年版简介《中华人民共和国药典》(简称《中国药典》)2010年版,按照第九届药典委员会成立大会暨全体委员大会审议通过的《中国药典》2010年版编制大纲所确立的指导思想、基本原则、任务目标及具体要求,在全体委员和常设机构工作人员的不懈努力及有关部门和参与单位的大力支持下编制完成。
经第九届药典委员会执行委员会审议通过,为中华人民共和国第九版药典。
本版药典分一部、二部和三部,收载品种总计4567种,其中新增1386种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准)、修订634种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种,其中新增330种、修订1500种;药典三部收载生物制品,品种共计131种,其中新增37种、修订94种。
本版药典收载的附录亦有变化,其中药典一部新增14个、修订47个;药典二部新增15个、修订69个;药典三部新增18个、修订39个。
一、二、三部共同采用的附录分别在各部中予以收载,并尽可能做到统一协调、求同存异。
本版药典的变化主要体现在:收载品种有较大幅度的增加。
本版药典积极扩大了收载品种范围,基本覆盖了国家基本药物目录品种范围。
此次收载品种的新增幅度和修订幅度均为历版最高。
对于部分标准不完善、多年无生产、临床不良反应多的药品,也加大调整力度,2005年版收载而本版药典未收载的品种共计36种。
现代分析技术得到进一步扩大应用。
除在附录中扩大收载成熟的新技术方法外,品种正文中进一步扩大了对新技术的应用。
如附录中新增离子色谱法、核磁共振波谱法、拉曼光谱法指导原则等。
中药品种中采用了液相色谱质谱联用、DNA分子鉴定、薄层生物自显影技术等方法,以提高分析灵敏度和专属性,解决常规分析方法无法解决的问题。
化药品种中采用了分离效能更高的离子色谱法和毛细管电泳法;总有机碳测定法和电导率测定法被用于纯化水、注射用水等标准中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3217
1386 43%
2237 70%
34
4567
2、品种收载情况
各部品种收载数量
内容 一部 新增 1019 修订 634 2010年版 2005年版 2165 1146
二部
三部 总计
330
37 1386
1500
94 2237
2271
131 4567
1970
101 3217
3、附录增修情况:
内容 05年版收载 新增 修订 10年版收载
3、药典基本结构:
2、正文: 每一个具体品种的质量标准
系根据药物自身的理化与生物学特性,按照批准的 处方来源、生产工艺、贮藏运输条件等虽制定的、用 以检测药品质量是否达到用药要求并衡量其质量是否 稳定均一技术的规定。
3、药典基本结构:
3、附录 主要收载制剂通则、通用检测方法和指导 原则。 制剂通则:按药物剂型分类,针对剂型特点所规定的 基本技术要求。 通用检测方法:检验时所用的设备、程序、方法及限 度 指导原则:为执行药典、考察药品质量、起草与复核 药品标准等的指导性规定。
2010版《中国药典》的凡例总则
7、首次明确附录的法律约束力 《中国药典》2000年版规定“附录中收载的指导原则 是为执行药典、考察药品质量标准所制定的指导性规 定,不作为法定标准。” 《中国药典》2005年版规定“附录中收载的指导原则 是为执行药典、考察药品质量标准所制定的指导性规 定。” 新版药典凡例虽然也有同样规定,但不在总则之中描 述,而在总则之中却明确药典收载的“凡例、附录” 对药典以外的其他国家药品标准具同等效力”,因此 可以理解为附录是具有法律约束力的指导性规定。
《中国药典》2010年版 有关内容概述
2010年10月20日 南京
主要内容
1 3 2 3 4 5 3
《中国药典》发展概况
10版《中国药典》概况
10版凡例增修订概况 《中国药典》的地位 《中国药典》的作用
主要内容
6 3 7 8 3 9 10 3
《中国药典》的特点
监管机构如何应用好药典
可见异物检查法修定概况
2010版《中国药典》的凡例总则
以上5、6、7使《中国药典》作为国家标准的核心地 位的一确立、得以确立。今后《中国药典》的变化将 超越自身的变化成为中国国家药品标准的变化。 8、首次界定了药典与行为标准的关系
规定“正文所设各项规定是针对符合《药品生产质量 管理规范》(GMP)的产品而言。任何违反GMP或有未 经批准添加物质所生产的药品,即使符合《中国药典 》或按《中国药典》没有检出其添加物质或相关杂质 ,亦不能认为其符合规定。”
2010版《中国药典》的凡例总则
3、首次阐明药典基本结构内容三部和增补本 组成”,内容分别包括“凡例、正文和附录”,强 化了《中国药典》的结构性、系统性整体性及其不 可分割的特点。
部间关系与部内结构
2010版《中国药典》的凡例总则
4、首次明确增补本的药典地位
解决了“增补本”的模糊地位问题,为
10版凡例增修订情况
《中国药典》的地位
《中国药典》的作用
《中国药典》的地位
1、国家药品标准体系的核心
国家药品法律体系的核心: 药品管理法—药法—行为标准—行为规范 国家药品标准体系的核心: 中国药典—药典—技术标准—技术规范
2、执法监督检验的技术规范
执行《药品管理法》、监督检验药品质量的技术规范
《中国药典》的地位
1、回顾《中国药典》发展简况
第九版:2010年版,为一部、二部和三部,一部首次 配套编撰:《临床用药须知》(中药饮片卷),中药 饮片标准和药用辅料标准大幅增加,原有药典标准修 定完善覆盖面广。二部《药典注释》20年后第二版; 《中国药典》增补本:1)与现行药典具同样法律地位 。2)对本版药典拟收载的品种由于时间等因素。3) 没能收载的品种进行增补4)由于药品监管或技术发 展需要进行修订的 ;
放射药
总数
23
2139
0
268
23
1871
0
1448
0
77.4%
举例
2010年版与2005年版药典 主要项目收载情况比对表
增修订项目 2005年版 2010年版
红外光谱鉴别
有关物质 残留溶剂
原料
制剂 HPLC方法
530
2 142 24
580
95 707 97
渗透压摩尔浓度
溶出度或释放度
4
315
45
建立“增补本”形成机制提供依据,打
破了中国药典五年一轮回的惯性,增
强了药典形成的灵活性。
科研成果及时转化为增补本。
2010版《中国药典》的凡例总则
5、首次在药典中规范国家标准
明确“国家药品标准由凡例、正文、及其引用的 附录共同构成”:依法规定《中国药典》只是国 家药品标准之一。此规定解决了两个问题:一是 解决了“国家药品标准”与《中国药典》之间的 模糊关系,确立了《中国药典》在国家药品体系 中的核心地位。此处之“国家药品标准”已经超 越了《中国药典》并扩大到整个国家药品体系, “凡例”和“附录”特指《中国药典》之“凡例 ”“附录”;二是明确了国家药品标准由凡例、 正文、及其引用的附录“共同”组成,而不仅仅 是正文本身,任何脱离凡例和附录来谈药品标准 都是片面的。 药典标准与注册标准,标准正文与凡例附录
《中国药典》地位的新发展
新版药典使《中国药典》的地位进一步提升、扩 大、完善、增强:
2010版《中国药典》的凡例总则
总之, “凡例总则”浓缩了我国当今 药品标准编修 理念和理论的精华,其制 定和颁发使中国药典具备了统领国家 标准的功能与作用,成为国家标准的“ 标准”,并是我国国家药品标准体系真 正成为有机的联动的整体。
主要内容
1 3 2 3 4 5 3
《中国药典》发展与概况 10版《中国药典》概况
1、回顾《中国药典》发展简况
(新中国成立以后算起)
第一版:1953年版,中药、化药合为一部,以中药为 主; 第二版:1963年版,为突出中药标准地位将药典分为 一部、二部、一部为中药,二部为化药;一部除收载 品种大量增加外,为体现中药特色增收了炮制、性味 、功能与主治、用法与用量等内容;
1、回顾《中国药典》发展简况
2、国家药品标准体系
1、《中国药典》 2、部(局)颁标准: (1)新药转正标准(包括成册、散页的)
(2)注册标准
(3)进口注册标准
(4)中药保护标准
3、药典基本结构:
凡例 正文 附录 标准物质:
对照品、标准品、 对照药材、对照提取物
3、药典基本结构:
1、凡例 了解凡例非常重要,它是为正确使用《中 国药典》进行药品质量检定的基本原则,是对《中国 药典》正文、附录及与质量检定有关的共性问题的统 一规定。 凡例包含:总则、正文、附录、名称与编排、项目与 要求、监测方法和限度、对照品、对照品、标准品、 对照药材、对照提取物、计量、精确度、试药、试液 、指示剂、动物实验、说明书、包装、标签等,一、 二、三部内容略有不同。
有关物质 (HPLC梯度洗脱) 异常毒性 细菌内毒素 HPLC外标法
举例:二部各类化学品种的增修订情况
类别 化学药 抗生素 生化药 收载品 种 1581 346 189 新增品 种 174 63 31 保留上 修订品种/无样 版品种 品 1407 283 158 1043 / 306 261 / 15 144 / 24 修订幅 度 74.1% 92.2% 91.1%
主要内容
1 3 2 3 4 5 3
《中国药典》发展与概况 10版《中国药典》概况
10版凡例增修订情况
《中国药典》的地位
《中国药典》的作用
1、2010版药典编制的指导思想:
一是以科学发展观为统领,服务于资源节约型社会 、环境友好型社会的需求:落实科学监管理念、着力 解决发展中的问题。 二是与时俱进,广泛吸纳 先进技术与成果;坚持自主与创新;积极推进药品标 准化战略,提高我国药品标准总体水平,着力提升《 中国药典》在国际社会中的地位和作用,提高综合竞 争力,促进医药产业健康发展,为构建社会主义和谐 社会作出贡献。
1、回顾《中国药典》发展简况
第五版:1990年版,二部首次配套编撰《临床用药须 知》,指导临床合理用药。二部首次配套编撰《药典 注释》,对本版药典作进一步解释。同时编译该年版 《中国药典》英文版; 第六版:1995年版,仍然是一部和二部。同时编译《 中国药典》英文版。同时编译该年版《中国药典》英 文版。但未配套编撰《药典注释》;
第三版:1977年版,两部:一部为中药,二部为化药 ,一部发展较快,收载药材品种最多,显微鉴别方法 首次进入《中国药典》,尤其是粉末显微鉴别,在中 成药初步打破了“丸、散、膏、丹神仙难辨”的说法 ; 第四版:1985年版,自此每五年修订一次,逐步增加 收载附录要求与品种,仍然是一部和二部。本版开始 编译《中国药典》英文版;
414
含量均匀度
无菌检查方法
165
107
219
132
细菌内毒素
含量测定 HPLC法
216
359
372
694
主要内容
1 3 2 3 4 5 3
《中国药典》发展与概况 10版《中国药典》概况
10版凡例增修订情况
《中国药典》的地位
《中国药典》的作用
2010版《中国药典》的凡例总则
1、首次在凡例中设置总则一节
一部
二部 三部
98
137 140
14
15 18
47
