实验六细胞凋亡的形态和生化特征观察
细胞凋亡的显示 (实验)

实验项目名称细胞凋亡的显示一、实验目的1.了解细胞凋亡的形态学观察2.掌握荧光显微镜的使用方法二、实验原理1.细胞凋亡,是由基因编辑控制的细胞主动参与的自杀过程,是一种生理性调节机制。
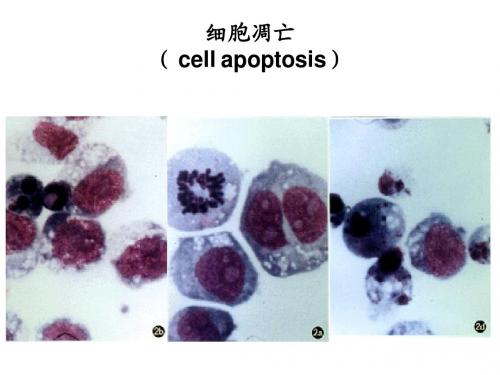
细胞发生凋亡时,在组织中是呈单个细胞发生;细胞体积浓缩:细胞器完整,细胞膜完好;细胞核浓缩、碎裂(染色质浓缩),有规律性的断裂成核碎片。
细胞凋亡过程中细胞核染色质的形态学改变分为三期:1期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;b期的细胞核裂解为碎块,产生凋亡小体。
2.顺铂等肿瘤化疗药物可以作为细胞凋亡诱导剂诱导细胞凋亡。
三、实验仪器与试剂1.材料:A549肺癌细胞2.仪器:荧光显微镜3.试剂:0.01mM PBS, 4%多聚甲醛,DAPI染料4.其它:盖玻片、载玻片、细胞培养板、移液枪、封口膜、烧杯、滤纸、滴管,吸水纸等。
四、实验步骤(一)荧光显微镜使用步骤○1将已处理好的样本放到载物台上○2将10X物镜转入光路,调节载物台纵横移动手轮,将标本移入光路○3调节滤光片转换器,选择3档UV光观察:○4调节粗条手轮,看清荧光图片轮廓后,再调节微调手轮调节,直至看到清晰的荧光图像。
○5推出摄影/目视切换杆,电脑拍照(二)观察细胞凋亡1. 盖玻片置于细胞培养皿中,二氧化碳培养箱培养A549肺癌细胞24h,形成细胞爬片;随后加入浓度为3ug/ml的顺铂培养24h,诱导细胞凋亡;2. 取出细胞培养皿,吸出培养基;3. PBS洗涤2次:加入2ml PBS,静置2min,吸出;重复操作一次;4. 加入2ml 37℃预温过的 4%多聚甲醛固定细胞10min;5. 在干净的封口膜中滴加20ul稀释好的DAPI,小心取出细胞爬片,细胞面向下避光孵育10min;6. PBS 洗涤2次:吸水纸吸干DAPI,在爬片一端用注射器加入PBS约0.1ml,吸水纸在爬片另一端吸出PBS(虹吸法);重复操作一次。
细胞凋亡的几种检测方法

细胞凋亡的几种检测方法一、形态学观察方法1、HE染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
2、丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
3、台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。
4、透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
二、DNA凝胶电泳(一)、检测原理细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
(二)结果判断正常活细胞DNA 电泳出现阶梯状(L ADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带。
三、酶联免疫吸附法(EL ISA)核小体测定凋亡细胞的DNA断裂使细胞质内出现核小体。
核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
(一)检测步骤1、将凋亡细胞裂解后高速离心,其上清液中含有核小体;2、在微定量板上吸附组蛋白体‟3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合…4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合‟4、加酶的底物,测光吸收制。
(二)用途该法敏感性高,可检测5*100/ml个凋亡细胞。
可用于人、大鼠、小鼠的凋亡检测。
该法不需要特殊仪器,适合基层工作,但是不能精确测定凋亡细胞发生的绝多对量。
细胞凋亡的几种检测方法

细胞凋亡的几种检测方法Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】细胞凋亡的几种检测方法1、形态学观察方法(1)HE(苏木精—伊红染色法)染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
(2)丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
(3)台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。
(4)透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
2、 DNA凝胶电泳细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
正常活细胞DNA 电泳出现阶梯状(LADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带3、酶联免疫吸附法(ELISA)核小体测定凋亡细胞的DNA断裂使细胞质内出现核小体。
核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
检测步骤1、将凋亡细胞裂解后高速离心,其上清液中含有核小体;2、在微定量板上吸附组蛋白体’3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合‘4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合’4、加酶的底物,测光吸收制。
用途该法敏感性高,可检测5*100/ml个凋亡细胞。
细胞凋亡
human prosurvival members (seven): Bcl-2, Bcl-xL, Bcl-w, Mcl-1, Bcl2l10, Bfl-1 and Bcl2l12 pro-apoptotic members (six): Bax, Bak, Bok, Bcl-G, Bcl-rambo and Bfk viral proteins (e.g. A52, K7) adopt a Bcl-2-like fold "BH3-only" subfamily (10): Bid, Bad, Bik, Bim, Bmf, Noxa, Puma, Hrk, Beclin1 and MULE.
BcL-2 family
Bc1-2(B cell lymphoma/leukemia-2,B细胞淋巴瘤 白血 ( 细胞淋巴瘤/白血 , 细胞淋巴瘤 是一种原癌基因, 在哺乳类中的同源物。 病-2) 是一种原癌基因,是ced-9在哺乳类中的同源物。和一 在哺乳类中的同源物 般的癌基因不同, 延长细胞的生存, 般的癌基因不同,Bc1-2延长细胞的生存,能抑制细胞凋亡, 延长细胞的生存 能抑制细胞凋亡, 而不是促进细胞的增殖 。 Bcl-2家族已发现 个成员,所有 家族已发现26个成员 家族成员均含有1 家族已发现 个成员,所有Bcl-2家族成员均含有 家族成员均含有 个或多个BH结构域 蛋白含有4个 结构域。 同源结构域, 个或多个 结构域。蛋白含有 个Bcl-2同源结构域,依次命 同源结构域 名为BHl、BH2、BH3和BH4。 名为 、 、 和 。 可分为3个亚族: 可分为 个亚族:Bcl-2亚家族 Bax亚家族 BH3亚家族 个亚族 亚家族, 亚家族, 亚家族 亚家族 亚家族
凋亡抑制( 凋亡抑制(apoptosis on)基因 )
细胞凋亡过程中细胞的形态学变化阶段

细胞凋亡过程中细胞的形态学变化阶段
细胞凋亡是一种程序性死亡方式,是维持机体内稳态的一种重要方式。
在细胞凋亡过程中,细胞会经历一系列形态学变化,这些变化可以分为几个阶段。
第一阶段:细胞收缩
在细胞凋亡的初期阶段,细胞会出现收缩的现象。
细胞体积减小,胞浆变得致密,细胞核也开始变得浓缩。
这种收缩是由于细胞内部发生了一系列的生化变化,导致细胞内部的骨架蛋白发生重组,细胞的结构逐渐改变。
第二阶段:细胞核凝集
随着凋亡的进行,细胞核会出现凝集的现象。
细胞核内的染色质开始凝聚成块状,核膜也开始破裂。
在这个阶段,细胞核的形态会发生明显的改变,呈现出不规则的形状,与正常的细胞核形态有明显区别。
第三阶段:细胞膜凹陷
在细胞凋亡的后期阶段,细胞膜会出现凹陷的现象。
细胞表面会形成凹陷或者泡状结构,最终导致细胞膜破裂。
这种凹陷的现象是由于细胞内部发生了一系列的酶促反应,导致细胞膜的脂质双层结构发生破坏。
第四阶段:细胞碎裂
在细胞凋亡的最终阶段,细胞会发生碎裂的现象。
细胞内部的成分会被分解成小片段,形成称为“凋亡小体”的结构。
这些小片段最终会被吞噬细胞摄取,完成整个凋亡过程。
细胞凋亡过程中的形态学变化阶段可以清晰地反映出细胞内部发生的生化变化。
通过对这些形态学变化的观察,科研人员可以更深入地了解细胞凋亡的机制,为相关疾病的治疗提供参考。
同时,对细胞凋亡过程的研究也有助于揭示机体内部细胞生存与死亡的平衡机制,为未来的生命科学研究提供重要的参考价值。
细胞凋亡检测细胞凋亡实验步骤检测方法

细胞凋亡检测,细胞凋亡实验步骤,检测方法一、定性和定量研究只定性的研究方法:常规琼脂糖凝胶电泳、脉冲场倒转琼脂糖凝胶电泳、形态学观察(普通光学显微镜、透射电镜、荧光显微镜)进行定量或半定量的研究方法:各种流式细胞仪方法、原位末端标记法、ELISA 定量琼脂糖凝胶电泳。
二、区分凋亡和坏死可将二者区分开的方法:琼脂糖凝胶电泳,形态学观察(透射电镜是是区分凋亡和坏死最可靠的方法),Hoechst33342/PI双染色法流式细胞仪检测,3) Telemerase Detection (端粒酶检测)3、生化检测:1)典型的生化特征:DNA 片段化2)检测方法主要有:琼脂糖凝胶电泳、原位末端标记(TUNEL)等3)TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记)4)通过DNA末端转移酶将带标记的dNTP (多为dUTP)间接或直接接到DNA 片段的3’-OH端,再通过酶联显色或荧光检测定量分析结果。
可做细胞悬液、福尔马林固定或石蜡处理的组织、细胞培养物等多种样本的检测。
4、LM-PCR Ladder (连接介导的PCR检测)当凋亡细胞比例较小以及检测样品量很少(如活体组织切片)时,直接琼脂糖电泳可能观察不到核DNA的变化。
通过LM-PCR,连上特异性接头,专一性地扩增梯度片段,从而灵敏地检测凋亡时产生梯度片段。
此外,LM-PCR 检测是半定量的,因此相同凋亡程度的不同样品可进行比较。
如果细胞量很少,还可在分离提纯DNA后,用32P-ATP和脱氧核糖核苷酸末端转移酶(TdT)使DNA标记,然后进行电泳和放射自显影,观察凋亡细胞中DNA ladder的形成。
上述两种方法都针对细胞凋亡晚期核DNA断裂这一特征,但细胞受到其它损伤(如机械损伤,紫外线等)也会产生这一现象,因此它对细胞凋亡的检测会受到其它原因的干扰。
需结合其它的方法来检测细胞凋亡。
)境,这可能导致了凋亡早期细胞线粒体膜电位的降低,从而使细胞色素C(三羧酸循环中的重要组分)从线粒体内转移到细胞液中,启动凋亡效应器caspase的级联反应。
细胞凋亡

细胞凋亡人体内的细胞注定是要死亡的,有些死亡是生理性的,有些死亡则是病理性的,有关细胞死亡过程的研究,成为生物学、医学研究的一个热点,至今,人们已经知道细胞的死亡有两种方式,即细胞坏死与细胞凋亡。
细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。
细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下,自体损伤的一种现象,而是为更好的适应生存环境而主动争取的一种死亡过程。
细胞凋亡的过程大致分为三个阶段,他们分别是(1)凋亡的起始:细胞皱缩,细胞链接消失,内质网膨胀,染色体固缩并沿着核膜分布,但细胞膜依然完整。
(2)凋亡小体的形成:核膜破裂,染色质断裂为大小不等的片段,与一些细胞器聚集后被内折的细胞膜包围,在细胞表面形成了许多泡状和芽状的突起,这些突起就叫做凋亡小体。
(3)细胞的解体:凋亡小体逐渐与细胞分离,脱落至细胞间质,最终被周围的细胞吞噬并消化。
细胞凋亡的生化特征主要有1.形态学变化:首先出现的是细胞体积缩小,连接消失,与周围的细胞脱离,然后是细胞质密度增加,线粒体膜电位消失,通透性改变,释放细胞色素C到胞浆,核质浓缩,核膜核仁破碎,DNA降解成为片段;胞膜有小泡状形成,胞膜结构完整,最终可将凋亡细胞遗骸分割包裹为几个凋亡小体,无内容物外溢,因此不引起周围的炎症反应,凋亡小体可迅速被周围专职或非专职吞噬细胞吞噬。
2.生物化学变化:(1)DNA 的片段化,细胞凋亡的一个显著特点是细胞染色体的DNA降解,这是一个较普遍的现象。
(2)大分子合成,细胞凋亡的生化改变不仅仅是DNA的有控降解,在细胞凋亡的过程中往往还有新的基因的表达和某些生物大分子的合成作为调控因子。
细胞凋亡的检测方法包括:一.形态学观察法1.HE染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
2.丫啶橙染色,荧光显微镜观察:细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
细胞凋亡实验报告

竭诚为您提供优质文档/双击可除细胞凋亡实验报告篇一:实验14细胞凋亡的诱导和检测实验14细胞凋亡的诱导和检测20世纪60年代人们注意到细胞存在着两种不同形式的死亡方式:凋亡(apoptosis)和坏死(necrosis)。
细胞坏死指病理情况下细胞的意外死亡,坏死过程细胞膜通透性增高,细胞肿胀,核碎裂,继而溶酶体、细胞膜破坏,细胞内容物溢出,细胞坏死常引起炎症反应。
细胞凋亡apoptosis一词来源于古希腊语,意思是花瓣或树叶凋落,意味着生命走到了尽头,细胞到了一定时期会像树叶那样自然死亡。
凋亡是细胞在一定生理或病理条件下遵守自身程序的主动死亡过程。
凋亡时细胞皱缩,表面微绒毛消失,染色质凝集并呈新月形或块状靠近核膜边缘,继而核裂解,由细胞膜包裹着核碎片或其他细胞器形成小球状凋亡小体凸出于细胞表面,最后凋亡小体脱落被吞噬细胞或邻周细胞吞噬。
凋亡过程中溶酶体及细胞膜保持完整,不引起炎症反应。
细胞凋亡时的生化变化特征是核酸内切酶被激活,染色体DnA被降解,断裂为50~300kb长的DnA片段,再进一步断裂成180~200bp整倍数的寡核苷酸片断,在琼脂糖凝胶电泳上呈现“梯状”电泳图谱(DnALadder)。
细胞凋亡在个体正常发育、紫稳态维持、免疫耐受形成、肿瘤监控和抵御各种外界因素干扰等方面都起着关键性的作用。
1.细胞凋亡的检测方法凋亡细胞具有一些列不同于坏死细胞的形态特征和生化特征,据此可以鉴别细胞的死亡形式。
细胞凋亡的机制十分复杂,一般采用多种方法综合加以判断,同时不同类型细胞的凋亡分析方法有所不同,方法选择依赖于具体的研究体系和研究目的(表?)。
表凋亡的检测方法(引自DL斯佩克特等,20XX)形态学观察方法:利用各种染色法可观察到凋亡细胞的各种形态学特征:(1)DApI时常用的一种与DnA结合的荧光染料。
借助于DApI染色,可以观察细胞核的形态变化。
(2)giemsa染色法可以观察到染色质固缩、趋边、凋亡小体形成等形态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验目的
• 1.掌握细胞凋亡的形态特征。 • 2.学会根据染色质的凝聚程度,是否形成凋
亡小体和细胞膜通透性变化,鉴别凋亡细胞, 坏死细胞及正常细胞。
实验原理
• 细胞死亡分为2种类型:程序性细胞死亡或称 细胞凋亡。凋亡细胞的膜保持完整性,但染 色质高度凝聚,有些凝聚块附着于核膜上,使 细胞和核的外形发生改变,并产生出大小不 同被膜包围的凋亡小体;正常细胞的膜保持 完整,且染色质较均匀分布;坏死细胞的膜损 伤,染色质凝聚程度远低于凋亡细胞。
• 3.加药后放入培养箱培养2.5h。
• 4.从1号培养瓶中取出178 µL细胞悬液加 到1号微量离心管中;从2号培养瓶中取出 178 µL细胞悬液加到2号微量离心管中。
• 5.向2个微量离心管中都加入两种荧光探 针:Ho33342储液加2 µL(终浓度为 10ug/mL);PI储液加20 µL(终浓度为 50ug/mL),混匀,37℃温箱中标记20-30min。
【实验报告】
• 根据观察,画出几种细胞典型图像。 【思考题】
• 总结凋亡细胞的形态特征 • 试述本实验鉴别凋亡细胞,坏死细胞和正常
细胞的原理。
二.培养细胞凋亡的生化特征观察
【实验目的】 1.了解凋亡细胞的生化特征 2.学会制作DNA ladder的一种方法
实验原理
• 由于大多数程序性死亡的细胞中,内源性核 酸内切酶活化,核DNA随机在核小体的连接 部位被打断,成为寡聚核小体,若对核DNA进 行琼脂糖凝胶电泳,可显示以180-200bp为 基数的DNA ladder特征;相比之下,正常细胞 的DNA不降解,电泳条带表现为一大分子片 段;坏死细胞的DNA虽然也存在降解,但由于 存在各种长度的DNA片段,无法形成梯状带 纹,表现为连续分布的弥散条带。
仪器、材料与试剂
• (一)仪器 微量加样器,恒温水浴锅,高速离心机,电泳仪 和电泳槽,暗箱式紫外透射仪,微量离心管,吸 头。
• (二)材料 • 体外培养细胞, • (三)试剂 • 酚,氯仿,TE(pH 8.0),抽提缓冲液,EDTA,蛋白
酶K,RNA酶,Tris-Cl,SDS。
实验步骤
一.提取细胞DNA
• 6.将2微量离心管1000r/min,离心5min,余 少量上清(约20 µL)悬液细胞(用手指弹微 量离心管底)。
• 7.从微量离心管1(对照组)取10 µL细胞悬 液,滴加到载玻片上,盖上盖玻片。从微量 离心管2取10 µL细胞悬液,滴加到载玻片 上,盖上盖玻片。两组各做2张片子,都作好 标记,保存于暗盒中。
• 9.3个培养瓶中余下的细胞,留做琼脂糖凝胶电泳 实验。
注意事项
• 荧光标记的细胞悬液滴片时,注意载玻片要洁净, 悬液量要充满于盖玻片下,但不要产生气泡,多余 的要有滤纸条从盖玻片边缘吸去,否则细胞将飘 浮运动,不易观察。
• 两种荧光探针的储液都分装在微量离心管中,20℃冻存,用前在室温下融化,荧光探针的储存和 标记都要保持在暗环境中。紫外光是强激发光, 极易漂白荧光。可在荧光观察前,先用透射光找 到细胞焦面,再关掉透射光照明,开启紫外光激发 样品。
1.将上面实验留下的3瓶细胞,按原实验分组的顺 序,分别作为(1)对照组;(2)加药组;(3)坏死组。
2.将3瓶细胞离心(1500r/min,5min)收集后分别移 入3个1.5mL微量离心管中,以下的步骤3个样品 同样操作。
3.用机械吹打法制成细胞悬液, 8000~10000 rpm离心收集细胞沉淀; 加入1mL抽提缓冲液 [10 m mol/L Tris-Cl (pH 8.0), 0.1 mol/L EDTA (pH 8.0), 0.5 % SDS], 轻轻摇匀,形成匀浆状;
实验步骤
• 1.在超净工作台中进行无菌操作。 实验前约24h, 接种3瓶培养细胞,每瓶含6mL培养基。在37℃,5 %CO2培养箱中培养。
• 2.当细胞密度达70-80%时(对数生长期),每瓶约 有106个细胞。用无菌离心管离心 (1000r/min,5min)收集细胞,弃上清,分别用6mL 培养基重悬细胞,用移液管轻轻将细胞悬液移回 原培养瓶中,分别进行处理:1号瓶(对照组)加入 PBS(pH7。4)6 µL;2号瓶(加药组)加入HT储液6 µL,使HT终浓度为1ug/mL;3号瓶不加任何试剂。
• 8.在荧光显微镜下,先用透射光观察,找到焦面后, 再用紫外光激发,40×荧光物镜观察。根据荧光 的颜色和细胞的形态进行记录,应看到对照组中 的细胞核质均匀,发蓝色荧光;加HT组分3种情况: 很多凋亡细胞出现染色质凝聚,边缘化,有凋亡小 体,发蓝色荧光;也有些正常细胞与对照组相同,还 有少量细胞为坏死细胞,发红色荧光。
ห้องสมุดไป่ตู้
7.移出水相,加入2倍体积乙醇使DNA形成沉 淀;然后用70 %乙醇洗涤DNA沉淀2次, 尽可能除去70 %乙醇;
8.用牙签将DNA沉淀从乙醇中移出,凉干; 9.加入500 µL TE (pH 8.0) 使DNA完全溶解;
加入RNA酶至终浓度50 µg/mL,37 ℃下 保温4 h。
4.将匀浆液转入5mL离心管中,加入 Proteinase K至终浓度100 µg/mL,50℃水 浴保温5~8h;直到细胞全部溶解,液体变 清亮为止;
5.加入等体积平衡酚,温和振荡,摇匀,置20 ℃ 5~10min; 10 000 rpm离心10 min, 将上层水相移至洁净的离心管中;
6.用酚:氯仿(1 : 1)抽提1次;然后用氯仿抽 提一次;
仪器、材料和试剂
• (一)仪器 荧光显微镜,CO2培养箱冰箱,超净工作台,倒置显微镜和离 心机等。
• (二)材料 • 体外培养细胞,微量加样器(1 µL-1mL),0。5mL和1。5mL
的微量离心管,20 µL。200 µL和1mL吸头,10mL培养瓶,载 玻片,盖玻片等。 • (三)试剂 • HT浓度为1mg/mL的针剂;荧光探针;用PBS(pH7。4)将PI 配成500ug/mL的储液,用蒸馏水将Ho。33342配成 1mg/mL的储液,2种储液都在-20℃冻存。
