高考化学一轮复习 排查落实练八 硫、氮及其化合物
高考化学一轮复习氮及其化合物 知识归纳总结及答案

高考化学一轮复习氮及其化合物 知识归纳总结及答案一、选择题1.如图所示,将相同条件下的m 体积NO 和n 体积O 2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留m2体积的气体,该气体与空气接触后立即变为红棕色。
则m 与n 的比值为( )A .3∶2B .2∶3C .8∶3D .3∶8【答案】C 【详解】在一定条件下,将m 体积NO 和n 体积O 2同时通入倒立于水中且盛满水的容器中内,充分反应, NO 和O 2全部溶于水时按照下列反应进行,化学方程式为:4NO + 3O 2+ 2H 2O = 4HNO 3,由于气体与空气接触后立即变为红棕色,所以容器内残留气体为NO ,那么与O 2反应的NO 气体为m-m 2=m2,NO 和O 2按照4:3混合溶于水恰好全部溶解所以mn 2: =4 :3,所以m :n=8:3; 故选C 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确C .①③正确D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。
2024届高考一轮化学复习(课件+练习)第4章 第10讲 硫及其重要化合物

①将SO2分别通入下列溶液中,把产生的现象与其体现的性质填入 下表空格中:
溶液 现象
石蕊 试液
加有酚酞 的氢氧化
钠溶液
KMnO4酸 性溶液
溴水
品红溶液
___变__红___ 红__色__褪__去__ __紫__红__色____ __溴__水__褪__色____ 品红__褪__色____ 褪去
(3)硫单质的化学性质
-2
S
氧――化→性S0
还―― 原→性+S4O2(从化合价角度认识硫单质的化学性质)
①与非金属反应
S_S_与+__HH_22_、=_=_△O=_=2_反=__H应_2_S的_。化学方程式为: _S_+__O_2_=_点=_=_燃=_=__S_O_2___(现象:氧气中明亮的__蓝__紫__色____火焰,空气中 微弱的___淡__蓝__色___火焰)。
④SO2 的还原性 2SO2+O2催△化剂2SO3 SO2+Cl2+2H2O===H2SO4+2HCl 5SO2+2MnO- 4 +2H2O===5SO24-+2Mn2++4H+ SO2+2Fe3++2H2O===2Fe2++SO24-+4H+
[微点拨] ①SO2使品红溶液褪色表现的是SO2的漂白性,加热后溶 液颜色复原;SO2使酸性高锰酸钾溶液、溴水、氯水、碘水褪色表现的 是SO2的还原性而不是漂白性,加热后溶液颜色不复原。
②SO2漂白原理:与某些有色物质生成不稳定的无色物质,其容易 分解而使有色物质恢复原来的颜色。适用于漂白纸浆、毛、丝等,SO2 不可漂白酸碱指示剂。
(3)SO2和CO2的鉴别方法 ①闻气味法:CO2无气味,SO2有刺激性气味。 ②品红溶液法:能使品红溶液褪色的是SO2,不能使品红溶液褪色 的是CO2。 ③酸性高锰酸钾或溴水法:使酸性高锰酸钾溶液或溴水褪色的是
高三化学一轮复习强化训练非金属硅硫氮及其化合物(含解析)

非金属硅、硫、氮及其化合物1.下列说法正确的是A.因为HF与SiO2反应,故用氢氟酸在玻璃器皿上刻蚀标记B.下列转化在一定条件下能够实现:SiO2SiCl4SiC.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物D.Si和SiO2都用于制造光导纤维【答案】A【解析】A 、HF与SiO2反应生成SiF4气体,会腐蚀玻璃,A 正确;B、SiO2与HCI不反应,B错误;C、SiO2只能与HF反应,不与其他酸反应,故不是两性氧化物,C错误;D、Si不能用于制造光导纤维,D错误。
故选A;2.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键个数之比为1∶2【答案】D【解析】二氧化硅晶体中,1个Si原子连接4个O原子,1个O原子连接2个Si原子,晶体中Si原子与Si—O键个数之比为1∶4。
3.如图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是A.SiO2属于两性氧化物B.盛放Na2CO3溶液的试剂瓶用玻璃塞C.硅胶吸水后可重复再生D.图中所示的转化都是氧化还原反应【解析】SiO 2是酸性氧化物,A 错误;Na 2CO 3溶液呈碱性,试剂瓶不能用玻璃塞,B 错误;题图中有的转化不是氧化还原反应,例如SiO 2与NaOH 溶液的反应,D 错误。
4.标准状况下,将3.36 L CO 2气体通入200 mL 1.00 mol ·L -1 NaOH 溶液中,充分反应后溶液中c (CO 32-)与c (HCO 3-)的比值为(不考虑CO 32-、HCO 3-的水解)A .1∶1B .1∶2C .2∶1D .1∶3 【答案】B【解析】设CO 32-、HCO 3-的物质的量分别为x 、y ,则有⎩⎪⎨⎪⎧ x +y =0.15 mol ,2x +y =0.2 mol ,解得x =0.05 mol ,y =0.1 mol 。
高中化学 一轮复习氮硫及其化合物

氮及其化合物【练习题】1.判断下列描述的正误(正确的打“√”,错误的打“×”)(1)用向上排空气法收集铜粉与稀硝酸反应产生的NO( )(2)密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A ( )(3)燃料的脱硫脱氮、SO 2的回收利用和NO x 的催化转化都是减少酸雨产生的措施( )(4)制取NO 2时,用水或NaOH 溶液吸收尾气( )(5)标准状况下,6.72 L NO 2与水充分反应转移的电子数目为0.1N A ( )(6)常温常压下,92 g 的NO 2和N 2O 4混合气体含有的原子数为6N A ( )(7)因为NH 4HCO 3受热易分解,故可用作氮肥( )(8)下列物质间的转化能够实现N 2――→H 2高温、高压、催化剂NH 3――→HCl (aq )NH 4Cl(aq) ( )(9) NH 4Cl 溶液与Ca(OH)2溶液混合的离子方程式为H ++OH -===H 2O( )(10)用生石灰与浓氨水制得的气体能使湿润的红色石蕊试纸变蓝,说明NH 3为碱性气体( )(11)检验溶液中是否含有NH +4:取少量试液于试管中,加入NaOH 溶液并加热,用湿润的红色石蕊试纸检验产生的气体( )(12)加热盛有NH 4Cl 的试管,试管底部有固体消失,试管口有晶体凝结,说明NH 4Cl 固体可以升华( )(13)实验室制取氨( ) (14)施肥时,草木灰(有效成分为K 2CO 3)不能与NH 4Cl 混合使用,是因为K 2CO 3与NH 4Cl 反应生成氨气会降低肥效( )(15)可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气( )(16)加热NH 4Cl 和Ca(OH)2混合物,并将产生的气体通入酚酞溶液中,酚酞溶液变成红色( )(17) 1 mol Fe 溶于过量硝酸,电子转移数为2N A ( )(18)将铜丝插入稀硝酸中:Cu +4H ++2NO -3===Cu 2++2NO 2↑+H 2O( )(19)将铁屑放入稀HNO 3中证明Fe 比H 2活泼( )(20)向稀HNO 3中滴加Na 2SO 3溶液:SO 2-3+2H +===SO 2↑+H 2O( )(21) SO 2和SO 3混合气体通入Ba(NO 3)2溶液可得到BaSO 3和BaSO 4( )(22)实验室里用锌粒与稀硝酸反应制取H 2( )(23)将可调高度的铜丝伸入稀HNO 3中,溶液变蓝,说明铜与稀HNO 3发生置换反应( )(24)稀硝酸可除去试管内壁的银镜( )2.如右图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。
高考化学一轮复习氮及其化合物知识归纳总结及答案

高考化学一轮复习氮及其化合物知识归纳总结及答案一、选择题1.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是()选项气体a b cA NH3浓氨水生石灰碱石灰B SO270%的浓H2SO4Na2SO3固体98%的浓H2SO4C NO稀HNO3铜屑H2OD NO2浓HNO3铜屑NaOH溶液A.A B.B C.C D.D【答案】B【详解】A. 因NH3的密度比空气的小,不能用图示装置收集,收集方法不合理,故A错误;B. Na2SO3与70%的浓硫酸反应生成SO2,SO2中混有的H2O用98%的浓H2SO4除去,收集装置合理,故B正确;C. NO与空气中的氧气反应,则不能用图示装置收集NO,应利用排水法收集,故C错误;D. NO2被NaOH溶液吸收,收集不到NO2,故D错误;故选B。
2.如图是产生和收集气体的实验装置示意图,该装置适合于()A.用浓硝酸和Cu制取NO2B.用H2O2溶液和MnO2制取O2C.用浓盐酸和MnO2制取Cl2D .用NH 4Cl 溶液和Ca(OH)2制取NH 3 【答案】B 【详解】A .二氧化氮会与水发生反应,不能用排水法收集,故A 不合适;B .分液漏斗中盛放双氧水,圆底烧瓶中为二氧化锰,二氧化锰可以催化双氧水分解产生氧气,氧气难溶于水,可以用排水法收集,故B 合适;C .浓盐酸和二氧化锰制取氯气需要在加热条件下反应,故C 不合适;D .氨气极易溶于水,不能用排水法收集,且氢氧化钙与溶于水时放出的热量较少,无法蒸出氨气,故D 不合适; 故答案为B 。
3.下列叙述与氮的固定无关的是 A .工业合成氨B .工业上将氨转化为硝酸和其他含氮化合物C .豆科植物的根瘤菌把空气中的氮气转化为含氮化合物D .电闪雷鸣的雨天,空气中的氮气会与氧气发生反应并最终转化为硝酸盐被植物吸收 【答案】B 【分析】氮的固定是指将空气中游离态的氮转化为含氮化合物的过程。
北京高考化学一轮复习专题八硫及其化合物课件

19
2.(2019江苏单科,3,2分)下列有关物质的性质与用途具有对应关系的是
()
A.NH4HCO3受热易分解,可用作化肥
B.稀硫酸具有酸性,可用于除去铁锈
C.SO2具有氧化性,可用于纸浆漂白
D.Al2O3具有两性,可用于电解冶炼铝
答案 B 本题涉及的考点是常见化合物的性质及其应用,通过性质与应用是否相符的判断,
。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论
是
。
答案 (1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(2)BaSO4 还原
(3)2NO+O2 2NO2
(4)①通N2一段时间,排除装置中的空气 饱和NaHSO3溶液
②甲:S
O
2 4
+Ba2+
()
答案 B 若要证明亚硫酸钠部分变质,须证明该样品中含有Na2SO3和Na2SO4,检验步骤:取少 量样品置于试管中溶解,滴入盐酸后有气泡冒出,继续滴加盐酸至无气泡冒出后,再滴入少量 BaCl2溶液,有白色沉淀产生,则证明Na2SO3部分变质。
2021/4/17
北京高考化学一轮复习专题八硫及其化 合物课件
2021/4/17
北京高考化学一轮复习专题八硫及其化 合物课件
3
2.(2019北京理综,28,16分)化学小组实验探究SO2与AgNO3溶液的反应。 (1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,
得到无色溶液A和白色沉淀B。
①浓H2SO4与Cu反应的化学方程式是
维、创新意识的价值观念。
第四章 排查落实练八 硫、氮及其化合物

;
排查落实练八 硫、氮及其化合物
⑨Cu 和稀 HNO3 的反应 3Cu+8H++2NO- 3 ===3Cu2++2NO↑+4H2O;
⑩Cu 和浓 HNO3 的反应 Cu+4H++2NO- 3 ===Cu2++2NO2↑+2H2O
⑪Fe 和过量稀 HNO3 的反应 Fe+4H++NO- 3 ===Fe3++NO↑+2H2O ;
答案 取样品,加入过量稀盐酸,产生有刺激性气味的气体,通 入品红溶液,品红溶液褪色;再加入 BaCl2 溶液,产生白色沉淀。 (2)检验 Na2SO4 中含有少量 NaCl 的实验操作及现象。 答案 取少量样品溶于水,加入过量的 Ba(NO3)2 溶液,静置, 取上层清液于试管中,再滴加 AgNO3 溶液,产生白色沉淀,证 明 Na2SO4 中含有少量 NaCl。
排查落实练八 硫、氮及其化合物
6.铜片和过量浓硝酸反应的现象 反应剧烈,有红棕色气体生 成,铜片消失,生成蓝色溶液 。
7.铜片和过量稀 HNO3 反应的现象 开始反应缓慢,铜片上有 少量气泡产生,随着反应的进行,反应速率加快,试管下端 产生无色气体,气体上升变成红棕色,最后铜片消失,生成 蓝色溶液 。
排查落实练八 硫、氮及其化合物
2.氮及其化合物 (1)知识网络构建
排查落实练八 硫、氮及其化合物
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①N2 和 H2 的反应
N2+3H2
高温、高压 催化剂
2NH3
;
②把 NH3 通入水中 NH3+H2O NH3·H2O
NH+ 4 +OH- ;
(2)重要反应必练 写出下列反应的方程式,是离子反应的写离子方程式。 ①S 溶于热的烧碱溶液生成两种钠盐 3S+6OH-==△===2S2-+SO23-+3H2O ; ②把 H2S 气体通入 CuSO4 溶液中 H2S+Cu2+===CuS↓+2H+ ; ③Na2S 溶液在空气中放置变浑浊 2S2-+O2+2H2O===2S↓+4OH-; ④铜丝在硫蒸气中燃烧 2Cu+S=点==燃==Cu2S ;
2024年高考化学一轮总复习氮及其重要化合物作业含解析新人教版
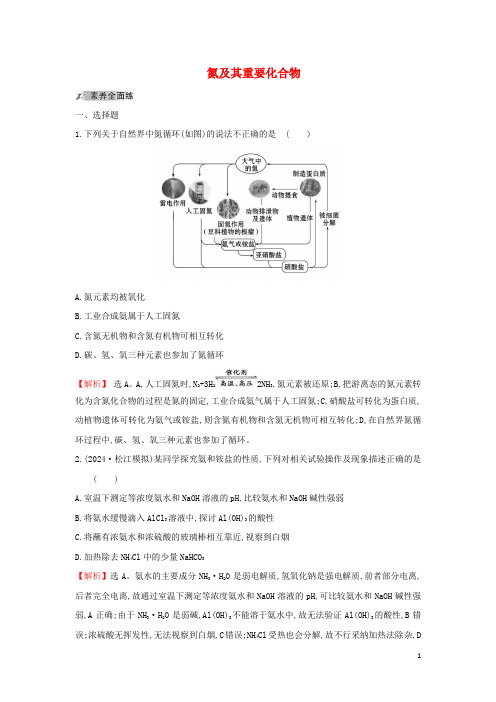
氮及其重要化合物一、选择题1.下列关于自然界中氮循环(如图)的说法不正确的是( )A.氮元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物和含氮有机物可相互转化D.碳、氢、氧三种元素也参加了氮循环【解析】选A。
A,人工固氮时,N2+3H22NH3,氮元素被还原;B,把游离态的氮元素转化为含氮化合物的过程是氮的固定,工业合成氨气属于人工固氮;C,硝酸盐可转化为蛋白质,动植物遗体可转化为氨气或铵盐,则含氮有机物和含氮无机物可相互转化;D,在自然界氮循环过程中,碳、氢、氧三种元素也参加了循环。
2.(2024·松江模拟)某同学探究氨和铵盐的性质,下列对相关试验操作及现象描述正确的是( )A.室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱B.将氨水缓慢滴入AlCl3溶液中,探讨Al(OH)3的酸性C.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,视察到白烟D.加热除去NH4Cl中的少量NaHCO3【解析】选A。
氨水的主要成分NH3·H2O是弱电解质,氢氧化钠是强电解质,前者部分电离,后者完全电离,故通过室温下测定等浓度氨水和NaOH溶液的pH,可比较氨水和NaOH碱性强弱,A正确;由于NH3·H2O是弱碱,Al(OH)3不能溶于氨水中,故无法验证Al(OH)3的酸性,B错误;浓硫酸无挥发性,无法视察到白烟,C错误;NH4Cl受热也会分解,故不行采纳加热法除杂,D错误。
3.某试验过程如图所示,则图中③试管的现象是( )A.无明显现象,因稀硫酸不与铜反应B.铜片溶解,产生无色气体,该气体遇到空气不变色C.铜片溶解,放出红棕色有刺激性气味的气体D.铜片溶解,产生无色气体,该气体在试管口变为红棕色【解析】选D。
生成的Cu(NO3)2在H2SO4的酸性条件下相当于又有了HNO3,铜片会接着溶解生成NO。
4.(2024·黄冈模拟)向盛有100 mL HNO3溶液的烧杯中加入肯定量的Cu、Al合金(还原产物为NO),充分反应后向溶液中加入1 mol·L-1的NaOH溶液,产生沉淀的质量与所加溶液的体积的关系如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.加热盛有NH4Cl固体的试管,现象 NH4Cl固体分解生成 气体,在试管口又生成白色晶体 。 5.无色试剂瓶内的浓HNO3受日光照射,其现象为 瓶中上 部空间部分呈棕色,硝酸显黄色 。 6.铜片和过量浓硝酸反应的现象反应剧烈,有红棕色气体 生成,铜片消失,生成蓝色溶液 。
2.浓硫酸为什么不能干燥NH3、H2S、HBr、HI等气体? 答案 浓硫酸具有酸性和强氧化性,吸收NH3生成 (NH4)2SO4或NH4HSO4,能把H2S、HBr、HI氧化成单质。 3.SO2的水溶液和Cl2的水溶液均能使品红溶液褪色,将SO2 和Cl2按1∶1体积比(同温同压)混合后通入品红溶液中,品 红溶液不褪色,其原因是___S_O_2_+__C_l_2_+__2_H_2_O_=_=_=_2_H__C_l_+___ _H__2S_O__4,__H__C_l_、__H_2_S_O_4_均__不__具__有__漂__白__性___。
7.铜片和过量稀HNO3反应的现象 开始反应缓慢,铜片上 有少量气泡产生,随着反应的进行,反应速率加快,试管
下端产生无色气体,气体上升变成红棕色,最后铜片消失,
生成蓝色溶液 。 8.把SO2气体通入到FeCl3溶液的现象溶液由棕黄色变成浅 绿色 。
9.将两支蘸有浓盐酸和浓氨水的玻璃棒相互靠近有大量白 烟产生 。 10.将浓硫酸滴到蓝矾晶体上,现象蓝矾晶体上出现白斑 。
⑧物质的量之比为1∶1的NO和NO2混合气体恰好被烧碱溶液 吸收生成一种钠盐 NO+NO2+2OH-===2NO- 2 +H2O ;
⑨Cu和稀HNO3的反应 3Cu+8H++2NO- 3 ===3Cu2++2NO↑+4H2O ;
⑩Cu和浓HNO3的反应 Cu+4H++2NO3-===Cu2++2NO2↑+2H2O ;
;
⑤NH4HCO3溶液中加入过量稀NaOH溶液 NH+ 4 +HCO- 3 +2OH-===NH3·H2O+CO23-+H2O ;
⑥NO2溶于水 3NO2+H2O===2H++2NO- 3 +NO ; ⑦NO2被烧碱溶液吸收生成两种钠盐 2NO2+2OH-===NO- 3 +NO- 2 +H2O ;
⑪Fe和过量稀HNO3的反应 Fe+4H++NO- 3 ===Fe3++NO↑+2H2O ;
⑫C和浓HNO3的反应 C+4H++4NO- 3 ==△===CO2↑+4NO2↑+2H2O ;
⑬浓硝酸见光分解(化学方程式)
4HNO3(浓)=光==照==4NO2↑+O2↑+2H2O
。
二、值得强化记忆的实验现象
排查落实练八 硫、氮及其化合物
一、重要方程式的书写 二、值得强化记忆的实验现象 三、简答类语言规范再落实
一、重要方程式的书写
1.硫及其化合物 (1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①S溶于热的烧碱溶液生成两种钠盐 3S+6OH-==△===2S2-+SO23-+3H2O ;
三、简答类语言规范再落实
1.离子检验 (1)检验Na2SO3样品部分被氧化的实验操作及现象。 答案 取样品,加入过量稀盐酸,产生有刺激性气味的气体, 通入品红溶液,品红溶液褪色;再加入BaCl2溶液,产生白 色沉淀。
(2)检验Na2SO4中含有少量NaCl的实验操作及现象。 答案 取少量样品溶于水,加入过量的Ba(NO3)2溶液,静置, 取上层清液于试管中,再滴加AgNO3溶液,产生白色沉淀, 证明Na2SO4中含有少量NaCl。
⑪C和浓硫酸反应 C+2H2SO4(浓)==△===CO2↑+2SO2↑+2H2O ;
⑫把浓H2SO4滴到Na2SO3固体上 H2SO4(浓)+Na2SO3===Na2SO4+H2O+SO2↑。
2.氮及其化合物 (1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
②把H2S气体通入CuSO4溶液中 H2S+Cu2+===CuS↓+2H+ ;
③Na2S溶液在空气中放置变浑浊 2S2-+O2+2H2O===2S↓+4OH- ;
④铜丝在硫蒸气中燃烧
2Cu+S
点燃 =====Cu2S
;
⑤将SO2气体通入到氢硫酸中 SO2+2H2S===3S↓+2H2O ;
⑥把H2S气体通入到FeCl3溶液中 H2S+2Fe3+===S↓+2Fe2++2H+ ;
⑦SO2通入足量的澄清石灰水 SO2+Ca2++2OH-===CaSO3↓+H2O;
⑧SO2通入溴水中,使溴水褪色 SO2+Br2+2H2O===SO24-+2Br-+4H+ ;
⑨用足量氨水吸收SO2尾气 2NH3·H2O+SO2===2NH+ 4 +SO23-+H2O ;
⑩Cu和浓硫酸的反应 Cu+2H2SO4(浓)==△===CuSO4+SO2↑+2H2O;
(3)NH
+
4
的检验
试剂及用品:_N__aO__H_溶__液__、__湿__润__的__红__色__石__蕊__试__纸____ 。
操作及现象:_向__所__取__试__液__中__加__入__浓__N_a_O__H_溶__液__,__加__热__,____ _把__湿__润__的__红__色__石__蕊__试__纸__放__在__试__管__口__,__若__试__纸__变__蓝__,__说__明__有__ _N_H_3_生__成__,__证__明__原__溶__液__含__有__N__H__+4_。
①NN2+2和3HH22的高反温 催应化 、剂高压 2NH3 ;
②把NH3通入水中 NH3+H2O NH3·H2O
Байду номын сангаас
NH+ 4 +OH-;
③实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3 2NH4Cl+Ca(OH)2==△===2NH3↑+2H2O+CaCl2 ;
④4NNHH3+3的5催O2化=催=氧=△ 化=化剂==4NO+6H2O
