酶的专一性
生物酶解技术原理

生物酶解技术原理引言:生物酶解技术是一种利用生物酶来加速化学反应的技术,广泛应用于生物工程、医药、食品加工、环境保护等领域。
本文将从生物酶解的基本原理、酶的特性、酶的作用机制以及酶解技术的应用等方面进行探讨。
一、生物酶解的基本原理生物酶解是指利用生物酶对底物进行分子水解或转化的过程。
生物酶是一类具有高度专一性和高效催化活性的蛋白质,能够在温和条件下催化化学反应。
它们通过与底物结合形成酶底物复合物,并在底物分子中引入特定的化学变化,从而将底物转化为产物。
二、酶的特性1. 酶的专一性:每种酶只能催化特定的底物反应,具有高度的专一性。
这种专一性是由于酶与底物之间的特定的空间结构和化学键相互作用所决定的。
2. 酶的催化效率:酶能够在较低的温度和压力下催化底物反应,具有高效的催化效率。
酶催化的速度常常比非酶催化的速度快上几个数量级。
3. 酶的可逆性:酶催化的反应通常是可逆的,酶可以在催化反应后恢复到其原始状态,从而参与下一轮的催化反应。
4. 酶的特异性:酶对于底物的特异性是由于酶活性中心与底物分子的亲和力所决定的。
酶活性中心的氨基酸残基与底物分子形成氢键、离子键或范德华力等相互作用,从而实现催化作用。
三、酶的作用机制酶催化作用的机制通常可以分为两类:酸碱催化和亲合催化。
酸碱催化是指酶通过给予或接受质子来改变底物的化学性质,从而促进反应进行。
亲合催化是指酶通过与底物分子结合形成酶底物复合物,通过改变底物分子的构象和电子分布来促进反应进行。
四、酶解技术的应用生物酶解技术在多个领域有着广泛的应用。
以下是一些典型的应用案例:1. 食品加工:生物酶解技术可以用于食品加工中的面包、啤酒、奶酪等产品的生产过程中。
通过选择合适的酶,可以改善产品的质地、口感和营养价值。
2. 医药领域:生物酶解技术可以用于药物的合成和制备。
酶可以催化特定的化学反应,从而合成具有特定活性的药物分子。
3. 环境保护:生物酶解技术可以用于废水处理和土壤修复。
《酶具有高效性和专一性等特点》 讲义

《酶具有高效性和专一性等特点》讲义一、酶的定义和作用在我们生活的这个世界里,无论是生物体内的各种化学反应,还是工业生产中的许多过程,都离不开一种神奇的物质——酶。
那什么是酶呢?酶是由活细胞产生的、对其底物具有高度特异性和高度催化效能的蛋白质或 RNA。
酶的作用极其重要。
它就像是生物体内的“小工人”,兢兢业业地推动着各种化学反应的进行。
如果没有酶的参与,很多生命活动根本无法正常进行。
比如说,我们吃进去的食物,要经过一系列复杂的化学变化才能被身体吸收和利用,而这其中就有很多酶在发挥作用。
二、酶的高效性酶的高效性是其最为显著的特点之一。
想象一下,在一个化学实验室里,要让一个化学反应快速、高效地进行,可能需要高温、高压等极端条件,还需要大量的化学试剂。
但在生物体内,酶能够在温和的条件下(比如常温、常压和接近中性的 pH 值),以惊人的速度催化化学反应。
举个例子,过氧化氢酶能够快速分解过氧化氢,使其转化为水和氧气。
在没有酶的情况下,这个反应进行得非常缓慢,但有了过氧化氢酶的参与,反应速度可以提高数百万倍甚至数十亿倍。
酶之所以具有如此高的催化效率,主要有以下几个原因。
首先,酶能够降低反应的活化能。
活化能就像是化学反应中的一道“门槛”,只有跨越了这个门槛,反应才能发生。
酶通过与底物结合,形成一种过渡态复合物,从而降低了活化能,使反应更容易进行。
其次,酶的活性中心具有特殊的结构和化学性质,能够与底物紧密结合,并为反应提供一个有利的微环境。
此外,酶还能够通过多种方式对反应进行协同催化,进一步提高反应速度。
三、酶的专一性酶的专一性也是其非常重要的特点之一。
简单来说,一种酶通常只能催化一种或一类特定的化学反应。
就好像一把钥匙只能开一把特定的锁一样,酶对底物具有高度的选择性。
例如,淀粉酶只能催化淀粉的水解,而不能催化纤维素的水解;蛋白酶只能作用于蛋白质,而对脂肪毫无作用。
这种专一性使得酶能够精准地控制生物体内的化学反应,确保各种代谢过程有条不紊地进行。
酶的专一性实验报告

酶的专一性实验报告篇一:实验酶的活性及专一性测定实验七酶的活性及专一性测定一、实验目的通过本实验,了解酶的活性测定方法及其对底物催化的专一性。
二、实验原理唾液淀粉酶能专一的催化淀粉水解,生成一系列水解产物,即糊精、麦芽糖、葡萄糖等。
麦芽糖或葡萄糖都属于还原糖,能使班氏试剂中的二价铜离子还原成亚铜,并生成砖红色的氧化亚铜。
淀粉酶不能催化蔗糖水解,且蔗糖本身不是还原糖,所以不能与班氏试剂作用呈色,以此证明酶催化底物的专一性。
三、器材及试剂1. 器材:试管、试管夹、样品杯、滴瓶、温度计、恒温水浴锅,冰箱等。
2. 试剂:(1)0.5%淀粉溶液(含0.3%NaCl):称取可溶性淀粉0.5g,加5ml蒸馏水调成糊状,徐徐倒入80ml煮沸的蒸馏水中,不断搅拌,待其溶解后,加0.3gNaCl,加蒸馏水至100ml。
此液应新鲜配制,防止细菌污染。
(2)2%蔗糖溶液:称2g蔗糖,加蒸馏水至100ml溶解。
(3)班氏试剂:溶解结晶硫酸铜17.3g于100ml热的蒸馏水中,冷却后加水至150ml为A液。
取柠檬酸钠173g和无水碳酸钠100g,加蒸馏水600ml ,加热溶解,冷却后加水至850ml为B液。
将A液缓慢倒入B液中,混合即可。
(4)稀释唾液:用清水漱口,清除食物残渣。
再含蒸馏水15ml作咀嚼运动,2分钟后将稀释唾液收集于样品杯中备用。
(5)碘-碘化钾溶液:四、实验方法1. 唾液淀粉酶的活性测定唾液的稀释:取10支试管,分别编上号1-6,取1ml唾液加入1号试管,加水稀释10倍后从中取出1ml加入2号试管,依次梯度稀释。
各取上述稀释的唾液各1ml,分别加入相应编号的试管里,然后向6支试管内同时加入1ml的0.5,的淀粉溶液,振荡混匀后放入37? 恒温水浴中,10分钟后取出,滴加2滴碘液,振荡混匀,观察颜色,选取颜色变化适中的一支,记录稀释倍数,计算酶的活性,用于后续实验。
2. 淀粉酶的专一性取3个试管,分别编号,按下表操作,记录实验现象。
酶的专一性实验分析各试管颜色变化原因

酶的专一性实验分析各试管颜色变化原因为了研究酶的专一性,可以进行专一性实验。
在实验中,选择一种特定的底物和一种酶,并观察试管中的颜色变化。
根据颜色变化可以初步判断酶对于该底物的催化效果,从而分析酶的专一性。
在专一性实验中,试管中发生颜色变化的原因主要有以下几种:1.酶催化反应导致底物的结构改变:底物在酶催化下经历一系列的化学反应,可能发生结构改变,从而导致颜色的变化。
例如,在酶催化下,一些底物会氧化还原反应,形成带有颜色的产物。
2.酶本身具有色素:有些酶本身就含有色素,因此与底物发生反应后,试管中的颜色会发生变化。
这种情况下,颜色的变化与底物的反应无关,而是由于酶本身的色素导致的。
3.酶的活性变化导致底物的反应速率变化:一些酶在特定条件下对不同底物的催化效果有差异。
因此,试管中的颜色变化可能是由于酶的活性变化导致底物的反应速率变化而引起的。
4.试剂或环境条件的改变引起的反应:有些试剂或环境条件的改变可以影响酶与底物的相互作用,从而导致试管中颜色的变化。
例如,pH、温度、离子浓度等的变化都可以影响酶催化反应的进行。
需要注意的是,试管中颜色的变化只是初步判断酶的专一性的一种方法,不能作为唯一的依据。
为了更加准确地判断酶的专一性,还需要结合其他实验数据和分析方法,如酶动力学研究、分子生物学技术等。
总之,酶的专一性实验中试管中颜色的变化主要是由于酶催化反应导致底物的结构改变、酶本身具有色素、酶的活性变化导致底物的反应速率变化以及试剂或环境条件的改变引起的反应等原因。
这些变化可以帮助我们初步判断酶对于底物的选择性,进一步分析酶的专一性以及酶催化机理的研究。
酶 答案

第四章 酶一、名词解释1.酶:是生物体内一类具有催化活性和特定空间构象的生物大分子,包括蛋白质和核酸。
2.酶的专一性:一种酶只作用于一类化合物或一定的化学键,以促进一定的化学变化,生成一定的产物。
这种现象称为酶的专一性或称酶的特异性。
3.酶的活性中心:或称活性部位。
指酶分子中直接和底物结合,并和酶催化作用直接有关的部位。
4.2.抗体酶(abzyme ):是一种具有催化能力的蛋白质,其本质上是免疫球蛋白,但是在易变区被赋予了酶的属性,所以又称为“催化型抗体”。
5.米氏方程:6.激活剂:使酶活性增加的物质称为激活剂。
7.酶活力:也称为酶活性,是指酶催化一定化学反应的能力。
8.米氏常数Km :酶的特征常数,其含义是酶促反应速度为最大反应速度一半时的底物浓度。
9.可逆抑制作用:抑制剂常以非共价键与酶可逆结合,使酶活性降低或丧失。
可以用透析或超滤等物理方法去除,这种抑制作用称可逆抑制作用。
10.不可逆抑制作用:抑制剂常以共价键与酶活性中心上的必需基团相结合,抑制剂与酶的结合牢固不能用透析或超滤等物理方法去除,这种抑制作用称不可逆抑制作用。
11.变构酶:除具有酶的活性中心外,还具有与调节物结合的调节中心的寡聚酶称为变构酶。
12.同工酶:指催化相同化学反应,而酶蛋白的分子结构、理化性质不同的一组酶。
13.单体酶:只有一条多肽链的酶。
14.寡聚酶:由几条或几十条相同或不同的多肽链亚基以非共价键结合的酶。
15.多酶复合体:由几种功能相关的酶彼此嵌合形成复合体。
16.核酶:化学本质为RNA 的酶。
17.酶的活力单位:单位时间内转化单位物质的量的底物所需要的酶量。
18.比活力:指每单位质量样品中的酶活力。
19. 诱导酶(inducenzyme )是细胞内在正常状态下一类很少存在或没有的酶,当细胞中因加入了诱导物后而被诱导产生的酶,它的含量在诱导物存在下显著增高,这种诱导物往往是该酶底物的类似物或底物本身。
20. 全酶;即蛋白质部分和非蛋白质部分(辅助因子)。
酶的特异性(专一性)及影响酶活性的因素

酶的特异性(专一性)及影响酶活性的因素实验目的1.掌握检查酶特异性的方法和原理。
2.了解温度对酶活性的影响。
3.了解激活剂、抑制剂对酶活力的影响。
实验原理1.酶的专一性酶是生物体中一种具有催化功能的特殊蛋白质(传统酶的概念),也常称为生物催化剂。
它与一般催化剂的最主要区别就是具有高度的特异性,即专一性。
根据各种酶对底物的选择程度不同,可分为绝对专一性、相对专一性、立体异构专一性,。
例如唾液淀粉酶属于相对专一性酶,它只能随机作用于淀粉链内部的a——1,4糖苷键,使其分子迅速断裂成较短的链,称为糊精,糊精分子量递减,淀粉——大分子糊精——中分子糊精——小分子糊精——简单分子糊精——麦芽糖和a——糊精(含a——1,6糖苷键的短链聚糖,平均分子量为8个残基)。
由于淀粉酶催化所形成的产物都是还原糖,故可用灵敏度较高的Benedict试剂检测和观察。
2.温度对酶促反应速度的影响酶的催化作用受温度的影响很大,与一般化学反应一样,提高温度可以增加酶促反应的速度,通常温度每升高10℃,反应速度加快一倍左右。
另一方面酶是一种蛋白质,温度过高可引起蛋白质变性,导致酶的失活。
因此,反应速度达到最大值以后,随着温度的升高,反应速度反而逐渐下降,以至完全停止反应。
反应速度达到最大值时的温度称为酶作用的最适温度。
大多数动物酶的最适温度为37—40℃,植物酶的最适温度为50—60℃。
但一种酶的最适温度不是完全固定的,它与作用的时间称短有关,反应时间增长时,最适温度向数值较低的方向移动。
最适温度不是酶的特征性物理常数。
酶对温度的稳定性与其存在形式有关。
大多数酶在干燥的固体状态与比较稳定,能在室温下保存数月至一年,溶液中的酶,易被微生物污染,常难长期保存,在高温的情况与,如100℃即可失活。
低温降低或抑制酶的活性,但不能使酶失活。
3.激活剂和抑制剂对酶活力的影响酶的活性常受某些物质的影响,有些物质能增加酶的活性,称为酶的激活剂;另一些物质则会降低酶的活性,称为酶的抑制剂。
第三节酶的专一性

1、结构专一性概念酶对所催化的分子底物Substrate化学结构的特殊要求和选择。
类别绝对专一性和相对专一性绝对专一性有的酶对底物的化学结构要求非常严格一种一种EE只能催化一种只能催化一种S S 脲酶催化脲酶催化尿素水解为尿素水解为氨和水氨和水。
相对专一性有的酶对底物的化学结构要求比上述绝对专一性略低一些一种一种EE能催化一能催化一类类S S 一种化学键一种化学键//水解酶类。
水解酶类。
1键专一性有的酶只作用于一定的键而对键两端的基团并无严格要求脂肪酶、磷酸酯酶等。
2基团专一性另一些酶除要求作用于一定的键以外对键两端的基团还有一定要求往往是对其中一个基团要求严格对另一个基团则要求不严格。
消化道内几种蛋白酶的专一性芳香赖、精碱性丙、甘、短脂肪链胰凝乳蛋白酶胃蛋白酶弹性蛋白酶羧肽酶胰蛋白酶氨肽酶羧肽酶芳香消化道蛋白酶作用的专一性2、立体异构专一性概念酶除了对底物分子的化学结构有要求外对其立体异构也有一定的要求。
类别旋光异构专一性L-氨基酸氧化酶只催化L-氨基酸氧化对D-氨基酸无作用几何异构专一性组HOCH3COOH组CH3OHL-乳酸D乳酸与LDH契合不能在LDH中的三点结合精精L-乳酸脱氢酶的催化作用特异性立体异构专一性只能催化一种立体异构体进行反应。
如L-乳酸脱氢酶作用于L-乳酸延胡索酸酶作用于反式的丁烯二酸CH3CCOOHOCH3CCOOHHO H NAD NADH HLDHCOOHCH2CH2COOHHOOCCOOHCCHH FAD FADH2SDH条件温和常温、常压、pH≈7高效率降低活化能专一性特异性底物、反应、产物特异??绝对专一作用于一种底物催化一个反应??相对专一作用于结构相近的一类底物键专一/基团专一??立体异构专一作用于某一种立体构型旋光异构/几何异构敏感性受各种因素的影响易失活可调性环境调节酶结构、数量、位置调节酶促反应的特点Binding site??酶分子中与底物结合的部位或区域一般称为结合部位1-多个氨基酸残基。
实验一酶的专一性实验
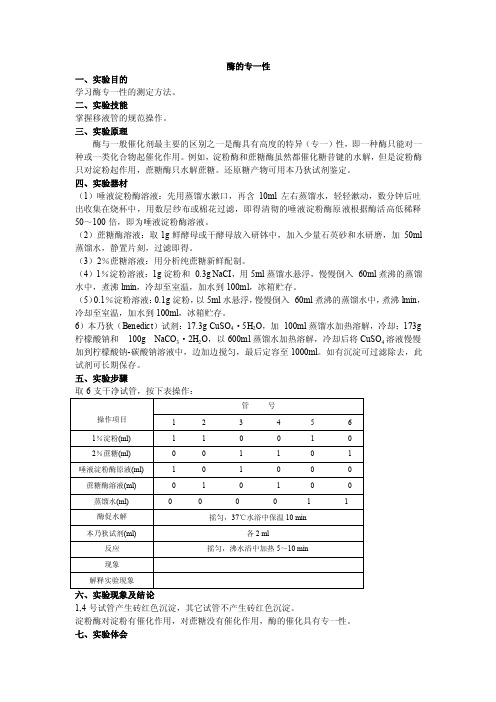
酶的专一性一、实验目的学习酶专一性的测定方法。
二、实验技能掌握移液管的规范操作。
三、实验原理酶与一般催化剂最主要的区别之一是酶具有高度的特异(专一)性,即一种酶只能对一种或一类化合物起催化作用。
例如,淀粉酶和蔗糖酶虽然都催化糖昔键的水解,但是淀粉酶只对淀粉起作用,蔗糖酶只水解蔗糖。
还原糖产物可用本乃狄试剂鉴定。
四、实验器材(1)唾液淀粉酶溶液:先用蒸馏水漱口,再含10ml左右蒸馏水,轻轻漱动,数分钟后吐出收集在烧杯中,用数层纱布或棉花过滤,即得清彻的唾液淀粉酶原液根据酶活高低稀释50~100倍,即为唾液淀粉酶溶液。
(2)蔗糖酶溶液:取1g鲜酵母或干酵母放入研钵中,加入少量石英砂和水研磨,加50ml 蒸馏水,静置片刻,过滤即得。
(3)2%蔗糖溶液:用分析纯蔗糖新鲜配制。
(4)1%淀粉溶液:1g淀粉和0.3g NaCI,用5ml蒸馏水悬浮,慢慢倒入60ml煮沸的蒸馏水中,煮沸lmin,冷却至室温,加水到100ml,冰箱贮存。
(5)0.1%淀粉溶液:0.1g淀粉,以5ml水悬浮,慢慢倒入60ml煮沸的蒸馏水中,煮沸lmin,冷却至室温,加水到100ml,冰箱贮存。
6)本乃狄(Benedict)试剂:17.3g CuSO4·5H2O,加100ml蒸馏水加热溶解,冷却;173g 柠檬酸钠和100g NaCO3·2H2O,以600ml蒸馏水加热溶解,冷却后将CuSO4溶液慢慢加到柠檬酸钠-碳酸钠溶液中,边加边搅匀,最后定容至1000ml。
如有沉淀可过滤除去,此试剂可长期保存。
五、实验步骤取6支干净试管,按下表操作:1,4号试管产生砖红色沉淀,其它试管不产生砖红色沉淀。
淀粉酶对淀粉有催化作用,对蔗糖没有催化作用,酶的催化具有专一性。
七、实验体会。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应专一性
一 酶对底物的专一性
立体专一性
当底物存在2种立体异构时, 酶只能作用于其中的一种。
eg:胰蛋白酶
二 关于酶专一性的假说
1.锁和钥匙学说 2.诱导契合学说
3.三点附着学说
二 关于酶专一性的假说
1.锁和钥匙学说
酶和底物结合时,底 物的结构和酶的活动中心 的结构十分吻合,就好像 一把钥匙配一把锁一样。 酶的这种互补形状,使酶 只能与对应的化合物契合 ,从而排斥了那些形状、 大小不适合的化合物,这 就是“锁钥学说”,是“ 诱导契合”学说的前身。
二 关于酶专一性的假说
2.诱导契合学说
“诱导契合”学说指出, 酶并不是事先就以一种与 底物互补的形状存在,而 是在受到诱导之后才形成 互补的形状。底物一旦结 合上去,就能诱导酶蛋白 的构像发生相应的变化, 从而使酶和底物契合而形 成酶-底物络合物,并引
起底物发生反应。
二 关于酶专一性的假说
3.三点附着学说
酶的立体专一性,酶 只能对那些至少有三 个结合点都是互相匹 配的底物才能发生催
化。
酶的专一性
1.酶对底物的专一性 2.关于酶专一性的假说
一 酶对底物的专一性
酶的专一 性
结构专一性 立体专一性
一 酶对底物的专一性
结构专一性
酶对底物的结构要求。 通常一种酶只能催化一种特定的底物进行特 定的反应
eg:脲酶,麦芽糖酶。(高) 己糖激酶,蛋白水解酶,脂肪水解酶(低)
