离子共存原则
离子共存问题规律总结

离子共存问题规律总结引言离子共存是指两种或多种离子在同一溶液中同时存在的现象。
在化学和生物学领域中,我们经常会遇到离子共存问题。
离子共存问题的规律总结对于我们理解溶液中的离子行为、化学反应以及环境污染等都具有重要意义。
本文将总结离子共存问题的一些规律,帮助读者更好地了解离子共存现象。
离子共存的基本原则离子在溶液中的行为受到一些基本原则的制约:1.电荷平衡原则:在溶液中,离子的总正电荷应当等于总负电荷,以保持电中性。
当不同离子共存时,需要满足总正电荷等于总负电荷的条件。
2.晶体溶解平衡原则:离子的溶解和沉淀受到溶液中浓度和溶解度的影响。
当不同离子的溶解度相互影响时,可能会发生沉淀反应。
3.共存离子间的相互作用:离子之间可能会发生相互作用,包括离子的吸附、配位反应等。
这些相互作用会影响离子在溶液中的行为。
离子共存问题的规律总结离子共存问题中存在一些常见的规律,我们可以通过以下几个方面进行总结:1. 离子产生共存的原因离子产生共存的原因可以归纳为以下几点:•相似的化学性质:具有相似化学性质的离子更容易共存,例如亲水性离子(如钠离子和氯离子)在水溶液中往往会共存。
相似性质的离子在溶液中的相互作用也较大,从而增加了共存的可能性。
•配位作用:一些离子可能通过配位作用形成络合物,使其共存于溶液中。
例如,金属离子可以与配位体形成络合物,从而增加了离子在溶液中共存的能力。
•缓冲作用:缓冲溶液中存在的离子共存是由于溶液中的缓冲剂起到了稳定离子浓度的作用。
缓冲作用可以使离子在一定浓度范围内共存,从而维持溶液的稳定性。
2. 离子共存造成的影响离子共存可能会产生以下影响:•溶解度的变化:不同离子的共存可能会影响溶解度的大小。
一些离子可能会与溶液中的其他离子发生配位反应,形成难溶盐或沉淀。
这会影响到溶液的浓度和化学反应的进行。
•腐蚀和沉积问题:某些离子的共存可能会导致金属腐蚀或沉积问题。
例如,水中存在氯离子和硫酸根离子会导致金属腐蚀加剧;而镁离子和碳酸根离子的共存会导致水垢的沉积。
离子大量共存口诀

离子大量共存口诀离子大量共存口诀是一个学习生物和化学离子交换的有用口诀,它有助于解释自然样品中质量平衡之间的关联。
它也可以帮助人们快速确定离子在潜在样品中的数量。
口诀记录了离子大量共存的基本原则:“当两种离子混合时,它们会自然形成一个正电荷和一个负电荷,在有限的容量中,总电荷必须保持零。
”离子大量共存口诀在水处理过程中也可以用来确定溶液的电离程度。
通过判断一定的质量平衡,我们可以计算出溶液中每种离子的数量。
此外,由于离子大量共存口诀基于实验推断而得,因此也可以用于测量溶液中离子的稳定性。
口诀的原理可以用以下方式来表示:A +B A+ + B-A- + B+ A- + B+A+ + B+/ A- + B- A+/A- + B+/B-式中,A和B分别代表带有正电荷和负电荷的两种离子。
而A+/A-和B+/B-则分别表示带有正电荷和负电荷的A离子和B离子的混合物。
离子大量共存口诀在化学和生物学领域都有重要的意义。
它可以帮助我们快速确定离子在某个溶液系统中的比例,也可以帮助我们确定不同离子在某个系统中的电离程度。
因此,离子大量共存口诀可以用来研究不同离子之间的交互作用,从而改善我们对自然系统的理解。
另外,离子大量共存口诀不仅可以用来研究自然界中的物质混合,它也可以用来研究化学反应及其产物之间的相互作用。
例如,在氧化还原反应中,我们可以使用离子大量共存口诀来确定某种特定物质(如氧化剂或还原剂)的数量。
此外,离子大量共存口诀还可以帮助我们了解离子是如何影响反应式产物的构成结构,以及它们如何影响反应式中物质的变化程度。
综上所述,离子大量共存口诀是一个有用的概念,它可以帮助我们了解自然界中的物质混合,也可以帮助我们了解化学反应及其产物之间的相互作用。
有了离子大量共存口诀,我们就可以更好地理解不同离子之间的关系,从而帮助我们更好地管理和保护自然系统。
离子共存问题讲解及口诀

初三化学离子共存问题一.离子间相互反应不能大量共存1.相互结合生成沉淀。
如:Ba2+和SO42-, Ag+和Cl-, Cu2+和OH-。
2.相互结合形成挥发性物质。
如:H+和S2-、HS-、CO32-、HCO32-、SO32-、HSO3-等。
3.离子间相互结合成弱电解质。
如:H+和OH-、PO43-弱酸根等。
4.弱酸根与弱碱的阳离子会发生双水解反应。
如:S2-和Al3+, Fe3+和CO32-。
5.离子间发生氧化还原反应。
如:Fe3+和S2-、I-, MnO4-和Fe2+、S2-、I-、SO32-等。
6.离子间相互结合形成络离子。
如:Fe3+与SCN-形成 [Fe(SCN)]2+络离子二.特殊条件要求某些离子不能大量共存1.无色溶液中,则有色离子不能大量共存:如:Cu2+、Fe2+、Fe3+、MnO4-均是有色离子。
2.强酸性溶液,则非强酸根离子、OH-不能大量共存。
如:PH=1的溶液中,OH-、S2-、HS-、CO32-、HCO3-、SO32-、HSO3-、ClO-、F-、PO43-、HPO42-、S2O32-等不能大量存在。
3.强碱性溶液中则H+、酸式根(如HCO3-、HSO3-、HS- )、非强碱的阳离子不能大量共存。
如:PH=13的溶液中,H+、Cu2+、HCO3-等不能大量共存。
4.具有较强氧化性微粒的溶液中,还原性离子不能大量共存。
如:有MnO4-离子大量存在的溶液中,I-、Fe2+、S2-、Br-和SO32-等不能大量共存。
5.具有较强还原性微粒的溶液中,氧化性离子不能大量共存:如在有I-离子大量存在的溶液中,Fe3+、MnO4-、H++NO3-和ClO-等不能大量共存。
6.其它特殊条件,如:①加入铝能放出H2的溶液中②“水电离产生的[H+]水=1×10-13 mol/l(或[OH-]水=1×10-13 mol/l)的溶液中”③“水电离产生的[H+]水[OH-]水=1×10-26 mol/l的溶液中”④“在水的电离度为1.8×10-13%的溶液中”以上条件均可有两种情况,即既可是强酸性溶液也可以是强碱性溶液。
离子共存规律

离子共存之一所谓离子共存,实质上就是看离子间是否发生反应的问题。
若在溶液中发生反应,就不能共存。
看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
一般注意以下几点:①在强酸性溶液中,不能大量存在弱酸根离子:如CO32-、HCO3-、S2-、HS-、SO32-、SiO32-、AlO2-、F-等,也不能有大量的OH-。
②强碱性溶液中,不能大量存在弱碱金属离子。
如:Mg2+、Fe2+、Al3+、Cu2+及NH4+等,也不能大量存在H+及酸式根离子:HCO3-、HSO3-、HS-、H2PO4-等。
③能发生氧化还原反应的离子也不能共存:如:Fe3+¬¬与I-、Cu2+与I2,H+、Fe2+与NO3-、H+与S2O32-,ClO-与S2-,ClO-与Fe2+。
H+、I-与NO3-,H+、I -与SO32-或S2-等。
④能形成络离子的也不能共存:如:Fe2+与SCN-,Ag+与S2O32-,Fe3+与C6H5O -等。
离子共存之二所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
(1)生成难溶物或微溶物:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等不能大量共存。
(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-、S2-、HS -、HSO3-、SO32-等不能大量共存。
(3)生成难电离的物质:如H+与Ac-、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水,这些离子不能大量共存。
(4)发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+ 、SO32-等)不能大量共存。
高考化学离子共存专项知识点总结

高考化学离子共存专项知识点总结离子共存是高考化学中的一个重要内容,要求学生了解不同离子在溶液中的共存与反应规律。
下面是对高考化学离子共存专项知识点的总结:一、离子共存的条件1. 相互之间没有剧烈发生化学反应的离子才能共存。
如Na+与Cl-、Ca2+与Cl-等。
2. 相互之间发生反应形成沉淀的离子不能共存。
如Ag+与Cl-、Pb2+与I-等。
3. 具有相同离子电荷的离子可以共存,但它们不能同时存在于一个水溶液中,如Na+、K+、NH4+等。
二、离子共存的规律1. 含有多种阳离子或阴离子的溶液,当它们共存时,可能会发生离子的交换反应。
2. 当溶液中存在两种可共存的阳离子或阴离子时,先用“金十字法则”判断是否发生沉淀反应。
满足金十字法则则会有沉淀生成。
3. 溶液中存在多种阳离子或阴离子时,可以借助溶液析出平衡常数的大小来确定是否发生沉淀反应。
平衡常数大的离子会先发生沉淀。
4. 溶液中多种阳离子或阴离子共存时,可以根据沉淀的溶解度积及阳离子或阴离子的加入顺序来确定产生的沉淀物。
三、常见离子共存实验操作1. 通常离子共存实验操作可以先通过外观来推断是否发生了沉淀反应,再通过试剂的颜色变化、沉淀物的产生和不产生等来确定是否发生了反应。
2. 实验中通常采用加酸和加碱的方法来选择不同的离子。
3. 在实验操作中,要注意保持反应体系的酸碱平衡,避免过量的酸碱反应。
四、离子共存的解析方法1. 离子共存的解析方法主要有质量分析法和电位滴定法。
2. 质量分析法是通过离子的各种物理和化学性质,如颜色、密度、熔点、沉淀物的溶解性等进行鉴别和测定。
3. 电位滴定法是通过离子间的氧化还原反应进行滴定分析,根据测得的电位变化来推断有关离子的存在。
五、离子共存的应用领域离子共存的知识点在实际应用中有许多方面的应用,主要包括:1. 离子共存在环境保护领域的应用,如饮用水、工业废水等中金属离子的共存与分离。
2. 离子共存在生活中的应用,如家庭自来水中钙、镁等金属离子的浓度分析。
离子共存判断的四个原则
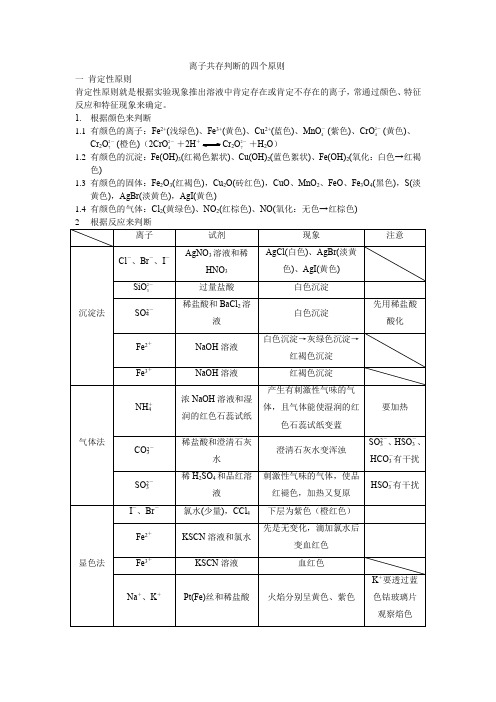
离子共存判断的四个原则一肯定性原则肯定性原则就是根据实验现象推出溶液中肯定存在或肯定不存在的离子,常通过颜色、特征反应和特征现象来确定。
1. 根据颜色来判断1.1有颜色的离子:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO-4(紫色)、CrO2-4(黄色)、Cr2O2-7(橙色)(2CrO2-4+2H+Cr2O2-7+H2O)1.2有颜色的沉淀:Fe(OH)3(红褐色絮状)、Cu(OH)2(蓝色絮状)、Fe(OH)2(氧化:白色→红褐色)1.3有颜色的固体:Fe2O3(红褐色),Cu2O(砖红色),CuO、MnO2、FeO、Fe3O4(黑色),S(淡黄色),AgBr(淡黄色),AgI(黄色)1.4有颜色的气体:Cl2(黄绿色)、NO2(红棕色)、NO(氧化:无色→红棕色)二互斥性原则互斥性原则是指在肯定某些离子的同时,结合离子共存规律(复分解反应、氧化还原反应的规律),否定一些离子的存在。
1根据溶液的酸碱性1.1强酸性溶液(非盐类水解)中不能共存:CH3COO-、F-、CO2-3/HCO-3、SO2-3/HSO-3、SiO2-3、ClO-、S2-(弱酸根)1.2强酸性溶液(非盐类水解)中不能共存:NH+4、Mg2+~Ag+、酸式根(HCO-3、HSO-3)溶液中隐含的酸碱性:①常温下,水电离产生的c(H+)= 1.0×10-12mol·L-1,则要注意溶液的pH可能为2或者12②与Al反应放出氢气的溶液,该溶液可能是酸性或强碱性③使酸碱指示剂变色,熟记常见指示剂变色范围:甲基橙:3.1~4.4(红、橙、黄)酚酞8.2~10.0(无色、粉、红)石蕊 5.0~8.2(红、紫、蓝)④常温下,c(H+)c(OH—)=10-a,若10-a>1则溶液呈酸性,若10-a<1则溶液呈碱性,当左右两边同乘以K w,c2(H+)=10-(a+14)2根据复分解反应不能大量共存K盐、Na盐和铵盐均可溶解;Fe2+、Fe3+、Cu2+、Mg2+与OH-、CO2-3、SO2-3、SiO2-3;Cl-只与Ag+不能共存;SO2-4只与Ba2+、Ag+、Ca2+不能大量共存;CO2-3、SO2-3只与K+、Na+、NH+4共存HCO-3、HSO-3不与会发生双水解的Fe2+、Fe3+、(Al3+)共存3三进出性原则进出性原则通常是在一些实验过程中应用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
高中化学离子共存知识点总结8篇

高中化学离子共存知识点总结8篇篇1一、离子共存的概念离子共存是指离子之间在一定的条件下,能够稳定地存在于同一溶液中,不会发生化学反应或沉淀现象。
在高中化学中,离子共存是一个重要的知识点,涉及到离子之间的相互作用、溶液的酸碱性、氧化还原反应等多个方面。
二、离子共存的条件1. 无毒无害:离子共存的首要条件是离子之间不会发生化学反应或产生有毒有害物质。
2. 电性中和:溶液中的正负离子应保持电性中和,即正离子的电荷总数等于负离子的电荷总数。
3. 浓度适中:离子浓度过高或过低都会影响溶液的稳定性,因此需要在合适的浓度范围内。
4. 温度适宜:温度也是影响离子共存的重要因素,过高或过低的温度都会导致溶液中的离子不稳定。
三、常见的离子共存组合1. Na+、Cl-、H2O:这是最常见的离子共存组合,氯化钠溶于水后形成氯化钠溶液,其中钠离子和氯离子可以稳定共存。
2. Ba2+、SO42-、H2O:硫酸钡是一种难溶于水的白色沉淀物,因此硫酸根离子和钡离子不能共存于同一溶液中。
3. Fe3+、OH-、H2O:铁离子和氢氧根离子在溶液中会发生反应生成氢氧化铁沉淀,因此它们不能稳定共存。
4. MnO4-、Cl-、H2O:高锰酸根离子和氯离子在酸性溶液中会发生反应生成氯气和水,因此它们不能稳定共存。
四、影响离子共存的因素1. 溶液的酸碱性:溶液的酸碱性会影响离子的存在状态,例如铁离子在酸性溶液中可以稳定存在,但在碱性溶液中则会生成氢氧化铁沉淀。
2. 氧化还原反应:有些离子之间会发生氧化还原反应,导致溶液中的离子不稳定。
例如,高锰酸根离子和氯离子在酸性溶液中会发生反应生成氯气和水。
3. 盐效应:盐效应是指盐类物质溶解后对溶液中其他离子的影响。
例如,氯化铵溶于水后会产生铵根离子和氯离子,而铵根离子和氢氧根离子会发生反应生成氨气和水,导致溶液中的氢氧根离子浓度降低。
五、总结与归纳通过以上分析可以看出,高中化学中涉及的离子共存知识点较为广泛且深入。
九年级离子共存知识点

九年级离子共存知识点离子共存是指在一个化学体系中,同时存在多种离子。
在离子化学中,离子的存在形式对于物质的性质和反应过程有着重要的影响。
本文将介绍九年级化学中关于离子共存的知识点。
一、离子共存的基本概念离子是由原子或分子通过失去或获得电子而形成的带电粒子。
正离子是指失去一个或多个电子的离子,带有正电荷;负离子是指获得一个或多个电子的离子,带有负电荷。
离子共存是指在一个溶液、晶体或混合物中,同时存在多种正离子或负离子。
二、离子共存的原理离子之间的共存是由溶液的溶剂和溶质间的相互作用及化学反应决定的。
1. 溶液中的离子共存当两种或多种离子共存于溶液中时,它们之间可以发生如下几种相互作用:- 离子间的静电作用:正负电荷之间的相互吸引力使离子形成离子晶体或稳定的溶液。
- 水合作用:溶液中的离子会与水分子发生静电作用,形成水合物,使离子溶解度增加。
- 氧化还原反应:不同离子之间的氧化还原反应可以导致离子共存溶液中的离子的浓度变化。
2. 晶体中的离子共存晶体是由离子通过全离子键或部分离子键排列有序构成的固体。
晶体中的离子共存是由离子的尺寸、电荷及空位等因素相互影响的结果。
在晶体中,离子相互间的排列会影响晶体的结构和性质。
三、离子共存的影响和应用离子共存不仅在化学反应和物质性质中起重要作用,还有广泛的应用。
1. 化学反应中的离子共存影响离子共存对于化学反应速率和平衡常数有重要影响。
- 通过提供催化剂:某些离子可以作为催化剂,加速化学反应的进行。
- 平衡常数的变化:某些离子的存在会改变平衡反应的位置和平衡常数的大小。
2. 离子共存的应用离子共存的知识在实际应用中有许多重要的方面:- 水处理:离子共存的知识有助于理解水中的阳离子和阴离子的含量,从而实现水的处理和净化。
- 化学分析和检测:离子共存的知识用于判断和检测样品中的离子种类和浓度。
- 工业应用:离子的存在对于某些工业过程的效果和效率有重要影响。
综上所述,离子共存是化学中重要的概念之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子共存原则
离子共存原则是化学中的一种基本规律,它描述了在溶液中不同离子之间的相互作用和共存关系。
离子是带电的原子或分子,在溶液中会与其他离子发生相互作用,这种相互作用是化学反应和溶解过程中不可忽视的因素。
离子共存原则对于理解溶液中离子的行为以及溶液化学反应的发生机制有着重要的意义。
离子共存原则的基本概念是指在溶液中,不同离子之间会发生各种相互作用,包括离子间的吸引力、斥力、配位作用等。
这些相互作用会影响离子的运动和行为,进而影响溶液的性质和化学反应的进行。
离子共存原则使我们能够理解和预测溶液中离子的行为,为溶液中离子的化学反应提供了理论基础。
离子共存原则可以总结为以下几个重要方面:
1. 离子间的吸引力和斥力:离子在溶液中会受到其他离子的吸引和斥力作用。
同电荷的离子会互相排斥,而异电荷的离子会互相吸引。
这种相互作用力决定了离子在溶液中的分布和运动方式。
2. 配位作用:离子在溶液中可以通过配位作用与其他离子或分子形成配合物。
这种配位作用可以改变离子的活性和溶解度,影响溶液中离子的行为和化学反应的进行。
3. 溶液的电导性:溶液中存在离子时,会导致溶液具有一定的电导
性。
离子的电荷使得溶液可以传导电流,这是溶液中离子共存的直接表现。
4. 溶液的溶解度:离子的溶解度是指在特定条件下,溶液中可以溶解的离子的最大浓度。
离子共存会影响溶解度,有时可以提高溶解度,有时则会降低溶解度。
离子共存原则在实际应用中有着广泛的意义。
例如,在药物设计中,根据离子共存原则可以选择合适的配体和离子进行配位作用,从而提高药物的活性和溶解度。
在环境保护中,离子共存原则可以帮助我们理解污染物在水体中的迁移和转化过程,为环境治理提供科学依据。
离子共存原则是描述溶液中离子相互作用和共存关系的基本规律。
离子在溶液中的行为受到其他离子的相互作用力和配位作用的影响,这种相互作用决定了溶液的性质和化学反应的进行。
离子共存原则在化学研究和实际应用中具有重要的意义,为我们理解溶液中离子的行为和化学反应的发生机制提供了理论基础。
