第八章-氧化还原反应与氧化还原滴定习题及答案
基础化学李保山第二版8-氧化还原反应习题答案

8 氧化还原反应习题解答(p222-226)1. 用氧化值法配平下列各氧化还原方程式。
(1)3Cu 2S +22HNO 3 = 6Cu(NO 3)2 +3H 2SO 4 +10NO+8H 2O (2)NH 4NO 2 = N 2 + 2H 2O(3)(NH 4)Cr 2O 7 = N 2 + Cr 2O 3 +4H 2O(4)3As 2S 3 + 28HNO 3+4 H 2O = 6 H 3AsO 4 + 9H 2SO 4 +28 NO (5)K 2Cr 2O 7 + 3H 2S +4 H 2SO 4 = Cr 2(SO 4)3 + 3S + 7H 2O + K 2SO 4 (6)2Na 2S 2O 3 + I 2 = Na 2S 4O 6 + 2NaI (7)2 MnO 4-+3 Mn 2++2 H 2O =5 MnO 2 +4 H +(8)4[Co(NH 3)6]2++ O 2 +2H 2O = 4 [Co(NH 3)6]3++ 4OH -2. 用离子-电子法配平下列方程式。
(1-11)为酸性介质,(12-14)为碱性介质 (1) Cr 2O 72-+ 3H 2O 2 + 8H += 2 Cr 3++ 3O 2 +7 H 2O (2) 2 MnO 4-+5 SO 32-+6 H += 2Mn 2++ 5 SO 42-+3 H 2O (3) ClO 3-+ 6I - + 6H += Cl - +3 I 2 + 3H 2O(4) 5NaBiO 3(s) + 2Mn 2++14 H += 5Na ++5 Bi 3++ 2 MnO 4-+7 H 2O (5) H 2S +2 Fe 3+= S +2Fe 2++ 2H +(6) 3P 4(s)+20HNO 3(浓)+8 H 2O =12H 3PO 4+20NO (7) 2FeS 2+30HNO 3Fe 2(SO 4)3+30NO 2+H 2SO 4+14H 2O (8) 7PbO 2+2MnBr 2+14HNO 37Pb(NO 3)2+2Br 2+2HMnO 4+6H 2O(9) 28HNO 3+3As 2S 3+4H 2O 9H 2SO 4+6H 3AsO 4+28NO (10) As 2S 5+10NO 3-+10H +2H 3AsO 4+10NO 2+5S+2H 2O (11) 2Bi 3++3S 2O 32-+3H 2O Bi 2S 3+3SO 42-+6H + (12) Cl 2 + 2OH -== Cl - + ClO -+ H 2O(13) 2[Cr(OH)4]-+ 3H 2O 2 + 2OH -== 2 CrO 42-+8H 2O (14) SO 32-+ Cl 2 +2OH -==2 Cl - + SO 42-+ H 2O3. (1)逆向进行(2) )(0=θ/Sn n θ+24V E E 15.=++S)(=θ/MgMg θ-V E E 37.22-=+)(2.370.15=-θ-θ+θV E E E 52.2=+=∴正向进行(3) )1.09(==θ/Br Br θ+-2V E E)(77.0==θ/Fe e F θ-+2+3V E E )(32.0=0.77-1.09=-=θ-θ+θV E E E∴正向进行(4) )(=θ/Pbθ+2V E E 13.0-=+Pb )(=θn/Z n θ-2V E E 76.0-=+Z )(0-0.13=-θ-θ+θV E E E 63.076.=+=∴正向进行4.(1)V n n E 55.1100.1)0.1(10.0lg 50592.051.1)M /O M (4824=⨯⨯+=-+-(2)V E 67.110.00.1lg 10592.072.1)Ce /Ce (34=+=++(3)VcK E E HAc 17.01075.110.0lg 0592.000.0lg 10592.0)/H H ()HAc/H (522-=⨯⨯+=+=-+θθ(4)Vc K g E E Cl sp 341.0100.1108.1lg 0592.0799.0lg 10592.0/Ag)A ()AgCl/Ag (210+=⨯⨯+=+=--+-θθ(5)Vc c c c c c E E 40.018.058.0)100.1(0.10.1lg 40592.058.0)/)(/()/(lg 40592.0)O /S SO ()O /S SO (6226OH O S 2SO 232232322323223-=+-=⨯⨯+-=+=--------θθθθ(6)Vc c p p E E O 564.0)100.1(100/0.10lg 40592.0401.0)/(/lg 40592.0)/OH O ()/OH O (434OH 222=⨯+=+=----θθθ5. 解答:(1)2Ag +(0.10 mol·L -1) + Cu(s) ==2Ag(s) + Cu 2+(0.010 mol·L -1) 电池符号: (-) Cu|Cu 2+(0.010 mol·L -1)||Ag +(0.10 mol·L -1)|Ag (+) 电极反应: (+) Ag ++e = Ag(s) (-) Cu-2e = Cu 2+电动势∶V c c g E A g E Ag 740.010.0lg 0592.0799.0lg 10592.0/Ag)A ()g /A (+=+=+=+++θθV c c C Cu E C Cu E Cu 278.0010.0lg 20592.0337.0lg 20592.0)u /()u /(222+=+=+=+++θθV C Cu E A g E E 462.0278.0740.0)u /()g /A (2=-=-=++(2)MnO 2(s)+ 2Cl -(12 mol·L -1) + 4H +(12 mol·L -1) = Mn 2+(1.0 mol ·L -1) + Cl 2(100kPa) + 2H 2O(l) 电池符号:(-) Pt, Cl 2(100kPa)|Cl -(12.0 mol·L -1)||Mn 2+(1.0mol·L -1),H +(12.0 mol·L-1)|MnO 2(s),Pt(+) 电极反应:(+) MnO 2+ 4H ++2e== Mn 2++ 2H 2O\(-) 2Cl —2e== Cl 2 电动势∶Vc c c c E E Mn 36.10.112lg 20592.023.1/)/(lg 20592.0)/Mn MnO ()/Mn MnO (44H 22222+=+=+=++++θθθV c c p p E E Cl 30.1121lg 20592.036.1)/(lg 20592.0)/Cl Cl ()/Cl Cl (22Cl 222+=+=+=--θθθV E 06.030.136.1=-=(3)H 3AsO 3(0.10 mol·L -1)+ I 2(s) + H 2O(l) = H 3AsO 4(1.0 mol·L -1) + 2I -(0.010 mol·L -1) +2H +(0.10 mol·L -1) 电池符号:(-) Pt|H 3AsO 4 (1.0 mol·L -1), H +(0.10 mol·L -1), H 3AsO 3(0.10 mol·L -1)||I -(0.010mol·L -1)|I 2(s), Pt (+) 电极反应: (+) I 2+2e =2I -(-) H 3AsO 3+ H 2O-2e = H 3AsO 4+2H +电动势∶34332H AsO H 34333433H AsO 2(/)(/)0.0592(H AsO /H AsO )(H AsO /H AsO )lg2/0.0592 1.0(0.10) 0.559lg 0.52920.10c c c c E E c c Vθθθθ+=+⨯=+=+22222I 0.059210.05921(I /I )(I /I )lg 0.536lg 0.6542(/)2(1.010)E E V c c θθ----=+=+=⨯E = 0.654-0.529=0.125V(4)Cr 2O 72-(1.0 mol·L -1) + 6Fe 2+(0.10 mol·L -1) +14H +(1.0 mol·L -1) = 2Cr 3+(0.10 mol·L -1) + 6Fe 3+(1.0 mol·L -1) + 7H 2O(l) 电池符号:(-)Pt|Fe 3+(1.0 mol·L -1), Fe 2+(0.10 mol·L -1)||Cr 2O 72-(1.0mol·L -1), Cr 3+(0.10mol·L -1), H +(1.0 mol·L -1)|Pt (+) 电极反应:(+) Cr 2O 72-+14H ++6e = 2Cr 3++ 7H 2O(-) Fe 2+-e = Fe3+电动势∶227314Cr O H 232327272Cr (/)(/)0.0592(Cr O /Cr )(Cr O /Cr )lg 6(/)c c c c E E c c θθθθ-++-+-+=+1420.0592(1.0)(1.0)1.33lg 1.356(0.10)V =+= 323232Fe Fe /0.0592 1.0(Fe /Fe )(Fe /Fe )lg 0.7710.0592lg 0.8301/0.10c c E E Vc c θθθ++++++=+=+=+E =1.35-0.830=0.52V6. 解答:(1) E =E (+)-E (-)θθθc c c c E E E /lg 20592.0440.0/lg 20592.0)/Fe Fe ()/Fe Fe ()(22Fe Fe 22+++-=+==+++ Vc c E E E 822.0100.1lg 20592.0763.0/lg 20592.0)/Zn Zn ()/Zn Zn ()(2Zn 222-=⨯+-=+==--+++θθ 0.293= -0.440+(0.0592/2)lg c (Fe2+)+0.822 c (Fe2+)=1.0×10-3(mol ·L -1) (2)(-)Ag ∣Ag +(y mol·L -1)‖Ag +(1.0×10-1mol·L -1)∣Ag (+) E =0.0592V ,求负极Ag +的浓度。
氧化还原反应与氧化还原滴定法

氧化还原反应与氧化还原滴定法一、单选择题1、不属于氧化还原滴定法的是A、铬酸钾法B、高锰酸钾法C、碘量法D、亚硝酸钠法E、重铬酸钾法2、氧化还原滴定法的分类依据是A、滴定方式不同B、配制滴定液所用氧化剂不同C、指示剂的选择不同D、滴定对象不同E、酸度不同3、高锰酸钾法中,调节溶液的酸性实用的是A、HClO4 B 、H2SO4 C 、HNO3D、HBr E 、HCl4、间接碘量法中,加入KI的作用是A、作为氧化剂B、作为还原剂C、作为沉淀剂D、作为掩蔽剂E、作为保护剂5、间接碘量法中,滴定至终点的溶液放置后(5分钟)又变为蓝色的原因是A、KI加入量太少B、空气中氧的原因C、待侧物与KI反应不完全D、溶液中淀粉过多E、反应速度太慢6、用K2Cr2O7作为基准物质标定Na2S2O3溶液的浓度,在放置10分钟后,要加入大量纯化水稀释,其目的是A、避免I2发挥B、增大I2的溶解度C、减慢反应速度D、降低酸度和减少[Cr3+]E、降低溶液的温度7、Na2S2O3溶液不能用直接法配制的原因是A、Na2S2O3分子量小B、具有吸湿性C、Na2S2O3常含有杂质D、水中溶解度小E、难于准确称量8、下列不能用碘量法测定含量的是A、漂白粉B、MnO2C、Na2SD、Na2SO4E、K2Cr2O79、用高锰酸钾法测定Ca2+时,所属的滴定方法是A、置换B、剩余C、直接D、间接E、返滴定10、在亚硝酸钠法中,能用重氮化滴定法测定的物质是A、季铵盐B、生物碱C、芳叔胺D、芳伯胺E、芳仲胺11、用亚硝酸钠法测定物质含量时,下列不正确的是A、亚硝酸钠法可以测定任何含氮的物质B、亚硝酸钠法一般用盐酸作为酸性介质C、亚硝酸钠法在HBr中反应速度最快D、磺胺类药物可以用亚硝酸钠法测定含量E、亚硝酸钠法采用快速滴定时温度规定在30℃以下12、配制Na2S2O3溶液时,要加入少许Na2CO3,其目的是A、中和Na2S2O3溶液的酸性B、增强Na2S2O3的还原性C、除去酸性杂质D、作抗氧剂E、防止微生物生长和Na2S2O3分解13、用K2Cr2O7作为基准物质标定Na2S2O3溶液的滴定方式是A、直接B、间接C、剩余D、置换E、氧化还原14、用间接法配制Na2S2O3溶液时,常加入少量的Na2CO3其目的是A、增大Na2S2O3的稳定性B、增大Na2S2O3的溶解性C、增大Na2S2O3的还原性D、中和Na2S2O3的碱性E、以上均是15、氧化还原反应条件平衡常数K'的大小A、能说明反应速度B、能说明反应的完全程度C、能说明反应的条件D、能说明反应的历程E、能说明反应的顺序16、亚硝酸钠法常用的酸性介质是A、HClO4B、H2SO4C、HNO3D、HBrE、HCl17、高锰酸钾法应在下列的哪一种溶液中进行:A、强酸性溶液B、弱酸性溶液C、弱碱性溶液D、强碱性溶液E、中性溶液18、高锰酸钾滴定法指示终点是依靠A、酸碱指示剂B、金属指示剂C、吸附指示剂D、自身指示剂E、专属指示剂19.关于配制和标定I2滴定液错误的是A、由于I2腐蚀性强,故不宜分析天平上称量B、标定I2常用的基准物质是As2O3C、I2应先溶解在KI溶液中,再稀释至所需体积D、标定操作应在碘量瓶中进行E、配制好的溶液应储存在棕色瓶中20、直接碘量法测定维生素C要求溶液的酸性是A、醋酸酸性B、盐酸酸性C、氢氧化钠碱性D、氨性E、硫酸酸性21、间接碘量法所用的滴定液是A、I2B、Na2S2O3C、Na2S2O3和I2D、Na2S2O3和KIE、I2和KI22、间接碘量法中加入淀粉指示剂的适宜时间是A、滴定开始时加入B、滴定液滴加到一半时加入C、滴定至近终点时加入D、滴定到溶液呈无色时加入E、滴定到溶液呈黄色时加入23、高锰酸钾法所用的指示剂是A、KMnO4B、K2Cr2O7C、K2CrO4D、KIE、淀粉24、氧化还原指示剂的作用原理是A、在滴定过程中因被氧化或还原而发生结构变化,引起颜色变化B、稍微过量的指示剂将溶液染色C、与被测OX或Red结合而发生颜色反应D、指示剂被空气作用而发生颜色变化E、因为溶液的酸碱度发生变化,而引起颜色的变化25、用直接法测定维生素样品的含量时,如果溶液呈碱性,对测定结果产生的影响是A、偏高B、偏低C、过高D、结果混乱E、无影响26、直接碘量法加入淀粉指示剂的时间是A、滴定前B、终点时C、滴定开始D、近终点E、计量点时27、用K2Cr2O7标定Na2S2O3时,应选用的指示剂和加入的时间是A、K2Cr2O7 滴定开始前B、淀粉滴定开始前C、淀粉近终点时D、碘化钾滴定前E、碘化钾近终点时28、下列各项中,不属于KMnO4溶液标定操作条件的是A、用新煮沸的冷纯化水溶解基准物Na2C2O4B、标定反应应在H2SO4酸性条件下进行C、标定温度应不高于65’CD、加入催化剂,提高反应速度E、终点颜色应保持30s不褪色29、下列注意事项中,与H2O2测定无关的是A、开始和近终点时的滴定速度要放慢B、取样后,加稀硫酸,立即滴定C、取样后。
基础化学第二版李保山8 氧化还原反应习题解答-学生

第八章氧化还原反应习题 (p222-226) 参考答案1.解答:(1)3Cu2S +22HNO3 ==6Cu(NO3)2 +3H2SO4 +10NO↑+8H2O(2)NH4NO2 == N2↑+ 2H2O(3)(NH4)2Cr2O7 == N2↑+ Cr2O3 +4H2O(4)3As2S3 + 28HNO3+4 H2O ==6 H3AsO4 + 9H2SO4 +28 NO↑(5)K2Cr2O7 + 3H2S +4 H2SO4 == Cr2(SO4)3 + 3S↓ + 7H2O + K2SO4(6)2Na2S2O3 + I2 == Na2S4O6 + 2NaI(7)2 MnO4-+3 Mn2+ +2 H2O ==5 MnO2↓ +4 H+(8)4[Co(NH3)6]2+ + O2 +2H2O ==4 [Co(NH3)6]3+ + 4OH-2.解答:(1)Cr2O72- + 3H2O2 + 8H+ ==2 Cr3+ + 3O2↑ +7 H2O(2)2 MnO4- +5 SO32- +6 H+ == 2Mn2+ + 5 SO42- +3 H2O(3)ClO3- + 6I- + 6H+ == Cl- +3 I2 + 3H2O(4)5NaBiO3(s) + 2Mn2+ +14 H+ == 5Na+ +5 Bi3+ + 2 MnO4- +7 H2O(5)H2S +2 Fe3+ ==S +2Fe2+ + 2H+(6) 3P4(s)+20HNO3(浓)+8 H2O ===12H3PO4+20NO↑(7) 2FeS2+30HNO3==Fe2(SO4)3+30NO2↑+H2SO4+14H2O(8) 7PbO2+2MnBr2+14HNO3==7Pb(NO3)2+2Br2+2HMnO4+6 H2O(9) 28HNO3+3As2S3+4H2O==9H2SO4+6H3AsO4+28NO↑(10) As2S5+10NO3-+10H+==2H3AsO4+10NO2↑+5S↓+2 H2O(11) 2Bi3++3S2O32-+3H2O==Bi2S3↓+3SO42-+6H+(12)Cl2 + 2OH-== Cl- + ClO-+ H2O(13)2[Cr(OH)4]—+ 3H2O2 + 2OH—== 2 CrO42- +8H2O(14)SO32- + Cl2 +2OH-==2 Cl—+ SO42-+ H2O3.解答:(1)逆向;(2)正向;(3)正向;(4)正向4.解答:(1)1.55V;(2)1.67V;(3)-0.17V;(4 ) 0.34V;(5)-0.40V;(6)0.56V5.解答:(1)所以电极反应:(+) Ag++e==Ag(-) Cu2+ +2e== Cu电池符号:(-) Cu|Cu2+(0.010mol·L-1)||Ag+(0.10 mol·L-1)|Ag (+)电动势∶E=0.46V(2)电极反应:(+) MnO2+ 4H++2e== Mn2++ 2H2O(-) Cl2+2e ==2C l-电池符号:(-) Pt, Cl2(100kPa)|Cl-(12.0 mol·L-1)||Mn2+(1.0 mol·L-1),H+(12.0mol·L-1)|MnO2(s),Pt (+)电动势∶E =0.06V(3)反应正向进行,电极反应为:(+) I 2+2e==2I -(-) H 3AsO 4+2H ++2e ===H 3AsO 3+ H 2O 电池符号:(-) Pt|H 3AsO 4 (1.0 mol·L -1) ,H +(0.10 mol·L -1), H 3AsO 3(0.10 mol·L -1)||I -(0.010 mol·L -1)|I 2(s),Pt (+)电动势∶E =0.13V(4)反应正向进行,电极反应:(+) Cr 2O 72-+14H ++6e= 2Cr 3++ 7H 2O (-) Fe 3++e ==Fe 2+ 电池符号:(-)Pt|Fe 3+(1.0 mol·L -1), Fe 2+(0.10 mol·L -1)||Cr 2O 72-(1.0mol·L -1),Cr 3+(0.10 mol·L -1),H +(1.0 mol·L -1)|Pt (+)电动势∶E =0.52V6.解答:(1)x =1.2×10-3 mol·L -1;(2)y = 0.010 mol·L -1;(3) x min =1.42 mol·L -17.解答: E θ(Ag +/Ag)= +0.79932V8.解答: =7.1×10θPbI sp,K -99.解答:E θ(Ag 3PO 4/Ag)==0.49V 10.解答:E Ag 2S/Ag =-0.20V11.解答: (HCN)=6.22×10θK -1012.解答: E θ(H 3PO 4/H 2)= - 0.13V 13.解答:(1)电极反应式为:(+) Ag ++e == Ag(-) Zn 2+ +2e == Zn原电池符号: (-)Zn|Zn 2+(0.30 mol·L -1)||Ag +(0.10 mol·L -1)|Ag (+) (2)该原电池的电动势E =1.52V (3) 52θ100.5×=K (4)127L mol 106.2]Ag [−−+⋅×=14.解答:K θ=3.8×10515.解答:Ag +先被还原;c (Ag +)=5.3×10-9mol .L -116.解答:V 1.1)/Cr O Cr (3-272=+E17.解答:(1)逆向进行(2)(-)Pt|Cr 3+(1 mol·L -1),Cr 2O 72-(1 mol·L -1),H +(1 mol·L -1)||Cl -(1mol·L -1)|Cl 2(p θ), Pt (+) 电极反应式:+)3Cl 2+6e = 6Cl --)Cr 2O 72-+14H ++6e=2Cr 3++3Cl 2+7H 2O(3) 逆向进行;V E 44.0=18.解答:]S [lg 20592.0]Cu lg[20592.02θsp,CuS θ)/Cu Cu (2θ)/Cu Cu ()/Cu Cu (222−++=+=+++K E EE126.0V 702.0783.0103.6lg 20592.0337.0θ/PbPb 362−=<−=×+=+−E V 所以可以正常放电。
第8章氧化还原滴定知识

第8章氧化还原滴定知识1. 一、单选题1.[2]用H2C204·2H20标定KMn04溶液时,溶液的温度一般不超过(),以防止H2C2O4 • 2H20 的分解。
[单选题] *A.60°CB.75°CC.40°CD.90°C(正确答案)2. [2]把反应Zn + Cu2+→Zn2+ + Cu设计成原电池,电池符号为()。
[单选题] *A.(-)Zn|Zn2+ || Cu2+|Cu( + )(正确答案)B.(-)Zn2+|Zn || Cu2+|Cu( + )C.(-)Cu2+|Cu || Zn2+|Zn( + )D.(-)Cu|Cu2+ || Zn2+|Zn( + )3. [2]将反应Fe2+ + Ag+ → Fe3+ + Ag构成原电池,其电池符号为()。
[单选题] *A.(-)Fe2+| Fe3+ || Ag+| Ag( + )B.(-)Pt| Fe2+;Fe3+ || Ag+| Ag( + )C.(-)Pt| Fe2+,Fe3+ || Ag+| Ag(+)(正确答案)D.(-)Pt| Fe2+,Fe3+ || Ag+|Ag| Pt(+)4. [2]当增加反应酸度时,氧化剂的电极电位会增大的是()。
[单选题] *A.Fe3+B.I2C.K2Cr207(正确答案)5. [2]电极电势的大小与下列哪种因素无关()。
[单选题] *A.电极本身性质B.温度C.氧化态和还原态的浓度D.化学方程式的写法(正确答案)6. [2]下列说法正确的是()。
[单选题] *A.电对的电位越低,其氧化形的氧化能力越强B.电对的电位越高,其氧化形的氧化能力越强(正确答案)C.电对的电位越高,其还原形的还原能力越强D.氧化剂可以氧化电位比它高的还原剂7. [3]反应 2Fe3+ + Cu = 2Fe2+ + Cu2+进行的方向为()。
[] [单选题] *A.向左B.向右(正确答案)C.已达平衡D.无法判断8. [3]在 2Cu2+ + 4I- = 2CuI ↓ + I2 中,则反应方向向()。
第8章氧化还原反应与 氧化还原滴定法2
定剩余的MnO4- 。根据已知过量的KMnO4和还原剂标
准溶液的浓度和消耗的体积,即可计算出甲酸的含量
。
7
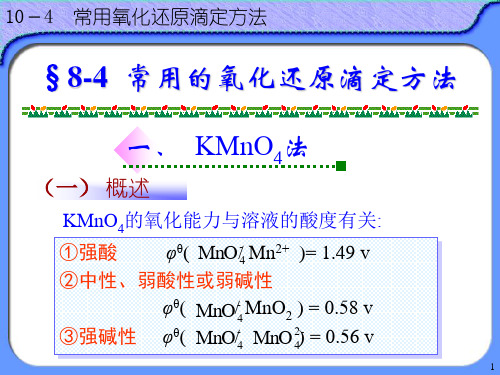
10-4 常用氧化还原滴定方法
二 、重铬酸钾法(Potassium Dichromate Method)
(一) 概述
K2Cr2O7在酸性条件下与还原剂作用: Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O (2) 应用范围比KMnO4 法窄;
18
10-4 常用氧化还原滴定方法 2. 硫酸铜中铜的测定
三、 碘 量 法
2 Cu2+ + 4 I - = 2CuI↓ + I2
I2 + 2S2O32- = S2O32- + 2 I -
n Cu 2+ / n Na 2S2O3= 1 / 1
可逆反应,应加入过量 KI。CuI 沉淀表面吸附 I2导致结果
(4) 滴定终点:高锰酸钾自身指示终点(淡粉红色30秒不退)。
4
10-4 常用氧化还原滴定方法
一、 KMnO4法
(三) 高锰酸钾法应用示例 1. 过氧化氢的测定
可用KMnO4标准溶液直接滴定,其反应为: 5H2O2 + 2MnO4- + 6H+ = 2Mn2+ + 5O2 + 8H2O 室温、在硫酸或盐酸介质。开始时反应进行较慢。
最后以Na2S2O3标准溶液滴定析出的 I2。
22
10-4 常用氧化还原滴定方法
2
10-4 常用氧化还原滴定方法
一、 KMnO4法
(二) 标准溶液的配制与标定(间接法配制)
KMnO4自行分解反应:
基础化学习题解答(8)

习题解答(第八章)一、选择题1. 下列反应中,属于氧化还原反应的是( C )A.硫酸与氢氧化钡溶液的反应B.石灰石与稀盐酸的反应C.二氧化锰与浓盐酸在加热条件下反应D.醋酸钠的水解反应2. 单质A和单质B化合成AB(其中A显正价),下列说法正确的是( C )A. B被氧化B. A是氧化剂C. A发生氧化反应D. B具有还原性3. 对于原电池的电极名称,叙述中有错误的是( B )A.电子流入的一极为正极B.发生氧化反应的一极是正极C.电子流出的一极为负极D.比较不活泼的金属构成的一极为正极4. 根据下列反应:2FeCl3+Cu→2FeCl2+CuCl22Fe3++Fe→3Fe2+2KMnO4+10FeSO4+8H2SO4→2MnSO4+5Fe2(SO4)3+K2SO4+8H2O 判断电极电势最大的电对为( C )A.Fe3+/Fe2+B.Cu2+/CuC.MnO4-/Mn2+D.Fe2+/Feϕ5. 在含有Cl-,Br-,I-离子的混合溶液中,欲使I-氧化成I2,而Br-,Cl-不被氧化,根据φ值大小,应选择下列氧化剂中的( B )A.KMnO4B.K2Cr2O7C.(NH4)2S2O8D.FeCl36. 在酸性溶液中和标准状态下,下列各组离子可以共存的是( D )A.MnO4- 和Cl-B.Fe3+ 和Sn2+C.NO3- 和Fe2+D.I- 和Sn4+7. 利用标准电极电势表判断氧化反应进行的方向,正确的说法是( B )A.氧化态物质与还原态物质起反应;ϕ较大电对的氧化态物质与φϕ较小电对的还原态物质起反应;B. φC.氧化性强的物质与氧化性弱的物质起反应;D.还原性强的物质屯还原性弱的物质起反应。
二、是非题(下列叙述中对的打“√”,错的打“×”)1. MnO4-离子中,Mn和O的化合价分别为+8和-2。
( ×)2. 根据标准电极电势判定SnCl2 + HgCl2 =SnCl4 + Hg反应能自发向右进行。
氧化还原滴定答案

氧化还原滴定(答案)一、单项选择1. 氧化还原滴定的主要依据是(C )A. 滴定过程中氢离子浓度发生变化B. 滴定过程中金属离子浓度发生变化C. 滴定过程中电极电位发生变化D. 滴定过程中有络合物生成2. 欲以氧化剂滴定还原剂,滴定反应为Ox1 + Red2 = Red1 + Ox2 (假设n1 = n2 = 1),若要求反应完全程度在99.9%以上,则平衡常数最小应为( D ) A. 108 B. 6 C. 105 D. 1063. 用KMnO4滴定Fe2+时,酸性介质宜由( D )提供A. HClB. HNO3C. HAcD. H2SO44. 提高氧化还原反应的速度可采取(A )措施 A. 增加温度B. 加入络合剂 C. 加入指示剂 D. 减少反应物浓度5.下列说法正确的是( B )A. 平衡常数大的氧化还原反应能用于滴定分析B. 讨论氧化还原反应能否进行时,不仅要从热力学角度考虑反应可行性,还应从动力学角度考虑反应进行的现实性C. 在滴定分析中都可以利用加热的办法来加速反应的进行D. 在氧化还原滴定分析中,化学计量点电势φsp位于滴定突跃的中点6. 氧化还原滴定曲线是(B )变化曲线A. 溶液中金属离子浓度与pH关系B. 氧化还原电极电位与滴定剂用量关系C. 溶液pH 与金属离子浓度关系D. 溶液pH与滴定剂用量关系7. 已知在1mol/L H 2 SO 4溶液中,MnO 4- /Mn2+ 和Fe 3+ /Fe 2+电对的条件电极电位分别为1.45V 和0.68V 。
在此条件下用KMnO4标准溶液滴定Fe 2+,其化学计量点的电位值为(C) A. 0.73V B. 0.89V C. 1.32V D. 1.49V8. 在酸性介质中,用KMnO 4溶液滴定草酸盐,滴定应(B)A. 象酸碱滴定那样快速进行B. 在开始时缓慢进行,以后逐渐加快,在近化学计量点附近缓慢进行C. 始终缓慢地进行D. 在近化学计量点附近加快进行9. 用铈量法测定H2SO4介质中Fe2+,当滴定至化学计量点的电位值为( C ) (φ'Fe3+/Fe2+=0.68V φ'Ce4+/Ce3+=1.44V)A. 1.44VB. 0.68VC. 1.06VD. 0.86V10. 碘量法测定胆矾中的铜时,加入硫氰酸盐的主要作用是( D )A. 作还原剂B. 作配位剂C. 防止Fe3+的干扰D. 减少CuI沉淀对I2的吸附11. 氧化还原反应进行的程度与(C)有关 A. 离子强度 B. 催化剂 C. 电极电势 D. 指示剂12. 间接碘量法(即滴定碘法)中加入淀粉指示剂的适宜时间是( B)A. 滴定开始时B. 滴定至溶液呈浅黄色时C. 滴定至I3-离子的红棕色退尽,溶液呈无色时D. 在标准溶液滴定了近50%13. 间接碘量法测定水中Cu2+含量,介质的pH值应控制在( A ) A. 弱酸性 B. 强酸性 C. 弱碱性 D. 强碱性14. 电极电位对判断氧化还原反应的性质很有用,但它不能判断(B )A. 氧化还原反应的完全程度B. 氧化还原反应速率C. 氧化还原反应的方向D. 氧化还原能力的大小15. (1) 用0.01mol•L-1KMnO4溶液滴定0.05mol•L-1Fe2+溶液:(2)用0.001mol•L-1KMnO4溶液滴定0.005mol•L-1Fe2+溶液。
第八章 氧化还原滴定法(3,4,5)

2. 反应应有一定的选择性
例:钛铁矿中Fe的测定 ETi 0.10V E 0.77V ( IV )/ Ti ( III ) Fe3 / Fe2
EZn 0.76V 2 / Zn ESn 0.15V 4 / Sn2
3. 过量的预氧化剂或预还原剂易除去 Sn2 HgCl2 (过量) Sn4 Hg2Cl (白丝) 2
分 析 化 学
第八章 氧化还原滴定
第三节
V
氧化还原滴定曲线
一、氧化还原滴定的滴定分数
设:c0(Ox1 ) c0( R e d2 ) ,V0
aOx1 bR e d2 aR e d1 bOx2
f bc0( Ox1 )V a c0( R e d2 )V0 bc0( Ox1 )V ac0( R e d 2 )V0
4
2、计量点
Ce4 Fe2 Ce3 Fe3
Esp ECe ( IV )/ Ce( III ) 0.059lg(cCe( IV ), sp cCe( III ), sp ) Esp EFe ( III )/ Fe( II ) 0.059lg(cFe( III ), sp cFe( II ), sp )
二、氧化还原滴定的指示剂 氧化还原指示剂是一类本身具有氧化还原性的有 机试剂,其氧化型和还原型具有不同的颜色。
0.1 cIn(Ox) cIn( Red )
0.059 10 E n
In
EIn
氧化还原指示剂、自身指示剂、专属指示剂
三、氧化还原滴定前的预处理
16
7
三、化学计量点电势的计算通式 对于对称电对的氧化还原反应通式:
aOx1 bR e d2 aR e d1 bOx2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章 氧化还原反应与氧化还原滴定习题1.是非判断题1-1氧化数在数值上就是元素的化合价。
1-2 Na 2S ,Na 2S 2O 3,Na 2SO 4和NaS 4O 6中,硫离子的氧化数分别为-2,2,4,6和+5/2 。
1-3 NH 4+中,氮原子的氧化数为-3,其共价数为4。
1-4氧化数发生改变的物质不是还原剂就是氧化剂。
1-5任何一个氧化还原反应都可以组成一个原电池。
1-6两根银丝分别插入盛有 mol ·L -1和 1 mol ·L -1 AgNO 3溶液的烧杯中,且用盐桥将两只烧杯中的溶液连接起来,便可组成一个原电池。
1-7在设计原电池时,θϕ值大的电对应是正极,而θϕ值小的电对应为负极。
!1-8原电池中盐桥的作用是盐桥中的电解质中和两个半电池中过剩的电荷。
1-9半反应NO 3- + H + + e ⇔NO + H 2O 配平后,氧化态中各物质的系数依次为1,4,3。
1-10在碱性介质中进行的反应CrO 2-+Cl 2+OH -⇔CrO 42-+Cl -+H 2O 被配平后反应生成物CrO 42-的系数分别为8和2。
1-11对电极反应S 2O 82-+2e2SO 42- 来说,S 2O 82- 是氧化剂被还原,SO 42-是还原剂被氧化。
1-12原电池中,电子由负极经导线流到正极,再由正极经溶液到负极,从而构成了回路。
1-13金属铁可以置换CuSO 4溶液中的Cu 2+,因而FeCl 3溶液不能与金属铜反应。
1-14标准电极电势表中的θ值是以氢电极作参比电极而测得的电势值。
1-15电极电势表中所列的电极电势值就是相应电极双电层的电势差。
1-16某电对的标准电极电势是该电对与标准氢电极组成原电池时的原电池电动势。
1-17电极反应为Cl2+2e2Cl -的电对Cl 2/Cl -的E θ=;电极反应为12Cl 2+e Cl -时θ(Cl 2/Cl -) …=1/2×=。
1-18电极电势大的氧化态物质氧化能力大,其还原态物质还原能力小。
1-19在一定温度下,电动势E θ只取决于原电池的两个电极,而与电池中各物质的浓度无关。
1-20在氧化还原反应中,两电对的电极电势的相对大小,决定氧化还原反应速率的大小。
1-21任何一个原电池随着反应的进行,电动势E 在不断降低。
1-22改变氧化还原反应条件使电对的电极电势增大,就可以使氧化还原反应按正反应方向进行。
1-23在自发进行的氧化还原反应中,总是发生标准电极电势高的氧化态被还原的反应。
1-24由自发进行的氧化还原反应设计而成的原电池,正极总是标准电极电势高的氧化还原电对。
1-25在电极反应Ag+ + e⇔Ag中,加入少量NaI(s),则Ag的还原性增强。
1-26电对的和θ的值的大小都与电极反应式的写法无关。
~1-27对于一个反应物与生成物都确定的氧化还原反应,由于写法不同,反应转移的电子数Z不同,则按能斯特方程计算而得的电极电势的值也不同。
1-28电对MnO4-/Mn2+和Cr2O7/Cr3+的电极电势随着溶液pH值减小而增大。
1-29对于电对Cu2+/Cu,加入某种配位剂后,对其电极电势产生的影响是逐渐增大。
1-30电池电动势等于发生氧化反应电极的电极电势减去发生还原反应电极的电极电势。
1-31原电池电动势与电池反应的书写方式无关,而标准平衡常数却随反应式的书写而变,氧化剂电对的电极电势必定与还原剂电对的电极电势相等。
1-32对于电池反应Cu2+ + Zn = Cu + Zn2+,增加系统Cu2+的浓度必将使电池的电动势增大,根据电动势与平衡常数的关系可知,电池反应的Kθ也必将增大。
1-33若氧化还原反应两电对转移电子的数目不等,当反应达到平衡时,氧化剂电对的电极电势必定与还原剂电对的电极电势相等。
1-34溶液中同时存在几种氧化剂,若它们都能被某一还原剂还原,一般说来,电极电势差值越大的氧化剂与还原剂之间越先反应,反应也进行得越完全。
1-35在25℃时(-)Fe | Fe3+(c1)|| Ag+(c2)|Ag(+)电池中,已知电池电动势为E,若在Ag+离子溶液中加入少量浓氨水,则电池的电动势降低。
1-36已知电池(-)Ag,AgCl(s)|| HCl mol·L-1)︱Cl2(Pθ),Pt(+)在25℃时的E=。
若以c= mol·L-1的HCl 代替c= mol·L-1的HCl时,电池电动势将发生改变。
,1-37电极反应Cu2+ + 2e⇔Cu和Fe3+ + e⇔Fe2+中的离子浓度减小一半时, (Cu2+/Cu)和 (Fe3+/Fe)的值都不变。
1-38酸碱指示剂的变色是由得失H+引起的,同样氧化还原指示剂的变色一定是由得失e所造成的。
1-39条件电极电势是考虑溶液中存在副反应及离子强度影响之后的实际电极电势。
1-40氧化还原滴定中,影响电势突跃范围大小的主要因素是电对的电势差,而与溶液的浓度几乎无关。
2.选择题2-1在2KMnO4 + 16HCl =5Cl2 + 2MnCl2 + 2KCl + 8H2O反应中,还原产物是下面哪一种A. Cl2B. HClC. KClD. MnCl22-2 半反应CuS + H2O→SO42- + H+ + Cu2 ++e的配平系数从左至右依次为A. 1,4,1,8,1,1,B. 1,2,2,3,4,2C. 1,4,1,8,1,8,D. 2,8,2,16,2,82-3下列半电池反应中,被正确配平的是*A. Sn 22+ + OH -==SnO 32- + H 2O+2eB. Cr 2O 72+ + 14H + + 3e==2Cr 3+ + 7H 2OC. Bi 2O 5 + 10H + + 2e===Bi 3+ + 5H 2OD. H 3AsO 3 + 6H + + 6e===AsH 3 + 3H 2O2-4反应Cr 2O 72-+ SO 32-→ Cr 3+ + SO 42-在酸性介质中进行,反应式配平后。
H 2O 的化学计量数的绝对值是A. 12-5反应H 2O 2+MnO 4-→O 2+Mn 2+在酸性介质中进行,反应式配平后。
H 2O 的化学计量数的绝对值是2-6反应MnO 4-+ SO 32-→ MnO 42- + SO 42-在碱性介质中进行,反应式配平后。
OH -的化学计量数的绝对值是2-7反应ClO 3-+ S 2-→Cl -+S 在碱性介质中进行,反应式配平后。
OH -的化学计量数的绝对值是$2-8配平反应式As 2S 3+ HNO 3 → H 3AsO 4 + H 2SO 4 + NO 。
H 2O 的化学计量数的绝对值是2-9配平下列反应方程式:Ca(OH)2+Cl 2→Ca(ClO 3)2+CaCl 2,H 2O 的化学计量数的绝对值是2-10反应Fe 3O 4+ Cr 2O 72-+H + →Cr 3++Fe 3++H 2O 中,下列哪一组为反应物Fe 3O 4和H +的系数A. 6和62 和31 C. 6和31 D. 2和62 2-11称取某氧化性试剂(M= g ·mol -1),溶解于酸性溶液中,加入过量KI ,释放出的I 2以·L -1Na 2S 2O 3溶液滴定至终点消耗,则它与KI 反应时,每摩尔试剂得到多少摩尔的电子A .1 B. C. 3 D. 22-12配制含Mn ·mL -1 的KMnO 4溶液,需取c (1/5KMnO 4)=·L -1(在酸性溶液中)的体积为多少毫升(KMnO 4和Mn 的摩尔质量分别为·mol -1,·mol -1)A .BC D【2-13已知()2/Ni Ni θϕ+=,测得某电极的()2/Ni Ni ϕ+=,说明在该系统中必有(Ni 2+)>1 mol ·L -1 B. c(Ni 2+)<1 mol ·L -1 (Ni 2+)=1 mol ·L -1 D.无法确定2-14将反应Fe 2+ + Ag +→Fe 3+ + Ag 构成原电池,其电池符号为A.(-)Fe 2+∣Fe 3+‖Ag +∣Ag(+)B.(-)Pt ∣Fe 2+∣Fe 3+‖Ag +∣Ag(+)C.(-)Pt ∣Fe 2+.Fe 3+‖Ag +∣Ag(+)D.(-)Pt ∣Fe 2+,Fe 3+‖Ag +∣Ag ∣Pt(+)2-15根据反应Cd + 2H + →Cd 2+ + H 2 构成原电池,其电池符号为A .(-) Cd ∣Cd 2+‖H +.H 2∣Pt(+). B.(-) Cd ∣Cd 2+‖H +∣H 2,Pt(+)C.(-) H 2∣H +‖Cd 2+∣Cd (+)D.(-) Pt, H 2∣H +‖Cd 2+∣Cd (+)2-16下列叙述中正确的是A.电极电势值的大小可以衡量物质得失电子容易的程度\B.某电极的电极电势就是该电极双电层的电势差C.原电池中,电子由负极经导线流到正极,再由正极经溶液到负极,从而构成了回路D.在一个实际供电的原电池中,总是由电极电势高的电对作正极,电极电势低的电对作负极2-17在Cu-Zn原电池中,已知铜做正极,若向正极中加入氨水,则可能发生A.电动势升高B.电动势降低C.电动势不变D.上述情形均可能发生2-18测得由反应2S2O32-+I2 →S4O62-+2I-构成的原电池标准电动势为。
已知电对I2/I-的Eθ为,则电对S4O62-/S2O32-的Eθ为原电池(-)Fe∣Fe2+‖Cu2+∣Cu(+)的电动势将随下列哪种变化而增加A.增大Fe2+离子浓度, 减小Cu2+离子浓度B. 减少Fe2+离子浓度, 增大Cu2+离子浓度C. Fe2+离子和Cu2+离子浓度同倍增加D. Fe2+离子和Cu2+离子浓度同倍减少2-20 已知原电池Sn∣Sn2+(c1)‖Pb2+(c2)∣Pb的电动势E=0V,为使Sn电极为原电池负极,Pb电极为正极, 应'A. 减小c1,增大c2B. c1和c2同倍减小C. c1和c2同倍增大D.减小c2,增大c1 2-21关于盐桥叙述中错误的是A.电子通过盐桥流动B.盐桥的电解质中和两个半电池中过剩的电荷C.可以维持氧化还原反应进行D盐桥中的电解质不参与反应2-22关于标准电极电势,下列哪项叙述是正确的A.标准电极电势都是利用原电池装置测得的B.同一元素有多种氧化态时,不同氧化态组成电对的标准电极电势不同C.电对中有气态物质时,标准电极电势是指气体处在273K和下的电极电势D.氧化还原电极的氧化型和还原型浓度相等时的电势也是标准电极电势2-23有关标准氢电极的叙述中不正确的是¥A.标准氢电极是指将吸附纯氢气(分压)达饱和的镀铂黑的铂片浸在H+离子活度为1 mol·L-1的酸溶液中组成的电极B.温度指定为289KC.任何一个电极的电势绝对值均无法测得,电极电势是指定标准氢电极的电势为零而得到的相对电势D.使用标准氢电极可以测定所有金属的标准电极电势2-24由镉电极浸在mol·L-1镉离子溶液中所组成的半电池的电极电势是多少已知:θ(Cd²+/Cd)= A. B. C. D.2-25根据下列正向进行的反应,判断电对电极电势由大到小的顺序是2FeCl3+SnCl2 →2FeCl2+SnCl4;2KMnO4+10FeSO4+8H2SO4 →2MnSO4+5Fe2(SO4)3+K2SO4+8H2OMn2+>Fe3+/Fe2+/Sn4+/Sn2+Mn2+>Sn4+/Sn2+>Fe3+/Fe2++/Fe2+>MnO4-/Mn2+>Sn4+/Sn2++/Fe2+>Sn4+/Sn2+>MnO4-/Mn2+2-26已知25℃时电极反应MnO4-+8H+ + 5e==MnO2 + 4H2O的θ=。
