第二章 4 蛋白质鉴定技术--质谱数据分析 end 2
蛋白质分析鉴定精品课件

最新 PPT
22
2. 分析多肽链的氨基酸组成。
将多肽链用酸或酶完全水解,再用离子交换树脂 (或用高效液相色谱)将各种氨基酸分离开,测 定其含量并计算各种氨基酸组成的百分比。下图 表示蛋白质的水解产物通过Moor-Stein Dowex 50 离子交换柱层析的自动分析结果。
最新 PPT
31
双向电泳:
2-DE技术依然是大多数蛋白质组研究 中分离复杂蛋白质混合物的首选技 术。
最新 PPT
32
双向电泳分析中的样品制备
制备原则:
应使所有待分析的蛋白样品全部处于溶解状态 (包括多数疏水性蛋白),且制备方法应具有可 重现性。
防止样品在聚焦时发生蛋白的聚集和沉淀。
防止在样品制备过程中发生样品的抽提后化学修 饰(如酶性或化学性降解等)。
a 加入脱水剂除去水膜 b 使pH=pI c 加入电解质使质点表面失去同种电荷。
最新 PPT
12
五、蛋白质的变性作用
天然蛋白质受到理化因素的影响, 氢键、盐键等次级键维系的高级结构遭 到破坏,分子内部结构发生改变,致使 生物学 性质、理化性质改变的现象。
最新 PPT
13
物理因素: 加热、紫外线、X—射线、超声波
最新 PPT
45
双向电泳的分类
非变性2D-PAGE:两向均在非变性条件下 进行,这样分离的蛋白质点的等电点和表观 分子量同生理条件下获得的这些蛋白的值是 一样的
非变性/SDS-2D-PAGE:第一向采用非变性 IEF,之后在2%SDS溶液中平衡;第二向也 在SDS存在的条件下进行。适于分析非共价 键连接的蛋白-蛋白间的相互作用。
蛋白质质谱鉴定

广州辉骏生物科技有限公司
蛋白质质谱鉴定
一、技术概述
质谱是将待测物质变为气态离子并将离子按质荷比(m/z)进行分离,检测各种离子谱峰的强度而实现分析的一种方法。
蛋白质定性通常采用质谱分析结合数据库检索的方法,所分析的样本可以是蛋白质溶液、蛋白质胶条或胶点。
简单蛋白样本,例如双向电泳斑点或纯化蛋白,通常采用MALDI-TOF/TOF质谱(MS/MS)进行分析。
混合蛋白样本,例如蛋白溶液,或SDS-PAGE条带,通常采用液相色谱-质谱联用(LC-MS/MS)技术进行分析。
应用领域有:亚细胞组分的全谱分析,IP、co-IP、Pull-down后的互作蛋白鉴定,或其他中等复杂蛋白样本的鉴定。
二、技术原理
串联质谱(MS/MS)检测蛋白的原理是:蛋白先经胰酶消化成肽段,肽段在质谱仪中离子化后,会带上一定量的电荷,通过检测器分析,可得到各肽段的质荷比(m/z),从而得知各肽段的相对分子质量。
为获得肽段的序列信息,质谱仪会选取某些肽段进行破碎,再次分析,获得二级质谱。
用检索软件选择相应的数据库对质谱数据进行分析,同时以打分的形式评判鉴定结果,当打分大于某个阈值时,即判定质谱鉴定成功,反之则鉴定失败。
LC-MS/MS方法是将蛋白酶切消化为肽段混合物,之后这些肽段先经高效液相色谱分离形成简单的组分,再进行串联质谱(MS/MS)分析;因此适合于混合蛋白样本的鉴定。
三、技术优势
1. 采用高效液相色谱和质谱联用的分析方法,可以一次性鉴定成百上千种蛋白质。
2. 鉴定准确性和灵敏度高。
四、技术流程
蛋白样本制备——蛋白酶解——串联质谱分析(或LC-MS/MS分析)——数据库检索——蛋白质鉴定结果。
蛋白质质谱分析技术

蛋白质质谱分析技术蛋白质质谱分析技术是一种广泛应用于生物医学研究和药物开发领域的重要分析方法。
它通过测定蛋白质的分子质量、结构以及相互作用等信息,为科学家提供了深入了解蛋白质功能和疾病机制的有力工具。
本文将介绍蛋白质质谱分析技术的原理、方法及其在不同领域的应用。
一、蛋白质质谱分析技术的原理蛋白质质谱分析技术基于质谱仪的原理,该仪器能够将蛋白质分子转化为离子,并通过质谱分析技术对离子进行检测和分析。
质谱分析技术主要包括四个步骤:样品制备、质谱仪分析、数据获取和解析。
在样品制备过程中,蛋白质通常需要经过蛋白质提取、纯化和消化等处理步骤,以获取高质量的样品。
随后,样品通过不同的离子化方法(如电喷雾离子化或激光解析离子化)将蛋白质转化为离子化的状态,并进入质谱仪进行分析。
质谱仪中的离子分离装置(如时间飞行法或四极杆)能够按照质量-电荷比将离子分离并进行测量。
最后,通过数据的获取和解析,科学家可以获得蛋白质的分子质量、序列信息、结构以及相互作用等重要参数。
二、蛋白质质谱分析技术的方法蛋白质质谱分析技术包括多种不同的方法和技术,下面将介绍其中的一些常用方法。
1. 质谱仪类型质谱仪分为多种类型,包括飞行时间质谱仪(TOF)、电子捕获质谱仪(ESI-MS)、多杆质谱仪等。
不同类型的质谱仪适用于不同的蛋白质分析需求,具有不同的优势和适用范围。
2. 核心技术蛋白质质谱分析中的核心技术包括蛋白质消化、亲和纯化、离子化方法以及质谱数据分析等。
消化方法如胰蛋白酶消化、化学消化等可将复杂蛋白质分子分解为易于分析的肽段。
亲和纯化方法则能够富集特定的蛋白质或肽段。
离子化方法常用的有电喷雾离子化和激光解析离子化,能够将蛋白质或肽段转化为离子态以进行分析。
质谱数据的解析和处理涉及到数据库比对、蛋白质定量以及结构分析等多个方面。
三、蛋白质质谱分析技术的应用蛋白质质谱分析技术在生物医学研究和药物开发领域有着广泛的应用。
1. 蛋白质鉴定蛋白质质谱分析技术可以用于鉴定复杂混合物中的蛋白质成分,如细胞蛋白质组、组织蛋白质组等,为研究蛋白质功能和疾病相关基因的表达提供重要的手段。
质谱分析蛋白质

百泰派克生物科技
质谱分析蛋白质
蛋白质质谱分析就是利用质谱技术对单一蛋白质或蛋白混合物进行鉴定、分析。
质谱技术主要是对物质的相对分子质量和含量或浓度进行分析,广泛运用于各种蛋白质分析中,如鉴定蛋白质种类、测定蛋白质氨基酸序列、预测蛋白质空间结构、验证或寻找相互作用蛋白、定性和定量鉴定蛋白翻译后修饰等。
质谱技术分析蛋白质的基本原理是利用质谱检测得到的质谱图如肽质量指纹图谱和肽序列标签数据与数据库中存储的数据进行匹配,从而鉴定一个蛋白质或多肽。
因此,质谱数据的可靠性程度直接关系到最后的鉴定结果,一台具有良好性能如灵敏度、分辨率和质量精确性等的质谱仪是保证质谱结果准确性的硬性条件。
百泰派克生物科技使用Thermo公司最新推出的Obitrap Fusion Lumos质谱仪结合Nano-LC纳升色谱技术,提供蛋白质质谱分析服务技术包裹,包括蛋白分子量鉴定、蛋白序列分析、蛋白结构测定、蛋白翻译后修饰鉴定以及蛋白相互作用检测等,百泰派克生物科技还可根据需求提供定制化检测方案,欢迎免费咨询。
蛋白质质谱的分析

蛋白质质谱的分析蛋白质是生物体中含量最高,功能最重要的生物大分子,存在于所有生物细胞,约占细胞干重质量的50%以上。
随着生命科学及生物技术的迅速发展,生物质谱目前已成为有机质谱中最活跃,最富生命力的前沿研究领域之一。
本文简要综述了肽和蛋白质等生物大分子质谱分析的特点,方法及蛋白质质谱分析的原理,方式和应用,并对其发展前景作出展望。
1 质谱分析的特点与方法1.1 质谱分析具有很高的灵敏度,能为亚微克级试样提供信息,能最有效地与色谱联用,适用于复杂体系中痕量物质的鉴定或结构测定,同时具有准确性、易操作性、快速性及很好的普适性。
1.2 质谱分析的方法质谱分析的软电离技术主要有下列几种:(1)电喷雾电离质谱;(2)基质辅助激光解吸电离质谱;(3)快原子轰击质谱;(4)离子喷雾电离质谱;(5)大气压电离质谱。
以前三种近年来研究最多,应用也最广泛。
2 蛋白质的质谱分析2.1 蛋白质的质谱分析原理原理是通过电离源将蛋白质分子转化为气相离子,然后利用质谱分析仪的电场、磁场将具有特定质量与电荷比值(M/Z值)的蛋白质离子分开来,经过离子检测器收集分离的离子,确定离子的M/Z值,分析鉴定未知蛋白质。
2.2 蛋白质和肽的序列分析现有的肽和蛋白质测序方法包括N末端序列测定的化学方法Edman法、C末端酶解方法、C末端化学降解法等,这些方法都存在一些缺陷。
在这种背景下,质谱由于很高的灵敏度、准确性、易操作性、快速性及很好的普适性而倍受科学家的广泛注意。
在质谱测序中,灵敏度及准确性随分子量增大有明显降低,所以肽的序列分析比蛋白质容易很多。
近年来随着电喷雾电离质谱(ESI)及基质辅助激光解吸质谱(MALDI)等质谱软电离技术的发展与完善,极性肽分子的分析成为可能,检测限下降到fmol级别,可测定分子量范围则高达100000Da,目前基质辅助的激光解吸电离飞行时间质谱法(MALDI TOP MS)已成为测定生物大分子尤其是蛋白质.多肽分子量和一级结构的有效工具,也是当今生命科学领域中重大课题――蛋白质研究所必不可缺的关键技术之一,目前在欧洲分子生物实验室(EMBL)及美国、瑞士等国的一些高校已建立了MALDI TOP MS蛋白质一级结构(序列)谱库,能为解析FAST谱图提供极大的帮助,并为确证分析结果提供可靠的依据。
第二章 4 蛋白质鉴定技术--质谱数据分析 end 2
(1)固定基线算法
这种固定基线方法简单易行,但最大的 不足就在于没有根据用户当前提供的数 据寻找基线,而固定一个基线,无法考 虑当前图谱的强度分布。
(2)固定峰数法
这个方法可以看作是有效峰挑选的方法.这 种方法将谱峰按照强度高低进行排序,保留 固定数日的峰作为信号峰(如200个),其他的 都作为噪音舍弃
(3)窗口基线法(b)
基线—采用局部线性拟合的方法来去除
(3)窗口基线法(b)
(4)窗口基线法和固定峰数法 的结合
例如,在图谱的质量方向上,每隔50Da 开一个窗口,在每个窗口中选择峰强最 高的5个谱峰作为信号峰,其他谱峰作为 嗓声而舍弃。 如 Mascot 通过在每一个固定范围内 (14Da)保留一个质峰的方法加强了对 小丰度值质峰的选取,以获得与离子 系列相对应的质峰阶梯。
识别质谱中的容易区分的噪声
4)谱峰中心化(Peak centroiding)
轮廓质谱图--->棒状质谱图
质谱数据的预处理
1 原始质谱数据的预处理 2 谱峰中心化后的质谱数据的预处理
2 谱峰中心化后的质谱数据的预处理 串联质谱中对肽序列鉴定有用的信息只 是很少量的几十个重要离子的单同位素 (monoisotope)谱峰 但通常一个Q-TOF类型的串联质谱对应 的.dta文件里包含300-5000甚至更多的 谱峰。 质谱中绝大多数的谱峰对应仪器的物理 噪声以及离子的同位素谱峰。 因此,有必要对质谱数据进行预处理
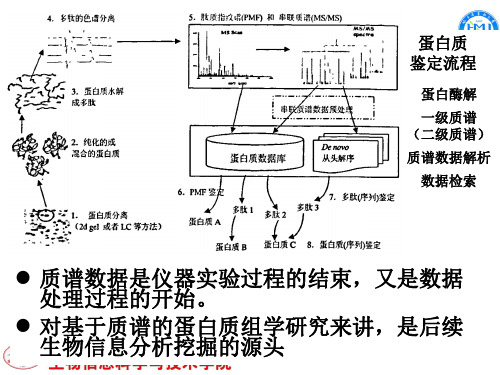
蛋白质 鉴定流程
蛋白酶解
一级质谱 (二级质谱) 质谱数据解析 数据检索
质谱数据是仪器实验过程的结束,又是数据 处理过程的开始。 对基于质谱的蛋白质组学研究来讲,是后续 生物信息分析挖掘的源头
蛋白质分析技术之质谱法

蛋白质分析技术之质谱法蛋白质是生物体内最为重要的有机大分子,既是构成细胞组织的基本单位,也是参与细胞代谢的重要分子。
而被称为“生命之光”的DNA也仅仅是蛋白质的编码者。
因此,全面了解蛋白质结构和功能对于深入理解细胞运作以及生命科学的研究都有着重要的作用。
而质谱法则是一种非常重要的蛋白质分析技术。
质谱法是一个非常灵敏、快速、高分辨率的蛋白质分析技术。
通过将样品通过质量分析器,分离样品中的离子,获得不同质量的信号,进而对分子进行分析。
质谱法对于蛋白质的结构分析、动态过程分析以及定量分析都有着非常重要的作用。
本文将从以下三个方面对质谱法进行深入讲解:一、质谱法基础质谱法有很多种不同的分析方法,比如MALDI-TOF、ESI-MS、Q-TOF等。
这些不同的质谱法对应着不同的离子化方式、分离模式和检测方式,都有各自的优缺点。
但无论哪种方法,都有一些基本的操作流程。
在质谱分析中,最根本的就是质量分析。
该过程要求先要将样品中的分子离子化,然后进行分离和检测。
常见的离子化方式有电子喷射(EI)、化学离子化(CI)、电喷雾(ESI)和基质辅助激光解吸飞行时间质谱(MALDI-TOF)。
此外,质量分析器也有不同的类型,先进的FTICR(傅立叶转换离子回旋共振质谱仪)可以对不同的离子进行分析,从而获得对应的质量谱峰。
二、蛋白质质谱分析质谱技术对于研究蛋白质分析十分重要。
具有相同分子量的蛋白质因为其各自的氨基酸组成不同而形成不同的质谱图。
通过质谱技术能够获得蛋白质分解物、多肽、蛋白质的修饰、蛋白质结构以及可解析计算蛋白质分子量。
相比于传统的蛋白质分析技术来说,质谱法的高灵敏度、高效率使得人们能够从低浓度的复杂蛋白质样品中分析出较小的蛋白质分子,拓宽了分析范围,获得了更多重要分析信息。
相对于其他的质谱分析方法,MALDI-TOF和ESI-MS技术在确定多肽组成和质量等信息方面表现出较大的区别。
基于MALDI-TOF的分析技术,样品的制备过程较为简单,允许大分子物质直接在样品板上进行脱离,加速了整个分析过程。
蛋白质鉴定的质谱法

蛋白质鉴定的质谱法
首先,质谱法的基本原理是利用质谱仪测定蛋白质分子的质量。
质谱仪能够将蛋白质分子离子化,并根据离子的质荷比来测定其质量。
通过比较实验测得的质谱图与已知蛋白质的质谱图数据库,可
以确定样品中蛋白质的身份。
其次,质谱法也可以用于测定蛋白质的氨基酸序列。
这种方法
通常涉及将蛋白质分子分解成小片段,然后使用质谱仪测定这些片
段的质量。
通过比较实验测得的片段质谱图和已知氨基酸序列的数
据库,可以确定蛋白质的氨基酸序列。
此外,质谱法还可以用于研究蛋白质的修饰,如磷酸化、甲基
化和糖基化等。
这些修饰可以通过质谱分析来确定其位置和类型,
从而揭示蛋白质功能的调控机制。
在实际应用中,质谱法通常与其他技术相结合,如色谱分离、
核磁共振和基因组学等,以实现对复杂蛋白质混合物的全面分析。
总的来说,质谱法作为一种高灵敏度、高分辨率的分析技术,在蛋
白质鉴定和研究中发挥着重要作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PMF VS blast
相似点:PMF需要对庞大的蛋白质数据 库进行筛选来找到和实验所测的分子量 所匹配的氨基酸序列 不同点:蛋白质研究领域中对于PMF没 有一个可以被广泛接受的算法和概率模 型
常用的质量纹算法
现在试验中可用的算法有:
Mascot: Profound: /cgibin/Profound Expasy tools: http://www.expasy.ch/tools/ PeptideSearch: http://mac-mann6.emblheidelberg.de
1)质谱过滤(Spmrum filtering)
去除一些已知的公共污染物,比如角蛋白或者酶 自解产生的多肽,可减少待测蛋白质鉴定中的错 误解释
2)质谱合并(Spectrum joining)
同一个多肽的不同的质谱识别出来并去掉,从而 减少质谱的数据量
1 原始质谱数据的预处理
3)质谱去噪(Dcnoising)
蛋白质 鉴定流程
蛋白酶解
一级质谱 (二级质谱) 质谱数据解析 数据检索
质谱数据是仪器实验过程的结束,又是数据 处理过程的开始。 对基于质谱的蛋白质组学研究来讲,是后续 生物信息分析挖掘的源头
质谱数据的预处理
1 原始质谱数据的预处理 2 谱峰中心化后的质谱数据的预处理
1 原始质谱数据的预处理
进一步简化质谱数据的复杂度
比较同位素峰簇中第一个同位素峰和第 二个同位素峰的强度
如果第一个同位素峰的强度大于或等于第 二个同位素的强度,只保留同位素峰簇中 的第一个同位素峰 如果第一个同位素峰的强度小于第二个同 位素的强度,则只保留第二个同位素峰。
去同位的效果
通过质谱去鉴定多肽序列
human hemoglobin血红蛋白 alpha chain
蛋白质酶解
http://www.expasy.ch/tools/peptidecutter/
粘贴蛋白序列:PGYRNNVVN TMRLWSAKAPNDFNLKDFNVG 点击Perform 选择“Only the following selection of enzymes and chemicals”,并选择胰酶Trypsin酶切
(3)窗口基线法(a)
根据图谱的谱峰分布,在谱峰分布强度 不同的区间给定不同的基线,这些平均 强度不同的区间被称为窗口(如50Da为一 个窗口),计算出每个窗口内谱峰强度 的平均值以及标准差,将强度的平均值 加上标准差作为窗口的基线。
这种方法相比于固定基线法有改进,设置基 线时考虑了在不同的质量段,会有不同的谱 峰强度分布。
Peptide Mass Fingerprint (肽指纹图谱检索 ) Sequence Query (部分序列比对) MS/MS Ion Search (串联质谱检索)
打分算法---分数计算
说明:这个分数算法是PMF的分数算法,MS/MS ion search则采用其它分数算法
打分算法---分数计算
(1)固定基线算法
这种固定基线方法简单易行,但最大的 不足就在于没有根据用户当前提供的数 据寻找基线,而固定一个基线,无法考 虑当前图谱的强度分布。
(2)固定峰数法
这个方法可以看作是有效峰挑选的方法.这 种方法将谱峰按照强度高低进行排序,保留 固定数日的峰作为信号峰(如200个),其他的 都作为噪音舍弃
通过质谱去鉴定多肽序列
采用计算的方法通过实验质谱去鉴定多肽序列的 问题可分成三大块: 1) 数据预处理
即从质谱中提取对鉴定有用且无偏的信息。
2)理论谱构造
构造趋近客观和完备的理论谱。
3) 肽序列鉴定
即比较理论和实验质谱而鉴别多肽的序列以致于 确定蛋白质身份。
质谱分析蛋白的方法
NCBI-Genpept,swiss-prot
பைடு நூலகம்
We also can do this with nucleotide sequence information by converting it to protein sequence information and then digesting.
采用计算的方法通过实验质谱去鉴定多肽序列的问题可 分成三大块: 1) 数据预处理---即从质谱中提取对鉴定有用且无偏 的信息。 1 原始质谱数据的预处理 2 谱峰中心化后的质谱数据的预处理 2)理论谱构造
构造趋近客观和完备的理论谱。
3) 肽序列鉴定
即比较理论和实验质谱而鉴别多肽的序列以致于确定蛋 白质身份。
VGAHAGEYGAEALER
has an exact monoisotopic mass of 1528.7348 Da.
Thus, the singly charged ion of this peptide has an m/z value of 1529.7348.
The theoreticalproteolytic peptides now becomes a valuable reference tool. One could rank these tryptic peptides from lowest mass to highest.
Mascot简介
使用类型 在线检索:免费,数据库总是最新的,检索 速度快,简单,只需将peak list文件导入即可 ,但文件大小受限制 本地检索:需要购买软件及安装数据库,但 使用方便、可以进行大规模的数据检索分析 和数据库配置,功能更加强大
Mascot是一款强大的数据库检索软件,可以 实现从质谱数据到蛋白质的鉴定,其检索方 式包括以下三种:
In principle, a complete genome sequence, properly annotated, can yield a complete list of proteins and, consequently, of tryptic peptides.
An inspection of the theoretical proteolytic peptide list would reveal that some of the peptides over about 6 amino acids in length (about 700 Da) would have unique masses.
识别质谱中的容易区分的噪声
4)谱峰中心化(Peak centroiding)
轮廓质谱图--->棒状质谱图
质谱数据的预处理
1 原始质谱数据的预处理 2 谱峰中心化后的质谱数据的预处理
2 谱峰中心化后的质谱数据的预处理 串联质谱中对肽序列鉴定有用的信息只 是很少量的几十个重要离子的单同位素 (monoisotope)谱峰 但通常一个Q-TOF类型的串联质谱对应 的.dta文件里包含300-5000甚至更多的 谱峰。 质谱中绝大多数的谱峰对应仪器的物理 噪声以及离子的同位素谱峰。 因此,有必要对质谱数据进行预处理
分数高低取决于数据库的大小与设定的E 值,对于特定的数据库和E值(如E=0.05) ,则可以算出S。
目前来说,由MALDI-TOF质谱仪产生的质谱 图精度较高,而由ESI质谱仪产生的质谱图精 度相对较低。 另一个问题是,ESI产生的质谱图中的离子通 常带有很多电荷,而MALDI质谱图中的离子 一般只带一个电荷,比较容易计算。 所以从一级质谱鉴定蛋白质的算法(质量纹 )主要用在MALDI-TOF产生的质谱图上。
2 谱峰中心化后的质谱数据的预处理
质谱噪声基线和信号峰的识别
质谱中的噪声分布有一定的规律 强度在基线以下的m/z值对应的谱峰是噪声的概 率非常大。
有效峰选取
从质谱中挑选出离子的单同位素谱峰,作为进一 步的序列鉴定之用
有效峰选取
理论上,同位素峰在图谱中表现为两个峰之 间的质量差为1Da。 去同位素峰:一个离子的同位素会在质谱图 上显示出不同的峰,峰间的距离为1,去同位 素峰就是把这些峰合并为一个峰。
2 谱峰中心化后的质谱数据的预处理
质谱噪声基线和信号峰的识别
质谱中的噪声分布有一定的规律 强度在基线以下的m/z值对应的谱峰是噪声的概 率非常大。
有效峰选取
从质谱中挑选出离子的单同位素谱峰,作为进一 步的序列鉴定之用
1) 信号峰的识别
比较流行的各种基于串联质谱的蛋白质 鉴定软件所采用的预处理方法,都是着 眼于对谱峰强度进行处理 大多属于阈值类方法,即根据某个阈值, 保留阈值以上的蜂作为信号峰,而阈值 以下的被当作噪音峰抛弃 这是由于仪器等原因,每张图谱都会有 一条噪音峰的水平强度基线(即阈值)。
tryptic digestion of each protein yields a specific number of peptides of specific length, sequence, and most importantly, of specific mass.
We can use a computer to generate this list of peptides by performing a virtual digestion of all the proteins in a database.
这个方法比固定基线方法有所改进,不需要考虑 图谱的谱峰强度分布,取强度最高的固定数目的 谱峰进行后续的分析。 但是有的图谱的谱峰可能很多,会丢掉太多的信 息(如图A所示);而有的图谱的谱峰可能很少, 甚至不到100个,这就会使得预处理产生不了作 用,所有的谱峰都被保留(如图B) 比如SEQUEST
用于质谱分析蛋白质的方法主要有三种: 肽质量指纹图谱法(PMF) 串联质谱法(CID) 梯形肽片段测序法(ladderpeptide sequencing)
